修回日期: 2016-07-24
接受日期: 2016-07-31
在线出版日期: 2016-08-18
目的: 探讨獐牙菜苦苷对大鼠胆汁淤积性肝损伤肝纤维化进程的影响.
方法: 30只♂幼年SD大鼠随机分为正常对照组(n = 10)、空白治疗模型组(n = 10)及獐牙菜苦苷治疗组(n = 10), 利用改良ANIT法构建大鼠胆汁淤积性肝损伤及肝纤维化模型, 造模期间给予獐牙菜苦苷治疗. 实验终点以大鼠肝功能指标、肝纤维化血清学指标、肝组织纤维化指标、肝纤维化病理学指标等以判定獐牙菜苦苷的治疗效果, 并利用Western blot法检测大鼠肝脏膜转运蛋白Mrp3、Mrp4的表达水平变化.
结果: 与空白治疗模型组相比, 獐牙菜苦苷治疗组大鼠肝功能指标包括谷丙转氨酶、谷草转氨酶、总胆红素、直接胆红素、碱性磷酸酶及谷氨酰转肽酶, 肝纤维指标包括血清透明质酸、层黏连蛋白、Ⅳ胶原及Ⅲ型前胶原, 肝组织纤维化指标肝组织羟脯氨酸含量, 病理学指标包括炎症活动度及纤维化程度SSS计分等均有显著改善. Western blot检测结果提示獐牙菜苦苷可显著提高模型大鼠肝脏膜转运蛋白Mrp3、Mrp4的表达水平.
结论: 獐牙菜苦苷可抑制大鼠胆汁淤积性肝损伤肝纤维化进程.
核心提示: 獐牙菜苦苷是藏茵陈的主要活性成分之一. 在本研究中, 我们利用大鼠模型证实獐牙菜苦苷对胆汁淤积性肝损伤肝纤维化进程有一定的抑制作用, 其为藏茵陈及相关提取物的进一步临床开发提供实验依据.
引文著录: 卫双连, 汪杰, 李德民. 獐牙菜苦苷对大鼠胆汁淤积性肝损伤肝纤维化的抑制作用. 世界华人消化杂志 2016; 24(23): 3482-3487
Revised: July 24, 2016
Accepted: July 31, 2016
Published online: August 18, 2016
AIM: To investigate the effect of Swertiamarin on fibrosis in rats with cholestatic liver damage.
METHODS: Thirty young male SD rats were randomly divided into three groups: a normal control group (n = 10), a model group (n = 10) and a Swertiamarin treatment group (n = 10). α-naphthylisothiocyanate was used to induce cholestatic liver damage and fibrosis. During the process of model development, rats in the treatment group were given Swertiamarin. After treatment, serum indexes for liver function and liver fibrosis, fibrosis of liver tissue and pathological tests were used to determine the therapeutic efficacy of Swertiamarin. Western blot was performed to determine the expression changes of hepatocyte membrane transporters Mrp3 and Mrp4 in rat liver tissue.
RESULTS: Compared with the model group, serum indexes for liver function (ALT, AST, TBIL, DBIL, ALP and GGT) and liver fibrosis (HA, LN, IV-C and PCIII), fibrosis of liver tissue (hydroxyproline content), and pathological tests (inflammation activity and fibrosis degree) were significantly improved in rats treated with Swertiamarin. Western blot results indicated that the expression of Mrp3 and Mrp4 was significantly increased in rats receiving Swertiamarin treatment.
CONCLUSION: Swertiamarin can inhibit the fibrosis in rats with cholestatic liver damage.
- Citation: Wei SL, Wang J, Li DM. Inhibitory effect of Swertiamarin on fibrosis in rats with cholestatic liver damage. Shijie Huaren Xiaohua Zazhi 2016; 24(23): 3482-3487
- URL: https://www.wjgnet.com/1009-3079/full/v24/i23/3482.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i23.3482
藏茵陈主要来源于龙胆科獐牙菜属植物, 为青藏高原所特有. 祖国传统医学认为其具有清热解毒、清肝利胆的功效. 现代药理研究也证实, 藏茵陈及其提取物具有保肝、抗菌、消炎等多种作用, 因此在临床上其已被广泛用于治疗急慢性肝炎、胆囊炎等疾病[1,2]. 獐牙菜苦苷, 又称獐牙菜苦素, 属于裂环烯醚萜氧糖苷类化合物, 是藏茵陈的主要活性成分之一[3]. 已有多个研究[4,5]显示獐牙菜苦苷对急慢性肝炎有显著的治疗作用. 国内陈文生教授课题组等的研究显示, 獐牙菜苦苷可通过上调膜转运蛋白3(multidrug resistance-associated protein 3, Mrp3)、Mrp4等的表达进而促进肝细胞胆酸排泌过程, 由此抑制大鼠胆汁淤积性肝脏损伤[6-9]. 在本研究中, 我们利用胆汁淤积性肝损伤大鼠模型, 探讨獐牙菜苦苷对胆汁淤积性肝损伤肝纤维化进程的影响及其机制.
健康♂幼年SD大鼠30只, 体质量150 g±20 g, 由武汉大学动物实验中心提供. 随机分为3组: 正常对照组、空白治疗模型组、獐牙菜苦苷治疗组, 每组10只. 采用欧巧群等的方法构建改良淤胆型肝病大鼠模型[10,11], 空白治疗模型组及獐牙菜苦苷治疗组均给予1.6% α-萘异硫氰酸酯(alpha-naphthylisothi, ANIT)花生油溶液灌胃诱导肝损伤, 剂量为大鼠体质量5 mL/kg于实验当天、第7天、第14天、第21天灌胃; 正常对照组大鼠给予花生油5 mL/kg于同样时间节点灌胃.
1.2.1 药物治疗: 于实验第2天始给予獐牙菜苦苷治疗组大鼠獐牙菜苦苷溶液100 mg/kg灌胃, 共持续21 d; 于同样时间点给予空白治疗模型组大鼠生理盐水100 mL/kg灌胃, 共持续21 d; 正常对照组大鼠实验期间自由进食进水. 实验结束前夜禁食, 第23天于麻醉状态下处死大鼠, 常规制作血清标本及肝脏标本, 保存于-80 ℃冰箱.
1.2.2 血清肝功能指标检测: 以日立SBA-300型全自动生化分析仪测量血清谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)、总胆红素(total bilirubin, TBIL)、直接胆红素(direct bilirubin, DBIL)、碱性磷酸酶(alkaline phosphatase, ALP)及谷氨酰转肽酶(glutamyl transpeptidase, GGT)等水平.
1.2.3 肝纤维化血清学指标的测定: 采用放射免疫法测定血清透明质酸(hyaluronic acid, HA)、层黏连蛋白(laminin, LN)、Ⅳ胶原(Ⅳ-C)和Ⅲ型前胶原(PCⅢ)[12,13], 操作按照试剂盒说明书进行.
1.2.4 肝组织羟脯氨酸含量的测定: 采用碱水解法羟脯氨酸试剂盒检测大鼠肝组织羟脯氨酸含量[14,15], 操作按照试剂盒说明书进行.
1.2.5 病理学诊断: 肝组织切片后以天狼星红-苦味酸染色, 光镜下观察大鼠肝组织胶原沉积情况, 并以半定量计分系统(semi-quantitative scaling system, SSS)判断肝组织炎症活动度及纤维增生水平[16,17].
1.2.6 Western blot检测: 提取大鼠肝脏组织蛋白后应用Western blot检测Mrp3和Mrp4蛋白表达水平变化, 以β-actin表达水平为内参.
统计学处理 实验结果用统计学SPSS19.0软件进行处理分析, 实验数据以mean±SD表示, 行student-t检验或ANOVA方差分析, P<0.05为差异具有统计学意义.
与正常对照组相比, 空白治疗模型组大鼠血清ALT、AST、TBIL、DBIL、ALP及GGT均显著增高(P<0.01); 而造模大鼠在给予獐牙菜苦苷治疗后, 其6项血清学指标与空白治疗模型组相比均显著下降(P<0.05.), 但与正常对照组相比, 各项指标仍较高(P<0.05)(表1).
| 指标 | 正常对照组 | 空白治疗模型组 | 獐牙菜苦苷治疗组 | F值 |
| ALT(U/L) | 28.3±10.15 | 139.3±64.29 | 90.4±30.11a | 18.05 |
| AST(U/L) | 99.0±28.95 | 281.8±86.03 | 133.7±36.73b | 29.49 |
| TBIL(μmol/L) | 16.5±6.55 | 283.3±75.67 | 97.0±41.68b | 74.85 |
| DBIL(μmol/L) | 2.19±1.58 | 210.2±65.85 | 52.1±24.15b | 71.87 |
| ALP(U/L) | 130.5±43.32 | 458.7±122.78 | 245.8±108.73b | 28.90 |
| GGT(IU/L) | 1.05±0.47 | 5.21±1.94 | 2.77±1.50b | 20.95 |
与正常对照组相比, 空白治疗模型组大鼠肝纤维化血清学指标HA、LN、Ⅳ-C及PCⅢ均有显著增高(P<0.01); 但在给予獐牙菜苦苷治疗的大鼠中, 肝纤维化血清学4项指标与空白治疗模型组相比均有显著改善(P<0.05)(表2).
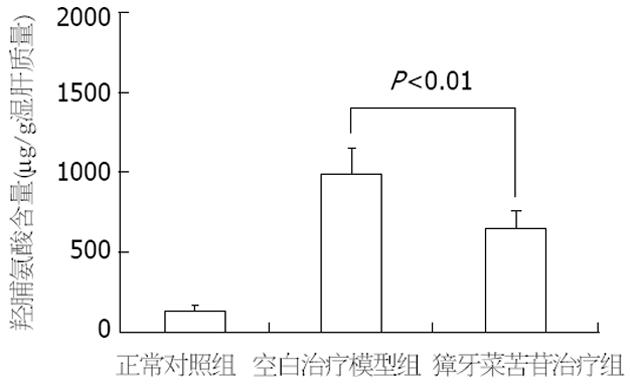
与空白治疗模型组相比, 经獐牙菜苦苷治疗后, 大鼠肝组织羟脯氨酸含量显著下降(652.4±116.53 vs 984.3±178.62, P<0.01); 但较正常对照组, 其肝组织羟脯氨酸含量仍较高, 有显著统计学差异(652.4±116.53 vs 126.5±36.51, P<0.01)(图1).
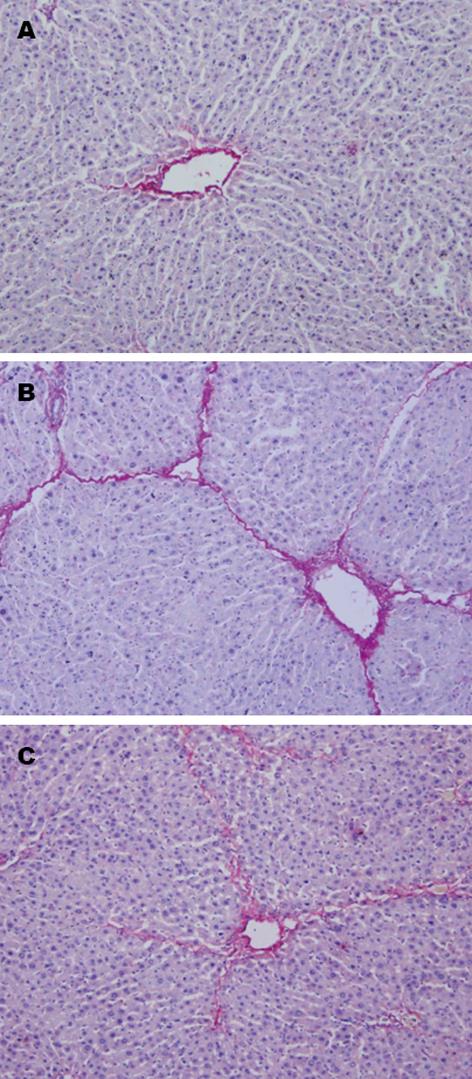
与正常对照组大鼠相比, 模型组大鼠正常肝小叶结构破坏, 存在大量纤维结缔组织增生; 与空白治疗模型组相比, 獐牙菜苦苷治疗组肝组织纤维增生程度显著减轻(图2). 根据SSS计分, 獐牙菜苦苷治疗组大鼠炎症活动度及纤维化程度在统计学上也显著低于空白治疗模型组(P<0.01), 但较正常大鼠对照组, 其炎症活动度及纤维化程度SSS计分仍较高(P<0.01)(表3).
| 项目 | 正常对照组 | 空白治疗模型组 | 獐牙菜苦苷治疗组 | F值 |
| 炎症活动度 | 0.25±0.11 | 10.9±2.63 | 6.2±1.08 | 105.47 |
| 纤维化程度 | 0 | 11.6±1.95 | 8.2±1.88 | 145.03 |
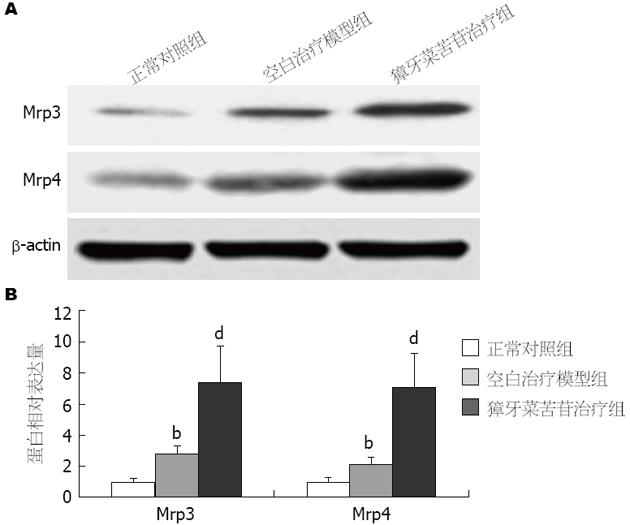
与正常对照组大鼠相比, 空白治疗模型组大鼠Mrp3、Mrp4表达水平适应性增加(Mrp3增加约2.7倍, Mrp4增加约2.1倍), 差异具有统计学意义(P<0.01); 而较空白治疗模型组, 獐牙菜苦苷治疗组大鼠其Mrp3、Mrp4表达水平进一步提高(Mrp3增加约7.4倍, Mrp4增加约7.1倍), 差异具有统计学意义(P<0.01)(图3).
藏茵陈是中华民族药中的瑰宝, 是藏药中最具特色的药物之一, 已被各族人民广泛用于治疗急慢性肝炎等疾病. 国内已有多个课题组致力于藏茵陈及其提取物的现代药理学研究. 冯伟力等[4]的研究显示, 藏茵陈可通过降低肝P450酶活性而对脂多糖(lipopolysaccharide, LPS)诱导的小鼠急性肝损伤起到显著的治疗作用. 王芳等[5]则观察了藏茵陈对大鼠肝缺血-再灌注损伤(hepatic ischemia-reperfusion injury, HIRI)的保护作用, 结果表明藏茵陈可通过提高体内NO水平, 可通过提高体内NO水平, 改善肝组织血供、改变肝细胞形态学而减轻HIRI. 而近年, 陈文生教授课题组更进一步探讨了藏茵陈原植物川西獐牙菜及其提取物的药理学作用, 其研究发现, 川西獐牙菜醇提物能促进胆汁向胆管排泌并明显减轻LPS所致大鼠胆汁淤积性肝损伤, 其机制可能与上调肝细胞胆酸转运蛋白BSEP有关[6-9]; 獐牙菜苦苷作为一个来源于川西獐牙菜的单体成分, 也可明显降低LPS诱导的大鼠胆汁淤积肝脏损伤, 进一步的机制研究显示獐牙菜苦苷可通过核受体Pxr、Car等上调肝脏膜转运蛋白Mrp3、Mrp4的表达, 进而增强大鼠肝脏胆汁向胆管的排泌能力[8,9].
肝组织羟脯氨酸含量是反映肝纤维化程度的一项客观指标[18,19]. 在本研究中, 我们以实验终点所取部分大鼠肝脏组织行羟脯氨酸含量检测, 为了进一步在病理学上明确獐牙菜苦苷治疗对内毒素诱导大鼠胆汁淤积性肝损伤肝纤维化进展的抑制作用, 我们对实验终点所取肝脏组织行天狼星红-苦味酸染色并观察大鼠肝组织病理形态学变化[20].
熊去氧胆酸是目前临床上用于治疗胆汁淤积最主要的药物之一, 其能够通过核受体Fxr及Pxr诱导肝脏膜转运蛋白Mrp2、Mrp3等的高表达, 促进胆汁分泌从而减轻胆汁酸在肝细胞内的淤积[21-23]. 临床实践已经证实, 长期应用熊去氧胆酸可显著减缓原发性胆汁性肝硬化(primary biliary cirrhosis, PBC)和原发性硬化性胆管炎(primary sclerosing cholangitis, PSC)等胆汁淤积性疾病的肝纤维化进程[24-26]. ANIT是一种能造成胆汁淤积性肝炎的肝毒剂, 其诱发肝损伤的物化学及病理学改变与人类胆汁淤积性肝炎相似, 因此被广泛地用于诱导胆汁淤积性肝炎模型, 其较胆总管结扎诱发大鼠肝外胆汁淤积性肝损伤模型有明显的优势. 陈文生教授课题组所采用的内毒素诱导胆汁淤积性模型为急性肝损伤模型, 由于大鼠肝脏的自我修复能力极强, 其模拟肝损伤的病理生理过程较短, 1-2 wk内肝脏形态和功能即可恢复到正常, 而临床上治疗胆汁淤积的药物通常更长时间才可起效, 因此也不适于本课题研究[27,28]. 在本研究中, 我们利用改良ANIT法构建大鼠胆汁淤积性肝损伤模型, 探讨獐牙菜苦苷对胆汁淤积性肝纤维化进程的影响, 结果显示该方法可显著诱导大鼠肝脏纤维化, 而给予獐牙菜苦苷治疗后, 模型大鼠在肝功能指标、肝纤维化血清学指标、肝纤维化组织学指标、肝纤维化病理学指标等多个层次得到改善, 这一结果提示獐牙菜苦苷可以应用于胆汁淤积性肝炎的治疗. 进一步, 我们应用Western blot检测证实, 在ANIT诱导大鼠胆汁淤积性肝损伤及肝纤维化模型中, 獐牙菜苦苷亦可以提高模型大鼠肝脏膜转运蛋白Mrp3、Mrp4的表达. 獐牙菜苦苷作用机制虽与熊去氧胆酸类似, 但其涉及信号通路并不完全重合, 因此, 将两者联合应用, 可能会起到更大的治疗效果.
国内对藏茵陈及其提取物的研究已较为深入, 但目前多处于动物实验阶段[29]. 獐牙菜苦苷作为由藏茵陈的主要活性成分之一, 也已越来越受到重视. 我们期望可以利用现代医学研究手段包括多中心、双盲、随机对照临床研究等去证实獐牙菜苦苷对胆汁淤积性肝损伤及肝纤维化的治疗作用, 使其有可能成为下一个"传统中医药送给世界人民的礼物"[30].
藏茵陈是藏药中最具特色的药物之一, 已被各族人民广泛用于治疗急慢性肝炎等疾病, 但其作用机制不明.
张宗明, 教授, 首都医科大学北京电力医院普外科; 张永生, 副研究员, 浙江中医药大学药学院
标准化是中医药现代化和全球化的必经之路. 只有切实建立一套行之有效的标准化程序, 并依据程序对中医药进行开发, 才是对祖国传统医学的真正继承和创新.
陈文生教授课题组长期以来致力于藏茵陈及相关提取物在肝纤维化中应用及作用机制研究, 其结果已得到国内外同行的高度认可和赞誉.
本研究利用改良ANIT法诱导大鼠胆汁淤积性肝炎及肝纤维化模型, 其可更好的模拟胆汁淤积性肝病的病理生理过程.
藏茵陈及相关提取物是中草药临床开发领域的热点. 本研究结果进一步证实藏茵陈提取物獐牙菜苦苷是抑制胆汁淤积性肝损伤肝纤维化进程的有效作用成分.
本研究系统探讨了獐牙菜苦苷对大鼠胆汁淤积性肝损伤肝纤维化进程的影响及其相关机制, 实验设计合理, 文章组织严谨, 数据充分, 其结果为藏茵陈及相关提取物的临床应用提供了进一步的实验基础.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 于明茜 电编:闫晋利
| 1. | 唐 丽, 金 振南, 门 美佳, 姜 思佳, 郑 亚男, 张 婉. 藏药藏茵陈的研究进展及开发利用. 中央民族大学学报(自然科学版). 2007;16:176-178. |
| 5. | 王 芳, 韩 丽莎, 李 风华. 藏茵陈对大鼠肝缺血-再灌注损伤NO含量及肝组织细胞学的影响. 中国民族民间医药杂志. 2002;2:109-111. |
| 6. | 高 宇, 柴 进, 李 绍雪, 刘 畅, 程 英, 刘 潇聪, 连 伟, 陈 文生. 川西獐牙菜醇提物对内毒素所致大鼠胆汁淤积性肝损伤的保护作用. 第三军医大学学报. 2014;36: 769-773. |
| 7. | 杜 晓煌, 柴 进, 封 欣婵, 张 樑君, 程 英, 陈 文生, 方 勇飞. 川西獐牙菜醇提物对大鼠胆汁酸转运蛋白Mrp4、转录因子Nrf2表达的影响. 第三军医大学学报. 2015;37: 957-961. |
| 8. | Feng XC, Du X, Chen S, Yue D, Cheng Y, Zhang L, Gao Y, Li S, Chen L, Peng Z. Swertianlarin, isolated from Swertia mussotii Franch, increases detoxification enzymes and efflux transporters expression in rats. Int J Clin Exp Pathol. 2015;8:184-195. [PubMed] |
| 9. | Zhang L, Cheng Y, Du X, Chen S, Feng X, Gao Y, Li S, Liu L, Yang M, Chen L. Swertianlarin, an Herbal Agent Derived from Swertia mussotii Franch, Attenuates Liver Injury, Inflammation, and Cholestasis in Common Bile Duct-Ligated Rats. Evid Based Complement Alternat Med. 2015;2015:948376. [PubMed] [DOI] |
| 10. | 欧 巧群, 钱 新华, 黄 笑群, 王 辉阳. ANIT诱导大鼠亚急性肝内胆汁淤积的生化和病理变化. 胃肠病学和肝病学杂志. 2015;24:463-465. |
| 11. | Chen Z, Zhu Y, Zhao Y, Ma X, Niu M, Wang J, Su H, Wang R, Li J, Liu L. Serum Metabolomic Profiling in a Rat Model Reveals Protective Function of Paeoniflorin Against ANIT Induced Cholestasis. Phytother Res. 2016;30:654-662. [PubMed] [DOI] |
| 14. | 兰 玲, 陈 源文, 孙 超, 刘 博伟, 孙 巧玲. IL-10基因修饰骨髓源性肝干细胞移植对肝纤维化大鼠细胞外基质积聚的影响. 世界华人消化杂志. 2009;17:2231-2236. [DOI] |
| 19. | Bolarin DM, Azinge EC. Biochemical markers, extracellular components in liver fibrosis and cirrhosis. Nig Q J Hosp Med. 2007;17:42-52. [PubMed] |
| 22. | Beuers U, Trauner M, Jansen P, Poupon R. New paradigms in the treatment of hepatic cholestasis: from UDCA to FXR, PXR and beyond. J Hepatol. 2015;62:S25-S37. [PubMed] [DOI] |
| 23. | Kakizaki S, Takizawa D, Tojima H, Horiguchi N, Yamazaki Y, Mori M. Nuclear receptors CAR and PXR; therapeutic targets for cholestatic liver disease. Front Biosci (Landmark Ed). 2011;16:2988-3005. [PubMed] |
| 24. | Poupon R. Ursodeoxycholic acid and bile-acid mimetics as therapeutic agents for cholestatic liver diseases: an overview of their mechanisms of action. Clin Res Hepatol Gastroenterol. 2012;36 Suppl 1:S3-12. [PubMed] [DOI] |
| 25. | Ghonem NS, Assis DN, Boyer JL. Fibrates and cholestasis. Hepatology. 2015;62:635-643. [PubMed] [DOI] |
| 26. | Czul F, Levy C. Novel Therapies on Primary Biliary Cirrhosis. Clin Liver Dis. 2016;20:113-130. [PubMed] [DOI] |