修回日期: 2016-07-08
接受日期: 2016-07-19
在线出版日期: 2016-08-18
目的: 探究miR-155-5p抑制胃癌细胞增殖和侵袭的机制.
方法: 采用实时定量PCR检测胃癌中miR-155-5p的表达. 采用mimics-miR-155-5p转染胃癌细胞, 然后利用荧光素酶检测和Western blot检测miR-155-5p在胃癌细胞的增殖和侵袭.
结果: miR-155-5p在胃癌细胞中比正常组细胞显著下调(P<0.05). 体外过表达miR-155-5p, 可抑制胃癌细胞的增殖和侵袭, 反之, 下调miR-155-5p促进胃癌细胞增殖和侵袭. SOX4与miR-155-5p表达负相关, 下调SOX4较未处理组胃癌细胞增殖侵袭受到抑制(P<0.05).
结论: miR-155-5p可能通过下调SOX4抑制胃癌细胞的增殖和侵袭. miR-155-5p可能在将来作为GC治疗的潜在治疗靶点.
核心提示: 采用实时定量PCR检测胃癌中miR-155-5p的表达. 采用mimics-miR-155-5p转染胃癌细胞, 然后利用荧光素酶检测和Western blot检测miR-155-5p在胃癌细胞的增殖和侵袭. miR-155-5p通过下调SOX4抑制肿瘤, miR-155-5p可能是胃癌的潜在治疗靶点.
引文著录: 庄伟. miR-155-5p通过下调SOX4抑制胃癌细胞增殖和侵袭机制. 世界华人消化杂志 2016; 24(23): 3476-3481
Revised: July 8, 2016
Accepted: July 19, 2016
Published online: August 18, 2016
AIM: To investigate the mechanism of miR-155-5p to inhibit the proliferation and invasion of gastric cancer (GC) cells.
METHODS: The expression of miR-155-5p in GC cells was detected by quantitative real-time PCR. The miR-155-5p mimics and inhibitor were designed and transfected into BGC-823 cells. Then, the role of miR-155-5p in GC cell proliferation and invasion in vitro was explored. Luciferase reporter assay and Western blot were performed to confirm the target gene of miR-155-5p.
RESULTS: MiR-155-5p expression was significantly down-regulated in GC cells (P < 0.05). Overexpression of miR-155-5p inhibited GC cell proliferation and invasion in vitro, while down-regulated expression of miR-155-5p promoted GC cell proliferation and invasion. SOX4 was identified as a target of miR-155-5p in GC cells, and SOX4 expression levels were inversely correlated with miR-155-5p. Knockdown of Sox4 inhibited the proliferation and invasion of GC cells (P < 0.05).
CONCLUSION: MiR-155-5p could inhibit GC cell proliferation and invasion partially by down-regulating SOX4. MiR-155-5p might be a potential therapeutic target for GC treatment in the future.
- Citation: Zhuang W. MiR-155-5p inhibits proliferation and invasion of gastric cancer cells by downregulation of SOX4. Shijie Huaren Xiaohua Zazhi 2016; 24(23): 3476-3481
- URL: https://www.wjgnet.com/1009-3079/full/v24/i23/3476.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i23.3476
胃癌是消化道恶性肿瘤最致命的类型, 在全球恶性肿瘤死亡率中高居第3位[1-3]. 据统计全球每年有将近百万的人诊断为胃癌[4,5]. 尽管在外科手术和化疗方面有了新进展, 胃癌的预后仍然不乐观[6,7]. 因此, 更进一步的理解胃癌进展的发病机制和分子机制为开发新的靶向治疗是有必要的.
miRNAs是小的非编码RNA分子绑定在靶mRNAs的3'非翻译区域, 导致翻译抑制和mRNA退化, 在各种各样的生物学事件比如增殖、进展、分化及细胞凋亡中扮演着重要角色[8-10]. 先前关于胃癌组织中miR-155的报道指出, 在一项91例甲醛固定的胃癌组织标本检测发现, miR-155上调表达, 并与腹膜和淋巴结侵袭转移有关, 但在另一项研究中发现, 相对于GES-1细胞, miR-155在胃癌细胞中明显低表达, 过表达miR-155则显著降低SMAD2的蛋白表达.
miR-155-5p在结肠癌, 口腔癌和头颈部鳞状细胞癌中表达上调[11,12], miRNA-155-5p的高表达与这些肿瘤患者的不良预后息息相关[13,14]. 最近几年, 许多miRNA研究表明, miR-155-5p的表达水平在很多类型的人类癌症中都是不正常的. 以前的研究[15-17]已经表明, 在不同类型的癌症包括胃癌中这些小的重要的分子的异常调节常常与癌症进展息息相关. 我们的研究可能为胃癌治疗的进一步研究提供一个新的靶点. 此外, 我们通过确定可能的靶向基因来探索miR-155-5p在胃癌发展中的机制. 在本研究中, 我们目的是确定miR-155-5p在胃癌中的表达和功能. 无论如何, 到目前为止, miR-155-5p在胃癌中扮演的角色和机制还没有报道过. 另一方面, miR-155-5p在上皮性卵巢癌, 肝细胞癌和乳腺癌中表达下调, 扮演着肿瘤抑制物的角色. 本研究中, 我们需要确定miR-155-5p在胃癌中的表达和功能, 并探讨mir-155-5p参与胃癌的发展机制.
人胃癌细胞系BGC-823、MKN-45和正常胃上皮细胞系GES-1购自中国医学科学院细胞中心. 细胞培养于10%的牛胎儿血清, 含链霉素和盘尼西林的RPMI 1640介质中, 环境潮湿, 温度37 ℃、CO2浓度50 mL/L. miR-155-5p类似物, 抑制剂和非特异性miRNA负调控分子是从锐博生物公司购买的. SOX4的小干扰RNA由上海吉玛制药技术有限公司设计的.
1.2.1 细胞转染: 细胞转染是根据厂家的说明书用脂质体2000直到50 nmol/L的最终浓度. 转染后培养48 h, 收集细胞做实时荧光定量PCR分析. 所有检测均独立进行3次.
1.2.2 细胞增殖试验: 细胞计数试剂盒(CCK-8, IBL)测定细胞增殖分析, 严格按照说明指示. 细胞接种于96孔培养板中, 在37 ℃恒温条件, 50 mL/L CO2培养箱中分别培养24、48、72及96 h. 在450 nm处的吸光度是采用微板阅读器测量. 所有检测均独立进行3次.
1.2.3 细胞侵袭试验: 细胞的侵袭能力的测定采用Transwell侵袭小室, 严格根据说明指示. 培养48 h后, 细胞被转移到上腔无血清RPMI 1640培养基. 下室中加入含10%胎牛血清的RPMI 1640培养. 在37 ℃恒温下, 细胞在50 mL/L CO2培养箱中孵育24 h. 然后, 在下表面上的浸润细胞进行染色, 结晶紫染色和计数的光镜. 所有检测均独立进行3次.
1.2.4 实时荧光定量PCR: 总RNA是用提取试剂从组织或者细胞提取出来的, 然后将miRNA和mRNA逆转录为cDNA. 逆转录是使用逆转录试剂盒进行的. 实时荧光定量PCR使用SYBR Green PCR试剂盒在ABI7500快速实时PCR系统进行的, 操作过程按照厂家说明书. miR-155-5p的表达均一化到U6, SOX4 mRNA均一化到GAPDH. 所有的试验都重复3次. 相关基因的表达用2-△△Ct的方法计算的.
1.2.5 荧光素酶试验检测试验: SOX4的3'非翻译区域序列预测与miR-155-5p有关, 或者是预测靶点的一个变异序列整合和插入在pGL3的催化剂载体pGL3-SOX4-wt和pGL3-SOX4-mut. 细胞是在一个24孔培养皿中培育的, 然后分别用miR-155-5p类似物或者miRNA控制物, 含有萤火虫荧光素酶的野生型或者突变型pGL3-SOX4质粒, 含有海肾荧光素酶的pGL3-SOX4载体转染. 用脂质体2000试剂进行转染. 转染48 h后收集细胞并且用双荧光素酶报告分析. 所有检测均独立进行3次.
统计学处理 应用SPSS20.0软件分析, 数据以mean±SD表示, 对所有的样本进行正态检验, 采用方差分析法进行组间比较. P<0.05为差异有统计学意义.
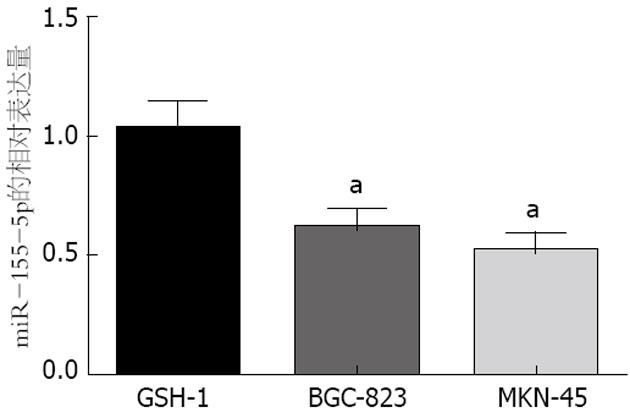
miR-155-5p在20组胃癌组织和非肿瘤组织中的表达是用实时荧光定量PCR方法检测的. 我们发现miR-155-5p在胃癌组织中比在非肿瘤组织中明显下调. 此外miR-155-5p在胃癌细胞系中的表达与在正常胃上皮细胞系GES-1中的表达相比也明显降低(图1).
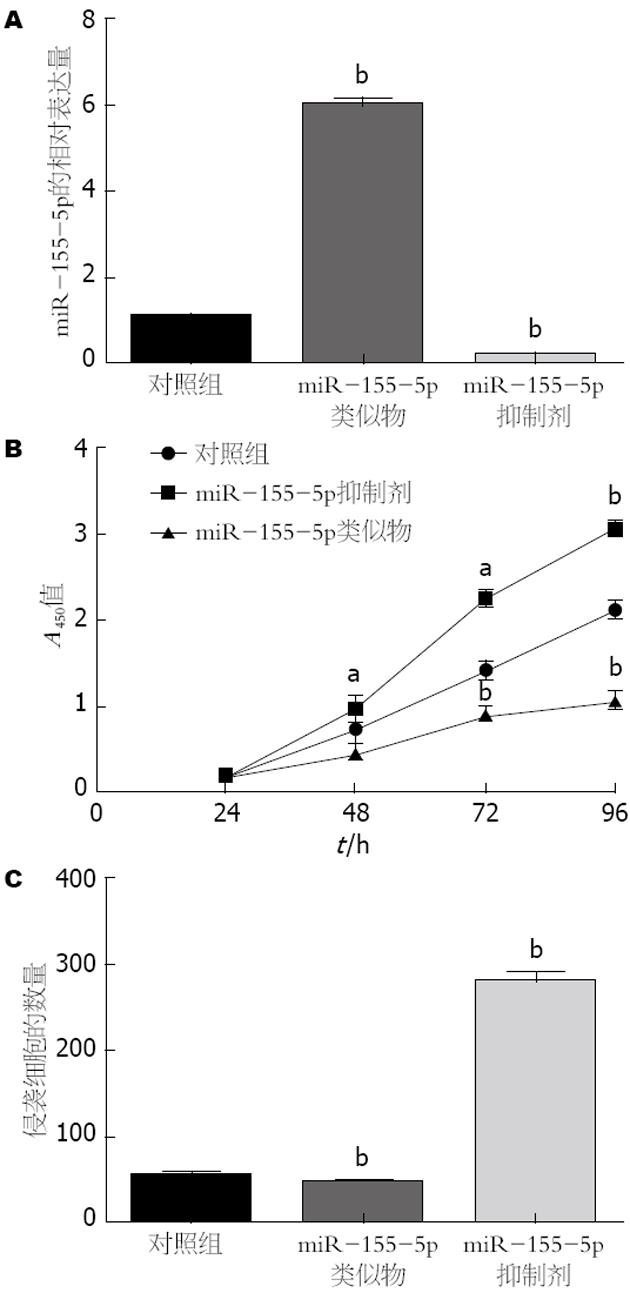
为了研究miR-155-5p在胃癌发病机制中所扮演的角色, miR-155-5p类似物, 抑制剂和相关阴性控制变量组分别整合和转染进BGC-823细胞. 结果表明, 用miR-155-5p类似物转染的实验组BGC-823细胞中miR-155-5p的表达水平比空白对照组升高了, 而用miR-155-5p抑制剂的实验组miR-155-5p的表达水平比空白对照组降低了. 接下来我们研究miR-155-5p对BGC-823细胞增殖的影响. miR-155-5p类似物转染的实验组的细胞增殖率比空白对照组明显降低了. 相反, miR-155-5p抑制剂明显提高了BGC-823细胞的增殖率(图2).
为了检测miR-155-5p是否影响胃癌细胞的活动, 进行侵袭试验. 结果显示与空白对照相比, miR-155-5p类似物显著降低BGC-823细胞的侵袭力, 然而miR-155-5p抑制物提高细胞的侵袭能力(图2).
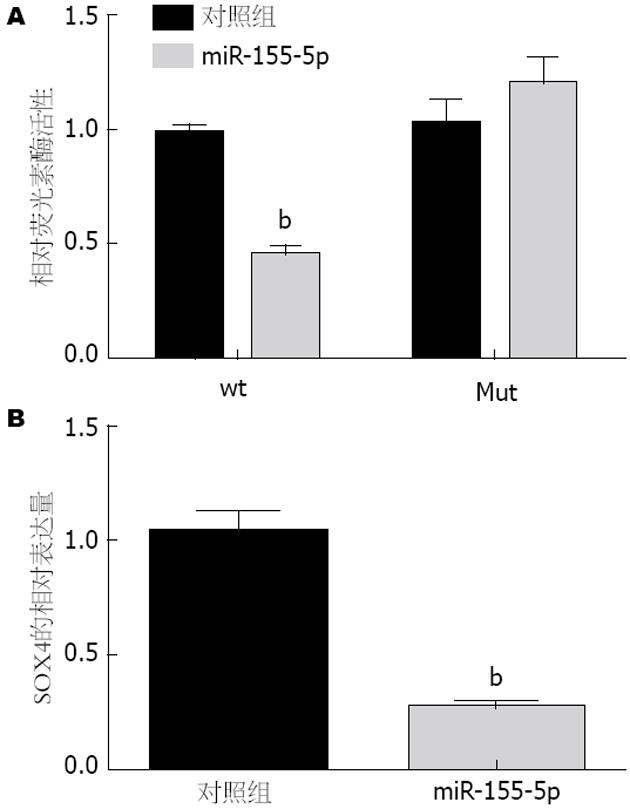
我们发现SOX4 mRNA的3'非翻译区域含有一个miR-155-5p的靶点. 为了确定SOX4是miR-155-5p的一个直接靶点, 进行了荧光素酶检测试验. 结果表明miR-155-5p明显抑制野生型而不是变异型SOX4的3'-UTR的荧光素酶活性. 此外, 实时定量PCR分析显示miR-155-5p的过表达显著降低BGC-823细胞SOX4的表达(图3).
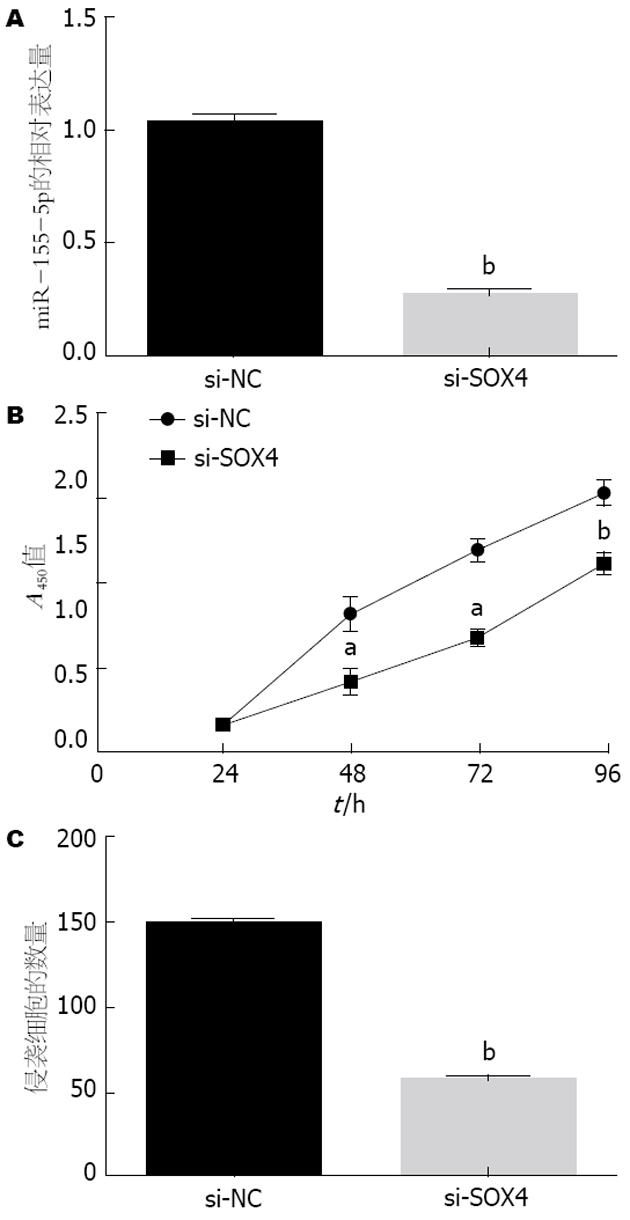
为了确定SOX4在胃癌细胞的增殖和侵袭中作用, 在BGC-823细胞中用小干扰RNA敲除了SOX4. 用si-SOX4转染的SOX4的表达水平与空白对照组相比明显降低了. 敲除SOX4与空白组转染了si-NC的细胞对照抑制了BGC-823细胞的增殖和侵袭. 这些结果显示, 敲除SOX4和miR-155-5p过表达作用相似, SOX4是miR-155-5p重要的功能靶点(图4).
本研究探究miR-155-5p在胃癌患者的肿瘤增殖和侵袭中作用. 结果发现miR-155-5p的表达在胃癌患者中下调. miR-155-5p过表达明显抑制胃癌细胞的增殖和侵袭, 相反, miR-155-5p的表达下调促进胃癌细胞的增殖和侵袭. 结果表明miR-155-5p可能在胃癌的增殖和侵袭中抑制肿瘤. 进一步研究了miR-155-5p抑制胃癌细胞增殖和侵袭的分子机制.
我们用生物信息学和实验确定了在胃癌细胞中SOX4[18]是miR-155-5p的一个直接靶点. 发现SOX4的mRNA的3'非翻译区域包含着一个miR-155-5p的补充序列. miR-155-5p的过表达显著降低胃癌细胞SOX4的表达. SOX4基因是转录因子的SOX4家族的一个成员, 在胚胎发育, 细胞分化和增殖中扮演重要角色[19,20]. 最近的研究[21-23]表明SOX4可能导致肿瘤演进. SOX4的表达水平在人类多种肿瘤中都上调, 包括非小细胞肺癌, 前列腺癌, 结肠癌和肝细胞癌. 而且, SOX4的过表达提高前列腺癌细胞的增殖, 用siRNA敲除SOX4显著降低细胞迁移和侵袭, 表明SOX4在癌症转移中的重要作用[24,25]. Song等[26]发现了SOX4过表达是乳腺癌患者的一个不良预后因素. 此外, 大量的研究显示miRNAs在SOX4的调节中扮演着重要角色[27,28]. 也有研究通过以SOX4为靶点报道了miRNA-138抑制卵巢癌细胞侵袭和转移[29,30].
然而SOX4在胃癌细胞中的表达机制仍然不清楚的. 在我们的研究中SOX4在胃癌组织中表达上调; SOX4在胃癌细胞系中的表达水平比正常胃上皮细胞系GES-1明显升高. 此外, 敲除SOX4抑制胃癌细胞的增殖和侵袭. 研究表明SOX4在胃癌是miR-155-5p的一个功能性靶基因, 并且miR-155-5p的过表达与SOX4的低表达相关, 抑制胃癌细胞的增殖和侵袭. 总之, miR-155-5p通过下调SOX4抑制肿瘤, miR-155-5p可能是胃癌的潜在治疗靶点.
胃癌是最致命的消化系恶性肿瘤, 尽管在外科手术和化疗方面有了新进展, 胃癌的预后仍然不乐观.
刘展, 主任医师, 湖南师范大学第一附属医院(湖南省人民医院)消化科; 王蔚虹, 教授, 主任医师, 北京大学第一医院消化内科
miR-155-5p在胃癌中扮演的角色和机制还没有报道, 在上皮性卵巢癌, 肝细胞癌和乳腺癌中表达下调, 扮演着肿瘤抑制物的角色.
miRNAs: 是小的非编码RNA分子绑定在靶mRNAs的3'非翻译区域, 导致翻译抑制和mRNA退化, 在各种各样的生物学事件比如增殖, 进展, 分化和细胞凋亡中扮演着重要角色.
本研究确定miR-155-5p在胃癌中的表达和功能, 并探讨miR-155-5p参与胃癌的发展机制, 研究对丰富胃癌发生发展的机制和调控有一定价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 江西省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 郭鹏 电编:闫晋利
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Lynch HT, Grady W, Suriano G, Huntsman D. Gastric cancer: new genetic developments. J Surg Oncol. 2005;90:114-133; discussion 133. [PubMed] [DOI] |
| 3. | Kalyani R, Das S, Kumar ML. Spectrum of gastro-intestinal cancers--a ten-year study. J Indian Med Assoc. 2010;108:659-662. [PubMed] |
| 4. | Cananzi FC, Belgaumkar A, Lorenzi B, Mudan S. Liver surgery in the multidisciplinary management of gastrointestinal stromal tumour. ANZ J Surg. 2014;84:937-942. [PubMed] [DOI] |
| 5. | Huang PY, Lin MZ, Wen JP, Li XJ, Shi XL, Zhang HJ, Chen N, Li XY, Yang SY, Chen G. Correlation of early postoperative blood glucose levels with postoperative complications, hospital costs, and length of hospital stay in patients with gastrointestinal malignancies. Endocrine. 2015;48:187-194. [PubMed] [DOI] |
| 6. | Shi J, Zhang G, Yao D, Liu W, Wang N, Ji M, He N, Shi B, Hou P. Prognostic significance of aberrant gene methylation in gastric cancer. Am J Cancer Res. 2012;2:116-129. [PubMed] |
| 7. | Tanaka N, Katai H, Taniguchi H, Saka M, Morita S, Fukagawa T, Gotoda T. Trends in characteristics of surgically treated early gastric cancer patients after the introduction of gastric cancer treatment guidelines in Japan. Gastric Cancer. 2010;13:74-77. [PubMed] [DOI] |
| 8. | Zhou X, Li L, Su J, Zhang G. Decreased miR-204 in H. pylori-associated gastric cancer promotes cancer cell proliferation and invasion by targeting SOX4. PLoS One. 2014;9:e101457. [PubMed] [DOI] |
| 9. | Shukla GC, Singh J, Barik S. MicroRNAs: Processing, Maturation, Target Recognition and Regulatory Functions. Mol Cell Pharmacol. 2011;3:83-92. [PubMed] |
| 10. | Lionetti M, Agnelli L, Lombardi L, Tassone P, Neri A. MicroRNAs in the pathobiology of multiple myeloma. Curr Cancer Drug Targets. 2012;12:823-837. [PubMed] |
| 11. | Cai K, Shen F, Cui JH, Yu Y, Pan HQ. Expression of miR-221 in colon cancer correlates with prognosis. Int J Clin Exp Med. 2015;8:2794-2798. [PubMed] |
| 12. | Chu TH, Yang CC, Liu CJ, Lui MT, Lin SC, Chang KW. miR-211 promotes the progression of head and neck carcinomas by targeting TGFβRII. Cancer Lett. 2013;337:115-124. [PubMed] [DOI] |
| 13. | Qu YL, Wang HF, Sun ZQ, Tang Y, Han XN, Yu XB, Liu K. Up-regulated miR-155-5p promotes cell proliferation, invasion and metastasis in colorectal carcinoma. Int J Clin Exp Pathol. 2015;8:6988-6994. [PubMed] |
| 14. | Baba O, Hasegawa S, Nagai H, Uchida F, Yamatoji M, Kanno NI, Yamagata K, Sakai S, Yanagawa T, Bukawa H. MicroRNA-155-5p is associated with oral squamous cell carcinoma metastasis and poor prognosis. J Oral Pathol Med. 2016;45:248-255. [PubMed] [DOI] |
| 15. | Xia B, Yang S, Liu T, Lou G. miR-211 suppresses epithelial ovarian cancer proliferation and cell-cycle progression by targeting Cyclin D1 and CDK6. Mol Cancer. 2015;14:57. [PubMed] [DOI] |
| 16. | Jiang G, Cui Y, Yu X, Wu Z, Ding G, Cao L. miR-211 suppresses hepatocellular carcinoma by downregulating SATB2. Oncotarget. 2015;6:9457-9466. [PubMed] [DOI] |
| 17. | Shen R, Pan S, Qi S, Lin X, Cheng S. Epigenetic repression of microRNA-129-2 leads to overexpression of SOX4 in gastric cancer. Biochem Biophys Res Commun. 2010;394:1047-1052. [PubMed] [DOI] |
| 18. | Wang D, Hao T, Pan Y, Qian X, Zhou D. Increased expression of SOX4 is a biomarker for malignant status and poor prognosis in patients with non-small cell lung cancer. Mol Cell Biochem. 2015;402:75-82. [PubMed] [DOI] |
| 19. | Bowles J, Schepers G, Koopman P. Phylogeny of the SOX family of developmental transcription factors based on sequence and structural indicators. Dev Biol. 2000;227:239-255. [PubMed] [DOI] |
| 20. | Foronda M, Morgado-Palacin L, Gómez-López G, Domínguez O, Pisano DG, Blasco MA. Profiling of Sox4-dependent transcriptome in skin links tumour suppression and adult stem cell activation. Genom Data. 2015;6:21-24. [PubMed] [DOI] |
| 21. | Lin CM, Fang CL, Hseu YC, Chen CL, Wang JW, Hsu SL, Tu MD, Hung ST, Tai C, Uen YH. Clinical and Prognostic Implications of Transcription Factor SOX4 in Patients with Colon Cancer. PLoS One. 2013;8:e67128. [PubMed] [DOI] |
| 22. | Wang L, Li Y, Yang X, Yuan H, Li X, Qi M, Chang YW, Wang C, Fu W, Yang M. ERG-SOX4 interaction promotes epithelial-mesenchymal transition in prostate cancer cells. Prostate. 2014;74:647-658. [PubMed] [DOI] |
| 23. | Chen X, Zhang L, Zhang T, Hao M, Zhang X, Zhang J, Xie Q, Wang Y, Guo M, Zhuang H. Methylation-mediated repression of microRNA 129-2 enhances oncogenic SOX4 expression in HCC. Liver Int. 2013;33:476-486. [PubMed] [DOI] |
| 24. | Wang L, Zhang J, Yang X, Chang YW, Qi M, Zhou Z, Zhang J, Han B. SOX4 is associated with poor prognosis in prostate cancer and promotes epithelial-mesenchymal transition in vitro. Prostate Cancer Prostatic Dis. 2013;16:301-307. [PubMed] [DOI] |
| 25. | Zhang J, Liang Q, Lei Y, Yao M, Li L, Gao X, Feng J, Zhang Y, Gao H, Liu DX. SOX4 induces epithelial-mesenchymal transition and contributes to breast cancer progression. Cancer Res. 2012;72:4597-4608. [PubMed] [DOI] |
| 26. | Song GD, Sun Y, Shen H, Li W. SOX4 overexpression is a novel biomarker of malignant status and poor prognosis in breast cancer patients. Tumour Biol. 2015;36:4167-4173. [PubMed] [DOI] |
| 27. | Zhang H, Alberich-Jorda M, Amabile G, Yang H, Staber PB, Di Ruscio A, Welner RS, Ebralidze A, Zhang J, Levantini E. Sox4 is a key oncogenic target in C/EBPα mutant acute myeloid leukemia. Cancer Cell. 2013;24:575-588. [PubMed] [DOI] |
| 28. | Parvani JG, Schiemann WP. Sox4, EMT programs, and the metastatic progression of breast cancers: mastering the masters of EMT. Breast Cancer Res. 2013;15:R72. [PubMed] [DOI] |
| 29. | Liu Y, Li Y, Liu J, Wu Y, Zhu Q. MicroRNA-132 inhibits cell growth and metastasis in osteosarcoma cell lines possibly by targeting Sox4. Int J Oncol. 2015;47:1672-1684. [PubMed] [DOI] |
| 30. | Li Y, Zu L, Wang Y, Wang M, Chen P, Zhou Q. miR-132 inhibits lung cancer cell migration and invasion by targeting SOX4. J Thorac Dis. 2015;7:1563-1569. [PubMed] [DOI] |