修回日期: 2016-07-13
接受日期: 2016-07-19
在线出版日期: 2016-08-08
肝细胞癌(hepatocellular carcinoma, HCC)是一种高发恶性肿瘤, 糖原代谢则是肝脏内重要的代谢过程, 其涉及的多种酶和蛋白在HCC发生过程中可发生结构、功能及表达水平的改变实现代谢重编程, 进而调控整个糖原代谢网络使其适合HCC生长. 本文主要总结葡萄糖转运体、糖原合成酶激酶3β、糖原磷酸化酶等糖原代谢调控因子, 近年来在糖原代谢重编程方面的研究进展.
核心提示: 肝细胞癌发生过程中, 葡萄糖转运体、糖原合成酶激酶3β、糖原磷酸化酶等糖原代谢调控因子可发生结构功能或表达水平的改变实现代谢重编程, 进而调控整个糖原代谢网络使其适合肝癌生长.
引文著录: 卢君, 夏强, 龙喜带. 肝细胞癌糖原代谢重编程的研究进展. 世界华人消化杂志 2016; 24(22): 3391-3397
Revised: July 13, 2016
Accepted: July 19, 2016
Published online: August 8, 2016
Hepatocellular carcinoma (HCC) is a highly prevalent malignant tumor. Abnormal glycogen metabolism, an important metabolism process in HCC, mainly results from the variant structure, function, and expression levels of the corresponding enzymes and proteins. This variation, also called metabolic reprogramming, can regulate glycogen metabolic pathway to promote HCC tumorigenesis. This review aims to summarize glycogen metabolism-regulated factors (including glucose transporters, glycogen synthase kinase 3β, and glycogen phosphorylase) involved in glycogen metabolic reprogramming in HCC
- Citation: Lu J, Xia Q, Long XD. Glycogen metabolic reprogramming in hepatocellular carcinoma: An update. Shijie Huaren Xiaohua Zazhi 2016; 24(22): 3391-3397
- URL: https://www.wjgnet.com/1009-3079/full/v24/i22/3391.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i22.3391
肝细胞癌(hepatocellular carcinoma, HCC)是最常见的恶性肿瘤之一, 且我国是HCC的高发病地区. 根据GLOBOCAN 2012的估计[1], 2012年世界HCC发病782451例, 占同期世界癌症发病总数的5.6%; 而中国发病394770例, 占同期中国癌症发病总数的12.9%, 该比重是世界水平的2.21倍. HCC的发生过程是涉及多个基因与蛋白的复杂过程, HCC细胞的代谢活动与正常细胞存在诸多差异, 其中某些异常改变可能对HCC的发生发展有一定的作用.
20世纪30年代, 德国生物化学家Warburg研究显示即使在有氧条件下肿瘤细胞仍然选择以糖酵解的方式产生能量, 该现象被称为"瓦伯格效应"(Warburg effect)或"有氧糖酵解"[2], 随后的研究提示该效应的出现是肿瘤细胞内代谢相关酶基因活性和表达异常的结果, 这种现象被称之为代谢重编程. 近年来, 关于糖原代谢重编程及其在HCC等肿瘤中的重要性越发受到研究者们的关注, 本文将对HCC在糖原代谢重编程及相关代谢酶等方面的研究进展作简要综述.
糖原是由葡萄糖结合而成的支链多糖, 主要贮存于肝脏与骨骼肌内, 是机体主要的能量来源. 糖原代谢涉及到合成与分解两个过程, 对于合成代谢来说, 肝细胞或骨骼肌细胞首先通过葡萄糖转运体(glucose transporters, GLUTs)将葡萄糖转运到细胞内, 然后在糖原合成酶等的作用下, 以糖原生成蛋白为葡萄糖基的受体合成直链多糖[3], 在分支酶作用再合成支链多糖. 当机体需要时, 糖原可通过胞质途径和溶酶体途径两条途径进行分解, 其中胞质途径是主要的分解代谢途径, 糖原磷酸化酶和脱支酶为调控该途径的关键酶; 糖原分解代谢过程可随机体不同生理状态而变化, 在有无氧条件下, 可通过糖酵解方式进行分解代谢. 但在一些疾病如肿瘤发生发展过程中, 糖原的代谢存在异常变化, 如即使在有氧条件下, 肿瘤细胞也是通过糖酵解方式获得能量, 可能机制是肿瘤细胞通过代谢重编程方式对糖原进行再调控. 研究[4]表明糖原代谢重编程可通过如下机制实现: 通过影响GLUTs功能或表达而调节葡萄糖摄取, 进而影响糖原的合成; 通过影响一些酶如蛋白激酶A、磷酸化酶激酶、蛋白激酶C、蛋白激酶CK1H和CK2、糖原合酶激酶3β(glycogen synthase kinase 3β, GSK-3β)等的活性或表达而调节糖原合成酶的磷酸化状态, 间接调节后者的活性, 进而调控糖原代谢过程[5]; 通过改变糖原磷酸化酶的脑型(brain-type glycogen phosphorylase, PYGB)与肝型(liver-type glycogen phosphorylase, PYGL)表达水平而影响分解代谢[6]. 此外, 葡萄糖磷酸变位酶和葡萄糖-6-磷酸酶的异常也可能是重要原因, 因为他们在糖原主要代谢产物葡糖-1-磷酸转变为葡萄糖-6-磷酸、进而转变成游离葡萄糖过程中发挥作用, 他们缺乏或功能缺陷可导致糖原代谢异常, 引起糖原贮积[7-9]. 流行病学调查表明葡萄糖-6-磷酸酶基因缺陷所引起的Ⅰ型糖原贮积症患者比正常人更容易罹患肝腺瘤和HCC[8,10-12], 临床病理学研究进一步证实葡萄糖-6-磷酸酶活性与HCC肿瘤细胞去分化正相关, 低分化HCC细胞者酶低活性, 这些结果提示由于葡萄糖-6-磷酸酶缺陷所导致的HCC细胞摄取葡萄糖减少在肿瘤的演进中起重要作用[13,14].
GLUTs是由是由溶质载体2(solute carrier 2, SLC2)家族基因编码的内在膜蛋白, 属于主要协助转运蛋白超家族(major facilitator superfamily, MFS). 目前已确认GLUTs有14种同工型, 其广泛存在于人体内, 几乎每个细胞上都存在至少一种GLUTs的同工型, 因此普遍认为GLUTs是整个机体葡萄糖稳态的关键调控者. GLUTs在结构上具有高度同源性, 他们均由约500个氨基酸组成, 都有12个跨膜螺旋环、1个N-糖基化位点和1个相对较大的、中心的细胞质连接区, 并且N端和C端均位于细胞质内侧[15]. 14种人GLUT蛋白有着不同的底物特异性, 参与肌醇[16]、尿酸[17]、氨基葡萄糖[18]、抗坏血酸[19]以及多种己糖的转运, 其中有11种同工型能在实验条件下转运葡萄糖, 但是多数GLUT蛋白的主要生理底物尚未确定[20]. 基于片段相似性以及结构和功能特点, GLUTs被划分为3个不同类别: Class 1(GLUTs 1-4、14), Class 2 (GLUTs 5、7、9和11), 以及Class 3(GLUTs 6、8、10、12和HMIT). Class 1和Class 2的GLUTs在结构上与Class 3有明显的区别, 前两者的N-糖基化位点定位在第一个外表面连接区, 而后者定位在第五个外表面连接区.
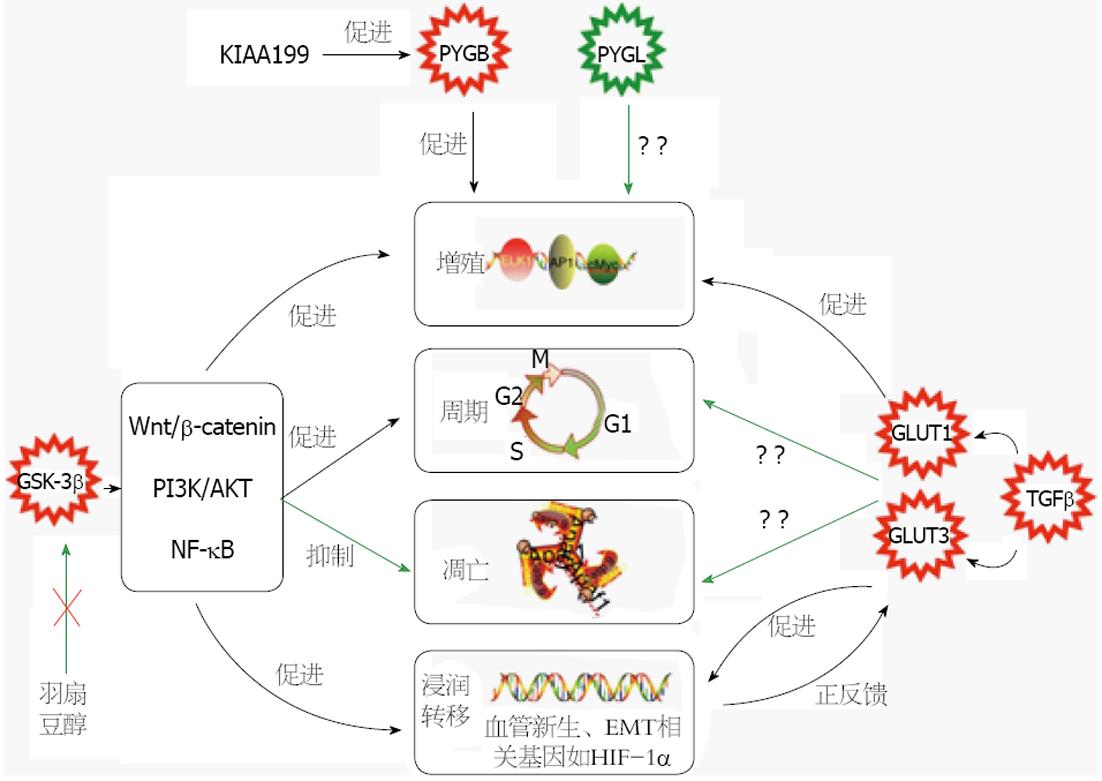
在多种实体瘤细胞中都观察到了GLUT1和GLUT3的过表达现象, 可能与肿瘤加强有氧条件下葡萄糖摄取的行为有关[21-23]. 在HCC细胞中, 同样发现GLUT1和GLUT3存在高表达(图1)[24,25], 并且TGF-β表达量的变化与GLUT1和GLUT3类似, 提示GLUT1和GLUT3表达增强可能是TGF-β所诱导. Amann等[4]研究发现GLUT1的表达水平能够影响其HCC细胞系的致瘤性, 通过RNA干扰技术抑制GLUT1表达可损伤HCC细胞的生长及迁移能力, 并且下调葡萄糖摄取和乳酸分泌; 缺氧条件能进一步上调GLUT1在HCC细胞中的表达水平, 并且该诱导变化依赖于转录因子缺氧诱导因子1α(hypoxia-inducible factor-1α, HIF-1α)的活化. GLUT-1的表达量改变对HCC细胞的葡萄糖摄取有重要的调控作用, 对HCC的糖原代谢及生长存活影响显著, 因此GLUT-1可能成为高侵袭性肿瘤的一个新的治疗靶点. 2014年GLUT-1的晶体结构得以解析[26], 为研发靶向GLUT1的治疗药物提供了指导方向. GLUT3与GLUT1有所不同, GLUT3在HCC细胞中的过表达主要发生在间充质组织中, 而非上皮组织, 其表达可在上皮间充质转化(epithelial-mesenchymal transition, EMT)中被诱导, 并且GLUT3可能在成功建立或维持EMT中起作用, 使肿瘤细胞获得更高的迁移和侵袭能力[27,28].
GSK-3是一种多功能的丝氨酸/苏氨酸激酶, 普遍存在于哺乳动物真核细胞中. GSK-3有两种亚型: GSK-3α和GSK-3β, 分别由不同的基因编码, 他们的激酶结构域具有98%的高度同源性, 但C端末端的76个残基仅有36%的同源性[29]. GSK-3最初被发现的功能是对糖原合成酶活性的调控作用, GSK-3能够磷酸化糖原合成酶的位点3从而使其失活, 他对糖原合成酶持续的磷酸化作用是糖原合成酶在基础状态下一直保持在低活性水平的主要原因[30]. 除了对糖原合成酶的调控之外, GSK-3α和GSK-3β的其他功能并不一致, 目前研究主要集中在GSK-3β. 研究[31]发现, 敲除小鼠的GSK-3β基因可导致胚胎死于严重的肝变性, 但是GSK-3α的存在无法补救此后果. 此外, GSK-3β还是多条信号通路中重要的信号分子, 参与细胞分裂、增殖、分化、凋亡等过程的调控, 其涉及的信号通路有Wnt/β-catenin通路、PI3K/AKT通路、核因子κB信号通路等[32,33], 其中PI3K/AKT通路在HCC发生的早期即被激活, Wnt/β-catenin通路则是在后期被激活[34], 这些信号通路的异常活化与肿瘤的发生、肿瘤细胞的增殖及恶性转化密切相关.
GSK-3β的活性可被AKT调节, AKT能够磷酸化GSK-3β的9号丝氨酸位点使之失活, 从而抑制GSK-3β对糖原合成酶的磷酸化, 上调糖原合成酶活性. 胰岛素能够通过PI3K/AKT途径使GSK-3β失活, 一般情况下, 这是胰岛素激活糖原合成酶的主要方式[35,36]. 尽管已有实验显示糖原合成酶的活性在多种HCC细胞系中均下调[37], 并且另有实验发现激活型的GSK-3β在HCC细胞中呈过表达(图1)[38], 但是HCC细胞糖原代谢中GSK-3β表达与糖原合成酶活性并未发现明确的相关性, 原因可能是糖原合成酶的活性可能同时受其他信号蛋白所调控. 在敲除胰岛素受体1的HCC细胞中过表达AKT1依然能够上调糖原合成酶的活性, 但是糖原合成酶活性的上调与GSK-3β并没有相关性[39], 可能AKT能够通过其他途径使糖原合成酶活性增强, 进而促进糖原合成. 对于不同肿瘤的增殖, GSK-3β可能起相反的作用. 在某些肿瘤中, 例如乳腺癌[40]、皮肤鳞癌[41], 活化型GSK-3β对肿瘤的生长起抑制作用, 但是在HCC中截然相反, 失活型GSK-3β表达缺失, 而活化型GSK-3β呈现过表达[38,42], 提示活化型的GSK-3β对HCC生长起到促进作用. 近来有研究显示羽扇豆醇可抑制GSK-3β磷酸化, HCC细胞增殖同时受到抑制, 提示GSK-3β失活能够抑制HCC细胞的生长[43].
糖原磷酸化酶是糖原分解的关键酶, 其作用于糖链的非还原端的α-1, 4-糖苷键, 催化分解一个葡萄糖基, 生成葡糖-1-磷酸. 糖原磷酸化酶主要有3种同工型: 肌型(mucle-type glycogen phosphorylase, PYGM)、脑型(brain-type glycogen phosphorylase, PYGB)和肝型(liver-type glycogen phosphorylase, PYGL), 他们分别由3个不同的基因所编码. 其中PYGL与另外两种同工型都具有80%的同源性, 而PYGM与PYGB具有83%的同源性[44]. 3种同工酶都为二聚体结构, 分别由841(PYGM)、862(PYGB)及846(PYGL)个氨基酸组成, 二聚体的每个亚基的中心都有一个磷酸吡哆醛辅基以共价键与赖氨酸残基连接. 通过磷酸化糖原磷酸化酶的14号丝氨酸位点, 糖原磷酸化酶可由低活性的去磷酸化形式(GPb)转变为高活性的磷酸化形式(GPa), 此过程由磷酸化酶激酶(phosphorylase kinase, PhK)催化, 而后者为c-AMP依赖的蛋白激酶A和钙离子水平的升高所激活[5,45-47]. 3种同工酶的生理功能有明显不同, PYGM主要功能是释放葡萄糖为肌肉收缩快速供能, PYGB可在短暂缺氧或低血糖时期释放葡萄糖, PYGL则主要为肝外组织提供游离葡萄糖, 调节血糖水平[44,48].
通过抑制糖原磷酸酶活性, 阻碍糖原的降解, 能够抑制肿瘤细胞的增殖并且诱导其凋亡[49]. 在正常肝细胞中主要的表达亚型是PYGL, 1972年Sako等[6]学者研究发现在大鼠HCC细胞中主要表达的是PYGB, 而非PYGL(图1). 根据PYGB的生理功能, 该转变的发生可能与HCC细胞缺氧或葡萄糖含量不足有关, 但目前尚无研究能够阐明相应机制. Terashima等[50]研究发现, 在胃癌及HCC细胞系中, KIAA1199能够作用于糖原磷酸化酶激酶B, 通过增强PYGB活性使肿瘤的糖原分解代谢增强, 同时发现肿瘤的生长受到促进. 目前PYGL在HCC中的相关研究较少, 尚待进一步探索, 但是已在其他肿瘤细胞中发现PYGL对肿瘤生长的重要作用, Favaro等[51]学者发现在缺氧的脑胶质瘤、乳腺癌以及结肠癌细胞中, PYGL的消耗使得糖原累积, 导致氧化应激, 诱导衰老, 影响肿瘤生长.
糖原代谢过程涉及多种酶和蛋白, HCC发生过程中这些酶和蛋白可发生结构功能及表达的改变实现代谢重编程, 进而调控整个糖原代谢网络使其适合HCC生长. 当前的研究显示, GLUT-1的高表达可增强HCC细胞的葡萄糖摄取促进糖原合成及HCC生长, 可能成为HCC治疗的潜在靶点; HCC细胞糖原合成酶活性与GSK-3β的关系尚未发现明确的相关性, 可能因为糖原合成酶同时受到其他信号蛋白调控; PYGB取代PYGL成为主要表达的糖原磷酸化酶亚型是HCC细胞的特征, 但发生这一转变的具体机制尚不明确. 以上存疑之处若能够阐明, 将有助于进一步理解HCC的糖原代谢重编程及其对HCC发生发展的意义, 从而对HCC的治疗提出新的可能性.
肝细胞癌(hepatocellular carcinoma, HCC)是最常见的恶性肿瘤之一, 其发生与发展过程复杂, 涉及多个基因与蛋白. Warburg效应早在20世纪30年代已被发现, 而糖原代谢重编程对于肿瘤发生发展的重要性则是近年来才受到关注. 葡萄糖转运体(glucose transporters, GLUTs)、糖原合成酶激酶3β(glycogen synthase kinase-3β, GSK-3β)、糖原磷酸化酶等糖原代谢调控因子在HCC糖原代谢重编程中的研究目前尚有许多值得探索之处.
崔杰峰, 副研究员, 硕士生导师, 复旦大学附属中山医院肝癌研究所; 王凯峰, 副主任医师, 浙江大学医学院附属邵逸夫医院
GLUT-1的高表达可增强HCC细胞的葡萄糖摄取促进糖原合成及HCC生长, 可能成为HCC治疗的潜在靶点; GSK-3β在HCC糖原重编程中作用的具体机制, 以及PYGB与PYGL在HCC中表达量改变的意义, 都是目前值得探讨的问题.
研究表明GLUT-1的表达量改变对HCC细胞的葡萄糖摄取有重要的调控作用, 对HCC的糖原代谢及生长存活影响显著, 因此GLUT-1可能成为高侵袭性肿瘤的一个新的治疗靶点.
糖原代谢重编程对于肿瘤的发生、发展有重要意义, 近年来才被研究者们所关注, 但是目前的研究十分有限, 研究其机制有助于了解肿瘤的发生发展机制, 为肿瘤治疗提供指引.
本文进一步明确GLUTs、GSK-3β、糖原磷酸化酶等糖原代谢调控因子在HCC糖原代谢重编程中的作用机制, 能够为HCC的治疗带来新方向.
代谢重编程: 德国生理学家Otto.Warburg发现, 某些癌细胞即使在有氧环境下也依赖葡萄糖的无氧酵解提供能量, 称为Warburg效应, 是肿瘤细胞内代谢相关酶基因活性和表达异常的结果, 即代谢重编程, 此现象在肿瘤的糖原代谢、核酸代谢以及脂类代谢过程均存在.
本文主要对GLUTs、GSK-3β、糖原磷酸化酶等糖原代谢调控因子在HCC糖原代谢重编程方面的研究进展进行了一个简要总结和综述, 整篇综述叙述条理清晰, 重点突出, 基本反映了近来HCC糖原代谢的一些研究趋势, 对HCC糖原代谢研究有一定的参考价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 上海市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 郭鹏 电编:闫晋利
| 1. | Ferlay J, Soerjomataram I, Ervik M, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D, Bray . GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC CancerBase No. 11 [Internet]. Lyon, France: International Agency for Research on Cancer, 2013. Available from: http: //globocan.iarc.fr, accessed on day/month/year. |
| 3. | Benarroch EE. Glycogen metabolism: metabolic coupling between astrocytes and neurons. Neurology. 2010;74:919-923. [PubMed] [DOI] |
| 4. | Amann T, Maegdefrau U, Hartmann A, Agaimy A, Marienhagen J, Weiss TS, Stoeltzing O, Warnecke C, Schölmerich J, Oefner PJ. GLUT1 expression is increased in hepatocellular carcinoma and promotes tumorigenesis. Am J Pathol. 2009;174:1544-1552. [PubMed] [DOI] |
| 5. | Loughlin WA. Recent advances in the allosteric inhibition of glycogen phosphorylase. Mini Rev Med Chem. 2010;10:1139-1155. [PubMed] |
| 6. | Sato K, Morris HP, Weinhouse S. Phosphorylase: a new isozyme in rat hepatic tumors and fetal liver. Science. 1972;178:879-881. [PubMed] |
| 7. | Ozen H. Glycogen storage diseases: new perspectives. World J Gastroenterol. 2007;13:2541-2553. [PubMed] |
| 8. | Wolfsdorf JI, Weinstein DA. Glycogen storage diseases. Rev Endocr Metab Disord. 2003;4:95-102. [PubMed] |
| 9. | Jeon JY, Lee H, Park J, Lee M, Park SW, Kim JS, Lee M, Cho B, Kim K, Choi AM. The regulation of glucose-6-phosphatase and phosphoenolpyruvate carboxykinase by autophagy in low-glycolytic hepatocellular carcinoma cells. Biochem Biophys Res Commun. 2015;463:440-446. [PubMed] [DOI] |
| 10. | Bannasch P, Hacker HJ, Klimek F, Mayer D. Hepatocellular glycogenosis and related pattern of enzymatic changes during hepatocarcinogenesis. Adv Enzyme Regul. 1984;22:97-121. [PubMed] |
| 11. | Bianchi L. Glycogen storage disease I and hepatocellular tumours. Eur J Pediatr. 1993;152 Suppl 1:S63-S70. [PubMed] |
| 12. | Limmer J, Fleig WE, Leupold D, Bittner R, Ditschuneit H, Beger HG. Hepatocellular carcinoma in type I glycogen storage disease. Hepatology. 1988;8:531-537. [PubMed] |
| 13. | Calderaro J, Labrune P, Morcrette G, Rebouissou S, Franco D, Prévot S, Quaglia A, Bedossa P, Libbrecht L, Terracciano L. Molecular characterization of hepatocellular adenomas developed in patients with glycogen storage disease type I. J Hepatol. 2013;58:350-357. [PubMed] [DOI] |
| 14. | Torizuka T, Tamaki N, Inokuma T, Magata Y, Sasayama S, Yonekura Y, Tanaka A, Yamaoka Y, Yamamoto K, Konishi J. In vivo assessment of glucose metabolism in hepatocellular carcinoma with FDG-PET. J Nucl Med. 1995;36:1811-1817. [PubMed] |
| 15. | Mueckler M, Caruso C, Baldwin SA, Panico M, Blench I, Morris HR, Allard WJ, Lienhard GE, Lodish HF. Sequence and structure of a human glucose transporter. Science. 1985;229:941-945. [PubMed] |
| 16. | Uldry M, Ibberson M, Horisberger JD, Chatton JY, Riederer BM, Thorens B. Identification of a mammalian H(+)-myo-inositol symporter expressed predominantly in the brain. EMBO J. 2001;20:4467-4477. [PubMed] [DOI] |
| 17. | So A, Thorens B. Uric acid transport and disease. J Clin Invest. 2010;120:1791-1799. [PubMed] [DOI] |
| 18. | Maher F, Harrison LC. Hexose specificity for downregulation of HepG2/brain-type glucose transporter gene expression in L6 myocytes. Diabetologia. 1990;33:641-648. [PubMed] |
| 19. | Lee YC, Huang HY, Chang CJ, Cheng CH, Chen YT. Mitochondrial GLUT10 facilitates dehydroascorbic acid import and protects cells against oxidative stress: mechanistic insight into arterial tortuosity syndrome. Hum Mol Genet. 2010;19:3721-3733. [PubMed] [DOI] |
| 20. | Thorens B, Mueckler M. Glucose transporters in the 21st Century. Am J Physiol Endocrinol Metab. 2010;298:E141-E145. [PubMed] [DOI] |
| 21. | Ramani P, Headford A, May MT. GLUT1 protein expression correlates with unfavourable histologic category and high risk in patients with neuroblastic tumours. Virchows Arch. 2013;462:203-209. [PubMed] [DOI] |
| 22. | Shim BY, Jung JH, Lee KM, Kim HJ, Hong SH, Kim SH, Sun DS, Cho HM. Glucose transporter 1 (GLUT1) of anaerobic glycolysis as predictive and prognostic values in neoadjuvant chemoradiotherapy and laparoscopic surgery for locally advanced rectal cancer. Int J Colorectal Dis. 2013;28:375-383. [PubMed] [DOI] |
| 23. | Younes M, Lechago LV, Somoano JR, Mosharaf M, Lechago J. Wide expression of the human erythrocyte glucose transporter Glut1 in human cancers. Cancer Res. 1996;56:1164-1167. [PubMed] |
| 24. | Su TS, Tsai TF, Chi CW, Han SH, Chou CK. Elevation of facilitated glucose-transporter messenger RNA in human hepatocellular carcinoma. Hepatology. 1990;11:118-122. [PubMed] |
| 25. | Yamamoto T, Seino Y, Fukumoto H, Koh G, Yano H, Inagaki N, Yamada Y, Inoue K, Manabe T, Imura H. Over-expression of facilitative glucose transporter genes in human cancer. Biochem Biophys Res Commun. 1990;170:223-230. [PubMed] |
| 26. | Deng D, Xu C, Sun P, Wu J, Yan C, Hu M, Yan N. Crystal structure of the human glucose transporter GLUT1. Nature. 2014;510:121-125. [PubMed] [DOI] |
| 27. | Masin M, Vazquez J, Rossi S, Groeneveld S, Samson N, Schwalie PC, Deplancke B, Frawley LE, Gouttenoire J, Moradpour D. GLUT3 is induced during epithelial-mesenchymal transition and promotes tumor cell proliferation in non-small cell lung cancer. Cancer Metab. 2014;2:11. [PubMed] [DOI] |
| 28. | Park SY, Kim HS, Kim NH, Ji S, Cha SY, Kang JG, Ota I, Shimada K, Konishi N, Nam HW. Snail1 is stabilized by O-GlcNAc modification in hyperglycaemic condition. EMBO J. 2010;29:3787-3796. [PubMed] [DOI] |
| 29. | Woodgett JR. Molecular cloning and expression of glycogen synthase kinase-3/factor A. EMBO J. 1990;9:2431-2438. [PubMed] |
| 30. | Roach PJ. Control of glycogen synthase by hierarchal protein phosphorylation. FASEB J. 1990;4:2961-2968. [PubMed] |
| 31. | Hoeflich KP, Luo J, Rubie EA, Tsao MS, Jin O, Woodgett JR. Requirement for glycogen synthase kinase-3beta in cell survival and NF-kappaB activation. Nature. 2000;406:86-90. [PubMed] [DOI] |
| 32. | Beaulieu JM, Gainetdinov RR, Caron MG. The Akt-GSK-3 signaling cascade in the actions of dopamine. Trends Pharmacol Sci. 2007;28:166-172. [PubMed] [DOI] |
| 33. | Doble BW, Woodgett JR. GSK-3: tricks of the trade for a multi-tasking kinase. J Cell Sci. 2003;116:1175-1186. [PubMed] |
| 34. | Chung W, Kim M, de la Monte S, Longato L, Carlson R, Slagle BL, Dong X, Wands JR. Activation of signal transduction pathways during hepatic oncogenesis. Cancer Lett. 2016;370:1-9. [PubMed] [DOI] |
| 35. | Cross DA, Alessi DR, Cohen P, Andjelkovich M, Hemmings BA. Inhibition of glycogen synthase kinase-3 by insulin mediated by protein kinase B. Nature. 1995;378:785-789. [PubMed] [DOI] |
| 36. | Qiao M, Sheng S, Pardee AB. Metastasis and AKT activation. Cell Cycle. 2008;7:2991-2996. [PubMed] [DOI] |
| 37. | Sato K, Morris HP, Weinhouse S. Characterization of glycogen synthetases and phosphorylases in transplantable rat hepatomas. Cancer Res. 1973;33:724-733. [PubMed] |
| 38. | Mai W, Kawakami K, Shakoori A, Kyo S, Miyashita K, Yokoi K, Jin M, Shimasaki T, Motoo Y, Minamoto T. Deregulated GSK3{beta} sustains gastrointestinal cancer cells survival by modulating human telomerase reverse transcriptase and telomerase. Clin Cancer Res. 2009;15:6810-6819. [PubMed] [DOI] |
| 39. | Varma S, Khandelwal RL. Overexpression of Akt1 upregulates glycogen synthase activity and phosphorylation of mTOR in IRS-1 knockdown HepG2 cells. J Cell Biochem. 2008;103:1424-1437. [PubMed] [DOI] |
| 40. | Farago M, Dominguez I, Landesman-Bollag E, Xu X, Rosner A, Cardiff RD, Seldin DC. Kinase-inactive glycogen synthase kinase 3beta promotes Wnt signaling and mammary tumorigenesis. Cancer Res. 2005;65:5792-5801. [PubMed] [DOI] |
| 41. | Ma C, Wang J, Gao Y, Gao TW, Chen G, Bower KA, Odetallah M, Ding M, Ke Z, Luo J. The role of glycogen synthase kinase 3beta in the transformation of epidermal cells. Cancer Res. 2007;67:7756-7764. [PubMed] [DOI] |
| 42. | Gotoh J, Obata M, Yoshie M, Kasai S, Ogawa K. Cyclin D1 over-expression correlates with beta-catenin activation, but not with H-ras mutations, and phosphorylation of Akt, GSK3 beta and ERK1/2 in mouse hepatic carcinogenesis. Carcinogenesis. 2003;24:435-442. [PubMed] |
| 43. | Zhang L, Tu Y, He W, Peng Y, Qiu Z. A novel mechanism of hepatocellular carcinoma cell apoptosis induced by lupeol via Brain-Derived Neurotrophic Factor Inhibition and Glycogen Synthase Kinase 3 beta reactivation. Eur J Pharmacol. 2015;762:55-62. [PubMed] [DOI] |
| 44. | Newgard CB, Hwang PK, Fletterick RJ. The family of glycogen phosphorylases: structure and function. Crit Rev Biochem Mol Biol. 1989;24:69-99. [PubMed] [DOI] |
| 45. | Hers HG. The control of glycogen metabolism in the liver. Annu Rev Biochem. 1976;45:167-189. [PubMed] [DOI] |
| 46. | Agius L. Physiological control of liver glycogen metabolism: lessons from novel glycogen phosphorylase inhibitors. Mini Rev Med Chem. 2010;10:1175-1187. [PubMed] |
| 47. | Donnier-Maréchal M, Vidal S. Glycogen phosphorylase inhibitors: a patent review (2013 - 2015). Expert Opin Ther Pat. 2016;26:199-212. [PubMed] [DOI] |
| 48. | Agius L. Role of glycogen phosphorylase in liver glycogen metabolism. Mol Aspects Med. 2015;46:34-45. [PubMed] [DOI] |
| 49. | Lee WN, Guo P, Lim S, Bassilian S, Lee ST, Boren J, Cascante M, Go VL, Boros LG. Metabolic sensitivity of pancreatic tumour cell apoptosis to glycogen phosphorylase inhibitor treatment. Br J Cancer. 2004;91:2094-2100. [PubMed] [DOI] |
| 50. | Terashima M, Fujita Y, Togashi Y, Sakai K, De Velasco MA, Tomida S, Nishio K. KIAA1199 interacts with glycogen phosphorylase kinase β-subunit (PHKB) to promote glycogen breakdown and cancer cell survival. Oncotarget. 2014;5:7040-7050. [PubMed] [DOI] |
| 51. | Favaro E, Bensaad K, Chong MG, Tennant DA, Ferguson DJ, Snell C, Steers G, Turley H, Li JL, Günther UL. Glucose utilization via glycogen phosphorylase sustains proliferation and prevents premature senescence in cancer cells. Cell Metab. 2012;16:751-764. [PubMed] [DOI] |