修回日期: 2016-06-21
接受日期: 2016-07-19
在线出版日期: 2016-08-08
目的: 观察乙型肝炎相关原发性肝癌患者(hepatitis B virus-related primary liver cancer, HBV-PLC)发生和进展过程中外周血T、NK、B细胞数量的变化, 并初步探讨T淋巴细胞减少与胸腺功能的联系.
方法: 收集在首都医科大学附属北京地坛医院住院的73例HBV-PLC患者, 50例乙型肝炎肝硬化患者(liver cirrhosis, LC), 37例慢性乙型肝炎(chronic hepatitis B, CHB)患者. 收集3组患者一般资料和临床生化指标. 采用流式方法检测3组患者外周血中CD3+ T淋巴细胞、CD4+ T、CD8+ T、CD3-CD16+CD56+ NK、CD3-CD19+ B的分布情况, 并检测了T淋巴细胞表面CD31、CD45RA分子的表达水平.
结果: 与CHB和LC患者相比, HBV-PLC患者外周血中性粒细胞升高, 淋巴细胞减少(P<0.001); 与CHB患者相比, HBV-PLC患者外周血NK细胞计数减少(P = 0.011), T淋巴细胞、CD4+ T、CD8+ T、B细胞计数减少, 纯真CD4+和CD8+ T细胞表面CD31表达降低(P<0.001). 在肝癌Child、Okuda、BCLC分期中晚期比早期淋巴细胞计数、T、CD4+ T、CD8+ T计数均降低(P<0.05).
结论: 随着肝癌的发生和进展, HBV-PLC患者外周血抗肿瘤免疫细胞减少, 这种减少与胸腺迁出功能降低有关.
核心提示: 乙型肝炎病毒相关原发性肝癌与慢性乙型肝炎、乙型肝炎肝硬化患者比较外周血存在T、NK和B细胞数量的减少, 尤其是CD4和CD8T细胞的减少, 这与肿瘤免疫逃逸密切相关. 肝癌患者胸腺功能降低是免疫细胞数量的减少原因之一.
引文著录: 刘晓利, 王丽佳, 张栓, 李梦阁, 江宇泳, 杨志云. HBV相关原发性肝癌患者外周血T、NK、B细胞及胸腺功能特征. 世界华人消化杂志 2016; 24(22): 3381-3390
Revised: June 21, 2016
Accepted: July 19, 2016
Published online: August 8, 2016
AIM: To explore changes in the distribution of peripheral blood T, NK and B cells and thymus function in the occurrence and progression of hepatitis B virus-related primary liver cancer (HBV-PLC).
METHODS: Clinical and laboratory data of 73 HBV-PLV patients, 50 liver cirrhosis (LC) patients and 37 chronic hepatitis B (CHB) patients were collected at Beijing Ditan Hospital, Capital Medical University. The distribution of CD3+ T, CD4+ T, CD8+ T, CD3-CD16+CD56+ NK, CD3-CD19+ B cells and the expression of CD31, CD45RA on T cells were detected in peripheral blood of all patients by flow cytometry.
RESULTS: Compared with CHB and LC patients, the percentage and absolute number of lymphocytes declined in HBV-PLC patients (P < 0.001). Compared with LC patients, the numbers of T, CD4+ T, CD8+ T, B (P < 0.001), and NK cells (P = 0.011) significantly decreased in HBV-PLC patients. With regard to Child-Pugh, Okuda, and BCLC stages, the numbers of lymphocytes, T, CD4+ T, and CD8+ T cells were significantly lower in advanced stages than in early stages (P < 0.05).
CONCLUSION: The immune cells that have anti-tumor effects decrease in the peripheral blood of HBV-PLC patients, which may be due to the reduced thymus function.
- Citation: Liu XL, Wang LJ, Zhang S, Li MG, Jiang YY, Yang ZY. Changes in peripheral blood T, NK and B cells and thymus function in patients with HBV-related primary liver cancer. Shijie Huaren Xiaohua Zazhi 2016; 24(22): 3381-3390
- URL: https://www.wjgnet.com/1009-3079/full/v24/i22/3381.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i22.3381
乙型肝炎相关原发性肝癌(hepatitis B virus related primary liver cancer, HBV-PLC)是我国第四大常见恶性肿瘤, 死亡率在所有肿瘤中居第2位[1], 其发生和进展与机体的免疫功能密切相关. 慢性乙型肝炎病毒感染是乙型肝炎肝硬化(liver cirrhosis, LC)和HBV-PLC发生的主要危险因素[2], 从慢性乙型肝炎(chronic hepatitis B, CHB)到肝硬化到肝癌是肝癌发生的主要过程. 本研究分析了粒细胞、淋巴细胞、T细胞(CD4+、CD8+T细胞)、NK细胞、B细胞在CHB、LC和HBV-PLC 3组患者外周血中的变化, 并采用流式细胞术分析了这种变化与胸腺功能是否有关系, 旨在探索细胞免疫和体液免疫在肝癌发生和进展过程中的意义.
选择首都医科大学附属北京地坛医院中西医结合中心和普外科2013-07/2014-02诊断为HBV-PLC的住院患者73例, 同时收集住院的CHB 37例、LC(代偿期或失代偿期)50例患者. 3组患者一般资料和实验室指标如表1. 所有患者均在了解研究方案基础上签署了知情同意书, 研究方案经伦理委员会批准. 诊断标准 原发性肝癌诊断标准: 符合2001年中国抗癌协会肝癌专业委员会正式修订[3]的《原发性肝癌的临床诊断与分期标准》诊断标准. 乙型肝炎肝硬化诊断标准: 符合《慢性乙型肝炎防治指南2010年更新版》[4]中肝硬化代偿期、肝硬化失代偿期的诊断标准. 慢性乙型肝炎诊断标准: 符合《慢性乙型肝炎防治指南2010年更新版》[4]中慢性乙型肝炎的诊断标准. 纳入及排除标准: 纳入标准: (1)3组患者HBsAg阳性和/或血清HBV DNA阳性者, 且符合上述诊断标准; (2)年龄18-75岁, 性别不限; (3)慢性乙型病毒性肝炎组患者入组前6 mo内未经过任何抗病毒治疗; (4)6 mo内未经过放疗、全身化疗及免疫治疗. 排除标准: (1)合并HCV、HIV感染, 合并酒精性肝病、自身免疫性肝病、遗传代谢性肝病、药物性肝病、重度脂肪肝等其他慢性肝病; (2)转移性肝癌或其他肿瘤患者; (3)合并其他严重的全身性疾病: 心、肺、肾、脑、血液等重要脏器功能不全和精神病患者; (4)合并严重感染、消化道出血等严重并发症患者; (5)孕妇及哺乳期妇女. 试剂及仪器: 1×PBS、FACSTM lysing solution(红细胞裂解液, Becton-Dickinson, BD公司, 美国)、BD公司的单克隆荧光抗体: MultiTEST CD3FITC/CD16+CD56PE/CD45PerCP/CD19APC, MultiTEST CD3FITC/CD8PE/CD45PerCP/CD4APC, CD8PerCP、CD31PE、 CD45RA APC、 CD4FITC. BD公司的FACS Calibur流式细胞仪.
| 指标 | CHB(n = 37) | LC(n = 50) | PLC(n = 73) | P值 |
| 年龄(岁) | 36.03±14.42bd | 51.20±8.50 | 54.63±10.05 | <0.001 |
| 性别(男/女) | 2.00:1(24/13) | 1.94:1(33/17) | 3.29:1(56/17) | 0.131 |
| 血小板(×109/L) | 150.8(109.2,196.0)ad | 58.8(43.05, 109.2)b | 106.6(65.8, 167.4) | <0.001 |
| ALT(U/L) | 172.5(43.6, 342.0)ac | 30.7(20.9, 57.8) | 29.7(16.9, 51.2) | <0.001 |
| AST(U/L) | 92.2(40.7, 145.0)ac | 39.9(24.6, 70.7) | 40.2(23.4, 87.8) | 0.007 |
| AFP(ng/mL) | 9.5(3.6, 88.8)c | 4.7(2.3, 14.9)b | 34.4(4.2, 735.5) | <0.001 |
| HBV DNA(copies/mL) | 64900(7318.8, 1703800)bd | 449.9(116, 76200) | 760(116, 19100) | <0.001 |
| 肌酐(μmol/L) | 66.17±9.71a | 64.56±13.54a | 77.36±36.00 | 0.020 |
T淋巴细胞亚群和NK、B细胞检测: 分别取50 μL混匀的EDTA抗凝血加入相应的计数管中, 加20 μL MultiTEST CD3 FITC/CD16+CD56PE/CD45PerCP/CD19APC, MultiTEST CD3 FITC/CD8PE/CD45PerCP/CD4APC混合抗体, 涡匀后室温避光孵育15 min, 加入2 mL红细胞裂解液涡匀室温避光静置5 min后, 1200 r/min 5 min离心后, 弃上清, 加入2 mL 1×PBS后涡匀, 1200 r/min 5 min, 弃上清后上机分析. T细胞表面分子检测: 取130 μL混匀的新鲜EDTA抗凝血于流式管中, 加入CD8PerCP/CD31PE/CD45RA APC/CD4FITC 抗体, 之后的步骤同前.
统计学处理 作图工具采用GraphPad Prism5.0软件, 流式细胞分析采用FlowJo7.6.1软件. 所有资料均采用SPSS19.0统计分析, 计量资料正态分布采用mean±SD表示, 非正态分布采用中位数(四分位间距)表示, 正态分布方差齐性数据采用两独立样本T检验或者方差分析, 否则采用秩和检验. 计数资料比较采用χ2检验或Fisher精确检验. 两组间比较P<0.05为差异有统计学意义.
肝癌患者外周血中性粒细胞计数和百分比均高于慢性乙型肝炎和肝硬化患者(P<0.001). 相反, 淋巴细胞百分比显著低于慢性乙型肝炎和肝硬化患者, 淋巴细胞计数显著低于慢性乙型肝炎患者(P<0.001). 在慢性乙型肝炎、肝硬化、肝癌的发展过程呈现出中性粒细胞百分比逐步升高, 淋巴细胞百分比逐步降低的趋势(P<0.001). 肝癌患者单核细胞计数高于肝硬化患者, 与慢性乙型肝炎患者无显著差异(表2).
| 项目 | CHB | LC | HBV-PLC | P值 |
| 中性粒细胞计数(×109/L) | 2.33(1.78, 3.27)bc | 1.91(1.43, 2.67)b | 3.51(2.55, 4.78) | <0.001 |
| 中性粒细胞百分比(%) | 48.86±9.75bc | 56.85±11.74b | 67.97±13.10 | <0.001 |
| 淋巴细胞计数(×109/L) | 2.04±0.82bd | 1.17±0.66 | 1.00±0.55 | <0.001 |
| 淋巴细胞百分比(%) | 39.17±9.02bd | 30.12±9.82b | 19.50±11.27 | <0.001 |
| 单核细胞计数(×109/L) | 0.4(0.35, 0.59) | 0.34(0.22, 0.49)b | 0.51(0.30, 0.72) | <0.001 |
| CD3+ T | 1483.62±603.06bd | 791.53±465.73 | 756.96±486.62 | <0.001 |
| CD3+CD4+ T | 833.65±378.54bd | 472.04±284.16 | 439.64±294.91 | <0.001 |
| CD3+CD8+ T | 569.38±246.61bd | 280.42±206.40 | 281.48±201.15 | <0.001 |
| CD3-CD16+CD56+ NK | 170.5(101.5, 250.5)ac | 123.5(29.75, 199.25) | 118.5(76.75, 178.5) | 0.028 |
| CD3-CD19+ B | 287.5(212.0, 413.75)bd | 185.0(86.25, 286.5)a | 124.0(82.5, 196.75) | <0.001 |
肝癌患者与慢性乙型肝炎患者比较, CD3+ T淋巴细胞、CD4+ T、CD8+ T、CD3-CD19+B、CD3-CD16+CD56+ NK(P = 0.011)细胞的数目均显著减少, 而与肝硬化患者比较则无明显统计学差异. 肝硬化与慢性乙型肝炎患者相比CD3+ T淋巴细胞、CD4+ T、CD8+ T、CD3-CD19+B(P<0.001)、CD3-CD16+CD56+NK(P = 0.039)细胞数量显著降低.
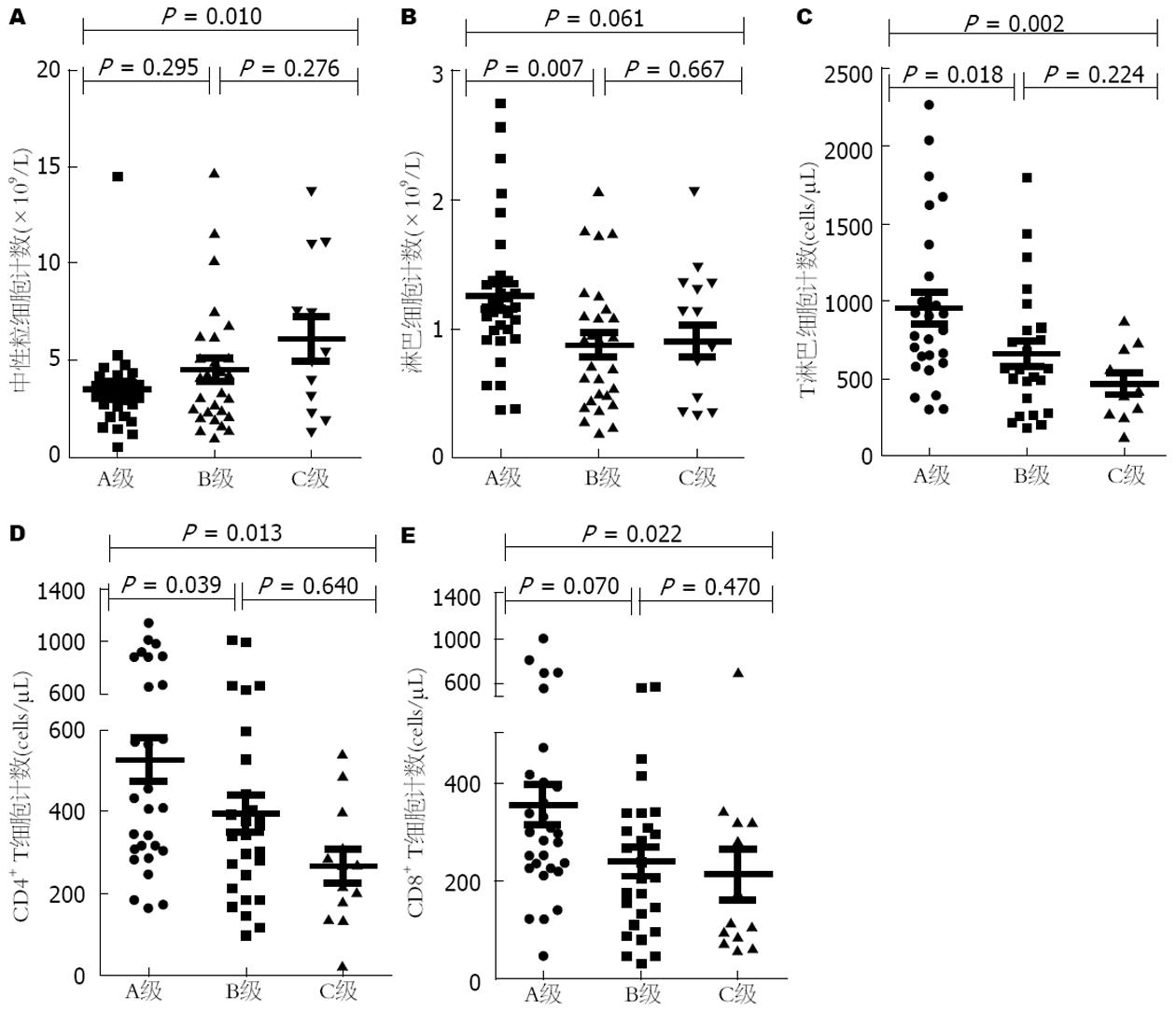
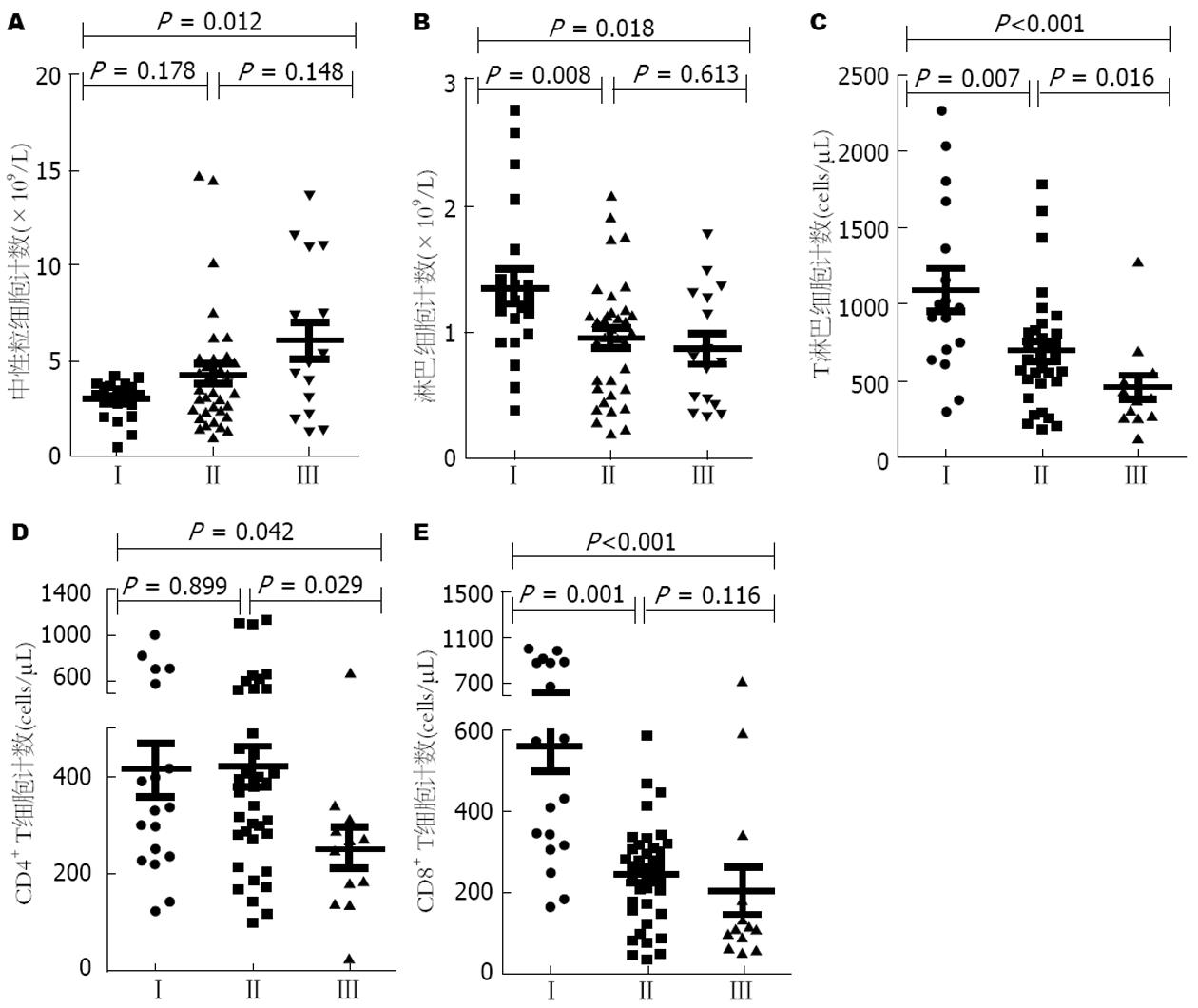
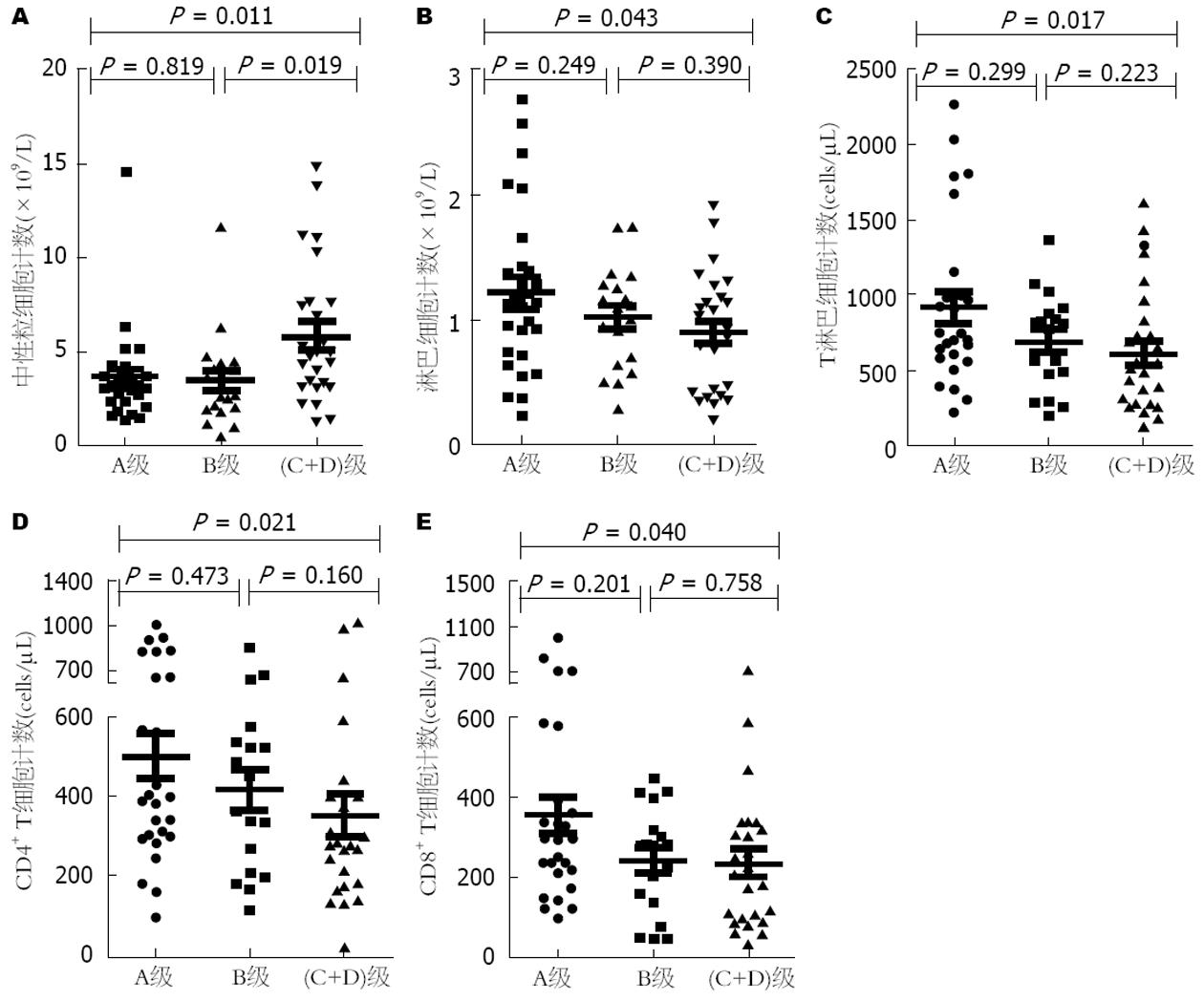
随着肝癌疾病的加重, 外周血中性粒细胞在逐渐增加, 淋巴细胞在逐渐减少; CD3+ T、CD4+ T、CD8+ T细胞数量也在逐渐减少, NK、B细胞没有明显差异(图1-3).
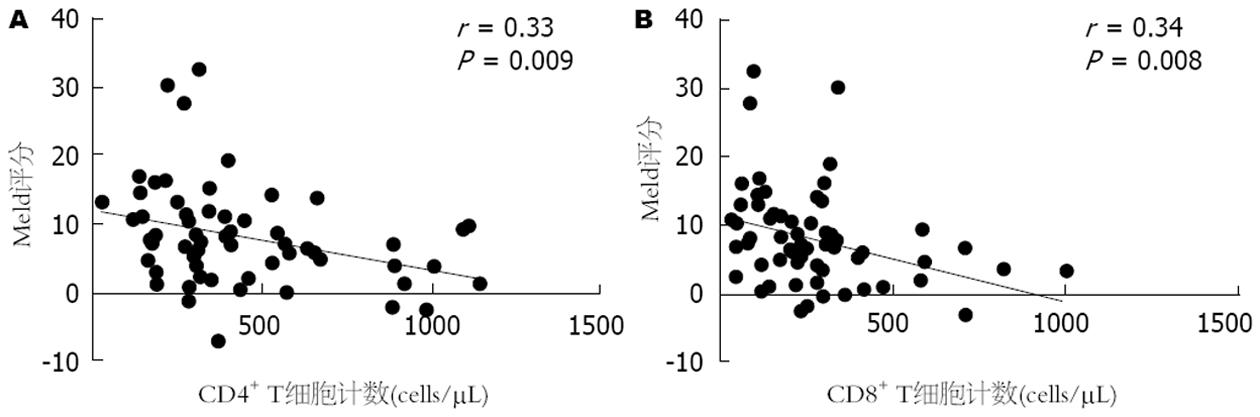
HBV-PLC患者CD4+、CD8+ T细胞数量与Meld评分呈负相关, 说明随着CD4+、CD8+ T细胞数量的减少Meld评分在逐渐升高, 疾病越处于终末期, 肝癌患者生存率也越低(图4, 5).
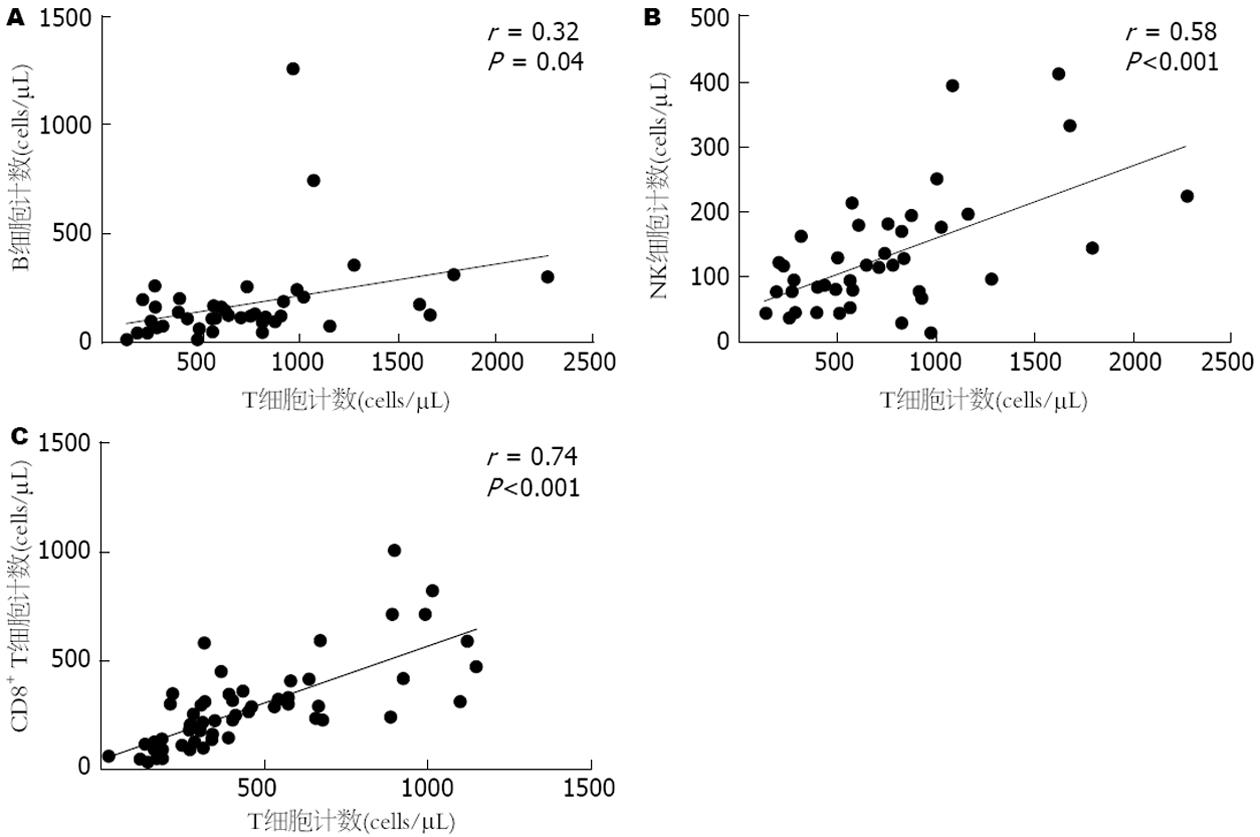
HBV-PLC患者外周血中NK细胞数量、B细胞数量均与T 淋巴细胞数量呈正相关, CD4+ T细胞数量与CD8+ T细胞数量呈正相关, CD4+ T和CD8+ T细胞数目同时均减少, 可能与T淋巴细胞数量减少有关.
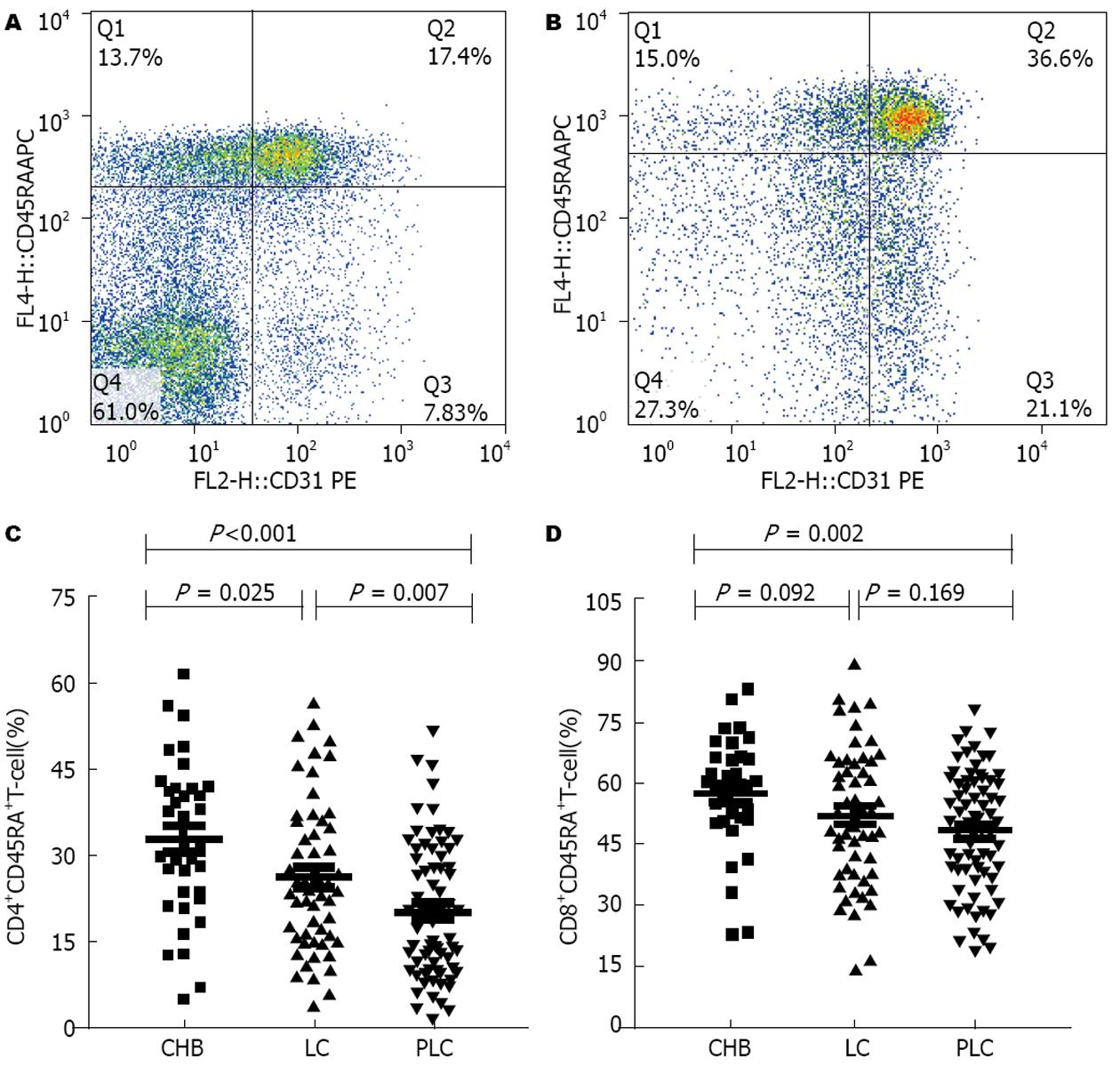
CD4纯真T细胞在肝癌患者中比例明显少于肝硬化和慢性乙型肝炎患者(P = 0.007, P<0.001), CD8纯真T细胞在肝癌中的比例小于慢性乙型肝炎患者(P = 0.002). 有研究报道CD45RA+ T细胞表面CD31+的表达水平反映胸腺新近迁出T细胞的数量多少[5]. CD31在CHB、LC、PLC患者外周血CD4+CD45RA+中的表达比例依次为66.6%±12.8%、59.0%±14.6%、52.0%±17.5%, 肝癌患者低于肝硬化(P = 0.018)和慢性乙型肝炎患者(P<0.001), 肝硬化患者低于慢性乙型肝炎患者(P = 0.013). CD31在CHB、LC、PLC患者外周血CD8+CD45RA+中的表达比例依次为87.8%±9.6%、81.5%±17.3%、73.3%±20.2%, 肝癌患者低于肝硬化(P = 0.006)和慢性乙型肝炎患者(P<0.001), 慢性乙型肝炎与肝硬化相比无统计学差异(图6).
随着肿瘤免疫逃逸概念的提出, 免疫功能在肿瘤的发生和进展中起的作用越来越重要[6,7]. 乙型肝炎相关原发性肝癌患者体内存在着肿瘤抗原和乙型肝炎病毒抗原的双重刺激[8], 其免疫状态也更为复杂, 探索免疫功能在HBV-PLC发生和进展过程中的变化有至关重要的意义.
机体内各种免疫功能主要是由免疫细胞来实现的, 其中中性粒细胞在外周血白细胞中数量最多, 主要参与人体的非特异性免疫反应, 有研究报道中性粒细胞与肿瘤的进展和转移有关[9,10]. 其可以通过产生细胞因子[如肿瘤坏死因子、白介素-1(interleukin-1, IL-1)、IL-6]、趋化因子(CCL3、CCL17、CXCR2)、颗粒酶来促进肿瘤增殖和内皮血管生成, 而且可以促进ROS的产生, 减少自发性细胞凋亡, 从而增加肿瘤转移风险[11-14]. 本研究结果显示在肝癌发生过程中中性粒细胞数目和比例均高于慢性乙型肝炎和肝硬化患者, 且随着疾病的进展, 不论是Child-Pugh分级、Okuda分级或者是BCLC分级, 中性粒细胞的数目均在肝癌晚期高于早期,与既往研究结果一致, 提示了中性粒细胞在肝癌患者中的负性免疫作用. 淋巴细胞主要包括T淋巴细胞、NK和B细胞, 在宿主对抗肝癌中扮演着重要角色. NK细胞可以直接识别肿瘤细胞或者在单核、巨噬、树突状细胞的作用下活化, 之后能通过穿孔素、颗粒酶和Fas、TRAIL相关途径直接杀伤肿瘤细胞, 并且快速释放炎性细胞因子(如干扰素γ)增强机体免疫反应, 从而控制局部肿瘤生长和转移[15-17]. 在动物模型[18]中给予IL-12和IL-18表现出肝脏中NK细胞数量的增加, 导致了肝内肿瘤结节的减小. B淋巴细胞主要通过产生IgG抗体介导体液免疫来发挥抗肿瘤效应, T淋巴细胞参与的细胞免疫是病毒清除和肿瘤杀伤免疫反应的核心. 本研究肝癌患者中淋巴细胞总数和比例以及NK、B、T细胞计数在肝癌发生和进展过程中均有不同程度的下降, 随着抗肿瘤效应细胞的减少机体无法有效的控制肿瘤的发生和进展, 不能对抗Treg细胞对机体的免疫抑制作用[19], 从而出现了肿瘤的免疫逃逸. 在HBV-PLC三种不同分级分析中发现淋巴细胞、T细胞计数在晚期比早期要少, 然而NK、B细胞在肿瘤进展中无差异, 可能是因为肿瘤通过调节微环境促进骨髓来源抑制性细胞[20]、免疫抑制性分子[21-23](如CTLA-4、PD-1、TIM-3)、免疫抑制细胞因子(如IL-10、IL-17)的表达[24], 从而抑制T细胞的活化和增殖, 然而其对NK和B细胞的抑制作用则研究较少.
人体成熟T细胞按表型不同可分为CD4+ T细胞和CD8+ T细胞, 两者主要参与细胞免疫, CD4+ T细胞具有协助体液免疫和促进CD8+ T细胞分化为细胞毒性T细胞(cytotoxic lymphocyte, CTL)的功能[25], CD8+ T细胞具有直接杀伤靶细胞的功能. 本研究发现, 肝癌患者外周血中CD4+ T、CD8+ T细胞计数相比慢性乙型肝炎和肝硬化患者均不同程度的下降, 在肝癌分级中也是晚期较早期降低, 提示肝癌患者中存在的抗肿瘤效应明显低下. 而且HBV-PLC患者外周血中CD4+、CD8+ T细胞计数与Meld评分呈负相关, 说明随着疾病进展, 抗肿瘤作用会逐渐减弱, 这种减弱可能与肿瘤免疫逃逸有关.
纯真(Naive)T细胞是体内一群没有接受过抗原刺激, 一旦受到抗原刺激则发生活化、增殖, 并分化为效应细胞发挥抗病毒和抗肿瘤作用的细胞. 肝癌患者Naive CD4+ T细胞和CD8+ T细胞均较慢性乙型肝炎减少, 提示机体更新CD4+和CD8+ T细胞的能力降低, 对新的肿瘤抗原反应失能, 从而导致肝癌的发生. 胸腺是人体内主要的免疫器官, 是T细胞分化、发育、成熟的场所[26], 为探求T细胞减少的原因, 我们采用流式细胞术分析了Naive(CD45RA+)T细胞表面CD31分子的表达来比较肝癌发生过程的胸腺功能变化. CD31是一种血小板内皮细胞黏附分子(platelet endothelial cell adhesion molecule, PECAM), 是一种新的、激活后表达水平不发生明显变化表面标记[27]. 之前有研究通过检测T细胞受体删除环含量来评价胸腺T细胞的输出[28], 也有研究报道CD45RA+ T细胞表面的CD31表达水平(CD31%, CD31+/CD45RA+ T)与TREC含量高度一致[5,29], 所以我们用CD31的表达水平来评价胸腺的输出情况. 我们的研究发现肝癌患者新近迁出CD4+和CD8+ T细胞的水平明显低于慢性乙型肝炎患者, 说明肝癌患者外周血T细胞的降低与胸腺功能降低有关. 由于胸腺会随着年龄的增加而逐渐衰老、萎缩[30], 可能会影响其T细胞迁出水平, 所以我们比较了肝硬化和肝癌两组年龄无差异患者的CD31表达水平, 同样发现肝癌中CD31表达水平有所降低, 则可以认为这种CD31水平的降低与病毒和肿瘤抗原对胸腺功能的影响有关. 胸腺中T细胞的产生减少是外周血T细胞减少的原因之一, 肿瘤患者的胸腺迁出T细胞的能力与其抗肿瘤效应直接相关, 对肿瘤的发生和进展有所影响, 需要我们在临床上密切关注.
总之, 乙型肝炎相关原发性肝癌患者外周循环存在着细胞免疫功能紊乱, 外周血粒细胞、淋巴细胞、T、B、NK细胞的变化特点使我们更好地认识到免疫细胞在肿瘤发生和进展中的重要作用. 在肝癌中, 促进肿瘤增殖的粒细胞增多, 对肿瘤起杀伤作用的淋巴细胞减少, 这种免疫细胞失衡强调了在临床上增加抗肿瘤免疫细胞数量, 提高自身抗肿瘤免疫能力对于预防肝癌发生和进展的重要意义. 胸腺输出功能的减弱是肝癌患者抗肿瘤免疫细胞减少的原因之一, 除此之外是否还存在其他机制影响T细胞数量和抗肿瘤功能需要我们进一步探讨.
肝癌的发生是乙型肝炎病毒和肿瘤抗原的双重刺激, 与炎症和免疫紧密相关. 免疫细胞是参与免疫反应的主体, B细胞参与的体液免疫, NK细胞的固有免疫, T细胞参与的细胞免疫, 在抗病毒和抗肿瘤中都发挥重要作用.
范辉, 副教授, 副主任医师, 江苏省南通市第二人民医院消化科
乙型肝炎相关原发性肝癌患者存在着细胞免疫功能降低, 在临床诊治肝癌患者要重视提高其免疫功能.
本文比较了乙型肝炎病毒相关性肝癌与慢性乙型肝炎、乙型肝炎后肝硬化患者外周血淋巴细胞各亚型的变化, 探讨了淋巴细胞各亚型变化与患者免疫功能、胸腺功能之间关系, 对消化、肿瘤科临床医生实践诊疗工作具有一定借鉴价值. 通过系统分析三类疾病, 思路有了一定程度拓宽, 可读性和可信度较高.
编辑: 郭鹏 电编:闫晋利
| 1. | Chen W, Zheng R, Zeng H, Zhang S, He J. Annual report on status of cancer in China, 2011. Chin J Cancer Res. 2015;27:2-12. [PubMed] [DOI] |
| 2. | El-Serag HB. Epidemiology of viral hepatitis and hepatocellular carcinoma. Gastroenterology. 2012;142:1264-1273.e1. [PubMed] [DOI] |
| 5. | Kimmig S, Przybylski GK, Schmidt CA, Laurisch K, Möwes B, Radbruch A, Thiel A. Two subsets of naive T helper cells with distinct T cell receptor excision circle content in human adult peripheral blood. J Exp Med. 2002;195:789-794. [PubMed] [DOI] |
| 6. | Kim R, Emi M, Tanabe K. Cancer immunoediting from immune surveillance to immune escape. Immunology. 2007;121:1-14. [PubMed] [DOI] |
| 7. | Stauffer JK, Scarzello AJ, Jiang Q, Wiltrout RH. Chronic inflammation, immune escape, and oncogenesis in the liver: a unique neighborhood for novel intersections. Hepatology. 2012;56:1567-1574. [PubMed] [DOI] |
| 8. | Chiba T, Marusawa H, Ushijima T. Inflammation-associated cancer development in digestive organs: mechanisms and roles for genetic and epigenetic modulation. Gastroenterology. 2012;143:550-563. [PubMed] [DOI] |
| 9. | Liang W, Ferrara N. The Complex Role of Neutrophils in Tumor Angiogenesis and Metastasis. Cancer Immunol Res. 2016;4:83-91. [PubMed] [DOI] |
| 10. | Galdiero MR, Garlanda C, Jaillon S, Marone G, Mantovani A. Tumor associated macrophages and neutrophils in tumor progression. J Cell Physiol. 2013;228:1404-1412. [PubMed] [DOI] |
| 11. | Houghton AM, Rzymkiewicz DM, Ji H, Gregory AD, Egea EE, Metz HE, Stolz DB, Land SR, Marconcini LA, Kliment CR. Neutrophil elastase-mediated degradation of IRS-1 accelerates lung tumor growth. Nat Med. 2010;16:219-223. [PubMed] [DOI] |
| 12. | Gong L, Cumpian AM, Caetano MS, Ochoa CE, De la Garza MM, Lapid DJ, Mirabolfathinejad SG, Dickey BF, Zhou Q, Moghaddam SJ. Promoting effect of neutrophils on lung tumorigenesis is mediated by CXCR2 and neutrophil elastase. Mol Cancer. 2013;12:154. [PubMed] [DOI] |
| 13. | Tsuda Y, Fukui H, Asai A, Fukunishi S, Miyaji K, Fujiwara S, Teramura K, Fukuda A, Higuchi K. An immunosuppressive subtype of neutrophils identified in patients with hepatocellular carcinoma. J Clin Biochem Nutr. 2012;51:204-212. [PubMed] [DOI] |
| 14. | Trellakis S, Farjah H, Bruderek K, Dumitru CA, Hoffmann TK, Lang S, Brandau S. Peripheral blood neutrophil granulocytes from patients with head and neck squamous cell carcinoma functionally differ from their counterparts in healthy donors. Int J Immunopathol Pharmacol. 2011;24:683-693. [PubMed] [DOI] |
| 15. | Vivier E, Tomasello E, Baratin M, Walzer T, Ugolini S. Functions of natural killer cells. Nat Immunol. 2008;9:503-510. [PubMed] [DOI] |
| 16. | Campbell KS, Hasegawa J. Natural killer cell biology: an update and future directions. J Allergy Clin Immunol. 2013;132:536-544. [PubMed] [DOI] |
| 17. | Oberoi P, Wels WS. Arming NK cells with enhanced antitumor activity: CARs and beyond. Oncoimmunology. 2013;2:e25220. [PubMed] [DOI] |
| 18. | Subleski JJ, Hall VL, Back TC, Ortaldo JR, Wiltrout RH. Enhanced antitumor response by divergent modulation of natural killer and natural killer T cells in the liver. Cancer Res. 2006;66:11005-11012. [PubMed] [DOI] |
| 19. | Fu J, Xu D, Liu Z, Shi M, Zhao P, Fu B, Zhang Z, Yang H, Zhang H, Zhou C. Increased regulatory T cells correlate with CD8 T-cell impairment and poor survival in hepatocellular carcinoma patients. Gastroenterology. 2007;132:2328-2339. [PubMed] [DOI] |
| 20. | Kapanadze T, Gamrekelashvili J, Ma C, Chan C, Zhao F, Hewitt S, Zender L, Kapoor V, Felsher DW, Manns MP. Regulation of accumulation and function of myeloid derived suppressor cells in different murine models of hepatocellular carcinoma. J Hepatol. 2013;59:1007-1013. [PubMed] [DOI] |
| 21. | Parry RV, Chemnitz JM, Frauwirth KA, Lanfranco AR, Braunstein I, Kobayashi SV, Linsley PS, Thompson CB, Riley JL. CTLA-4 and PD-1 receptors inhibit T-cell activation by distinct mechanisms. Mol Cell Biol. 2005;25:9543-9553. [PubMed] [DOI] |
| 22. | Shi F, Shi M, Zeng Z, Qi RZ, Liu ZW, Zhang JY, Yang YP, Tien P, Wang FS. PD-1 and PD-L1 upregulation promotes CD8(+) T-cell apoptosis and postoperative recurrence in hepatocellular carcinoma patients. Int J Cancer. 2011;128:887-896. [PubMed] [DOI] |
| 23. | Li H, Wu K, Tao K, Chen L, Zheng Q, Lu X, Liu J, Shi L, Liu C, Wang G. Tim-3/galectin-9 signaling pathway mediates T-cell dysfunction and predicts poor prognosis in patients with hepatitis B virus-associated hepatocellular carcinoma. Hepatology. 2012;56:1342-1351. [PubMed] [DOI] |
| 24. | Ben-Neriah Y, Karin M. Inflammation meets cancer, with NF-κB as the matchmaker. Nat Immunol. 2011;12:715-723. [PubMed] [DOI] |
| 25. | Kennedy R, Celis E. Multiple roles for CD4+ T cells in anti-tumor immune responses. Immunol Rev. 2008;222:129-144. [PubMed] [DOI] |
| 26. | Anderson G, Takahama Y. Thymic epithelial cells: working class heroes for T cell development and repertoire selection. Trends Immunol. 2012;33:256-263. [PubMed] [DOI] |
| 27. | Marelli-Berg FM, Clement M, Mauro C, Caligiuri G. An immunologist's guide to CD31 function in T-cells. J Cell Sci. 2013;126:2343-2352. [PubMed] [DOI] |
| 28. | Hazenberg MD, Verschuren MC, Hamann D, Miedema F, van Dongen JJ. T cell receptor excision circles as markers for recent thymic emigrants: basic aspects, technical approach, and guidelines for interpretation. J Mol Med (Berl). 2001;79:631-640. [PubMed] [DOI] |