修回日期: 2016-05-10
接受日期: 2016-05-16
在线出版日期: 2016-07-08
目的: Hegdehog信号通路在胰腺癌发生发展过程中发挥着重要的作用, 针对其调控机制的研究将对胰腺癌发病机制的阐明奠定良好的理论基础. 构建携带SMO靶向siRNA慢病毒表达载体, 并证实其对胰腺癌细胞中SMO基因表达的抑制作用.
方法: 设计并合成3条SMO基因靶向siRNA片段, 利用基因重组技术构建携带此3条片段的慢病毒表达载体并测定其滴度, 构建好的慢病毒表达载体转染人胰腺癌细胞株SW1990后, 采用RT-PCR法检测SMO基因的表达以筛选出效果最佳的干扰表达载体, 并以此载体转染SW1990细胞后采用Western blot法检测SMO蛋白表达.
结果: 基因测序与酶切电泳结果提示成功合成SMO靶向siRNA片段且其正确插入慢病毒表达载体, 无碱基缺失错排与突变, 测定病毒滴度分别为5.31×108 TU/mL, 1.49×109 TU/mL及8.50×108 TU/mL, 经转染SW1990细胞后, 测定对SMO基因表达的抑制率分别为86.00%、74.85%及19.22%, 效果最优的干扰表达载体转染SW1990细胞后对SMO蛋白表达的抑制率>80%.
结论: 成功构建携带SMO基因靶向siRNA的慢病毒表达载体, 且该载体可有效抑制胰腺癌细胞中SMO基因的表达, 为进一步的研究提供了良好的实验工具.
核心提示: Hegdehog信号通路中的关键成员SMO基因为靶点, 构建携带SMO siRNA的慢病毒表达载体, 为进一步深入分析Hegdehog信号通路在胰腺癌发生过程中的作用与调控机制奠定基础.
引文著录: 迪力夏提•吐尼牙孜, 丁伟, 依马木买买提江•阿布拉, 易超, 苏雅婷, 李海军. SMO基因siRNA慢病毒表达载体的构建及其对胰腺癌细胞SMO基因表达的影响. 世界华人消化杂志 2016; 24(19): 2974-2981
Revised: May 10, 2016
Accepted: May 16, 2016
Published online: July 8, 2016
AIM: To construct a recombinant lentiviral vector carrying siRNA targeting the SMO gene, and to confirm its inhibitory effect on SMO gene expression in pancreatic cancer cells.
METHODS: Three SMO gene-targeted siRNA fragments were designed and synthesized, and recombinant DNA technology was used to introduce these three fragments into a lentiviral expression vector. After determination of the virus titer, the constructed lentiviral vector was tranfected into human pancreatic cancer cell line SW1990. RT-PCR was used to detect the expression of SMO gene and identify the best interference expression vector. SMO protein expression was detected by Western blot.
RESULTS: Gene sequencing and restriction endonuclease digestion results suggested successful synthesis of SMO-targeted siRNA fragments and correct insertion into the lentiviral vector. The virus titers were 5.31 × 108 TU/mL, 1.49 × 109 TU/mL and 8.50 × 108 TU/mL, respectively. After transfecting SW1990 cells, the SMO gene expression inhibition rates were 86.00%, 74.85% and 19.22%, respectively. The best interference expression vector can achieve an SMO protein inhibition rate > 80% in SW1990 cells.
CONCLUSION: We have successfully constructed an SMO gene-targeted siRNA lentiviral vector, and the vector can effectively inhibit the expression of SMO gene in pancreatic cancer cells, thus providing a good experimental tool for further research.
- Citation: Dilxat•Tunyaz, Ding W, Imammamat•Ablajan, Yi C, Su YT, Li HJ. Construction of a recombinant lentiviral vector carrying siRNA targeting SMO gene: Effect on SMO gene expression in pancreatic cancer cells. Shijie Huaren Xiaohua Zazhi 2016; 24(19): 2974-2981
- URL: https://www.wjgnet.com/1009-3079/full/v24/i19/2974.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i19.2974
近年来, 胰腺癌的发病率在全球范围呈逐年上升趋势[1]. 2010年相关统计数据显示, 胰腺癌位居全美恶性肿瘤发病率第10位, 但死亡率则高居第5位[2]. 在我国, 胰腺癌年发病率约为3.3/10万[3], 年死亡率接近发病率, 居常见恶性肿瘤死亡原因第7位[4]. 尽管学者们在胰腺癌病因及其发病机制的研究上做了多年的努力, 但时至今日, 其直接病因尚不明确, 且仍无有效的早期诊断方法. 因此, 寻找具有高度特异性及敏感性的胰腺癌标志物具有重要的现实意义. 前期研究中[5], 我们证实了Hegdehog信号通路在胰腺癌发生发展中的关键作用, 本研究以Hegdehog信号通路中的关键成员SMO基因为靶点, 构建携带SMO siRNA的慢病毒表达载体, 为进一步深入分析Hegdehog信号通路在胰腺癌发生过程中的作用与调控机制奠定基础.
细菌摇床(华利达实验设备公司), Blue Pard隔水式恒温(上海一恒科学仪器有限公司), 细胞培养箱(日本三洋SANYO), 移液器(吉尔森公司), 超净工作台(苏州佳宝净化工程设备有限公司), 高速离心机(Thermo Scientific), 荧光显微镜(奥林巴斯), 生物安全柕(上海振样创空气净化设备有限公司), 超速离心机(Beckman), PCR仪(Applied Biosystems公司), 测序仪(美季生物公司), 数显式稳压稳流电泳仪、凝胶成像仪(天能公司), GeneRuler 1 kb DNA Ladder(Thermo Scientific公司), NormalRun™ 250 bp-Ⅱ DNA Ladder(GeneRay公司), Restriction Endonuclease(NEB公司), Taq Plus DNA polymerase(Vazyme公司), T4 DNA ligase(Thermo Scientific公司), Primer(GeneRay公司), TOP10 competent cell(Genechem公司), EndoFree midi Plasmid Kit(TIANGEN公司), GV248慢病毒载体与慢病毒包装试剂盒、TaKaRaMiniBEST Viral RNA/DNA Extraction kit试剂盒(吉凯基因化学技术有限公司), PBS缓冲液等常用分子生物化学试剂(新疆医科大学附属肿瘤医院肿瘤研究所), SW1990人胰腺癌细胞(中科院上海细胞库).
1.2.1 SMO基因siRNA片段设计与合成: 依据GenBank提供的人SMO基因全长信息, 由上海吉凯基因化学技术有限公司设计并筛选出3条SMO siRNA片段(碱基序列如表1). 根据上述设计好的片段信息设计并合成3对引物(表2), 引物干粉溶解于退火缓冲溶解于退火缓冲液中, 90 ℃水浴15 min, 自然况却至室温合成双链DNA, 退火产物送生工生物工程(上海)有限公司测序.
| SMO siRNA片段 | 增加物 | 目标序列 | 片段 | GC比例(%) |
| SMO-RNAi(37303-1) | NM_005631 | TGATGGACACAGAACTCAT | 281.2644 | 42.11 |
| SMO-RNAi(37304-1) | NM_005631 | GGAGAAGATCAACCTGTTT | 281.2644 | 42.11 |
| SMO-RNAi(37305-1) | NM_005631 | TGACTGTGAGATCAAGAAT | 281.2644 | 36.84 |
| Description | Homo sapiens smoothened homolog(Drosophila) (SMO), mRNA | |||
| 引物 | 5'端 | 茎 | 环 | 茎 | 3'端 |
| SMO-RNAi(37303-1)-a | Ccgg | ccTGATGGACACAGAACTCAT | CTCGAG | ATGAGTTCTGTGTCCATCAGG | TTTTTg |
| SMO-RNAi(37303-1)-b | aattcaaaaa | ccTGATGGACACAGAACTCAT | CTCGAG | ATGAGTTCTGTGTCCATCAGG | |
| SMO-RNAi(37304-1)-a | Ccgg | gtGGAGAAGATCAACCTGTTT | CTCGAG | AAACAGGTTGATCTTCTCCAC | TTTTTg |
| SMO-RNAi(37304-1)-b | aattcaaaaa | gtGGAGAAGATCAACCTGTTT | CTCGAG | AAACAGGTTGATCTTCTCCAC | |
| SMO-RNAi(37305-1)-a | Ccgg | ccTGACTGTGAGATCAAGAAT | CTCGAG | ATTCTTGATCTCACAGTCAGG | TTTTTg |
| SMO-RNAi(37305-1)-b | aattcaaaaa | ccTGACTGTGAGATCAAGAAT | CTCGAG | ATTCTTGATCTCACAGTCAGG |
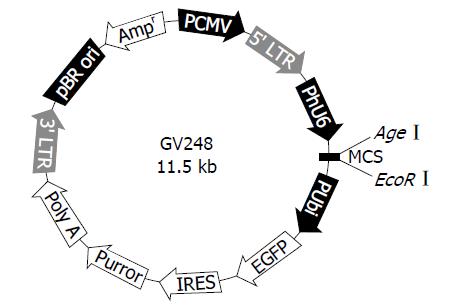
1.2.2 携带SMO siRNA基因片段慢病毒表达载体的构建: 将2 µL GV248慢病毒载体质粒(1 µg/µL, 载体信息如图1)与5 µL 10×CutSmart Buffer 2, 1 µL AgeⅠ(10 U/µL), 1 µL EcoRⅠ(10 U/µL), 41 µL ddH2O配制成酶切反应体系对GV248慢病毒载体质粒进行双酶切. 酶切好的慢病毒载体质粒与上述退火产物连接过夜, 反应体系为: 1 µL线性化慢病毒载体质粒(100 ng/µL), 1 µL退火产物双链DNA(100 ng/µL), 1 µL T4 DNA ligase及2 µL 10×T4 DNA ligase缓冲液并用ddH2O补足至20 µL. 10 µL交换反应产物加入到100 µL Top10化学感受态细胞中混匀后冰上放置30 min, 42 ℃热激90 s, 冰水浴孵育2 min, 加入500 µL LB培养基, 置于37 ℃摇床振荡培养1 h, 加适量菌液均匀涂布在含有相应抗生素的平板上, 在恒温培养箱中倒置培养16 h, 挑选生长较好的菌落行PCR菌检(引物如表2; 反应参数设定为: 95 ℃ 5 min, 94 ℃ 30 s, 52 ℃ 40 s, 72 ℃ 30 s, 72 ℃ 7 min, 28 cycle), 利用大量质粒提抽试剂盒提取阳性克隆质粒行测序鉴定, 鉴定无误阳性克隆提抽质粒-80 ℃冻存. PCR菌检反应体系: ddH2O, 9.2 µL, 2×Taq Plus Master Mix, 10 µL, 上游引物(10 µmol/L), 0.4 µL, 下游引物(10.0 µmol/L), 0.4 µL, 单菌落.
1.2.3 慢病毒包装: 购置的293T细胞培养至对数生长期后行胰蛋白酶消化制成单细胞悬液, 以含10%血清的培养基调整细胞密度约5×106细胞/15 mL, 重新接种于10 cm细胞培养皿, 37 ℃、50 mL/L CO2培养箱内培养24 h, 待细胞生长到90%汇合度后更换无血清培养基, 用OptiMEM培养基洗涤细胞3次后, 将293T细胞加入5 mL OptiMEM培养基, 37 ℃、50 mL/L CO2培养箱孵育20 min. 参照吉凯基因化学技术有限公司转染试剂盒说明书, 将20 µg SMO siRNA-GV248质粒与25 µg慢病毒包装体系(pHelper 1.0载体质粒15 µg、pHelper 2.0载体质粒10 µg)用转染试剂混匀并补足至1 mL, 室温下, 50 mL/L CO2培养箱孵育20 min后配制成转染混合液加入293T细胞中培养8 h去除培养基, 并用PBS缓冲液冲洗细胞3次后加入DMEM培养基25 mL中37 ℃、50 mL/L CO2培养箱培养72 h. 完成转染后荧光显微镜观察293T细胞荧光蛋白表达情况评价转染效果, 确定转染成功后, 收集培养瓶内上清液, 4 ℃、4000 g离心15 min后留上清液0.45 µm滤器过滤后再次4 ℃、4000 g离心15 min, 收集瓶内上清液即为病毒浓缩液, 分装后-80 ℃冻存.
1.2.4 病毒滴度测定: TaKaRaMiniBEST Viral RNA/DNA Extraction kit试剂盒提取250 µL病毒液RNA后稀释至30 µL, 取2 µL RNA以10-1011 copies/µL的pLenti6质粒作为标准样品进行实时定量PCR检测测定病毒滴度.
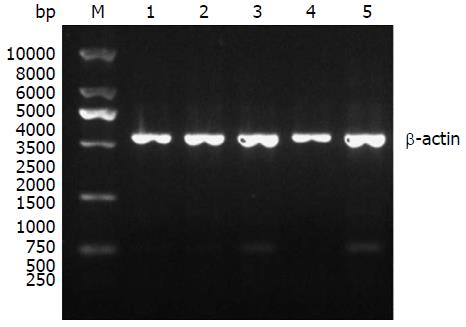
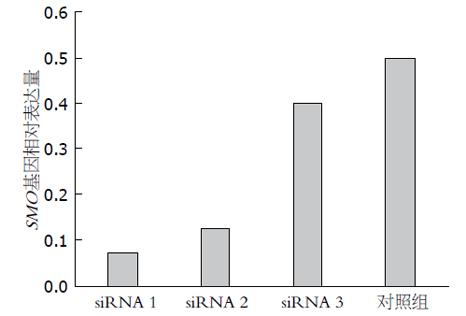
1.2.5 携带SMO siRNA慢病毒表达载体的筛选: SW1990胰腺癌细胞株培养至对数生长期后行胰蛋白酶消化制成单细胞悬液铺10 cm板培养24 h至90%汇合度, 细胞分成4组, 其中3组分别加入上述制备好的3组病毒液250 µL作为实验组, 1组加入等量PBS缓冲液作为参照组, 4组细胞37 ℃、50 mL/L CO2培养箱孵育72 h后采用TRIzol试剂盒提取各组细胞总RNA, 参照两步法RT-PCR试剂盒说明书, 检测各组细胞SMO基因表达, PCR引物为: 上游: 5'-CTCCTACTTCCACCTGCTCAC-3'; 下游: 5'-CAAAACAAATCCCACTCACAGA-3', 反应参数设定为: 95 ℃ 5 min, 94 ℃ 30 s, 52 ℃ 40 s, 72 ℃ 30 s, 72 ℃ 7 min, 28 cycle, 内参照β-actin. 凝胶成像仪成像后, Image Lab 4.0软件分析对比相较于参照组各反应组SMO基因相对表达量, 筛选最优SMO siRNA慢病毒表达载体.
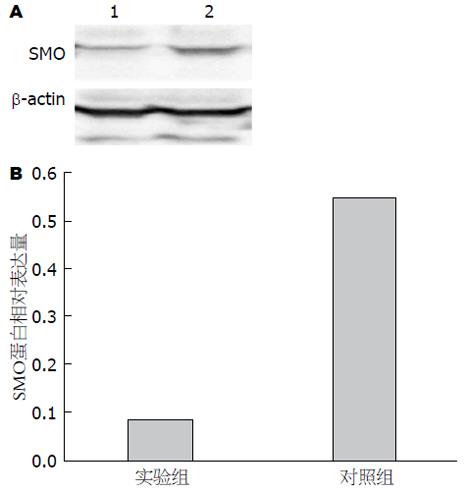
1.2.6 携带SMO siRNA慢病毒表达载体对SW1990细胞SMO蛋白表达的影响: 将SW1990细胞分为2组, 实验组同前法选用上述最优SMO siRNA慢病毒表达载体病毒转染, 对照组细胞中加入等量PBS缓冲液, 两组细胞37 ℃、50 mL/L CO2培养箱孵育72 h后提取总蛋白采用Western blot法检测两组细胞蛋白表达, Bio-Rad Chemi DOC MP全能型成像分析系统曝光、显影、定影, 并测定条带的面积和灰度值, 对比两组细胞间蛋白表达差异.
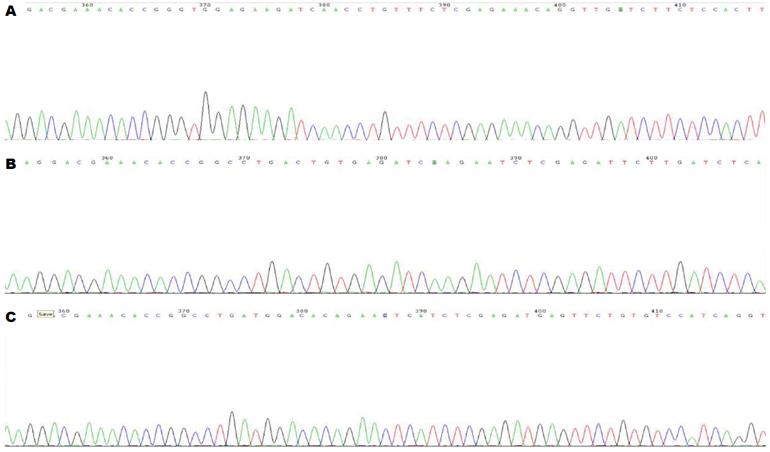
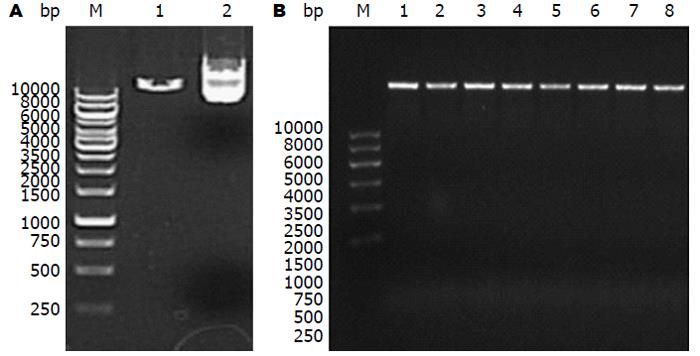
引物退火产物测序结果如图2, 结果提示合成的基因片段碱基序列与设计相符, 碱基序列排列正确, 无碱基错排、缺失及突变. GV248慢病毒载体质粒AgeⅠ与EcoRⅠ双酶切电泳照片如图3, 提抽质粒测序结果提示SMO siRNA慢病毒表达质粒构建成功, 且基因插入方向正确无误.
3种SMO siRNA慢病毒质粒转染293T细胞后, 细胞生长良好, 仅有少量细胞坏死脱落, 图4为被转染的293T细胞荧光显微镜下照片, 转染率分别为71.92%、83.25%及63.44%. 经实时定量PCR法测定3种SMO siRNA慢病毒表达载体的滴度分别为5.31×108 TU/mL、1.49×109 TU/mL及8.50×108 TU/mL.
3种SMO siRNA慢病毒表达载体对SMO基因表达的抑制率分别为86.00%、74.85%及19.22%, 故SMO siRNA1慢病毒表达载体对SMO基因表达抑制率最高, 选其进行后续研究(图5, 6).
Hedgehog信号通路由Hammerschmidt等首先在果蝇中发现, 随后又在脊椎动物中被证实[6], 目前已有大量的研究[7]显示, Hedgehog信号通路在胚胎发育过程中参与胰腺的形成, 但在正常胰腺组织中则处于关闭或微量激活状态, 只有当胰腺发生炎症修复或恶性肿瘤形成时才被重新激活[8]. SMO是一个7次跨膜的膜蛋白, 可调控下游转录因子Gli的表达[9], 被认为是该通路发挥细胞调控作用的核心环节[10]. 依马木买买提江•阿布拉等[11]的研究提示, 针对SMO基因的靶向阻滞药物GDC-0449可有效抑制胰腺癌干细胞表面标志物CD44与CD133的表达, 而目前的干细胞学说认为胰腺癌干细胞是胰腺癌恶性生物学特性产生与维持的根源[12]. 诸娴[13]则在其研究中证实, 缺氧环境可通过激活SMO基因的表达, 从而增强胰腺唉细胞的增殖与侵袭性[14], 说明SMO基因在胰腺癌发生发展中可能具有关键性的作用. 美国田纳西大学生命科学中心的Martin等[15]报道了以SMO等Hedgehog信号通路关键成员为靶点的奥美昔芬可有效的降低胰腺癌对吉西他滨的耐药性, 并指出奥美昔芬与吉西他滨的联合用药或可替代吉西他滨单药成为胰腺癌治疗的一线用药方案[16]. 在前期研究[17]中, 我们对48例胰腺癌组织及其癌旁组织中Hedgehog信号通路成员进行了表达检测, 结果显示SMO基因在胰腺癌中的表达明显高于癌旁组织且与胰腺癌组织的分化程度密切相关[18], 提示SMO基因的异常激活可能与胰腺癌的发生发展密切相关[19].
RNA干扰(RNA interference, RNAi)是指利用具有同源性的双链RNA(dsRNA)诱导序列特异的目标基因的沉寂[20], 迅速阻断基因活性[21], 他只以特异的mRNA降解为目标, 不影响非同源mRNA的稳定性[22]. RNAi因其高特异性和高抑制率这两大明显优势[23], 在基因药物、基因治疗和分子生物学等科研领域中的应用日益广泛[24]. siRNA是RNAi途径中的中间产物[25], 在RNA沉寂通道中起中心作用, 是RNAi发挥效应所必需的因子[26]. siRNA病毒载体转染是目前用于信号通路研究的主要方法之一[27], 而因其制备方便、价格低廉、高度的特异性及高效性等优点, 也使其在肿瘤靶向治疗的临床应用成为可能[28].
本研究中, 我们设计并合成了3条SMO基因靶向siRNA片段, 并通过基因重组技术成功构建了携带这3条基因片段的慢病毒表达载体, 基因测序与酶切检测结果均提示目的基因成功插入病毒载体中[29], 且无碱基序列的缺失、错排与突变; 转染胰腺癌细胞株后通过对SMO基因表达的检测[30], 我们成功筛选出对SMO基因抑制效果最佳的siRNA慢病毒表达载体, 并证实此病毒载体对SMO蛋白转录的抑制作用. 在研究的过程中, 经靶向干扰病毒载体转染的细胞仅有少量的坏死脱落, 且病毒滴度达到了实验用要求, 证实该病毒载体的安全有效, 为进一步研究Hedgehog信号通路在胰腺癌发生发展过程中的关键作用及其调控机制提供了理想的研究工具. 同时, 随着对慢病毒载体安全性与可靠性的进一步完善, SMO靶向siRNA慢病毒表达载体在胰腺癌临床治疗中或将发挥巨大的作用, 为胰腺癌治疗现状的改变带来契机.
SMO基因为模板所转录的SMO蛋白所包含的信息在Hedgehog信号通路中起着信息转换作用, SMO蛋白能够将细胞外的Shh信号转变成细胞内的Gli1信号, 进一步诱导细胞核内基因的转录, 此过程起着激活Hedgehog信号通路的作用.
袁周, 副主任医师, 上海交通大学附属第六人民医院
随着对慢病毒载体安全性与可靠性的进一步完善, SMO靶向siRNA慢病毒表达载体在胰腺癌临床治疗中或将发挥巨大的作用, 为胰腺癌治疗现状的改变带来契机, 尽管慢载体的研究有了很大进展, 但距离临床应用还有很长的路要走.
本文选出了抑制SMO基因表达效率最好的siRNA慢病毒表达载体, 并证实此病毒转染胰腺癌细胞株后对SMO基因表达的检测, 经计算3种SMO siRNA慢病毒表达载体抑制率, 证实SMO siRNA1慢病毒表达载体对SMO基因表达抑制率最高.
靶向干扰病毒载体转染的细胞仅有少量的坏死脱落, 且病毒滴度达到了实验用要求, 证明该病毒载体的安全有效性, 为进一步研究在胰腺癌发生发展过程中Hedgehog信号通路的决定性作用及其调控机制提供了理想的研究工具.
RNA干扰: 是生物体内目的基因沉默的过程, 他主要在信息核糖核酸层面通过双联核糖核酸分子诱导下具有特异性序列的介导, 这种沉默现象的小片段RNA称为干扰RNA.
本文研究以Hegdehog信号通路中的关键成员SMO基因为靶点, 构建携带SMO siRNA的慢病毒表达载体, 为进一步深入分析Hegdehog信号通路在胰腺癌发生过程中的作用与调控机制奠定基础.
编辑: 于明茜 电编:都珍珍
| 1. | Hao K, Tian XD, Qin CF, Xie XH, Yang YM. Hedgehog signaling pathway regulates human pancreatic cancer cell proliferation and metastasis. Oncol Rep. 2013;29:1124-1132. [PubMed] [DOI] |
| 2. | Chang Q, Foltz WD, Chaudary N, Hill RP, Hedley DW. Tumor-stroma interaction in orthotopic primary pancreatic cancer xenografts during hedgehog pathway inhibition. Int J Cancer. 2013;133:225-234. [PubMed] [DOI] |
| 3. | Morifuji Y, Onishi H, Iwasaki H, Imaizumi A, Nakano K, Tanaka M, Katano M. Reoxygenation from chronic hypoxia promotes metastatic processes in pancreatic cancer through the Hedgehog signaling. Cancer Sci. 2014;105:324-333. [PubMed] [DOI] |
| 4. | Xu Y, An Y, Wang X, Zha W, Li X. Inhibition of the Hedgehog pathway induces autophagy in pancreatic ductal adenocarcinoma cells. Oncol Rep. 2014;31:707-712. [PubMed] [DOI] |
| 5. | 王 玉琼, 高 军, 李 兆申. 胰腺癌中Hedgehog通路与其他通路间相互作用的研究进展. 中国肿瘤生物治疗杂志. 2015;22:112-115. |
| 8. | Damhofer H, Medema JP, Veenstra VL, Badea L, Popescu I, Roelink H, Bijlsma MF. Assessment of the stromal contribution to Sonic Hedgehog-dependent pancreatic adenocarcinoma. Mol Oncol. 2013;7:1031-1042. [PubMed] [DOI] |
| 9. | Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-2917. [PubMed] [DOI] |
| 10. | AJDS , RS , JX , EWV . Cancer statistics 2010. CA Cancer J Clin. 2010;60:277-300. [DOI] |
| 11. | 依马木买买提江•阿布拉, 李东伟, 易超, 李海军. Hedgehog信号通路基因Shh、Ptch1、Smo及Gli1在胰腺癌中的表达及意义. 世界华人消化杂志. 2015;23:2894-2900. [DOI] |
| 12. | Guo J, Gao J, Li Z, Gong Y, Man X, Jin J, Wu H. Adenovirus vector-mediated Gli1 siRNA induces growth inhibition and apoptosis in human pancreatic cancer with Smo-dependent or Smo-independent Hh pathway activation in vitro and in vivo. Cancer Lett. 2013;339:185-194. [PubMed] [DOI] |
| 13. | 诸 娴. 胰腺癌发病中Hedgehog-Gli1信号通路效应MicroRNAs的筛选与鉴定. 上海: 第二军医大学 2015; . |
| 14. | Hammerschmidt M, Brook A, Mc Mahon AP. The world according to hedgehog. Trends Genet. 1997;13:14-21. [DOI] |
| 15. | Martin ST, Sato N, Dhara S, Chang R, Hustinx SR, Abe T, Maitra A, Goggins M. Aberrant methylation of the Human Hedgehog interacting protein (HHIP) gene in pancreatic neoplasms. Cancer Biol Ther. 2005;4:728-733. [PubMed] [DOI] |
| 16. | Feldmann G, Dhara S, Fendrich V, Bedja D, Beaty R, Mullendore M, Karikari C, Alvarez H, Iacobuzio-Donahue C, Jimeno A. Blockade of hedgehog signaling inhibits pancreatic cancer invasion and metastases: a new paradigm for combination therapy in solid cancers. Cancer Res. 2007;67:2187-2196. [PubMed] [DOI] |
| 19. | Walter K, Omura N, Hong SM, Griffith M, Vincent A, Borges M, Goggins M. Overexpression of smoothened activates the sonic hedgehog signaling pathway in pancreatic cancer-associated fibroblasts. Clin Cancer Res. 2010;16:1781-1789. [PubMed] [DOI] |
| 21. | Onishi H, Morisaki T, Nakao F, Odate S, Morisaki T, Katano M. Protein-bound polysaccharide decreases invasiveness and proliferation in pancreatic cancer by inhibition of hedgehog signaling and HIF-1α pathways under hypoxia. Cancer Lett. 2013;335:289-298. [PubMed] [DOI] |
| 22. | Yang SH, Hsu CH, Lee JC, Tien YW, Kuo SH, Cheng AL. Nuclear expression of glioma-associated oncogene homolog 1 and nuclear factor-κB is associated with a poor prognosis of pancreatic cancer. Oncology. 2013;85:86-94. [PubMed] [DOI] |
| 23. | Li X, Ma Q, Xu Q, Liu H, Lei J, Duan W, Bhat K, Wang F, Wu E, Wang Z. SDF-1/CXCR4 signaling induces pancreatic cancer cell invasion and epithelial-mesenchymal transition in vitro through non-canonical activation of Hedgehog pathway. Cancer Lett. 2012;322:169-176. [PubMed] [DOI] |
| 24. | Mo W, Xu X, Xu L, Wang F, Ke A, Wang X, Guo C. Resveratrol inhibits proliferation and induces apoptosis through the hedgehog signaling pathway in pancreatic cancer cell. Pancreatology. 2011;11:601-609. [PubMed] [DOI] |
| 25. | Coni S, Infante P, Gulino A. Control of stem cells and cancer stem cells by Hedgehog signaling: pharmacologic clues from pathway dissection. Biochem Pharmacol. 2013;85:623-628. [PubMed] [DOI] |
| 26. | Chenna V, Hu C, Pramanik D, Aftab BT, Karikari C, Campbell NR, Hong SM, Zhao M, Rudek MA, Khan SR. A polymeric nanoparticle encapsulated small-molecule inhibitor of Hedgehog signaling (NanoHHI) bypasses secondary mutational resistance to Smoothened antagonists. Mol Cancer Ther. 2012;11:165-173. [PubMed] [DOI] |
| 27. | Li SH, Fu J, Watkins DN, Srivastava RK, Shankar S. Sulforaphane regulates self-renewal of pancreatic cancer stem cells through the modulation of Sonic hedgehog-GLI pathway. Mol Cell Biochem. 2013;373:217-227. [PubMed] [DOI] |
| 28. | Spivak-Kroizman TR, Hostetter G, Posner R, Aziz M, Hu C, Demeure MJ, Von Hoff D, Hingorani SR, Palculict TB, Izzo J. Hypoxia triggers hedgehog-mediated tumor-stromal interactions in pancreatic cancer. Cancer Res. 2013;73:3235-3247. [PubMed] [DOI] |
| 29. | Onishi H, Kai M, Odate S Iwasaki H, Morifuji Y, Ogino T, Morisaki T, Nakashima Y, Katano M. Hypoxia activates the hedgehog signaling path way in a ligand-independent manner by upregulation of Smo transcription in pan creatic cancer. Cancer science. 2011;102:1144-1150. [DOI] |
| 30. | Kogame A, Tagawa Y, Shibata S, Tojo H, Miyamoto M, Tohyama K, Kondo T, Prakash S, Shyu WC, Asahi S. Pharmacokinetic and pharmacodynamic modeling of hedgehog inhibitor TAK-441 for the inhibition of Gli1 messenger RNA expression and antitumor efficacy in xenografted tumor model mice. Drug Metab Dispos. 2013;41:727-734. [PubMed] [DOI] |