修回日期: 2016-05-26
接受日期: 2016-06-06
在线出版日期: 2016-06-28
目的: 探讨胆宁片对实验性非酒精性脂肪肝大鼠的治疗作用.
方法: SD♂大鼠53只, 首先随机分为2组, 正常饲料组10只、高脂肪饲料组43只. 通过高脂饲料喂养的方式复制非酒精性脂肪肝大鼠模型. 4 wk造模结束后, 处死10只正常饲料组和3只高脂饲料组大鼠, 观察模型复制情况. 确定模型复制成功后, 将剩余高脂肪饲料组40只随机分为模型组、胆宁片组、绞股蓝组、多烯磷脂酰胆碱组. 分别给予相应剂量的生理盐水、胆宁片及各组对应的药物. 连续给药4 wk后处死各组大鼠, HE染色法观察病理变化, 生化法检测血清甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)、高密度脂蛋白(high density lipoprotein, HDL)、低密度脂蛋白(low density lipoprotein, LDL), ELISA法测定肝组织匀浆中肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、转化生长因子-β1(transforming growth factor-β1, TGF-β1)的含量, 分光光度计法测定琥珀酸脱氢酶(succinate dehydrogenase, SDH)的含量.
结果: 治疗结束后, 与模型组比较, 治疗各组大鼠肝脏病理学改变有不同程度的改善. 与模型组比较, 各治疗组大鼠血清中的血脂含量有不同程度的下降(P<0.01), 各治疗组肝组织TNF-α、TGF-β1含量下降(P<0.01)、SDH含量升高(P<0.01). 胆宁片在降低TNF-α、TGF-β1含量、提高SDH方面与多烯磷脂酰胆碱比较无明显差异性(P>0.05), 但优于绞股蓝组(P<0.05).
结论: 胆宁片对非酒精性脂肪肝大鼠有治疗作用.
核心提示: 非酒精性脂肪肝的发病率逐年升高, 传统治疗方案虽有一定的效果, 但不能从根本上控制血脂, 且不能有效改善肝区不适、乏力、腹胀等不典型症状. 实验中, 胆宁片能有效降低模型组大鼠血脂及转化生长因子-β1、肿瘤坏死因子-α含量, 提高琥珀酸脱氢酶含量, 因此是治疗非酒精性脂肪肝有效的药物.
引文著录: 张金华, 王湘宁, 江娜, 周胜兰, 冯岳湘, 刘志平, 徐莹, 周海波. 胆宁片对非酒精性脂肪肝大鼠的治疗作用. 世界华人消化杂志 2016; 24(18): 2875-2880
Revised: May 26, 2016
Accepted: June 6, 2016
Published online: June 28, 2016
AIM: To investigate the therapeutic effect of Danning tablets on experimental nonalcoholic fatty liver in rats.
METHODS: Fifty-three male rats were randomly divided into two groups, including 10 in a normal diet group and 43 in a high fat diet group. Nonalcoholic fatty liver disease was induced in rats by giving a high fat diet. At the end of 4 wk, 10 normal rats and 3 rats in the high fat diet group were killed to determine if the model was established successfully. The remaining rats in the high fat diet group (n = 40) were randomly divided into a model group, a Danning tablets group, a gynostemma group, and a polyene phosphatidylcholine group and given normal saline, Danning tablets and the corresponding drugs, respectively. After 4 wk of treatment, the rats were sacrificed. Pathological changes were examined by HE staining, and biochemical methods were used to detect serum triglyceride (TG), total cholesterol (TC), high density lipoprotein (HDL), and low density lipoprotein (LDL). ELISA was used to determine the contents of tumor necrosis factor-α (TNF-α) and transforming growth factor-β1 (TGF-β1) in liver homogenate, and photometric meter method was used for the determination of the content of succinate dehydrogenase (SDH).
RESULTS: After treatment, compared with the model group, the pathological changes of the liver of rats in each group were improved in varying degrees, serum lipid levels showed varying degrees of decrease (P < 0.01), liver tissue TNF-α and TGF-β1 contents significantly decreased (P < 0.01), and SDH increased (P < 0.01). Danning tablets showed similar effects to polyene phosphatidylcholine in reducing TNF-α and TGF-β1 contents and improving SDH (P > 0.05), but was better than gynostemma (P < 0.05).
CONCLUSION: Danning tablets have an appreciated therapeutic effect on nonalcoholic fatty liver disease in rats.
- Citation: Zhang JH, Wang XN, Jiang N, Zhou SL, Feng YX, Liu ZP, Xu Y, Zhou HB. Therapeutic effect of Danning tablets on nonalcoholic fatty liver disease in rats. Shijie Huaren Xiaohua Zazhi 2016; 24(18): 2875-2880
- URL: https://www.wjgnet.com/1009-3079/full/v24/i18/2875.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i18.2875
随着人民生活水平的不断提高, 我国常见的疾病谱也发生着变化, 其中非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)发病率逐年升高[1], 目前已经成为仅次于病毒性肝炎的第二大肝病[2]. NAFLD是指除外酒精和其他明确的损肝因素所致, 以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征. 目前随着研究的不断深入, NAFLD不仅可以引起非酒精性脂肪肝肝炎(non-alcoholic steatohepatitis, NASH), 甚至可以直接引起肝硬化的发生, 过去不明原因的肝硬化中可能有相当一部分是由NAFLD引起[3]. 病因学研究发现NAFLD发生与多种因素有关, 包括: 肥胖和高脂血症、2型糖尿病和胰岛素抵抗[4]等, 肝细胞内脂质特别是甘油三酯沉积是形成NAFLD的一个先决条件. 目前西医针对NAFLD的治疗, 主要包括控制饮食、加强运动, 若发生肝功能异常时予以多烯磷脂酰胆碱、水飞蓟素等护肝药物治疗, 往往容易复发, 不易从根本上去除脂肪在肝脏过度堆积的病因, 于是人们纷纷把目光投向了传统中医药.
胆宁片是根据祖国医学六腑以通为用的理论, 研制而成的治疗胆道疾病的"老药", 其在治疗慢性胆道感染、胆石病的总有效率达95.83%, 其有效率已得到临床的验证[5]. 部分学者在临床实践过程中发现, 胆宁片可以通过疏肝利胆达到治疗慢性胆道疾病的同时, 还能起到养肝柔肝治疗NAFLD的作用[6]. 我们希望通过复制NAFLD大鼠模型的方式, 利用胆宁片来进行治疗, 初步探究胆宁片治疗NAFLD的机制.
SPF级别53只♂SD大鼠体质量180-220 g [许可证编号SCXK(湘)2011-0003]. 湖南斯莱克景达实验动物有限公司提供. 胆宁片(由上海和记黄埔药业有限公司生产, 国药准字: Z10910040)配制成56.25 mg/mL的溶液; 绞股蓝总甙片(由亚宝药业集团股份有限公司生产, 国药准字Z20000091)配制成1.875 mg/mL的溶液; 多烯磷脂酰胆碱胶囊(由赛诺菲·安万特公司生产, 国药准字: HZ20059010)配制成14.25 mg/mL的溶液. 高脂饲料(配方: 猪油10%, 蛋黄粉5%, 胆固醇1%, 丙基硫氧嘧啶0.2%, 脱氧胆酸钠0.5%, 蔗糖5%, 基础饲料78.3%[7]; 固体饲料的制备: 将各成分按比例计算出所需量, 由武汉市万千佳兴科技生物有限公司制作). 普通饲料(由武汉大学动物实验中心提供). 大鼠转化生长因子-β1(transforming growth factor-β1, TGF-β1) ELISA试剂盒、肿瘤坏死因子-α(tumor necrosis factor α, TNF-α) ELISA试剂盒均由欣博盛生物科技有限公司提供, 琥珀酸脱氢酶(succinate dehydrogenase, SDH)试剂盒由南京建成生物工程研究所提供. 酶标检测仪(由Rayto生产型号Rt2100c). 水浴锅, 由姜堰市天力医疗器械厂有限公司生产, 型号TL-420D; 超低温冰箱, 由海尔生产, 型号DW-86L626; 涡旋混合器, 由天悦电子生产, 型号TYXH-Ⅱ; 纯水仪, 由青岛富勒姆科技生产, 型号FBZ2001-UP-P; 台式高速冷冻离心机, 由Heal Force生产, 型号Neofuge 15R; 超声细胞粉碎机, 由宁波新芝生物生产, 型号JY92-Iin; 电动玻璃匀浆器, 由宁波新芝生物生产, 型号DY89-Ⅱ; 电子天平, 由梅特勒-托利多仪器(上海)有限公司生产, 型号PL-203; 紫外可见分光光度计, 由上海现科仪器有限公司生产, 型号752-P; 实验场所: 武汉大学动物实验中心.
1.2.1 动物饲养环境: 53只SD大鼠饲养于SPF级动物房, 给予普通饲料喂养, 自由进食进水, 环境温度控制在17 ℃-24 ℃之间, 适应性喂养1 wk后, 随机分为两组: 正常饲料组10只, 高脂肪饲料组43只.
1.2.2 动物模型的制备: 正常组予以正常饲料喂养, 模型组予以高脂肪饲料喂养共4 wk, 喂养期间每周处死1只模型组大鼠了解模型制作情况. 于造模4 wk后处死10只正常饲料组和3只高脂饲料组大鼠. 比较两组的肝组织病理切片及肝组织生化检测结果, 以高脂饲料组大鼠肝脏30%以上的肝细胞均已形成大泡伴小泡性脂肪变性, 及肝脏脂肪含量水平上升为标准, 确定造模成功[8].
1.2.3 实验分组及材料准备: 造模结束后, 将剩余高脂饲料组大鼠随机分为4组(每组10只), 各自进行灌胃治疗: 模型组, 灌胃生理盐水10 mL/(kg•d)、胆宁片组, 灌胃胆宁片562.5 mg/(kg•d)、绞股蓝组, 灌胃绞股蓝溶液18.75 mg/(kg•d)、多烯磷脂酰胆碱组, 灌胃多烯磷脂酰胆碱溶液142.5 mg/(kg•d). 治疗4 wk后处死所有动物, 采集血液和肝脏标本备用.
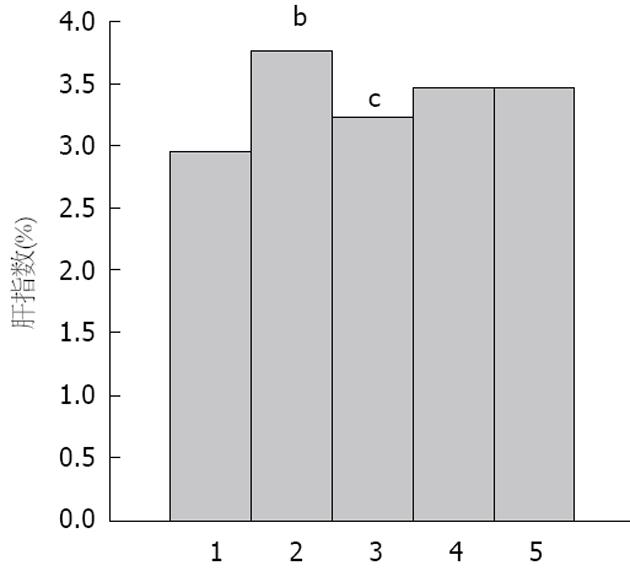
1.2.4 观察指标及检测: (1)一般情况: 实验过程中每周称重1次, 观察大鼠毛发、精神及食欲等, 处死动物时称量肝脏湿质量, 计算肝指数(肝指数 = 肝湿质量/体质量×100%); (2)血清生化: 测定血清甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)、高密度脂蛋白(high density lipoprotein, HDL)、低密度脂蛋白(low density lipoprotein, LDL)含量. 采集血液标本送交武汉市汉口医院检验科完成; (3)组织学病检: 40 g/L多聚甲醛固定标本, 石蜡切片进行HE染色, 在光镜下观察肝脏脂肪变性的情况; (4)ELISA法测定肝组织TGF-β1、TNF-α测定: 将各组肝组织约100 mg加入匀浆器, 制作10%组织匀浆液. 采用ELISA法检测TGF-β1和TNF-α担保含量. 按照ELISA试剂盒说明书进行操作; (5)分光光度计法测定肝组织SDH含量: SDH测定: 取大鼠肝组织制作成10%组织匀浆, 按操作步骤进行SDH活力测定, 测得5 s时吸光度A1值, 继续测得65 s时吸光度为A2值, 同时测得该组织匀浆的蛋白浓度, 按说明书给出公式计算出组织中SDH含量.
统计学处理 统计学软件选用SPSS13.0软件包, 实验数据以mean±SD来表示, 结果用单因素方差分析, 组间用q检验, P<0.05为差异有统计学意义.
整个实验过程中, 各组大鼠体质量均无明显差异性(P>0.05)(图1); 模型组大鼠活动度欠佳, 可见大便稀软情况.
与正常组比较, 模型组TG、TC、LDL均显著升高, HDL显著降低(P<0.05); 与模型组比较, 各治疗组TG、TC、LDL有不同程度的下降. 给药治疗有提高HDL的作用, 与模型组比较, 有统计学差异(P<0.05)(表1).
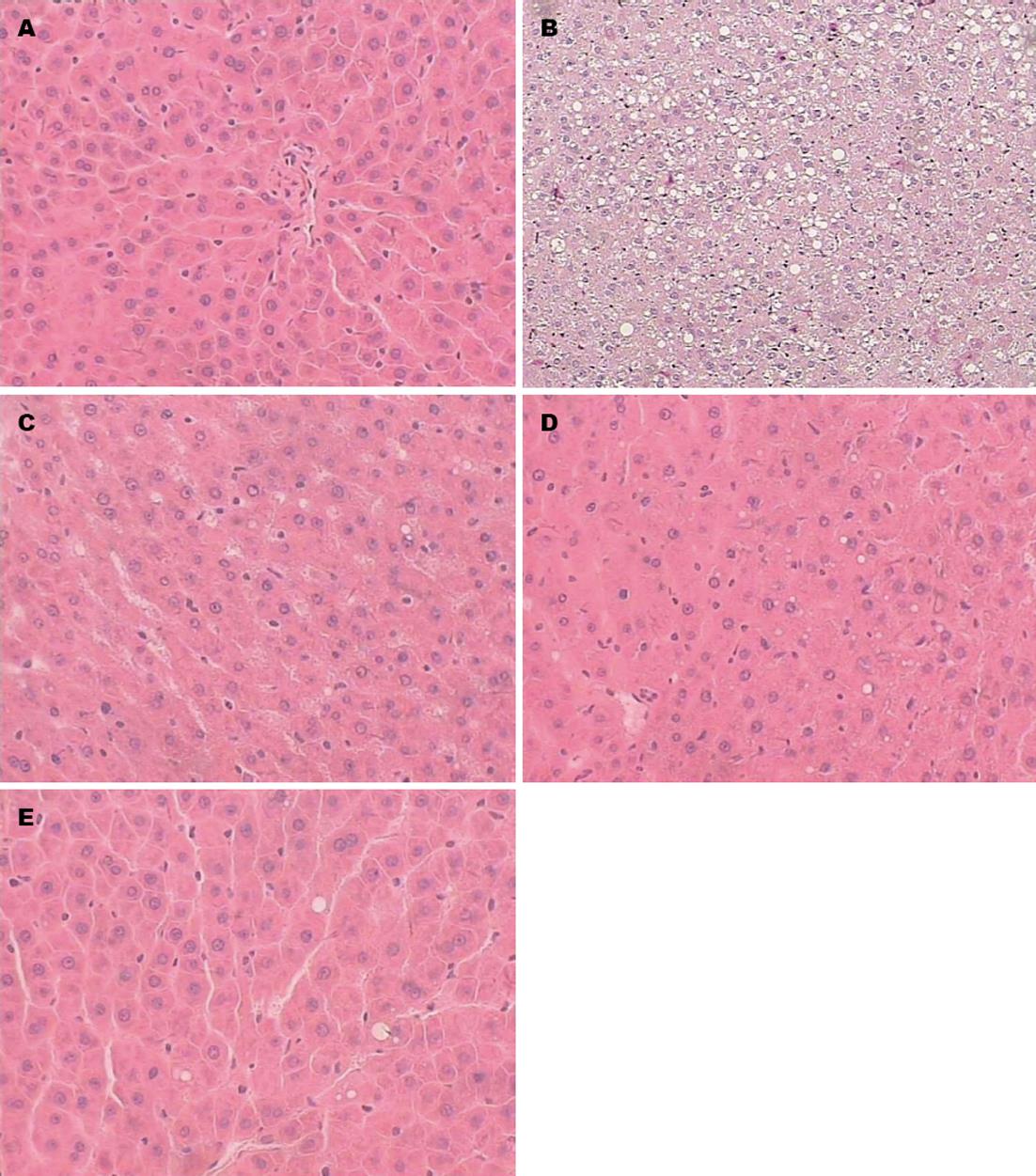
内镜下观察各组大鼠肝组织HE染色, 正常组肝细胞形态正常, 未见明显脂滴分布; 模型组大鼠肝细胞肿胀, 大小不均, 胞浆内含多量大小不等的脂滴分布, 并可见肝细胞内脂滴融合, 占据整个胞浆, 细胞核被挤压至细胞边缘, 偶见坏死灶; 治疗组大鼠均出现不同程度的弥漫性肝细胞脂肪变性(图2).
与正常组比较, 模型组TGF-β1、TNF-α均显著升高, SDH含量显著降低; 与模型组比较, 各治疗组TGF-β1、TNF-α有不同程度的下降, SDH含量有不同程度升高. 给药治疗有提高SDH的作用, 降低TGF-β1 、TNF-α的作用(表2).
随着我国社会的不断发展, 高热量、高脂肪等生活方式的逐渐西化, 在摄入过量的能量而又少于运动, 久之则生湿热、痰浊, 湿热痰浊痹阻经络, 聚滞为积; 同时随着社会节奏的加快, 生活工作压力增大, 长期情志不畅, 导致肝气失于疏泄、肝气郁结, 从而加重NAFLD的发生[9]. 目前"二次打击学说"可以解释NAFLD的部分发病机制[10], 初次打击主要为肥胖、胰岛素抵抗、瘦素抵抗等原因引起肝细胞内脂质过度沉积, 第二次打击是以氧化应激为主, 表现为线粒体损伤、炎症介质的产生. 实验中, 实验动物肝脏脂肪酸产生增多、脂肪过度堆积, 促使出现肝源性胰岛素抵抗、脂质过氧化、活性氧簇水平升高, 启动TGF-β1、TNF-α等基因转录, 引起炎症反应; 同时通过影响体内SDH的活力, 使肝细胞内线粒体氧化磷酸化不能正常进行, 最终必然导致能量生成障碍并进而引起肝脏功能和代谢异常[11]. 本实验中模型组中TC、TG、LDL、TGF-β1、TNF-α含量均较正常组显著升高(P<0.01), HDL、SDH含量显著下降(P<0.01); 经治疗后各组大鼠TGF-β1 、TNF-α含量均有不同程度下降, 其中胆宁片组明显优于绞股蓝组, 与多烯磷脂酰胆碱组无明显差异性(P>0.05)、各组SDH含量均有不同程度升高, 其中胆宁片组优于绞股蓝组(P<0.05). 可见胆宁片对非酒精性脂肪肝大鼠有较好的治疗作用.
本实验通过高脂饮食复制大鼠非酒精性脂肪肝的模型, 造模后大鼠TG、TC水平均显著升高, 病理结果也显示肝脏脂质沉积过多, 并且伴有1/3以上的大泡性脂肪变性, 比较符合人类由高脂饮食方式引起单纯的血脂升高, 逐步发展至NAFLD的过程.
目前临床上NAFLD以病因治疗、基础治疗为主, 一般无特殊药物应用; 若进展至NASH, 出现血清ALT明显升高时, 则需要联用保肝抗炎药物, 尤其应选择安全且疗效确切的药物[12]. 依据季光等[13]研究结论, 胆宁片能有效改善NAFLD患者肝功能、血脂及肝脏影像学变化, 疗效略优于优思弗; 此外, 多年来的临床应用中尚未出现严重不良反应的报道[14]; 提示胆宁片是作为治疗NAFLD的一种安全、有效且价格低廉的"新药". 我们认为, 根据"二次打击学说", 具有降低血脂和抗氧化应激双重作用的药物更有利于NAFLD的防治, 能真正达到"标本兼治". 胆宁片在降低TGF-β1、TNF-α含量方面与多烯磷脂酰胆碱虽无明显明显差异性, 但在调脂方面要优于多烯磷脂酰胆碱, 更有利于NAFLD的治疗; 依据隋晓丹等[15]综述, 胆宁片中除白茅根外, 其余成分如大黄、虎杖、山楂、陈皮等均为各位医家治疗NAFLD经方、验方中的常见药物, 胆宁片中各药物配伍, 共奏疏肝利胆、清热泻下之功, 对于缓解由NAFLD引起的肝区不适、腹胀、纳差等不典型症状有明显优势[16]. 因此, 胆宁片在治疗NAFLD方面具有广阔的应用前景.
实际工作中发现胆宁片能够治疗非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD), 且具有便宜、安全、有效等特点; 本文通过高脂饮食复制NAFLD动物模型, 初步探究其作用机制, 以更好的指导临床工作.
刘旭东, 副主任医师, 广西中医学院附属瑞康医院肝病科; 郝微微, 主任医师, 医学博士, 硕士生导师, 上海中医药大学附属岳阳中西医结合医院消化内科; 迟宝荣, 教授, 吉林大学第一医院消化内科
目前尚未发现治疗NAFLD的特效制剂, 且临床用药不统一、缺乏大样本、多中心、随机双盲对照的临床试验研究; 胆宁片临床证实有效, 但仅针对湿热型, 其他类型如肝郁脾虚型、肝肾亏虚型等则疗效欠佳; 且因存在中医辩证分型用药的特点, 限制了西医临床医师的应用.
在季光等的研究报道中证实了胆宁片是治疗NAFLD(湿热型)有效的药物, 其作用略优于优思弗.
本文除了常规比较不同组别大鼠血脂、肝组织HE染色、肝脏指数外, 运用统计学比较了各组之间肿瘤坏死因子、琥珀酸脱氢酶的含量, 得出具有降低血脂和抗氧化应激双重作用的药物更有利于NAFLD的防治的结论.
胆宁片已运用于临床10多年, 已证实是安全有效的药物; 目前的研究结论, 扩大了其临床应用范围; 且该药价格适中、易于接受, 具有广阔的应用前景.
文章通过比较胆宁片与降脂药绞股蓝, 以及保肝药多烯磷脂酰胆碱对NAFLD治疗的效果, 得出胆宁片对NAFLD治疗有效, 且优于绞股蓝. 另外, 胆宁片还有降血脂的作用. 本研究立题新颖, 设计合理, 逻1/4严谨, 统计学处理恰当, 实验证据充足. 通过实验证实了胆宁片对NAFLD治疗的有效性, 并从中医理论讨论了该药的治病机制.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 郭鹏 电编:闫晋利
| 6. | 季 光, 范 建高, 陈 建杰, 陆 伦根, 邢 练军, 郑 培永, 顾 宏刚, 魏 华凤, 尤 圣富, 寿 德刚. 胆宁片治疗非酒精性脂肪性肝病(湿热型)的临床研究. 中国中西医结合杂志. 2005;25:485-488. |
| 10. | Day CP, James OF. Steatohepatitis: a tale of two "hits"? Gastroenterology. 1998;114:842-845. [PubMed] [DOI] |
| 11. | 时 昭红, 张 介眉, 王 湘宁, 韦 秀明, 冯 云霞, 刘 浩. 葱白提取物对非酒精性脂肪肝大鼠肝脏线粒体琥珀酸脱氢酶的影响. 中国中西医结合消化杂志. 2010;18:284-287. |