修回日期: 2016-06-01
接受日期: 2016-06-06
在线出版日期: 2016-06-28
目的: 探讨热休克蛋白70(heat shock protein 70, HSP70)在小鼠酒精肝损伤过程中的变化规律及意义.
方法: 将50只♂小鼠随机分为两组, 对照组(n = 10)和模型组(n = 40). 对照组小鼠正常饲养处死取肝脏; 模型组小鼠连续4 wk白酒灌胃(0.05 mL/10 g), 每天1次, 并分别在第1、2、3、4周各用小鼠5只取肝脏. 将所得肝脏分别处理做组织切片染色观察小鼠肝脏组织病理变化以及用Western blot 法检测小鼠酒精肝损伤过程中HSP70含量的动态变化.
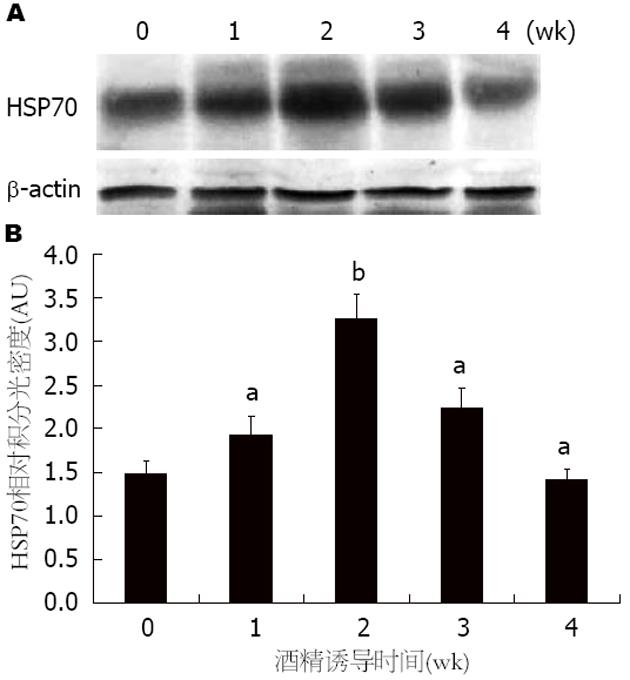
结果: 在小鼠酒精性肝损伤过程中, 模型组小鼠第1周HSP70的表达量明显高于对照组(P<0.05), 并在第2周达到最高峰(P<0.01), 随后HSP70表达量开始下降; 在第3周时, HSP70的表达量仍比对照组高(P<0.05); 但在第4周时小鼠HSP70的表达量却明显低于对照组(P<0.05). HE染色显示, 与对照组相比, 模型组中小鼠肝组织中炎细胞浸润增加, 肝细胞的脂肪变、气球样变也明显增多, 甚至在第4周时肝组织中出现了点状坏死.
结论: 小鼠酒精肝损伤过程中HSP70的表达量有明显的动态变化规律, 与小鼠肝脏损伤程度变化一致, 表明HSP70表达与小鼠酒精性肝损伤过程中的保护作用密切相关.
核心提示: 本研究使用蛋白印迹的方法检测热休克蛋白70(heat shock protein 70, HSP70)在小鼠急性酒精肝损伤过程中表达量的动态变化, 探讨HSP70表达量的增加与肝脏组织修复的关系, 认为HSP70对小鼠酒精肝损伤具有保护作用, 同时也为进一步研究HSP70可能作为靶点的药物提供了理论基础.
引文著录: 王莲丽, 李三强, 卢华杰, 马秀青, 侯松林, 潘勇阳, 叶倩雅, 孙晓昕. 小鼠酒精性肝损伤过程中热休克蛋白70的表达及意义. 世界华人消化杂志 2016; 24(18): 2869-2874
Revised: June 1, 2016
Accepted: June 6, 2016
Published online: June 28, 2016
AIM: To detect the dynamical expression of heat shock protein 70 (HSP70) during alcoholic liver injury in mice.
METHODS: Fifty healthy male mice were randomly divided into a control group (n = 10) and a model group (n = 40). Alcoholic liver injury was induced in mice by intragastric infusion of 56% alcohol (0.05 mL/10 g), once a day for 4 wk. At the end of weeks 1, 2, 3 and 4, liver samples were, respectively, taken for observing tissue pathological changes and for preparing 10% liver homogenate to detect the amount of HSP70 during liver injury using Western blot.
RESULTS: Compared with normal mice, the expression of HSP70 in the model group gradually increased from 1st week to 2nd week, peaking at the 2nd week (P < 0.01). At the 3rd week, HSP70 expression began to gradually decline but was still significantly higher than that of the normal mice. At the 4th week, HSP70 expression was lower in model mice than in the normal mice (P < 0.05). HE staining showed that there was more significant inflammatory cell infiltration in the model group compared with the control group, and hepatic steatosis and ballooning degeneration were increasingly seen during alcoholic liver injury. Especially, spotty necrosis was found at the 4th week.
CONCLUSION: The expression of HSP70 significantly changes during alcoholic liver injury, indicating that the expression of HSP70 may play a protective role during alcoholic liver injury in mice.
- Citation: Wang LL, Li SQ, Lu HJ, Ma XQ, Hou SL, Pan YY, Ye QY, Sun XX. Significance of expression of heat shock protein 70 in alcoholic liver injury in mice. Shijie Huaren Xiaohua Zazhi 2016; 24(18): 2869-2874
- URL: https://www.wjgnet.com/1009-3079/full/v24/i18/2869.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i18.2869
近几年随着我国居民生活习惯的改变, 酒精消耗量不断增加, 酒精性肝病的发病率呈逐年增长的趋势, 过量或长期的饮酒会影响体内正常的糖代谢渠道, 从而产生氧自由基导致心、肝、脾、肾等许多脏器系统的损害[1], 给人们的生活质量带来极大的危害. 因此近几年国内研究者不断探究该疾病的发病机制, 但引起肝损伤的因素有很多, 具体的分子学机制仍不是很清楚. 目前为止, 国内外研究最成熟的酒精性肝损伤模型是大鼠或小鼠酒精灌胃[2]. 大量研究表明热休克蛋白70(heat shock protein 70, HSP70)在药物性肝损伤中具有重要的保护作用, 但在酒精性肝损伤中作用机制的研究并不多. 我们实验就是通过直接酒精灌胃检测酒精性肝损伤过程中HSP70表达量的变化, 来讨论HSP70的表达在酒精性肝损伤中的保护作用, 以及其可能的潜在临床意义.
清洁健康Balb/c ♂小鼠, 体质量25 g±4 g, 河南科技大学医学院动物实验中心提供. 56%红星二锅头, 北京红星股份有限公司生产; HSP70鼠源性单克隆抗体, 购自美国Santa Cruz公司; 辣根过氧化物酶标记的兔抗小鼠二抗, 购自北京中杉金桥生物技术有限公司; 其余化学试剂均为市售分析纯. JY300C电泳仪, 北京君意东方电泳设备有限公司产品; CX31RBSF光学显微镜, 奥林巴斯(中国)有限公司产品.
1.2.1 小鼠酒精性肝损伤模型的建立: 将50只健康♂小鼠分为对照组(n = 10)和模型组(n = 40). 在室温22 ℃的实验室里饲养1 wk后, 模型组中的小鼠用56%红星二锅头连续灌胃4 wk(0.05 mL/10 g), 每天1次, 观察小鼠的活动状态, 分别于第1、2、3、4周时取5只小鼠的肝脏; 对照组小鼠正常喂养4 wk后直接取肝脏. 将所得肝脏分为两份, 一份制成蜡块进行HE染色观察小鼠肝脏病变, 另一份匀浆取蛋白检测HSP70在小鼠肝脏中表达情况.
1.2.2 HE染色: 肝组织石蜡切片在二甲苯中脱蜡2次, 每次15分钟, 再移入二甲苯和纯乙醇(1∶1)混合液中10 min, 逐次移入1000、950、850、700 mL/L的乙醇中浸泡, 各为5 min, 最后经蒸馏水转入苏木精染液. 染色1 min, 水冲洗玻片上多余染液, 在0.5%-1.0%盐酸乙醇(700 mL/L乙醇配制)溶液中分色4 s, 在碳酸锂饱和液中短时间碱化, 放入蒸馏水中返蓝后用0.5%伊红染液染色5 min, 再依次经过700、850、950、1000 mL/L乙醇脱水处理, 各为5 min, 用二甲苯透明(2次), 共约10 min, 最后用树胶脂进行分片, 镜下观查组织病变.
1.2.3 蛋白印迹HSP70检测及处理: 利用考马斯亮蓝G250蛋白定量后取50 μg蛋白样品经SDS-PAGE电泳后, 将蛋白转移到硝酸纤维素膜上, 用5%脱脂奶粉、0.1%Tween-20、PBS(PBST)室温封闭45 min, 用一抗HSP70(1∶600), 37 ℃孵育1 h, PBST洗3次, 每次5 min, 加入辣根过氧化物酶标记的羊抗鼠二抗(1∶800)于37 ℃孵育1 h, PBST洗3次每次5 min, DAB显色, 检测阳性信号. 扫描仪扫描后, 用Gel Pro4.0软件计算出蛋白相对表达值, 进行比较(被检测的目的蛋白相对表达值 = 目的蛋白条带灰度值/β-actin蛋白条带灰度值).
统计学处理 利用Gel Pro4.0软件分析蛋白条带, 实验数据以mean±SD表示, 显著性分析用ANOVA, 组间比较使用Duncan's test, 用SPSS13.0进行数据统计分析处理. P<0.05为差异有统计学意义.
正常对照小鼠整体表现为运动状况良好, 反应敏捷, 活泼多动, 精神、食欲状况良好, 毛发光滑, 光泽鲜明. 模型组小鼠在灌胃后的急性表现为行走摇摆, 活动度减少; 灌胃1 wk后, 与对照组相比, 活动度和食欲状态下降, 易激惹; 但从第3周开始, 小鼠精神和饮食情况差异更加明显, 毛发光泽感降低, 颜色变得粗糙有发黄的趋势, 不同程度的懒动, 行动迟缓, 体质量不增或增长迟缓.
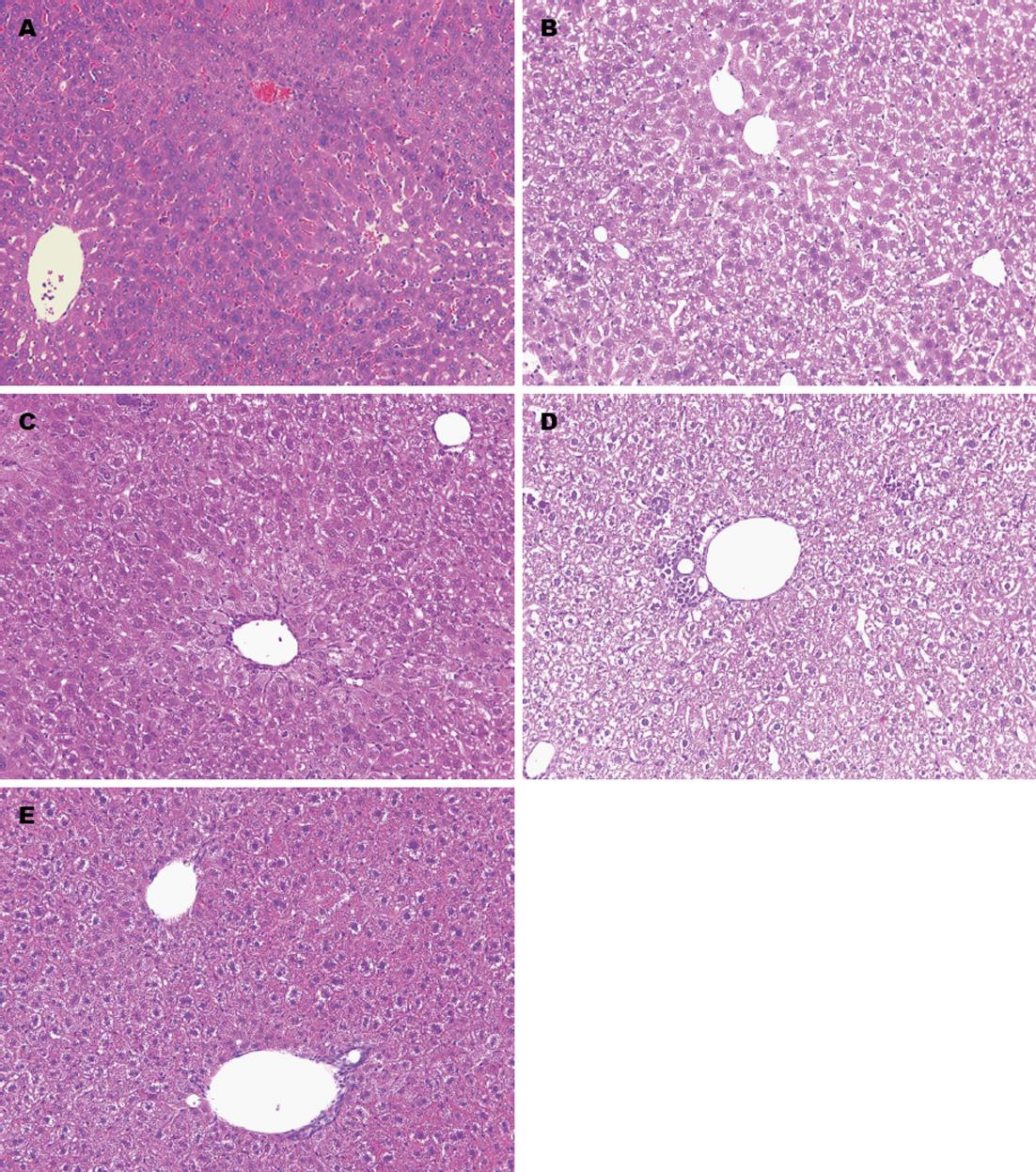
镜下组织切片显示: 对照组小鼠(图1A)肝细胞以中央静脉为中心向外周呈放射状分布, 结构紧密, 排列整齐, 肝细胞轮廓清晰, 胞质均染; 对照组中小鼠第1周(图1B), 肝小叶中央静脉有轻微的充血扩张, 细胞排列尚好, 轻微肿胀; 第2周(图1C), 肝小叶血管旁出现了少量的炎性细胞浸润, 细胞胞浆内散在空泡, 肝细胞肿胀明显, 间隙增大, 肝细胞排列欠规则; 第3周(图1D), 炎细胞浸润增多, 肝窦充血扩张明显, 肝小叶中央静脉区脂肪变性增多, 胞浆染色不均, 鲜见肝细胞点状坏死; 第4周(图1E), 肝组织内炎性细胞成团聚集, 肝小叶形成以较大空泡样变为主的变化, 出现肝细胞的点状和小片状的坏死. 肝组织病理变化的进展表明肝脏损伤越来越严重, 说明酒精肝损伤模型建立成功.
在连续酒精损伤刺激下, 与对照组相比, 第1周HSP70的表达量显著上升, 并在第2周达到最高(P<0.01); 第3周该蛋白的表达量开始下降, 但仍高于对照组(P<0.05); 在第4周HSP70的量继续降低, 并明显低于对照组HSP70的蛋白表达量(P<0.05)(图2).
酒精主要是在肝脏中代谢, 饮酒达到一定量后会对肝脏造成明显的损伤, 所以实验通过持续酒精灌胃建立酒精性肝损伤模型, 并根据肝脏的病理生化变化来判断酒精性肝损伤的程度. 酒精对肝脏的损伤是由多因素引起的: 酒精及其代谢产物的直接损伤; 氧化应激及自由基损伤; 细胞因子及内毒素引导的免疫炎症反应; 局部的缺血缺氧以及胞膜结构的损伤等.具体的分子机制却不是很明确, 但损伤的核心主要是由氧化应激和自由基产生增多引起的. 因为无论是细胞色素P450 2e1(cytochrome P450 2E1, CYP2e1)产生增多、还是KUPERR激活、线粒体功能的丧失, 都使活性氧(reactive oxygen species, ROS)的生成增多, 产生脂质过氧化反应, 使肝细胞不断凋亡、坏死[3-5]. 酒精性损伤作为外来的应激源, 刺激机体产生应激反应, 通过各种分子信号的传导, 来增强机体的保护能力; 在这个过程中, HSP70的表达量也随着酒精肝损伤的加重, 呈现出一定变化规律, 说明HSP70可能与肝脏的应激保护机制密切关系.
HSP70是热休克蛋白家族中最保守、最重要的一族, 也是机体由各种损伤刺激导致的应激反应中变化最显著的、高度保守的一类蛋白质. 在本实验中, 第1、2周, HSP70的表达量逐渐上升, 是肝脏保护作用逐渐增强的表现. 这与HSP70的各种重要的生物学保护功能有关[6]: (1)分子伴侣作用, HSP70在HSF与SHE协调作用下, 增加表达, 与机体产生的变性蛋白结合, 遏制其错误的折叠, 影响蛋白翻译成熟, 通过其他细胞器将其降解, 从而减少变性蛋白对机体的损伤; (2)抗细胞凋亡的作用, HSP70与合成诱导凋亡酶激活因子-1(apoptotic protease activating factor-1, Apaf-1)结合, 来阻止Caspase9前体聚集到Apaf-1蛋白体上, 从而阻断功能性凋亡蛋白的装配, 抑制细胞凋亡; (3)抗氧化作用, HSP70通过抑制氧自由基的关键酶即NADPH氧化酶的产生以及直接释放内源性过氧化物酶, 来减少氧自由基, 增强机体抵抗应激的作用; (4)免疫调节作用, HSP70通过与核因子-κB(nuclear factor-κB, NF-κB)结合, 阻断其向核转移, 同时诱导NF-κB的抑制蛋白(IκB)合成增加, 进一步抑制NF-κB的活化, 从而减少炎症介质的释放, 对肝脏起免疫保护作用.
第3周HSP70的表达量开始下降, 组织观察肝脏的损伤程度也明显加重, 说明HSP70的保护作用下降, 导致肝脏抗损伤的能力减弱, 这可能与HSP70的生理老化现象有关. 因为HSP70本身也是一种蛋白质, 他的合成与分解、表达与变性也和其他蛋白质一样, 受到内环境变化的影响. 持续的酒精刺激使其代谢产物在肝脏中过多蓄积, 特别是氧化应激的产物ROS增多, 脂质过氧化物蓄积, 直接使肝细胞变性、凋亡、坏死, 使产生HSP70的功能性肝组织不断减少. 赵云霞等[7]在显微镜下观察到酒精性损伤的肝细胞膜以及膜结构, 如线粒体、内质网, 还有细胞核的结构发生明显改变, 这会使三羧酸循环、磷酸化、脂质代谢以及蛋白转录翻译等生理生化过程紊乱, 导致HSP70合成障碍; 再加上肝细胞水肿破裂坏死, 炎性反应增强, 以及肝窦的缺血缺氧, 进一步使HSP70的表达、翻译受阻. 这解释了第4周灌胃后肝脏HSP70表达量低于对照组, 说明HSP70的表达不足而不能抵抗酒精损伤刺激, 使肝脏损伤加重. 最新研究表明, 这也可能与脂质过氧化物的标志物在机体过度蓄积有关: 4-羟基壬烯酸(4-hydroxynonena, 4-HEN)与肝细胞中蛋白HSP70形成加合物影响蛋白的翻译和修饰, 改变HSP70结构和功能, 使其有效含量减少, 导致机体的抗氧化的作用减弱[8]. 这些过程都可以作为增强HSP70表达的靶点. 总的来说, 本实验结果证明在酒精性肝损伤中, HSP70表达量与其损伤进程密切相关: HSP70表达量增多, 对肝脏保护作用增强; HSP70表达量减少, 其保护作用减弱.
近几年来, HSP70作为机体保护因子以及敏感的刺激反应信号, 已被广泛的引入各种医学临床研究中: 在肝脏手术切除创伤研究中发现, 创伤越重, HSP70表达的量越多, 在创伤修复过程中, 其表达量又逐渐恢复, 可以使其作为评断手术创伤严重程度的指标[9]; 短暂性脑缺血中, HSP70在一定的缺血域中具有量效关系, 可作为脑缺血的敏感指标[10]; 多器官功能障碍重症中, 血清HSP70的变化值对评估病情的程度上具有重要意义: 变化值越大, 死亡率越高[11]; HSP70表达的增加不仅是炎性肠病进展中表达一个重要因子, 也可能会成为未来药物治疗的新靶点[12]. 而且有研究在肝损伤进程中通过使用谷氨酰胺、槲皮素来分别调节HSP70的表达增加和减少, 其对损伤恢复的进程分别有着促进和抑制的作用, 进一步说明可以通过药物调节体内HSP70的表达来增强应激反应, 加强对肝脏的保护作用[13-15]. 本实验结果表明, HSP70在小鼠酒精性肝损伤中同样具有重要的保护作用, 也许也可以通过机体预刺激增加HSP70或直接补充体内HSP70含量, 加强机体抗氧化作用, 减缓或控制酒精性肝脏病程的发展.
总之, 小鼠酒精性肝损伤中HSP70的表达对机体具有重要保护作用. HSP70能否作为检测肝功能、评估肝损伤程度的一种指标或能否通过增加HSP70的含量及抑制体内HSP70的减少来增加机体抗应激作用, 作为治疗酒精性肝病药物的作用靶点, 还需要进一步的实验研究证明. 本次实验为以后进一步研究HSP70与酒精性肝病的诊断或治疗提供了一定的理论基础.
随着国内生活水平的日益提高, 人们的工作生活竞争压力的增加, 酒精消耗量显著增长, 长期大量的酒精摄入所致的肝脏损伤性疾病, 包括轻症酒精性肝损伤、酒精性脂肪肝、酒精性肝炎、酒精性肝纤维化和酒精性肝硬化等病变, 也呈逐年增加的趋势. 目前仍需大量的研究来证实酒精性肝损伤的具体机制, 为临床进一步诊断治疗酒精性肝病提供理论支持.
程明亮, 教授, 博士生导师, 贵州医科大学附属医院感染科
酒精性肝病是西方国家最常见的肝病, 但近几年我国酒精消耗量也在不断增加, 因此对酒精性肝损伤机制的研究成为国内外的热点, 但其具体的分子机制不是很明确, 需要大量的研究进一步明确, 并为酒精性肝病临床诊断治疗提供有力的理论支持.
林红华等通过对不同病理分化的肠黏膜组织中热休克蛋白70(heat shock protein 70, HSP70)的过表达情况的研究, 证明了两者之间的相关性, 对病变的恶变倾向及病情、疗效、预后的评估和检测发挥十分重要的作用, 对临床治疗上起着一定的治疗指导作用.
已有大量研究表明HSP70在药物性肝损伤中具有重要的保护作用, 但在酒精性肝损伤中作用机制以及可能的实用意义的研究讨论并不多.
本实验成功建立了小鼠酒精性肝损伤模型, 对实验动物模型的建立具有指导意义; 同时实验证明了HSP70的表达对小鼠酒精性肝损伤可能具有保护作用, 为进一步研究增加HSP70在体内的含量作为保肝药物治疗的新靶点提供理论基础.
HSP70: 是热休克蛋白家族中的重要成员, 热休克蛋白参与细胞的损伤与修复, 生物细胞在如肿瘤、病毒感染、炎症等应激刺激下激活HSP基因并高度表达, 其结构高度保守, 在机体适应外部环境上起到了重要的保护作用.
本实验动态观察了酒精性肝损伤过程中HSP70表达量的变化情况, 探究讨论了HSP70表达量增加对脏器组织以及机体的保护作用, 为进一步研究以HSP70为作用靶点的保肝药物提供了理论基础. 本文语言流畅, 行文逻1/4清晰, 具有一定的学术价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 河南省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 郭鹏 电编:闫晋利
| 3. | Dey A, Cederbaum AI. Induction of cytochrome P450 2E1 [corrected] promotes liver injury in ob/ob mice. Hepatology. 2007;45:1355-1365. [PubMed] [DOI] |
| 4. | Kolios G, Valatas V, Kouroumalis E. Role of Kupffer cells in the pathogenesis of liver disease. World J Gastroenterol. 2006;12:7413-7420. [PubMed] [DOI] |
| 5. | Cichoż-Lach H, Michalak A. Oxidative stress as a crucial factor in liver diseases. World J Gastroenterol. 2014;20:8082-8091. [PubMed] [DOI] |
| 8. | Smathers RL, Galligan JJ, Stewart BJ, Petersen DR. Overview of lipid peroxidation products and hepatic protein modification in alcoholic liver disease. Chem Biol Interact. 2011;192:107-112. [PubMed] [DOI] |
| 9. | 席 兴字. 不同肝切除方式对HSP70表达的影响. 河南师范大学学报(自然科学版). 2011;39:169-174. |
| 10. | 赵 珺, 傅 震, 周 建平. 全脑缺血再灌注后HSP70的表达及其与缺血耐受关系的实验研究. 南京医科大学学报(自然科学版). 2003;23:338-340. |
| 11. | 侯 云峰, 卜 培莉. 多器官功能障碍综合征患者血清热休克蛋白70的变化及其临床意义. 山东大学学报(医学报). 2013;51:64-70. |
| 12. | Samborski P, Grzymisławski M. The Role of HSP70 Heat Shock Proteins in the Pathogenesis and Treatment of Inflammatory Bowel Diseases. Adv Clin Exp Med. 2015;24:525-530. [PubMed] [DOI] |
| 14. | Marino LV, Pathan N, Meyer R, Wright VJ, Habibi P. The effect of 2 mMol glutamine supplementation on HSP70 and TNF-α release by LPS stimulated blood from healthy children. Clin Nutr. 2015;34:1195-1201. [PubMed] [DOI] |
| 15. | Storniolo A, Raciti M, Cucina A, Bizzarri M, Di Renzo L. Quercetin affects Hsp70/IRE1α mediated protection from death induced by endoplasmic reticulum stress. Oxid Med Cell Longev. 2015;2015:645157. [PubMed] [DOI] |