修回日期: 2016-05-20
接受日期: 2016-05-31
在线出版日期: 2016-06-28
目的: 探讨蟾毒灵对人胃癌MGC803细胞生长增殖的影响, 并探索其可能的作用机制.
方法: 用蟾毒灵溶液干预胃癌MGC803细胞. 采用MTT法与台盼蓝染色实验测蟾毒灵溶液作用对胃癌MGC803细胞生长增殖影响; ELISA法检测MGC803细胞培养基中转化生长因子-β1(transforming growth factor-β1, TGF-β1)蛋白的含量; 蛋白质印迹法检测蟾毒灵干预后MGC803细胞中P-smad3、smad4、cyclin D1信号通路相关蛋白表达的变化.
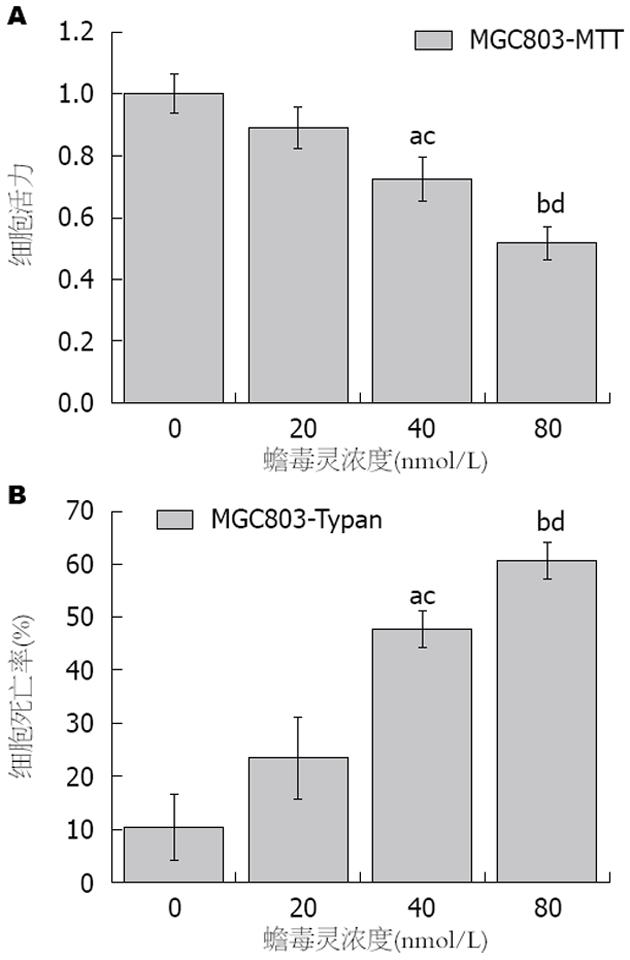
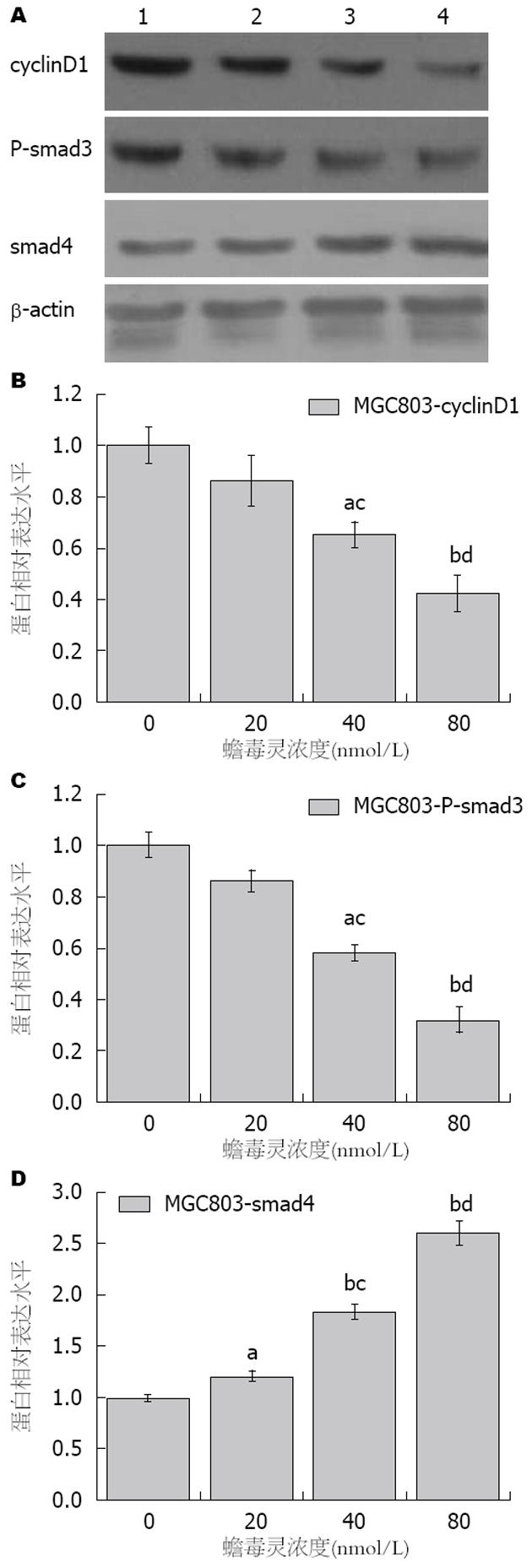
结果: MTT检测显示: 低、中、高剂量的蟾毒灵组MGC803细胞的活力均发生明显一直, 且各剂量组间细胞活力存在明显差异(F = 13.216, P = 0.002); 同时台盼蓝染色计数结果也发现: 低、中、高剂量蟾毒灵组MGC803细胞的死亡率也随药物浓度的过高而升高, 其中中、高剂量组MGC803细胞死亡率较对照组上升明显(χ2 = 9.667, P = 0.022); 同时, 与对照组相比, 低、中、高剂量蟾毒灵组MGC803细胞上清液中TGF-β1的含量明显的下降, 组间数据比较具有明显统计差异(F = 36.455, P<0.001); 蛋白质印迹检测显示, 蟾毒灵干预后, MGC803细胞中P-smad3、cyclin D1蛋白水平明显下降, 并且随着蟾毒灵的剂量的增加, 抑制作用明显增强(P<0.05); 而同时smad4蛋白的表达水平呈现明显上调, 且亦与蟾毒灵剂量存在明显的量效关系(P<0.001).
结论: 蟾毒灵可抑制胃癌MGC803细胞的增殖, 并且其作用的发挥可能与蟾毒灵对TGFβ1/smad信号通路的调控作用有关.
核心提示: 本实验从细胞实验角度, 研究蟾毒灵对胃癌MGC803细胞的作用, 发现其可明显抑制胃癌细胞MGC803的生长增殖, 且发现其作用机制可能与其通过阻滞TGFβ1/smad信号通路的信号传导, 阻滞MGC803细胞的细胞增殖周期有关.
引文著录: 王师英, 林江, 邢立凯, 陈腾. 蟾毒灵调控TGFβ1/smad信号通路对胃癌MGC803细胞增殖的影响作用. 世界华人消化杂志 2016; 24(18): 2862-2868
Revised: May 20, 2016
Accepted: May 31, 2016
Published online: June 28, 2016
AIM: To investigate whether TGFβ1/smad signaling pathways are involved in the effect of Bufalin on the proliferation of human gastric cancer MGC803 cells.
METHODS: Human gastric cancer MGC803 cells were treated with Bufalin. Cell proliferation was tested by MTT assay and Trypan blue assay. The content of TGFβ1 protein in culture medium treated with Bufalin was detected by ELISA. The expressions of cyclinD1, phosphorylated smad3 and smad4 was detected by Western blot.
RESULTS: Bufalin significantly reduced the viability of MGC803 cells in a dose-dependent manner, and there was a significant difference among different concentrations (F = 13.216, P = 0.002). The results of Trypan blue assay showed a similar trend (χ2 = 9.667, P = 0.022). Compared with the control group, the expression of TGFβ1 protein in culture medium was decreased after the cells were treated with Bufalin (F = 36.455, P < 0.001), and the expression of P-smad3 and cyclinD1 protein in MGC803 cells was also decreased after the cells were treated with Bufalin (P < 0.05). However, the content of smad4 protein in MGC803 cells was increased after the application of Bufalin (P < 0.001).
CONCLUSION: Bufalin inhibits the proliferation of MGC803 cells via mechanisms possibly associated with inhibiting TGFβ1/smad signaling transduction pathways.
- Citation: Wang SY, Lin J, Xing LK, Chen T. Bufalin inhibits proliferation of human gastric cancer MGC803 cells via TGFβ1/smad signaling pathways. Shijie Huaren Xiaohua Zazhi 2016; 24(18): 2862-2868
- URL: https://www.wjgnet.com/1009-3079/full/v24/i18/2862.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i18.2862
近年来, 随着胃癌防治意识与治疗水平的提高, 其发病率和病死率均有所下降, 但在我国, 胃癌的发病率与癌性死亡率仍高居癌症第3位[1]. 华蟾素(蟾酥提取的抗癌制剂)作为重要的临床化疗药物, 具有较好的抗胃癌作用. 但由于其成分复杂以及用量较大, 因而极易于对机体产生不良反应. 因此, 进一步分析其主要活性成分, 开发更为有效且用量较少的药物成为相关研究的重点. 其中蟾毒灵(Bufalin)是临床肿瘤化疗药华蟾素的重要活性成分, 具有抑制胃癌细胞生长增殖, 诱导细胞凋亡等多种抗肿瘤作用[2,3], 但蟾毒灵抗胃癌作用的作用机制尚不明确; 其中TGFβ1/smad信号通路作为细胞内重要的信号通路, 与组织细胞生长增殖, 分化等生理过程的调控有关[4,5]. 相关研究发现TGFβ1/smad信号通路参与组织细胞的增殖、分化、凋亡和迁移等多种生物学行为调控, 而阻断该信号转导通路可产生抑制胃癌细胞生长增殖, 诱导细胞分化等特异性抗肿瘤效应[6-8]. 本实验通过研究蟾毒灵对胃癌细胞MGC803增殖及对胃癌细胞中TGFβ1/smad信号通路的影响, 进而探讨蟾毒灵的抗肿瘤的可能作用机制.
人胃癌细胞株MGC803购自中国科学院上海生命科学研究院细胞资源中心. 胎牛血清、RMPI 1640培养液和0.25%胰蛋白酶购自美国Gibco公司; 青霉素和链霉素购自上海博光生物科技有限公司; Bufalin(货号B0261), MTT和DMSO购自美国Sigma公司; 鼠抗人P-smad3、smad4与辣根过氧化物酶(horseradish peroxidase, HRP)标记的山羊抗鼠IgG 与羊抗兔IgG购自Santa Cruz公司、兔抗人cyclin D1、β-actin单克隆抗体均购自美国cell signaling公司; HRP发光试剂盒购自Millipore公司; ELISA购自美国BD公司; 蛋白质印迹及蛋白质提取相关试剂购自碧云天生物技术研究所.
1.2.1 细胞培养: MGC803细胞用含10%小牛血清的RMPI 1640培养液, 置于37 ℃、50 mL/L CO2细胞培养箱中培养, 待细胞铺满瓶底后, 用0.25%胰蛋白酶和0.02%乙二胺四乙酸二钠的混合消化液消化, 传代培养, 取对数生长期的细胞进行相关实验.
1.2.2 实验分组: 实验处理前1 d传代细胞, 实验分为3组: (1)对照组(MGC803细胞组); (2)低剂量蟾毒灵组(20 nmol/L); (3)中剂量蟾毒灵组(40 nmol/L); (4)高剂量蟾毒灵组(80 nmol/L). 蟾毒灵处理[3]后培养24 h 后, 收集提取细胞总蛋白, 采用蛋白质印迹法检测各组细胞中P-smad3、smad4、cyclin D1蛋白的表达水平, 并用ELISA法检测MGC803培养液中TGFβ1蛋白含量.
1.2.3 蛋白质印迹法检测: 根据实验设计处理贴壁生长24 h后的各组细胞, 提取细胞总蛋白; 用10%SDS-PAGE配样. 电泳分离蛋白, 并转移至0.22 μm聚偏二氟乙烯(polyvinylidene difluoride, PVDF)膜上, 室温条件下在含5%BSA中封闭处理2 h; 分别加入兔抗人P-smad3(1∶1000)、smad4(1∶1000)、cyclin D1(1∶1000)、β-actin(1∶1000)单克隆抗体4 ℃摇床过夜, 次日加入HRP标记的山羊抗兔IgG(1∶5000), 室温下孵育1 h后, 采用HRP化学发光剂发光, 压片显影. 并测定条带灰度值与分析结果.
1.2.4 MTT法检测蟾毒灵对MGC803细胞活力的影响: 取对数生长期的MGC803细胞, 调整细胞密度为1×105个/mL, 接种于96孔培养板上(每孔200 μL), 取不含细胞的培养液作空白调零. 将96 孔板置于37 ℃、CO2体积分数为5%的培养箱中培养过夜后, 用按上述分组处理细胞, 各组均设4个复孔. 培养24 h后, 分别加入MTT(5 mg/mL)20 μL, 继续培养4 h, 吸除培养液, 再加入150 μL DMSO, 振荡10 min后, 在免疫酶标检测仪波长490 nm 处测各孔的吸光度(A)值, 并计算细胞抑制率. 抑制率(%) = [(1-实验组A值)/对照组A值]×100%. 实验重复3次.
1.2.5 ELISA法检测实验处理后MGC803细胞培养上清液中TGFβ1蛋白的含量: 将处于对数生长期的MGC803细胞(1×105个/mL)接种在6孔板内, 培养24 h后, 按实验设计实验处理MGC803细胞, 培养24 h, 采各组细胞培养基, 离心1000 r/min×5 min, 取上清液. 按ELISA试剂盒说明书操作, 检测各组上清液中TGFβ1的含量.
1.2.6 Typan蓝染色检测实验处理后MGC803细胞的状态: 取对数生长期的MGc803细胞, 调整细胞密度为1×105个/mL, 接种于96孔培养板上(每孔200 μL), 取不含细胞的培养液作空白调零. 将96孔板置于37 ℃、CO2体积分数为5%的培养箱中培养过夜后, 用按上述分组处理细胞, 各组均设4个复孔. 培养24 h后, 分别加入去除培养基, 并且用PBS轻轻清洗2次, 加入0.4%的Typan蓝染液对各组细胞进行染色, 随后在倒置显微镜下观察染色情况并记录10个视野中染色细胞数与总细胞数, 计算细胞死亡率(细胞死亡率 = 着色细胞/总细胞×100%).
统计学处理 应用SPSS18.0统计学软件对实验结果进行统计学分析. 计量资料以mean±SD表示, 数据均符合正态分布且存在方差齐性, 两组间比较采用独立样本的t检验, 多个样本均数之间的比较采用单因素方差分析, 组间两两比较采用LSD-t检验; 计数资料采用%表示, 数据采用χ2检验. P<0.05为差异有统计学意义.
在用蟾毒灵作用于MGC803细胞时, 观察发现细胞的数目减少, 摇动培养皿可见部分细胞脱落.
MTT法检测细胞活力结果显示: 低、中、高剂量的蟾毒灵组MGC803细胞的活力分别为对照组的0.892±0.067、0.725±0.071和0.518±0.053倍, 其中各剂量组之间细胞活力存在明显差异(F = 13.216, P = 0.002). 其中低剂量蟾毒灵对MGC803细胞活力的影响作用较微弱(t = 1.453, P = 0.220>0.05), 而中、高剂量蟾毒灵对MGC803细胞活力存在明显的抑制作用, 细胞活力随药物作用浓度的增加而下降, 存在明显的量效关系(t中剂量 = 3.527, P中剂量 = 0.024<0.05; t高剂量 = 7.817, P高剂量 = 0.001)(图1A); 台盼蓝染色发现: 对照组、低、中、高剂量蟾毒灵组MGC803细胞的死亡率分别为10.40%±6.24%、23.50%±7.69%、47.70%±3.58%和60.60%±3.40%, 其中低剂量蟾毒灵对MGC803细胞的抑制作用较微弱(χ2 = 2.000, P = 0.275), 而中、高剂量蟾毒灵对MGC803细胞的增殖存在明显的抑制作用, 两组细胞死亡率随药物作用浓度的增加而增加, 存在明显的量效关系, 且蟾毒灵各剂量组之间数据仍然存在明显差异(χ2 = 9.667, P = 0.022)(图1B).
ELISA检测结果显示, 蟾毒灵处理后MGC803细胞24 h 后, 对照组、低、中、高剂量蟾毒灵组MGC803细胞上清液中TGF-β1的含量分别为1332.32 pg/mL±16.45 pg/mL、1293.94 pg/mL±15.13 pg/mL、1192.10 pg/mL±8.48 pg/mL和1146.45 pg/mL±15.83 pg/mL. 其中低剂量蟾毒灵对MGC803细胞TGFβ1表达的影响较微弱(t = 1.717, P = 0.161>0.05), 而中、高剂量蟾毒灵对TGFβ1表达存在明显抑制, 且抑制作用随药物作用浓度的增加而增强, 存在明显的量效关系(t中剂量 = 7.575, P中剂量 = 0.002<0.05; t高剂量 = 8.141, P高剂量 = 0.001), 且各用药组之间数据具有明显的统计差异(F = 36.455, P<0.001).
蛋白质印迹法检测显示(图2), 低剂量蟾毒灵对MGC803细胞内cyclin D1蛋白的表达的影响作用较微弱(t = 1.149, P = 0.314>0.05), 而中、高剂量蟾毒灵对MGC803细胞内cyclin D1蛋白的表达具有明显的抑制作用, 且随药物作用浓度的增加而增强, 存在明显的量效关系, 组间差异均具有统计学意义(t中剂量 = 4.060, P中剂量 = 0.015<0.05; t高剂量 = 5.889, P高剂量 = 0.004<0.01); 并且各用药组之间比较, MGC803细胞中cyclinD1蛋白的表达水平依然存在明显的差异(F = 11.462, P = 0.003).
同时蟾毒灵处理MGC803细胞24 h后. 低剂量蟾毒灵对MGC803细胞内P-smad3蛋白的表达的影响作用较微弱(t = 2.163, P = 0.097>0.05), 而中、高剂量蟾毒灵对MGC803细胞内P-smad3蛋白的表达具有明显的抑制作用, 且随药物作用浓度的增加而增强, 存在明显的量效关系, 组间差异均具有统计学意义(t中剂量 = 7.147, P中剂量 = 0.002<0.05; t高剂量 = 9.627, P高剂量 = 0.001); 并且各用药组之间比较, MGC803细胞中P-smad3蛋白的表达水平依然存在明显的差异(F = 46.746, P = 2.04×10-5<0.001).
同时低、中、高剂量蟾毒灵均对MGC803细胞内smad4蛋白的表达具有明显的上调作用, 且随药物作用浓度的增加而增强, 存在明显的量效关系. 其中低、中、高剂量蟾毒灵组MGC803细胞中smad4蛋白的表达分别为对照组的1.21±0.05(t = 3.386, P = 0.028<0.05)、1.83±0.08(t = 10.268, P = 0.001)、2.60±0.12(t = 10.225, P =1.89×10-4<0.001)倍(图2C). 同时各用药组之间比较蛋白表达水平存在明显的差异(F = 89.052, P = 1.74×10-6<0.001).
蟾毒灵作为华蟾素的重要活性成分, 前期研究已发现其具有多种抗肿瘤效应. 在此实验中. 我们通过采用MTT法与台盼蓝染色法检测蟾毒灵对胃癌MGC803细胞增殖的影响发现存活MGC803细胞数以及细胞活力随药物作用浓度的增加而下降, 存在明显的量效关系; 此外, 试验中Western blot检测cyclin D1蛋白表达的结果显示: cyclin D1蛋白表达随药物作用浓度的增加而下降, 存在明显的量效关系; 相关研究中发现cyclin D1蛋白表达作为一种重要的细胞增殖周期因子, 在肿瘤细胞的增殖调控过程中具有重要作用[9,10], 其参与可增殖细胞周期G0/G1期的调控[11,12]. 当相关因素或药物作用于肿瘤细胞时, 肿瘤细胞中cyclinD1蛋白的表达下降, 则细胞的增殖周期将停留在G0/G1期, 从而使细胞的增殖受到抑制[13,14]. 因此可知, 蟾毒灵对胃癌MGC803的生长增殖具有抑制作用, 且可能与调节细胞增殖周期有关.
此外, 通过ELISA检测细胞培养中TGFβ1蛋白含量发现: 蟾毒灵对TGFβ1表达存在明显的抑制, 且抑制作用随药物作用浓度的增加而增强, 同样存在明显的量效关系. 又因为TGFβ1蛋白是调控TGFβ1/smad信号通路的重要因子, 其具有调控组织细胞生长增殖, 分化等生物学行为[4,5,15]. 且以往的实验已发现TGFβ1/smad信号通路在调控胃癌细胞的生长增殖方面具有重要的作用. 通过抑制TGFβ1蛋白的表达, 可以阻滞TGFβ1/smad信号通路的信号传导, 进而抑制肿瘤细胞的生长增殖[6,8]. 因此, 蟾毒灵对胃癌MGC803细胞的生长增殖的抑制作用可能与蟾毒灵阻滞胃癌MGC803细胞中TGFβ1/smad信号通路信号传导有关.
此外, 同时以往的研究发现P-smad3、samd4蛋白作为TGFβ1/smad信号通路中重要的信号分子, 对肿瘤细胞的增殖, 分化等生物学行为具有重要的调控作用[16,17]. 相应的药物或干扰因素可使P-smad3、smad4表达改变, 从而发挥其抗肿瘤作用[18,19]. 本实验通过蛋白印迹法检测MGC803细胞经蟾毒灵处理后, P-smad3、smad4蛋白在MGC803细胞中的表达发现: 蟾毒灵对MGC803细胞内P-smad3蛋白表达具有明显的抑制, 且对smad4蛋白的表达呈现明显的促进作用, 且两种蛋白的改变均与蟾毒灵存在明显的量效关系. 且相关实验研究也已证实TGFβ1/smad信号通路可调控cyclinD1的表达, 进而影响肿瘤细胞的增殖周期. 当TGFβ1/smad信号通路受到抑制时, 肿瘤细胞中cyclinD1的表达下调, 从而使细胞的增殖受到明显抑制[20]. 且在实验中, 当蟾毒灵作用于MGC803细胞后, TGFβ1/smad信号通路受到抑制的同时, cyclinD1蛋白的表达也呈现明显下调, 并且与蟾毒灵对P-smad3与smad4蛋白表达的作用具有相似的趋势. 由此可知, 蟾毒灵抗胃癌治疗作用机制可能是通过调控胃癌MGC803细胞中TGFβ1/smad信号通路信号传导, 进而下调cyclinD1蛋白的表达, 抑制MGC803细胞的细胞增殖.
总之, 本研究结果表明, 蟾毒灵作用于人胃癌MGC803细胞后, 其可明显抑制胃癌细胞MGC803的生长增殖, 且其作用机制可能与蟾毒灵阻滞TGFβ1/smad信号通路的信号传导, 进而阻滞MGC803细胞的细胞增殖周期有关. 但目前并未得蟾毒灵抑制TGFβ1/smad信号通路的作用靶点及抑制TGFβ1/smad信号通路与MGC803细胞增殖的具体作用机制有直接相关的研究结果, 还有待进一步探讨, 但通过本实验进一步明确蟾毒灵的抗胃癌作用, 且发现其作用可能与影响TGFβ1/smad信号通路与细胞增殖周期有关, 这对明确蟾毒灵抗肿瘤机制具有重要意义.
胃癌细胞的生长增殖在胃癌的发生发展中具有重要的地位, 是影响胃癌生物学行为改变的最主要原因, 因此, 发现与开发有效抑制胃癌细胞增殖的抗肿瘤药物对治疗胃癌具有重要意义.
王学美, 研究员, 北京大学第一医院中西医结合研究室; 梁国刚, 教授, 大连医科大学附属第一医院; 周彤, 教授, 主任医师, 川北医学院附属医院普通外科
转化生长因子-β1(transforming growth factor-β1, TGF-β1)/smad信号通路在调控胃癌细胞的生长增殖方面具有重要的作用, 且阻滞TGFβ1/smad信号通路的信号传导, 可以有效抑制肿瘤细胞的生长增殖. 但蟾毒灵对胃癌MGC803细胞的生长增殖的抑制作用是否与调控TGFβ1/smad信号通路信号传导有关, 尚不明确.
蟾毒灵是临床肿瘤化疗药华蟾素的重要活性成分, 其具有多种抗肿瘤作用. 且TGFβ1/smad信号通路参与组织细胞的增殖、分化、凋亡和迁移等多种生物学行为调控, 而阻断该信号转导通路可产生抑制胃癌细胞生长增殖, 诱导细胞分化等特异性抗肿瘤效应. 但蟾毒灵对胃癌细胞MGC803增殖抑制作用以及与TGFβ1/smad信号通路的关系, 尚未见文献报道.
在前期相关研究的基础上, 从体外实验角度, 探讨蟾毒灵对胃癌细胞MGC803增殖抑制作用以及与TGFβ1/smad信号通路的关系, 从一定程度上明确蟾毒灵抗胃癌细胞MGC803增殖的作用机制, 为进一步明确蟾毒灵抗胃癌机制提供一定的理论基础.
华蟾素作为重要的临床化疗药物, 具有较好的抗胃癌作用. 但由于其成分复杂且用量较大, 因而极易对机体产生不良反应. 因此, 进一步分析其主要活性成分-蟾毒灵的抗肿瘤作用以及作用机制, 对开发更为有效且用量较少的药物具有重要意义.
本文明确阐述蟾毒灵对胃癌细胞增殖的抑制作用, 实验设计合理, 科学理论依据正确, 多重实验联系紧密, 具有较强的科学价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 上海市
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 郭鹏 电编:闫晋利
| 1. | He M, Zhang Q. There still a long way to go for cancer registration in China. Ann Transl Med. 2014;2:70. [PubMed] [DOI] |
| 2. | Zhao H, Zhao D, Tan G, Liu Y, Zhuang L, Liu T. Bufalin promotes apoptosis of gastric cancer by down-regulation of miR-298 targeting bax. Int J Clin Exp Med. 2015;8:3420-3428. [PubMed] |
| 3. | Wang H, Zhang C, Xu L, Zang K, Ning Z, Jiang F, Chi H, Zhu X, Meng Z. Bufalin suppresses hepatocellular carcinoma invasion and metastasis by targeting HIF-1α via the PI3K/AKT/mTOR pathway. Oncotarget. 2016; Mar 6. [Epub ahead of print]. [PubMed] [DOI] |
| 4. | Vaidya A, Kale VP. TGF-β signaling and its role in the regulation of hematopoietic stem cells. Syst Synth Biol. 2015;9:1-10. [PubMed] [DOI] |
| 5. | Sanders YY, Cui Z, Le Saux CJ, Horowitz JC, Rangarajan S, Kurundkar A, Antony VB, Thannickal VJ. SMAD-independent down-regulation of caveolin-1 by TGF-β: effects on proliferation and survival of myofibroblasts. PLoS One. 2015;10:e0116995. [PubMed] [DOI] |
| 6. | Da C, Liu Y, Zhan Y, Liu K, Wang R. Nobiletin inhibits epithelial-mesenchymal transition of human non-small cell lung cancer cells by antagonizing the TGF-β1/Smad3 signaling pathway. Oncol Rep. 2016;35:2767-2774. [PubMed] [DOI] |
| 7. | Yamada N, Kuranaga Y, Kumazaki M, Shinohara H, Taniguchi K, Akao Y. Colorectal cancer cell-derived extracellular vesicles induce phenotypic alteration of T cells into tumor-growth supporting cells with transforming growth factor-β1-mediated suppression. Oncotarget. 2016; Jan 27. [Epub ahead of print]. [PubMed] [DOI] |
| 8. | 王 靖思, 王 逊, 刘 玉琴, 陈 兰羽, 朱 昱翎, 顾 蓓, 孙 桂芝. 桃红芪术软肝煎基于TGF-β/Smad信号通路逆转上皮-间质转化抗肝纤维化作用. 世界华人消化杂志. 2015;23:2036-2049. [DOI] |
| 9. | Mercer KE, Pulliam C, Hennings L, Lai K, Cleves M, Jones E, Drake RR, Ronis M. Soy Protein Isolate Protects Against Ethanol-Mediated Tumor Progression in Diethylnitrosamine-Treated Male Mice. Cancer Prev Res (Phila). 2016;9:466-475. [PubMed] |
| 10. | Ma Z, Ma Y, Xia Q, Li Y, Li R, Chang W, Chen J, Leng Z, Tao K. MicroRNA-155 expression inversely correlates with pathologic stage of gastric cancer and it inhibits gastric cancer cell growth by targeting cyclin D1. J Cancer Res Clin Oncol. 2016;142:1201-1212. [PubMed] [DOI] |
| 11. | Cai X, Hu X, Tan X, Cheng W, Wang Q, Chen X, Guan Y, Chen C, Jing X. Metformin Induced AMPK Activation, G0/G1 Phase Cell Cycle Arrest and the Inhibition of Growth of Esophageal Squamous Cell Carcinomas In Vitro and In Vivo. PLoS One. 2015;10:e0133349. [PubMed] [DOI] |
| 12. | Han J, Zhang F, Yu M, Zhao P, Ji W, Zhang H, Wu B, Wang Y, Niu R. RNA interference-mediated silencing of NANOG reduces cell proliferation and induces G0/G1 cell cycle arrest in breast cancer cells. Cancer Lett. 2012;321:80-88. [PubMed] [DOI] |
| 13. | Zhu J, Chen M, Chen N, Ma A, Zhu C, Zhao R, Jiang M, Zhou J, Ye L, Fu H. Glycyrrhetinic acid induces G1phase cell cycle arrest in human nonsmall cell lung cancer cells through endoplasmic reticulum stress pathway. Int J Oncol. 2015;46:981-988. [PubMed] [DOI] |
| 14. | He X, Xiang H, Zong X, Yan X, Yu Y, Liu G, Zou D, Yang H. CDK2-AP1 inhibits growth of breast cancer cells by regulating cell cycle and increasing docetaxel sensitivity in vivo and in vitro. Cancer Cell Int. 2014;14:130. [PubMed] [DOI] |
| 15. | Kim KO, Sampson ER, Maynard RD, O'Keefe RJ, Chen D, Drissi H, Rosier RN, Hilton MJ, Zuscik MJ. Ski inhibits TGF-β/phospho-Smad3 signaling and accelerates hypertrophic differentiation in chondrocytes. J Cell Biochem. 2012;113:2156-2166. [PubMed] [DOI] |
| 16. | Yang H, Wang L, Zhao J, Chen Y, Lei Z, Liu X, Xia W, Guo L, Zhang HT. TGF-β-activated SMAD3/4 complex transcriptionally upregulates N-cadherin expression in non-small cell lung cancer. Lung Cancer. 2015;87:249-257. [PubMed] [DOI] |
| 17. | Fang J, Xu H, Yang C, Morsalin S, Kayarthodi S, Rungsrisuriyachai K, Gunnal U, Mckenzie B, Rao VN, Reddy ES. Ets Related Gene and Smad3 Proteins Collaborate to Activate Transforming Growth Factor-Beta Mediated Signaling Pathway in ETS Related Gene-Positive Prostate Cancer Cells. J Pharm Sci Pharmacol. 2014;1:175-181. [PubMed] |
| 18. | Thacker PC, Karunagaran D. Curcumin and emodin down-regulate TGF-β signaling pathway in human cervical cancer cells. PLoS One. 2015;10:e0120045. [PubMed] [DOI] |
| 19. | Nailing T, Zhi G, Xueling Y. Cryoablation induced the change of TGF-β pathway in CWR-22RV prostate cancer cell line. Cryobiology. 2015;71:130-134. [PubMed] [DOI] |
| 20. | Chen L, Zhang W, Liang HF, Zhou QF, Ding ZY, Yang HQ, Liu WB, Wu YH, Man Q, Zhang BX. Activin A induces growth arrest through a SMAD- dependent pathway in hepatic progenitor cells. Cell Commun Signal. 2014;12:18. [PubMed] [DOI] |