修回日期: 2016-05-19
接受日期: 2016-05-31
在线出版日期: 2016-06-28
目的: 研究生长抑素受体(somatostafin receptor, SSTR)亚型SSTR2在结直肠神经内分泌肿瘤组织中的表达情况, 以及与临床病理特征的关系.
方法: 收集结直肠神经内分泌瘤患者组织标本及相关临床病理资料, 应用免疫组织化学EnVision二步法检测肿瘤组织中SSTR2表达情况.
结果: 56例患者纳入研究, 其中SSTR2阳性表达率为76.8%. SSTR2的阳性表达与淋巴结转移、肿瘤浸润肌层、出现远处转移关系密切(P<0.05), 但是与性别和年龄无关(P>0.05). 此外, 肿瘤的最大径及组织学分级也与SSTR2阳性表达有关(P<0.05).
结论: SSTR2异常表达与重要的临床病理学特征相关, SSTR2可能成为一个新的结直肠神经内分泌瘤诊断和预后的分子指标.
核心提示: 神经内分泌肿瘤发病逐年增加, 特别是神经内分泌癌预后差, 目前无特效药, 生长抑素类似物是重要一类药物, 而检测受体的是否存在有重要意义, 生长抑素受体2可能成为一个新的结直肠神经内分泌瘤诊断和预后的分子指标.
引文著录: 刘中元, 张冲, 张黎. 生长抑素受体2在结直肠神经内分泌肿瘤中的表达及意义. 世界华人消化杂志 2016; 24(18): 2817-2822
Revised: May 19, 2016
Accepted: May 31, 2016
Published online: June 28, 2016
AIM: To detect the expression of somatostafin receptor subtype 2 (SSTR2) in human colorectal neuroendocrine neoplasms and analyze its clinicopathological significance.
METHODS: Clinical samples and clinicopathological information of patients with colorectal neuroendocrine neoplasms were collected. The expression of SSTR2 in tumor tissues was examined by immunohistochemical EnVision method.
RESULTS: A total of 56 patients were enrolled in this study. The rate of positive expression of SSTR2 in colorectal neuroendocrine neoplasms was 76.8%. Positive expression of SSTR2 in tumor tissues was associated with lymph node metastasis, muscularis invasion and distant metastasis (P < 0.05), but not with sex or age (P > 0.05). In addition, a significant correlation was found between SSTR2 expression and tumor diameter and histological grade (P < 0.05).
CONCLUSION: Abnormal expression of SSTR2 correlates closely with some important clinicopathological characteristics of colorectal neuroendocrine neoplasms. SSTR2 may be used as a new biomarker for the diagnosis and prognosis evaluation of colorectal neuroendocrine neoplasms.
- Citation: Liu ZY, Zhang C, Zhang L. Expression of somatostatin receptor subtype 2 in colorectal neuroendocrine neoplasms. Shijie Huaren Xiaohua Zazhi 2016; 24(18): 2817-2822
- URL: https://www.wjgnet.com/1009-3079/full/v24/i18/2817.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i18.2817
神经内分泌肿瘤(neuroendoerine neoplasm, NEN)是一组起源于肽能神经元和神经内分泌细胞的肿瘤, 可发生于全身多个部位. 消化系尤其是结直肠是NEN的好发部位之一, 其发病率近年呈明显上升趋势, 结直肠NET的发病率增长超过10倍, 他有别于一般结直肠肿瘤. 虽然人们加强了重视, 加大了研究力度, 治疗上也取得了一些进展, 但是到目前为止还未形成统一的治疗规范, 其中生长抑素类似物(somatostatin analogs, SSTA)可有效地抑制肿瘤进展, 缓解类癌综合征的症状. 长效SSTA还具有抑制肿瘤增殖, 直接抗肿瘤的作用. 在应用SSTA之前需行生长抑素受体(somatostafin receptor, SSTR)检测以确定对SSTA治疗的敏感性. SSTR有5种亚型(SSTR1-5), 最为重要的是SSTR2, 可以通过免疫组织化学及RT-PCR法进行检测. 现有资料表明, SSTR2的检测不仅有助于胃肠胰NEN(gastmentem-pancreatic neumendocrine neoplasms, GEP-NENs)的诊断与治疗, 而且还有助于预测SSTA治疗患者的临床转归. 本实验应用免疫组织化学方法检测SSTR2在结直肠NEN组织中的表达情况, 评价结直肠NEN组织表达SSTR2的差异, 并探讨其表达与结直肠NEN发生、发展的关系, 以期为SSTA应用于结直肠NEN的治疗提供依据[1-5].
收集山东省立医院和济宁市第一人民医院胃肠外科和消化内科2005-01/2015-12收治结直肠NEN 56例, 术前均行肠镜检查并取活检证实. 治疗原则: 对于直径<1 cm的肿瘤, 超声内镜证实未浸润固有肌层, 无淋巴结转移证据者, 选择内镜下局部切除; 直径1-2 cm者, 超声内镜证实未浸润固有肌层, 无淋巴结转移证据者, 行局部切除或局部扩大切除; 而对于直径>2 cm或虽不足2 cm但超声内镜证实侵及肌层者, 则依照腺癌的要求行根治术. 对于已有转移的病例行根治术, 如无法根治也应争取作减瘤手术. 所有患者术前均未接受过放化疗、生物治疗、核素治疗和分子靶向治疗. 其中男32例, 女24例, 男女比例为1.3∶1. 年龄22-78岁, 年龄<60岁者45例, ≥60岁11例, 平均52.4岁. 其中直肠35例, 盲肠和升结肠10例, 乙状结肠8例, 降结肠3例. 按照2010年世界卫生组织(World Health Organization, WHO)胃肠胰NEN分级标准[6], 组织学1级34例, 2级10例, 3级12例. 所使用试剂鼠抗人的SSTR2购自丹麦DAKO公司.
1.2.1 标本收集: 所收集标本置40 g/L中性甲醛固定48 h用于免疫组织化学染色.
1.2.2 免疫组织化学检测: 采用EnVision二步法, 固定标本先按常规制成石蜡块, 染色时切成厚度为4 μm的连续切片, 常规脱蜡至脱水. 用3%H2O2阻断内源性过氧化物酶, 孵育5 min. PBS冲洗, 5 min×3次. 加一抗, 室温孵育30 min, PBS冲洗, 5 min×3次. 滴加试剂A(ChemMateTM EnVision+/HRP), 室温孵育30 min, PBS冲洗, 5 min×3次. 二氨基联苯胺(diamionben zidene, DAB)显色, 常规脱水、透明、中性树胶封片.
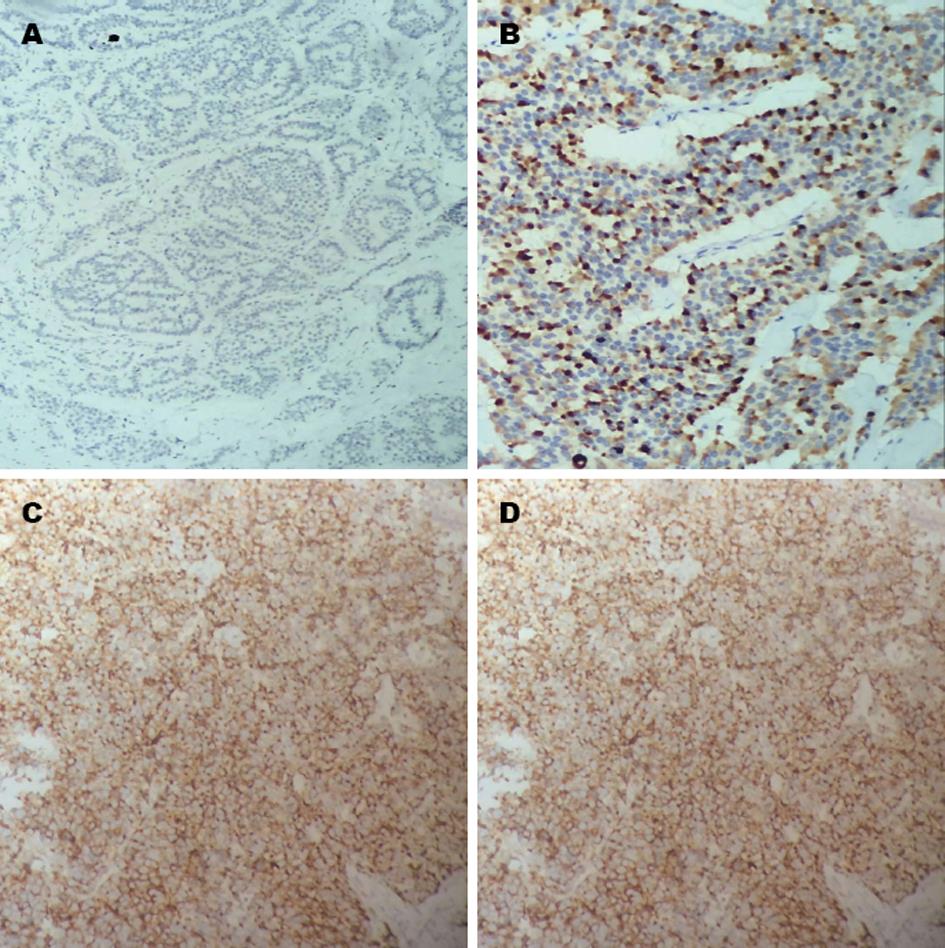
1.2.3 结果判定: 结果按如下方法分级[7]: A: 根据免疫阳性细胞染色的程度: 无染色为0分, 胞质内见淡黄色颗粒, 明显高于背景为1分, 较多棕黄色颗粒为2分, 大量深棕黄色颗粒为3分; B: 每片随机观察5个视野(×400), 计数染色阳性细胞数, 阳性细胞数<30%为1分, 30%-75%为2分, 75%为3分. A×B得0分者为-, 1-2分为+, 3-4分为++, 4分以上为+++. <1分判断为表达阴性, 其余判断表达为阳性.
统计学处理 数据分析使用SPSS16.0统计软件, 计数资料以率表示, 组间比较采用χ2检验, P<0.05为差异有统计学意义.
由表1和图1可知, 结直肠神经内分泌肿瘤组织中SSTR2总表达率为76.8%(43/56). 女性表达率高于男性, 但两者无统计学差异. <60岁患者与≥60岁患者的表达率无统计学差异. SSTR2在浸润肌层的患者表达率显著低于未浸润肌层患者. SSTR2在淋巴结转移的患者表达率明显低于无淋巴结转移患者, 远处转移患者表达率显著低于无远处转移患者. 随着肿瘤直径的增大, 患者SSTR2表达率逐渐下降, SSTR2的表达随肿瘤的临床分级进展呈降低趋势, G1、G2、 G3三者有统计学差异. 直肠NEN的表达率显著高于结肠NEN表达率. SSTR2的阳性表达与淋巴结转移、肿瘤浸润肌层、出现远处转移、肿瘤的最大径及组织学分级关系密切, 但是与性别和年龄无关.
| 临床病理特征 | n | SSTR2蛋白 | |
| 阳性 | P值 | ||
| 性别 | >0.05 | ||
| 男 | 34 | 25(73.5) | |
| 女 | 22 | 18(81.8) | |
| 年龄(岁) | >0.05 | ||
| <60 | 34 | 26(76.5) | |
| ≥60 | 22 | 17(77.3) | |
| 肌层浸润 | <0.05 | ||
| 无 | 42 | 38(90.5) | |
| 有 | 14 | 5(35.7) | |
| 淋巴结转移 | <0.05 | ||
| 无 | 41 | 35(70.7) | |
| 有 | 15 | 8(53.3) | |
| 远处转移 | <0.05 | ||
| 无 | 49 | 42(85.7) | |
| 有 | 7 | 1(14.3) | |
| 肿瘤最大径(cm) | <0.05 | ||
| <1 | 36 | 35(97.2) | |
| 1-2 | 8 | 4(50.0) | |
| >2 | 12 | 4(33.3) | |
| 肿瘤分级 | <0.05 | ||
| G1 | 34 | 32(94.1) | |
| G2 | 10 | 6(60.0) | |
| G3 | 12 | 5(41.7) | |
| 肿瘤部位 | <0.05 | ||
| 直肠 | 35 | 29(82.3) | |
| 结肠 | 21 | 14(66.7) | |
NEN是一组可分泌神经内分泌物质、相对罕见的肿瘤, 起源于肽能神经元和神经内分泌细胞的异质性肿瘤, 以往称为类癌[8,9], 可发生于全身许多组织和器官, 其中胃肠道NEN最常见, 每年的发病率是(2.5-5.0)/10万例, 占所有NEN的55%-70%, 而直肠又占胃肠道NEN的第3位, 约为14%[10-12], 目前, 我国直肠NEN在胃肠道神经内分泌瘤中占据第1位, 且近年来其发病率有升高趋势[13]. 且治疗效果不甚理想[14], 胃肠道NEN, 男性多于女性, 比例为1.8∶1; 5年生存率75.4%[15]. 结直肠NET中直肠更为多见占54%, 其次为盲肠20%、乙状结肠7.5%、直乙交界5.5%和升结肠5%[10]. 40-60岁为发病高峰, 肠道NEN女性好发于35-44岁, 男性好发于45-54岁[16]. 本组患者男性稍多于女性, 比例为1.3∶1, 中位年龄52.4岁, 直肠占62%, 盲肠和升结肠占19%, 乙状结肠占14%, 降结肠占5%. 直肠类癌常发现于结肠镜检查时, 肿瘤体积常常较小, 无功能且无局部及远处转移[17].
手术切除是唯一能治愈结直肠NEN的手段, 手术方式选择取决于肿瘤的生物学行为, 肿瘤的大小是与肿瘤生物学行为关系最密切同时也最易测量的指标, 直径<1 cm的肿瘤很少发生转移(<3%); 1-2 cm的肿瘤发生转移的机率为10%-15%; >2 cm的肿瘤发生转移的机率可达60%-80%[18]. 有研究表明, 结直肠NEN位于直肠中下段占绝大多数, 距肛缘4-8 cm的直肠前壁和侧壁占90%以上, 一般无类癌综合征表现. 高巍等[19]报道, 114例肠道内分泌肿瘤中仅有1例患者出现类癌综合征. 本组患者距肛缘4-8 cm患者为77.1%(27/35), 未见患者有类癌综合征表现. 本组患者组织学分级1级患者为34例, 占60.0%, 绝大多数患者为行结肠镜检查时发现, 由内镜大夫给予局部切除. 组织学2级患者10例, 直肠5例、盲肠和升结肠2例、乙状结肠2例、降结肠1例. 单纯内镜下切除4例, 其中1例内镜下切透肠壁, 及时发现后行腹腔镜下修补术, 1例患者内镜切除后, 切缘有肿瘤残余, 后行腹腔镜下局部扩大切除, 其余5例行腹腔镜结肠镜双镜联合局部扩大切除, 这其中2例患者冰冷病理证实肿瘤有肌层浸润, 行根治性术. 发现3级患者12例, 直肠4例、盲肠和升结肠4例、乙状结肠2例、降结肠2例, 7例发生远处转移, 7例转移患者中直肠2例、盲肠和升结肠3例、降结肠2例, 给予行减瘤手术, 其余5例均行根治性手术. 内镜超声检测肿瘤浸润深度的准确率为75%, 本组患者依据术后病理, 超声内镜符合率为80%. 肌层浸润是恶性的重要指标, 肿瘤>2 cm又有肌层浸润时, 转移率高达90%. 本组患者有肌层浸润患者14例, 转移率50%. 本组结直肠NEN的区域淋巴结转移率为26.8%(15/56), 低于国外报道的46.0%-53.3%的水平. 结直肠NEN的区域淋巴结转移并不少见. 伴有淋巴结转移提示肿瘤恶性度增高, 预后不良. 本组结肠的NEN淋巴结转移率高于直肠肿瘤, 但差异并无统计学意义, 与国外文献报道基本一致. 我们同时发现结直肠NEN的淋巴结转移主要局限于肠旁和肠系膜淋巴结, 而中央组淋巴结转移较少. 结直肠NEN的预后相关因素为组织学分级、肿瘤最大径、浸润深度、淋巴结转移情况、远处转移情况. 因该组患者随访记录不全, 无法进行相关因素预后评估.
SST或SSTA通过与SSTR结合来发挥抗肿瘤作用, 包括直接抗增殖作用、间接抗增殖作用、促进肿瘤细胞凋亡作用、抑制肿瘤血管形成的作用、免疫调节作用. 研究表明肿瘤细胞Ki-67指数越低, 与SSTR亲和力越强[20-22]. 80%-90%的神经内分泌胃肠道肿瘤表达SSTR, 多数SSA与SSTR2和SSTR5联系密切[23-25]. 虽然SSTR5发现研究更早, 但目前研究更多为SSTR2[26,27]. 本研究把SSTR2作为检测指标. SSTA是目前GEP-NENs唯一成熟的激素治疗方法. SSTR2检测不但有助于NEN的诊断, 而且还有助于确定患者是否可以用SSTA(如奥曲肽)治疗.
我们选取SSTR2作为研究对象, 本实验结果表明结直肠NEN组织中SSTR2表达阳性率较高, 表达率为76.8%, 其表达率与性别及年龄无关. 有研究[28]表明, 肿瘤细胞SSTR表达与其分化程度有关, 高分化肿瘤细胞通常有SSTR高表达, 而低分化肿瘤细胞SSTR低表达. 本实验患者数据同样提示, 随着结直肠NEN组织分级级别越低、肿瘤最大径的增大、出现肌层浸润、淋巴结出现转移、出现远处转移, 肿瘤恶性程度的增加, SSTR2蛋白低表达越明显, 理论上讲, SSTA(如奥曲肽)治疗效果应该越差. 相反, SSTR2低表达的患者更可能出现组织分级级别低、肿瘤较大、浸润肌层、淋巴结转移及远处转移, SSTR2测可能可以作为结直肠NEN判断的预后指标之一.
因此, 了解结直肠NEN组织中SSTR2的表达, 有助于指导SSTA用于结直肠NEN治疗, 可在SSTR2表达阳性的结直肠NEN患者中应用SSTA, 特别是可为有转移灶和不能手术患者提供治疗方法[29], 就可使得SSTA治疗效应达到最大化. 至于结直肠NEN组织中SSTR2的表达是否可作为评价预后的指标, 尚有待进一步研究.
神经内分泌肿瘤(neuroendoerine neoplasm, NEN)其发病率近年呈明显上升趋势, 生长抑素类似物(somatostatin analogs, SSTA)可有效地抑制肿瘤进展, 缓解类癌综合征的症状, 生长抑素受体(somatostafin receptor, SSTR)的检测不仅有助于胃肠胰NEN的诊断与治疗, 而且还有助于预测SSTA治疗患者的临床转归.
孙光, 副主任医师, 海南省海口市人民医院胃肠外科; 黄培, 副主任医师, 江苏省无锡市第二人民医院中医科; 刘鹏飞, 主任医师, 东南大学医学院附属江阴医院消化内科
SSTA是重要一类药物, 临床上应用SSTA是否有效无法评价, 检测其受体是重要方法.
相关报道有SSTR2在结直肠癌、肝癌及血管瘤、炎性肠病表达, 无针对结直肠NEN相关报道.
研究发现NEN, 特别是神经内分泌癌恶性程度越高, SSTR2表达率越低, 理论上讲应用SSTA有效率越低.
内分泌肿瘤恶性程度越高, SSTR2表达率越低, 分期越晚, 理论上讲应用SSTA有效率越低.
神经内分泌肿瘤(NEN): 一组起源于肽能神经元和神经内分泌细胞的异质性肿瘤, 以往称为类癌, NEN是一类可分泌神经内分泌物质、相对罕见的肿瘤.
作者运用免疫组织化学测定SSTR2水平, 分析其与临床病理关系, 研究具有一定临床价值.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 山东省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 郭鹏 电编:闫晋利
| 1. | Slaby O, Sachlova M, Bednarikova M, Fabian P, Svoboda M, Vytopilova S, Valik D, Vyzula R. Gene expression of somatostatin receptor 4 predicts clinical outcome of patients with metastatic neuroendocrine tumors treated with somatostatin analogs. Cancer Biother Radiopharm. 2010;25:237-243. [PubMed] |
| 2. | Sclafani F, Carnaghi C, Di Tommaso L, Rodari M, Destro A, Rimassa L, Giordano L, Chiti A, Roncalli M, Santoro A. Detection of somatostatin receptor subtypes 2 and 5 by somatostatin receptor scintigraphy and immunohistochemistry: clinical implications in the diagnostic and therapeutic management of gastroenteropancreatic neuroendocrine tumors. Tumori. 2011;97:620-628. [PubMed] [DOI] |
| 3. | Fazio N, Cinieri S, Lorizzo K, Squadroni M, Orlando L, Spada F, Maiello E, Bodei L, Paganelli G, Delle Fave G. Biological targeted therapies in patients with advanced enteropancreatic neuroendocrine carcinomas. Cancer Treat Rev. 2010;36 Suppl 3:S87-S94. [PubMed] |
| 4. | Kim HS, Lee HS, Kim WH. Clinical significance of protein expression of cyclooxygenase-2 and somatostatin receptors in gastroenteropancreatic neuroendocrine tumors. Cancer Res Treat. 2011;43:181-188. [PubMed] |
| 5. | Mizutani G, Nakanishi Y, Watanabe N, Honma T, Obana Y, Seki T, Ohni S, Nemoto N. Expression of Somatostatin Receptor (SSTR) Subtypes (SSTR-1, 2A, 3, 4 and 5) in Neuroendocrine Tumors Using Real-time RT-PCR Method and Immunohistochemistry. Acta Histochem Cytochem. 2012;45:167-176. [PubMed] [DOI] |
| 6. | Bosman FT, Carneiro F, Hruban RH, Theise ND. WHO classification of tumours of the digestive system. Lyon: IARC Press 2010; 217-224. |
| 7. | Fromowitz FB, Viola MV, Chao S, Oravez S, Mishriki Y, Finkel G, Grimson R, Lundy J. ras p21 expression in the progression of breast cancer. Hum Pathol. 1987;18:1268-1275. [PubMed] |
| 8. | Williams ED, Sandler M. The classification of carcinoid tum ours. Lancet. 1963;1:238-239. [PubMed] |
| 9. | Massironi S, Sciola V, Peracchi M, Ciafardini C, Spampatti MP, Conte D. Neuroendocrine tumors of the gastro-entero-pancreatic system. World J Gastroenterol. 2008;14:5377-5384. [PubMed] |
| 10. | Modlin IM, Kidd M, Latich I, Zikusoka MN, Shapiro MD. Current status of gastrointestinal carcinoids. Gastroenterology. 2005;128:1717-1751. [PubMed] |
| 13. | 孟 曼, 令狐 恩强, 赵 坡卢, 卢 忠生, 王 志强, 王 永华, 黄 启阳. 不同病理分级的直肠神经内分泌肿瘤的临床特征与预后分析. 中华消化外科杂志. 2014;13:789-792. |
| 15. | Garcia-Carbonero R, Capdevila J, Crespo-Herrero G, Díaz-Pérez JA, Martínez Del Prado MP, Alonso Orduña V, Sevilla-García I, Villabona-Artero C, Beguiristain-Gómez A, Llanos-Muñoz M. Incidence, patterns of care and prognostic factors for outcome of gastroenteropancreatic neuroendocrine tumors (GEP-NETs): results from the National Cancer Registry of Spain (RGETNE). Ann Oncol. 2010;21:1794-1803. [PubMed] [DOI] |
| 17. | Scherübl H. Consensus guidelines for the management of patients with digestive neuroendocrine tumours: well-differentiated colon and rectum tumour/carcinoma. Neuroendocrinology. 2008;88:157-158; author reply 158-159. [PubMed] [DOI] |
| 18. | Caplin M, Sundin A, Nillson O, Baum RP, Klose KJ, Kelestimur F, Plöckinger U, Papotti M, Salazar R, Pascher A. ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms: colorectal neuroendocrine neoplasms. Neuroendocrinology. 2012;95:88-97. [PubMed] |
| 20. | Fusco A, Zatelli MC, Bianchi A, Cimino V, Tilaro L, Veltri F, Angelini F, Lauriola L, Vellone V, Doglietto F. Prognostic significance of the Ki-67 labeling index in growth hormone-secreting pituitary adenomas. J Clin Endocrinol Metab. 2008;93:2746-2750. [PubMed] [DOI] |
| 21. | Kasuki L, Wildemberg LE, Neto LV, Marcondes J, Takiya CM, Gadelha MR. Ki-67 is a predictor of acromegaly control with octreotide LAR independent of SSTR2 status and relates to cytokeratin pattern. Eur J Endocrinol. 2013;169:217-223. [PubMed] [DOI] |
| 22. | Strosberg J, Nasir A, Coppola D, Wick M, Kvols L. Correlation between grade and prognosis in metastatic gastroenteropancreatic neuroendocrine tumors. Hum Pathol. 2009;40:1262-1268. [PubMed] [DOI] |
| 23. | Hope N, Butt G, Ross I, Warhurst G, Arn M, Grigor M, Lubcke R, Barbezat GO. Somatostatin enhances cAMP-dependent short-circuit current in human colon via somatostatin receptor subtype-2. Dig Dis Sci. 2001;46:2499-2503. [PubMed] |
| 24. | Saveanu A, Gunz G, Dufour H, Caron P, Fina F, Ouafik L, Culler MD, Moreau JP, Enjalbert A, Jaquet P. Bim-23244, a somatostatin receptor subtype 2- and 5-selective analog with enhanced efficacy in suppressing growth hormone (GH) from octreotide-resistant human GH-secreting adenomas. J Clin Endocrinol Metab. 2001;86:140-145. [PubMed] |
| 25. | Shimon I. Somatostatin receptors in pituitary and development of somatostatin receptor subtype-selective analogs. Endocrine. 2003;20:265-269. [PubMed] |
| 26. | Gatto F, Feelders RA, van der Pas R, Kros JM, Waaijers M, Sprij-Mooij D, Neggers SJ, van der Lelij AJ, Minuto F, Lamberts SW. Immunoreactivity score using an anti-sst2A receptor monoclonal antibody strongly predicts the biochemical response to adjuvant treatment with somatostatin analogs in acromegaly. J Clin Endocrinol Metab. 2013;98:E66-E71. [PubMed] [DOI] |
| 27. | Wildemberg LE, Neto LV, Costa DF, Nasciuti LE, Takiya CM, Alves LM, Rebora A, Minuto F, Ferone D, Gadelha MR. Low somatostatin receptor subtype 2, but not dopamine receptor subtype 2 expression predicts the lack of biochemical response of somatotropinomas to treatment with somatostatin analogs. J Endocrinol Invest. 2013;36:38-43. [PubMed] |
| 29. | Van Essen M, Krenning EP, De Jong M, Valkema R, Kwekkeboom DJ. Peptide Receptor Radionuclide Therapy with radiolabelled somatostatin analogues in patients with somatostatin receptor positive tumours. Acta Oncol. 2007;46:723-734. [PubMed] |