修回日期: 2016-03-23
接受日期: 2016-03-29
在线出版日期: 2016-06-28
幽门螺杆菌(Helicobacter pylori, H. pylori)是胃癌的关键性诱因, 而胃癌干细胞的形成在胃癌的发生发展中发挥重要作用, 因此两者必然关系密切. 本文分别概述了H. pylori感染和胃癌干细胞与胃癌的关系, 并进一步阐明H. pylori感染一方面通过上皮-间质转化产生胃癌干细胞, 另一方面通过影响Wnt/β-catenin、Hh/SHH、Notch、FGF/BMP等肿瘤干细胞信号通路来参与胃癌干细胞的形成和进展. 在此基础上, 我们提出H. pylori感染与胃癌干细胞研究领域内面临的挑战以及将来可能的进展方向.
核心提示: 幽门螺杆菌(Helicobacter pylori)感染通过上皮-间质转化产生胃癌干细胞, 并且通过影响Wnt/β-catenin、Hh/SHH、Notch、FGF/BMP等信号通路来参与胃癌干细胞的形成和进展. 研究二者之间的关系有望为胃癌发生机制的研究指明新的方向.
引文著录: 周林, 张伟. 幽门螺杆菌感染在胃癌干细胞形成中的作用. 世界华人消化杂志 2016; 24(18): 2767-2777
Revised: March 23, 2016
Accepted: March 29, 2016
Published online: June 28, 2016
Helicobacter pylori (H. pylori) is a key cause of gastric cancer, and gastric cancer stem cells play an important role in the development of gastric cancer. Therefore in this paper, we try to explore the relationship between H. pylori infection and stem cells in gastric cancer. H. pylori infection promotes the generation of gastric cancer stem cells through the epithelial-mesenchymal transition (EMT). In addition, H. pylori participates in the processes of the formation and progression of gastric cancer stem cells by affecting related signal pathways, such as Wnt/β-catenin, Hh/SHH, Notch, FGF/BMP. On this basis, we disscuss the challenges and future directions in the research of H. pylori infection and gastric cancer stem cells.
- Citation: Zhou L, Zhang W. Role of Helicobacter pylori infection in generation of gastric cancer stem cells. Shijie Huaren Xiaohua Zazhi 2016; 24(18): 2767-2777
- URL: https://www.wjgnet.com/1009-3079/full/v24/i18/2767.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i18.2767
目前学术界已普遍认定感染, 尤其慢性感染, 是肿瘤发生发展的关键性驱动因素. 国际癌症研究协会已经确定了11种生物感染作为强致癌因子, 包括EB病毒、乙型肝炎病毒、丙型肝炎病毒、卡波西氏肉瘤病毒、16型和18型人乳头状瘤病毒、艾滋病毒、人类T淋巴细胞病毒、幽门螺杆菌(Helicobacter pylori, H. pylori)、华支睾吸虫、单纯疱疹病毒2型、和Merkel细胞多瘤病毒[1]. H. pylori是一种螺旋形的革兰氏阴性菌, 主要定植在人的胃部, 是慢性胃炎、消化性溃疡和胃癌的主要诱因. 流行病学研究发现, 全世界一半以上人群都有H. pylori感染, 其中大多数感染者没有任何临床表现, 但是约1%感染者最终会发展成胃癌[2,3]. 目前已有基础和临床研究表明H. pylori感染可导致胃癌形成, 但是他如何诱发胃癌的分子机制仍知之甚少[4].
近年的研究认为, 胃癌组织中有一小部分(0.01%-1.00%)与干细胞相似具有自我更新、无限增殖和多向分化等潜能的特殊肿瘤细胞, 即肿瘤干细胞(cancer stem cells, CSC), 其在一定条件下可促进癌细胞生长, 导致术后复发和转移. 胃癌干细胞(gastric cancer stem cells, GCSC)的形成是胃癌发生和进展的关键步骤[5], 因此, H. pylori在GCSC形成中发挥的作用成为研究H. pylori诱发胃癌发生机制的重要突破口. 本文将重点阐述H. pylori导致GCSC形成的研究进展, 并讨论未来研究面临的挑战和机遇.
H. pylori呈螺旋形, 具有鞭毛结构, 其分泌的黏附素和尿素酶等毒力因子可以克服各种不利定居因素长期寄生在胃黏膜表面. H. pylori主要有四种毒力因子: 细胞毒素相关基因A蛋白(cytotoxin-associated antigen A, CagA)、cag致病岛(cag-pathogenicity island, cagPAI)、细胞空泡毒素(vacuolating cytotoxin, VacA)和外膜蛋白(outer membrane proteins, OMPs). cagPAI是H. pylori基因组中一个40000碱基的区域, 编码大约30个基因, 包括Ⅳ型分泌系统(type four secretion system, TFSS), 负责运送CagA蛋白和肽聚糖进入宿主细胞, 对发病必不可少[6,7]. H. pylori CagA蛋白是由cagPAI中的cagA基因编码, 分子量在120-145 kDa左右, 诱导宿主多种细胞信号通路改变[8]. VacA是一个分子量为88 kDa的菌体蛋白毒素, 他可以通过蛋白水解形成P33和P55两种亚基, 造成宿主细胞空泡化和凋亡, 并抑制细胞增殖[9]. OMPs包括Hop(H. pylori外膜蛋白)和Hor(Hop相关蛋白)两组共33个蛋白, 其功能主要是增强胃黏膜炎症和使细菌黏附于上皮细胞[10]. 研究[3,11]表明感染cagPAI和cagA阳性的H. pylori菌株的人群胃癌发生率显著增加.
H. pylori感染是胃癌的强致癌因素, 其基本机制包括胃黏膜慢性炎症刺激、肿瘤抑癌基因的遗传学和表观遗传学改变、致癌信号通路的激活和GCSC的形成. 最近数十年慢性炎症被认为是肿瘤的标志之一[12,13], 免疫细胞的异常激活和炎性细胞因子过度产生促进胃癌的发生发展[14-17]. H. pylori可以直接导致DNA双链断裂[18], 并且能通过刺激活性氧(reactive oxygen species, ROS)和活性氮(reactive nitrogen species, RNS)的产生或通过增加胞苷脱氨酶的活性间接导致DNA损伤[19-21]. 甲基化以及肿瘤抑癌基因的相继下调是H. pylori相关胃癌重要的表观遗传学调控机制[22]. H. pylori可引起胃上皮细胞上皮-间质转化(epithelial-mesenchymal transition, EMT), 并产生潜在的CSC[23,24]. H. pylori感染还刺激了一些致癌信号通路, 如表皮生长因子受体(epidermal growth factor receptor, EGFR)的活化可以抵抗H. pylori诱发的胃上皮细胞凋亡[25,26].
肿瘤干细胞理论认为胃癌的发生与干细胞的突变有关, 这些干细胞从胚胎发育开始保持在一个未分化的状态, 或是起源于成熟细胞的去分化, 成熟细胞的去分化可以使细胞回到具有增生和更新潜能的胚胎细胞类型. GCSC是胃癌发生、发展、浸润、转移及复发的重要因素, 对其进行研究, 寻找和鉴定特异性的GCSC分子标志物, 并且明确其分子调控机制, 为研究胃癌的发生和发展机制开辟了新途径.
GCSC的起源目前尚不清楚, 普遍认为可能来源于胃干细胞(gastric stem cells, GSC)或骨髓干细胞(bone marrow stem cells, BMSC).
GSC定位于腺体峡部区域, 各种前体细胞由此向上或向下双向迁移分化, 最终形成成熟的有功能的胃黏膜细胞. 由于胃肠道上皮细胞更新速度较快, 几天之内就会脱落, 所以上皮细胞的突变一般不足以形成恶变, 而干细胞寿命较长, 更容易累积突变, 正因为如此, 人们普遍认为是由于干细胞突变导致恶性肿瘤发生[27]. 众多研究[28-30]证实GSC发生突变时可导致胃癌形成, 进一步支持了胃癌起源于GSC的观点.
Houghton等[31]提出了GCSC起源的另一种可能即BMSC. 研究[32,33]表明, BMSC是最有多向分化潜能的干细胞, 他们的分化主要依赖于局部微环境. Houghton课题组[31]和Varon课题组[34]的研究表明, 胃部H. pylori感染导致的慢性炎症可招募BMSC迁移至胃黏膜, 通过分泌因子和细胞应答, 分化为胃的各种上皮细胞修复损伤的胃黏膜, 但是这些分化的细胞并不正常, 他们生长、分支、聚集、变形、扭曲, 并且生长速度开始增加, 进而形成早期胃癌.
现阶段GCSC缺乏特异性标志物, 分离纯化GCSC的技术尚不是十分理想, 因此, 利用肿瘤细胞表面的特异性标志物来分离纯化GCSC 也就成为目前研究的热点和方向. 目前发现的可能用于分离GCSC的潜在标志物众多, 其中仅CD44及上皮细胞黏附分子(epithelial cell adhesion molecule, EpCAM)比较确定, 其他的分子标志物特异性不高, 而且有些标志物的研究中甚至存在相互矛盾的结论, 这都提示我们在将来的研究中要更加有效地寻找分离GCSC的方法, 进一步统一GCSC的标志物, 从而更好地研究GCSC的生物学特性, 为胃癌预防和治疗提供新的方法.
CD44是当前学术界研究比较多的细胞表面标志物, 又称Hermes抗原、人类白细胞黏附分子(human cellular adhesive p85 molecule, H-CAM)、淋巴细胞归巢受体和细胞外基质(extracellular matrix, ECM)Ⅲ型受体(ECMR-Ⅲ)等, 是位于细胞表面的一类跨膜糖蛋白, 是透明质酸的受体, 也可与其他配体作用, 如骨桥蛋白、胶原和基质金属蛋白. CD44作为细胞表面的组分与细胞外间质相互作用, 在多种实体肿瘤干细胞表达. 现认为他是多种CSC的标志物, 如乳腺癌、结肠癌、前列腺癌和肝癌等[35-38]. 2009年, Takaishi等[39]首次提出细胞表面标志物CD44可用于识别GCSC. CD44(+)胃癌细胞在体外培养时可以形成集落, 接种到免疫缺陷鼠的胃和皮肤后可形成肿瘤, 且具有分化的能力; 而CD44(-)肿瘤细胞经培养无法产生CD44(+)肿瘤细胞, 用siRNA敲除CD44后, 体外培养细胞集落形成减少, 动物模型上的肿瘤体积也随之减小. CD44(+)肿瘤细胞对放化疗有明显的抵抗性. 而其他一些CSC标志物则未显示出明显的体内外的致瘤作用. 而Han等[40]在从原代的胃癌组织中分离GCSC时采用EpCAM和CD44作为表面标志物, 发现EpCAM(+)/CD44(+)细胞亚群占肿瘤细胞总数的4.5%. 在免疫缺陷小鼠中, 仅EpCAM(+)/CD44(+)的细胞能够形成肿瘤细胞, 而EpCAM(-)/CD44(-)、EpCAM(+)/CD44(-)及EpCAM(-)/CD44(+)的胃癌细胞均不能成瘤. 异种种植的EpCAM(+)/CD44(+)胃癌肿瘤细胞保持了分化表型, 再现了原始胃肿瘤组织的形态和表型的异质性, 而且EpCAM(+)/CD44(+)细胞对抗肿瘤药物的抵抗要高于其他亚群.
信号通路在调控干细胞增殖、分化中具有重要作用. 研究表明, 肿瘤干细胞与正常干细胞具有共用的调节自我更新、增殖分化的信号通路, 其中包括Wnt/β-catenin、Hedgehog(HH)、Notch、FGF/BMP等信号通路, 当某些关键基因发生突变导致通路紊乱或过度激活, 都可能导致肿瘤发生[41]. GCSC的形成和发展同样与这些信号通路密切相关, 本文将在3.2部分重点阐述.
H. pylori感染通过基因突变和蛋白质表达改变诱导并促进胃癌的发展进程, 是胃癌最重要的独立致癌因子, 而GCSC在胃癌的发生过程中扮演重要的角色, 那么这二者之间存在怎样的相互关系呢? 研究[42-44]发现, H. pylori直接通过局部炎症反应间接刺激导致GCSC表面标志物CD44及其变体CD44v9的表达,从而提示胃癌的产生和发展中H. pylori相关CD44(+)的GCSC可能参与其中. 另一方面, 前述的多项研究发现H. pylori诱发的炎症引起干细胞从骨髓向胃部迁移, 之后发展成早期胃癌[31,34,45]. 这些研究均表明H. pylori感染导致的GCSC形成与进展在胃癌的初始发生中发挥至关重要的作用.
EMT是指上皮细胞失去细胞极性和细胞间连接的过程, 此过程细胞形态和结构发生改变并获得间质细胞的特征, 如成纤维细胞样细胞的形态, 细胞迁移能力和侵袭能力的增强, 具体表现为上皮细胞标志物E-cadherin等的减少和间叶细胞标志物Fibronectin和Vimentin等的增多. EMT发生在多种生物进程中, 如原肠胚形成、伤口愈合, 和肿瘤进展, 尤其是发生转移. 多项研究表明, EMT不仅与肿瘤转移相关, 并且参与干性细胞的形成[46-48]. 2008年Mani等[46]在Cell杂志发表的文章首次揭示了EMT与干细胞的关系, 他们在永生化乳腺上皮细胞(human mammary epithelial cell, HMLE)中诱导EMT发生, 结果发现其在获得间质细胞特性的同时干细胞标志物表达增加, 这些细胞的球形集落形成能力显著提升. 另外, 直接从HMLE细胞中分离出来的乳腺上皮干细胞和EMT诱导的干样细胞表达相似的间质细胞及干样细胞的标志物. 接下来的研究证实了在肿瘤中同样存在这样类似的联系[47,48].
2012年, 在此前的研究基础上, Xue等[49]通过长春新碱(vincristine, VCR)短暂预处理的方法诱导胃癌细胞SGC-7901发生EMT而存活, 再经高通量实验分离出这些未被VCR杀死的胃癌细胞即胃癌干细胞候选细胞, 将其移植入NOD/SCID鼠体内, 证实其具有较高的致瘤性, 成功分离出了胃癌干细胞样细胞, 为胃癌干细胞的分离纯化提供了新的思路, 也初步揭示了胃癌干细胞与EMT之间的关系. 而之前已有研究[50,51]证实H. pylori通过CagA上调间质细胞标志物并下调上皮细胞标志物的表达来诱导EMT的发生, 其中miR-200和ZEB1发挥重要作用. 另外, 在H. pylori和CagA的影响下, 不仅间质标志物表达上调, GCSC标志物CD44同样上调, 并且这些细胞表现出肿瘤干细胞的干性[23].
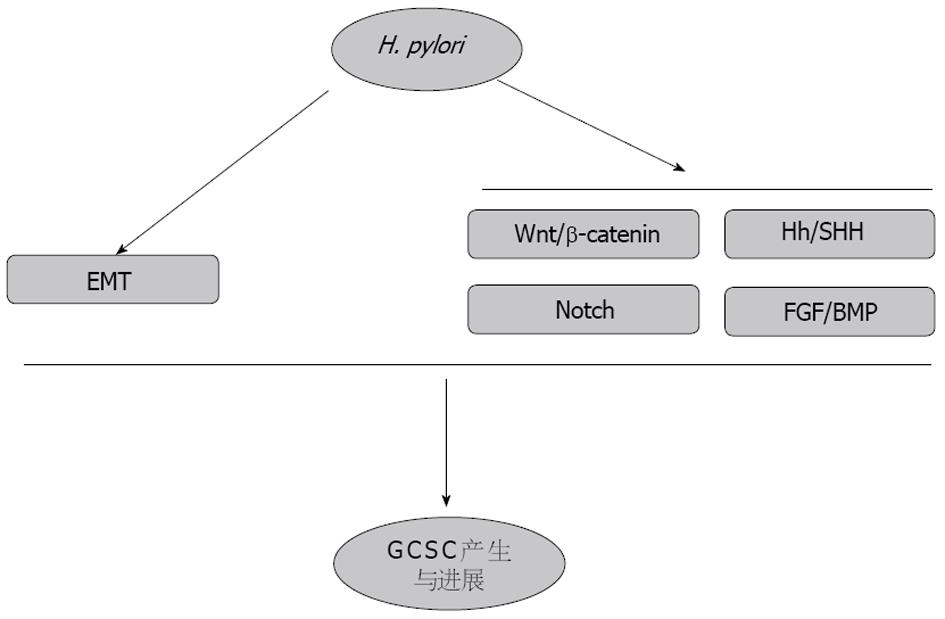
H. pylori定居于胃部引起局部黏膜持续性炎症反应, 促使肿瘤起始相关信号因子如核因子-κB(nuclear factor-κB, NF-κB)、活化蛋白-1、磷脂酰肌醇3激酶(phosphoinositide 3 kinase, PI3K)、信号传导和转录激活子3(signal transducers and activators of transcription 3, STAT3)、Wnt/β-catenin及环氧合酶2(cyclooxygenase 2, COX-2)的激活, 其中的PI3K、JAKSTAT、Wnt/β-catenin等初始信号通路分子是肿瘤微环境的重要调控因子. 以上通路主要作用于肿瘤发展的早期阶段, GCSC十分依赖自我更新, 因此, 初始信号通路对GCSC的存活意义重大. 肿瘤发生之后, H. pylori感染部位可促进肿瘤发育, 其中的基质细胞将变为肿瘤微环境及转移前微环境的组成因子, 促进肿瘤的生长转移. 因此, H. pylori感染与GCSC之间存在协同作用, 共同促进胃肿瘤的发生和生长. 下文将从GCSC的相关信号通路与H. pylori之间的相互作用来阐明H. pylori感染在GCSC形成与进展中的作用(图1).
3.2.1 Wnt/β-catenin通路: Wnt/β-catenin信号通路在肿瘤发生和胚胎发育发挥重要作用[52]. Wnts是由一类通过Frizzled家族受体转导信号的分泌型糖蛋白组成. 经典的Wnt/β-catenin信号通路从AXIN/GSK3B降解复合物中释放β-catenin, 聚集的β-catenin导致维持干细胞干性和诱导细胞增殖的靶基因转录激活; 而非经典的Wnt信号通路则是激活各种控制组织极性、细胞黏附和运动的胞内级联通路(RhoA、JNK、PKC、NFAT和NLK)[53,54]. 具体来说, 无论是经典的β-catenin/T细胞因子(T cell factor, Tcf)信号通路还是由JNK、PKC、Ca2+或Rho介导的非经典级联反应均参与了多能间质干细胞的增殖和分化的调控[55]. Wnt信号分子, 特别是Wnt8A和Wnt8B, 可能通过协同激活β-catenin/Tcf信号来对胚胎性肿瘤和胚胎干细胞发挥重要作用[56]. Wnt2和Wnt5A通常在胃癌中表达上调[57], 而人胃黏膜中Wnt10B的上调可通过激活β-catenin/Tcf信号通路来形成胃癌[58]. Oshima等[59]在K19-Wnt1转基因小鼠模型中已证实Wnt信号通路在维持胃体峡部区域祖细胞的未分化状态中具有重要作用, 实验中观察到该信号的异常激活可使祖细胞数目显著增多. 后续研究发现一种具有慢循环特征的CD44(+)干细胞样亚群细胞持续定植于小鼠胃腔柱状上皮连接处, 当同时激活前列腺素E2(prostaglandin E2, PGE2)时, CD44(+)干细胞样细胞的数量显著增加, 促使胃癌形成[60]. 另外, 可溶性Wnt拮抗剂在胃癌的发生中具有抑制作用. Mao等[61]证实Wnt/β-catenin信号会加速GCSC的体内外增殖, 而盐霉素可以抑制GCSC中的Wnt1信号而抑制胃癌生长. 这些研究结果均表明Wnt/β-catenin通路在GCSC的形成、自我更新等过程中扮演重要的角色.
H. pylori感染与Wnt/β-catenin通路同样关系密切[62]. 由TNF-α和H. pylori诱导的Wnt10A上调也是通过激活Wnt/β-catenin/Tcf信号通路来生成胃癌[58]. 值得注意的是, H. pylori感染诱导白介素-6(interleukin, IL-6)和肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)的表达, 他们又分别上调WNT5A和Wnt10b, 最终激活经典及非经典的Wnt通路[58]. 近期研究[24]表明CagA通过直接抑制GSK-3的活性诱导胃癌EMT, 从而参与GCSC的形成. 总的来说, 上述研究均表明H. pylori感染和GCSC相关的Wnt/β-catenin/Tcf信号通路相互作用, 从而参与胃癌形成.
3.2.2 Hh/SHH通路:HH基因是一种分节极性基因, 因突变的果蝇胚胎呈多毛团状, 酷似受惊刺猬而得名. 哺乳动物中存在三个Hedgehog的同源基因: SonicHedgehog(SHH)、Indian Hedgehog(IHH)和Desert Hedgehog(DHH), 分别编码Shh、Ihh和Dhh蛋白, 他们都对多个器官系统发展起至关重要的作用. Hh信号通路是哺乳动物胃肠道正常发育的关键通路[63]. 此外, 这些蛋白质调控干细胞的产生, 并且能驱动包括胃恶性肿瘤在内的各种肿瘤的扩散[63,64], Hh信号在食道癌、胃癌、胰腺癌和其他恶性肿瘤中被异常激活[65,66]. 在慢性炎症过程中, Hh信号被证实可稳态上调细胞增殖, 同时阻止细胞凋亡, 最终引起肿瘤发生[66,67]. Song课题组[68]初步鉴定出悬浮细胞球为CSC富集, 其patched 1(Ptch1)和glioma-associated oncogene 1(Gli1)(SHH通路的靶基因)明显升高, 在SHH通路的特异抑制剂环巴胺和5E1的作用下, 悬浮细胞球的自我更新能力和抗化疗能力明显下降, 由此认为SHH途径是维护人GCSC样细胞的必要条件. 后期Yoon等[69]的研究进一步证实了Hh/SHH通路对于维持GCSC的干性及其相关表型极其重要. 与前述所提的信号传导通路相比, Hh/SHH也构成干细胞信号网络[67], 他在慢性H. pylori感染时被激活[53], 从而调控肿瘤干细胞与H. pylori相关胃癌相互作用的进展过程.
具体来说, SHH是参与胃底腺体稳态的成形素, 调控壁细胞的成熟和分化[70]. 在H. pylori慢性感染过程中SHH参与了胃黏膜修复过程. 另一方面, 在萎缩性胃炎中, SHH信号由于壁细胞系的损耗而减弱[71]. 由于黏膜损伤, 异常SHH信号可以帮助修复受损上皮细胞. 此外, 我们经常观察到SHH、IHH、PTCH1、GLI1的表达以及HHIP1基因启动子的甲基化在食管和胃的恶性肿瘤中的下调[72-75]. SHH表达的缺失和CDX2基因的异常表达与肠上皮化生的类型有关, 可能与胃癌发生相关[76]. SHH缺失发生在恶性改变之前的黏膜早期改变过程中[77]. 重要的是, 由H. pylori感染引起的胃黏膜SHH表达抑制在根除H. pylori感染后明显恢复[78,79]. Donnelly等[80]证实Hh/SHH通路是H. pylori感染诱导的BM-MSCs向胃部迁移并发展为GCSC过程中尤为重要的一条信号通路. 因此, SHH信号可能在上消化道肿瘤中发挥重要作用, 其与H. pylori、肿瘤及干细胞相互作用, 引起肿瘤发生.
3.2.3 Notch通路: Notch信号通路由Notch家族受体和他们的跨膜型配体构成. Notch信号的产生是通过相邻细胞的Notch配体与受体相互作用, 由胞内段释放入胞质, 并进入细胞核与CSL或NF-κB转录因子相互作用. 相邻细胞可以通过Notch受体与配体的结合传递Notch信号, 从而扩大并固化细胞间的分子差异, 最终决定细胞命运, 影响器官形成和形态发生. Notch信号是相邻细胞之间通讯进而调控细胞增殖、分化和凋亡的重要通路. Notch信号在胃癌中上调, 通过抑制上皮分化来维持细胞干性[81]. 尤其是Notch在慢性H. pylori感染时被激活[53]. 此外, 同源Notch 1属于Notch家族跨膜受体, 其在细胞分化中扮演重要角色. Notch 1在肿瘤形成中发挥重要作用, 他既可致癌, 亦可抑癌. Notch 1的表达失调可能与胃癌的发生和发展有重大关联, 是胃恶性肿瘤的新型预后标志物[82,83]. 最新的一项研究[84]表明Notch信号调控LGR5(+)GSC的功能, 其异常激活可能导致GSC发展为GCSC并发生胃癌. 另外, COX-2在胃癌组织中表达升高, 可作为胃癌预后判断的独立因子, 与胃癌患者生存率降低密切相关[85]. Notch信号通路的激活促进胃癌进展部分是通过COX-2的作用[86,87]. COX-2抑制剂塞来昔布可通过降低H. pylori感染胃组织中的趋化因子受体2的表达抑制具有GCSC特性的CD133+细胞转移[88]. 纵观上述数据, 与H. pylori和GCSC均相关的Notch信号对胃癌的发展与预后有着非常重要的意义.
3.2.4 FGF/BMP通路: 除了Wnt和Notch信号通路之外, FGFs也一并构成干细胞的信号网络, 他在包括肿瘤形成等多种生物进程中起到关键性作用[67,89]. FGFs及其受体可诱发潜在的原癌基因激活而引起和促进肿瘤发生[90]. 当FGF配体结合于FGF受体, 随后受体同源二聚化和自身磷酸化, FGF信号通路被激活, 并被转导至PKC, NFAT RAS-ERK及PI3K-Akt信号级联[91]. 重要的是, FGF/FGFR通路与胃肠道肿瘤关系密切[92], 胃癌中FGFR2基因扩增或错义突变[93]. 在印戒胃癌中FGFR和BMP4的过表达尤为突出, 这种FGF和BMP信号通路的活化在弥漫型胃癌中可能有助于SHH信号的下调[94]. 值得注意的是, H. pylori细胞毒素相关蛋白CagA通过FRS2/FRS3-SHP2-GRB2蛋白复合物到RAS-ERK和PI3K-Akt信号级联反应诱导SHP2功能障碍, 影响FGF信号转导[53,95]. 由于FGF信号通路在慢性H. pylori感染中也被激活[53], 因此这个通路与干细胞信号网络相关, H. pylori可能在胃肿瘤形成中发挥更多的作用.
骨成型蛋白质BMPs隶属于TGFβ总科, 并且作为调节扩张和分化之间平衡的调节因子在干细胞和祖细胞生物学中扮演着重要的角色. 骨成型蛋白质促进干细胞分化, 从而从干细胞室移出. BMP/TGFβ信号通路在慢性H. pylori感染中亦被激活[52], 对癌变过程起关键作用[66]. 值得注意的是, BMP信号利用R-SMAD蛋白质作为信号传导中介而激活靶基因[96]. H. pylori感染导致炎症细胞的浸润, 扰乱胃上皮成形素的表达. 人们发现, 炎性细胞分泌BMP2和BMP4以激活上皮细胞的BMP-IHH信号环路. 有趣的是, 人们在对胃的前体细胞隔室(峡部)中发现了一个BMP通路的激活[97], 而BMP2和BMP4活动也与弥漫型胃癌密切相关.
H. pylori感染是胃癌发生的关键性因素, 然而其机制仍不清楚. CSC理论发展迅速, GCSC的存在和意义被广泛认可, 新型GCSC标志物逐渐发现, 为H. pylori感染导致胃癌的研究提供了一个全新的方向, 同时也为胃癌的治疗带来了巨大的机遇. 然而, 我们关于H. pylori和GCSC的研究仍有不足, 需要在以下几个方面进行更多的研究: (1)目前GCSC的分离和培养获取的仍然是不纯的干细胞, 其在体外分化导致不能进行长期培养[5], 这也导致无法将H. pylori和GCSC在体外长期共培养以开展实验. 未来随着GCSC标志物明确, 获取单一的GCSC, 有助于H. pylori感染和GCSC的研究; (2)EMT是产生GCSC的一个重要途径, 是否抑制EMT的发生就能控制胃癌的发生和进展? (3)EMT和GCSC均与胃癌细胞耐药密切相关[98-100], 是否参与其中? 几者之间有何联系? (4)H. pylori根除预防胃癌已在很多临床研究中开展, 但仍不能完全消除H. pylori相关胃癌[101]. 究其原因是H. pylori根除前已启动体内相关致癌信号通路(如Wnt/β-catenin、HH、Notch、FGF/BMP等), 能否切断H. pylori与GCSC相关通路的联系成为H. pylori相关胃癌预防的一个重要课题.
H. pylori感染引发炎症, 而细菌与宿主细胞的相互作用在这种局部微环境的相互作用也影响GSC或BMSC的分化, 这可能导致GCSC的形成. 另外, H. pylori感染可通过EMT和Wnt/β-catenin、HH、Notch、FGF/BMP等信号通路影响GCSC的产生从而参与胃癌的形成和发展. 因此, 着眼于H. pylori引起GCSC的形成和变化将是研究胃癌分子机制及起源的一个重要途径, 也将为胃癌预防和治疗提供新的方法.
近年来, 胃癌干细胞在胃癌中的作用已经越来越明确, 其研究已深入到机制层面, 而幽门螺杆菌(Helicobacter pylori, H. pylori)感染是胃癌致癌的主要因素, 因此, 胃癌干细胞与H. pylori的相互作用成为研究胃癌发生机制的新突破口.
徐阿曼, 教授, 博士生导师, 安徽医科大学第一附属医院胃肠外科
明确胃癌干细胞的分离纯化方法, 获取纯度较高的胃癌干细胞, 进而探索其与H. pylori感染的相互关系, 是目前乃至今后的研究热点.
近年来关于胃癌干细胞与H. pylori感染的研究精华多被本述评引用在内, 这些成果极大丰富了胃癌发生机制的研究.
目前, 专门关于H. pylori感染与胃癌干细胞相互作用的研究并不多, 本述评对这些零散的研究做出了高度概括、凝炼和总结, 使读者对该领域有基本的了解和认识. 另外, 本文还对该领域的研究现状及所面临的困境做出了阐释, 对年轻研究人员具有一定的指导性意义.
抑制H. pylori感染与胃癌干细胞的相互作用有望成为控制胃癌发生和进展的新策略.
本文阐述H. pylori在胃癌干细胞形成过程中所起的作用, 对胃癌干细胞及进一步研究具有重要的参考价值.
手稿来源: 邀请约稿
学科分类: 胃肠病学和肝病学
手稿来源地: 山东省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
编辑: 郭鹏 电编:闫晋利
| 1. | Bouvard V, Baan R, Straif K, Grosse Y, Secretan B, El Ghissassi F, Benbrahim-Tallaa L, Guha N, Freeman C, Galichet L. A review of human carcinogens--Part B: biological agents. Lancet Oncol. 2009;10:321-322. [PubMed] |
| 2. | De Falco M, Lucariello A, Iaquinto S, Esposito V, Guerra G, De Luca A. Molecular Mechanisms of Helicobacter pylori Pathogenesis. J Cell Physiol. 2015;230:1702-1707. [PubMed] [DOI] |
| 3. | Ernst PB, Peura DA, Crowe SE. The translation of Helicobacter pylori basic research to patient care. Gastroenterology. 2006;130:188-206; quiz 212-213. [PubMed] [DOI] |
| 4. | Amieva M, Peek RM. Pathobiology of Helicobacter pylori-Induced Gastric Cancer. Gastroenterology. 2016;150:64-78. [PubMed] [DOI] |
| 5. | Stojnev S, Krstic M, Ristic-Petrovic A, Stefanovic V, Hattori T. Gastric cancer stem cells: therapeutic targets. Gastric Cancer. 2014;17:13-25. [PubMed] [DOI] |
| 6. | Segal ED, Cha J, Lo J, Falkow S, Tompkins LS. Altered states: involvement of phosphorylated CagA in the induction of host cellular growth changes by Helicobacter pylori. Proc Natl Acad Sci USA. 1999;96:14559-14564. [PubMed] [DOI] |
| 7. | Viala J, Chaput C, Boneca IG, Cardona A, Girardin SE, Moran AP, Athman R, Mémet S, Huerre MR, Coyle AJ. Nod1 responds to peptidoglycan delivered by the Helicobacter pylori cag pathogenicity island. Nat Immunol. 2004;5:1166-1174. [PubMed] [DOI] |
| 8. | Hatakeyama M. Linking epithelial polarity and carcinogenesis by multitasking Helicobacter pylori virulence factor CagA. Oncogene. 2008;27:7047-7054. [PubMed] [DOI] |
| 9. | Radin JN, González-Rivera C, Ivie SE, McClain MS, Cover TL. Helicobacter pylori VacA induces programmed necrosis in gastric epithelial cells. Infect Immun. 2011;79:2535-2543. [PubMed] [DOI] |
| 10. | Odenbreit S, Swoboda K, Barwig I, Ruhl S, Borén T, Koletzko S, Haas R. Outer membrane protein expression profile in Helicobacter pylori clinical isolates. Infect Immun. 2009;77:3782-3790. [PubMed] [DOI] |
| 11. | Peek RM, Crabtree JE. Helicobacter infection and gastric neoplasia. J Pathol. 2006;208:233-248. [PubMed] |
| 12. | Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011;144:646-674. [PubMed] [DOI] |
| 13. | Diakos CI, Charles KA, McMillan DC, Clarke SJ. Cancer-related inflammation and treatment effectiveness. Lancet Oncol. 2014;15:e493-e503. [PubMed] [DOI] |
| 14. | Tu S, Bhagat G, Cui G, Takaishi S, Kurt-Jones EA, Rickman B, Betz KS, Penz-Oesterreicher M, Bjorkdahl O, Fox JG. Overexpression of interleukin-1beta induces gastric inflammation and cancer and mobilizes myeloid-derived suppressor cells in mice. Cancer Cell. 2008;14:408-419. [PubMed] [DOI] |
| 15. | Oguma K, Oshima H, Aoki M, Uchio R, Naka K, Nakamura S, Hirao A, Saya H, Taketo MM, Oshima M. Activated macrophages promote Wnt signalling through tumour necrosis factor-alpha in gastric tumour cells. EMBO J. 2008;27:1671-1681. [PubMed] [DOI] |
| 16. | Oshima H, Hioki K, Popivanova BK, Oguma K, Van Rooijen N, Ishikawa TO, Oshima M. Prostaglandin E2 signaling and bacterial infection recruit tumor-promoting macrophages to mouse gastric tumors. Gastroenterology. 2011;140:596-607.e7. [PubMed] [DOI] |
| 17. | Zhuang Y, Peng LS, Zhao YL, Shi Y, Mao XH, Chen W, Pang KC, Liu XF, Liu T, Zhang JY. CD8(+) T cells that produce interleukin-17 regulate myeloid-derived suppressor cells and are associated with survival time of patients with gastric cancer. Gastroenterology. 2012;143:951-962.e8. [PubMed] [DOI] |
| 18. | Toller IM, Neelsen KJ, Steger M, Hartung ML, Hottiger MO, Stucki M, Kalali B, Gerhard M, Sartori AA, Lopes M. Carcinogenic bacterial pathogen Helicobacter pylori triggers DNA double-strand breaks and a DNA damage response in its host cells. Proc Natl Acad Sci USA. 2011;108:14944-14949. [PubMed] [DOI] |
| 19. | Obst B, Wagner S, Sewing KF, Beil W. Helicobacter pylori causes DNA damage in gastric epithelial cells. Carcinogenesis. 2000;21:1111-1115. [PubMed] [DOI] |
| 20. | Katsurahara M, Kobayashi Y, Iwasa M, Ma N, Inoue H, Fujita N, Tanaka K, Horiki N, Gabazza EC, Takei Y. Reactive nitrogen species mediate DNA damage in Helicobacter pylori-infected gastric mucosa. Helicobacter. 2009;14:552-558. [PubMed] [DOI] |
| 21. | Shimizu T, Marusawa H, Matsumoto Y, Inuzuka T, Ikeda A, Fujii Y, Minamiguchi S, Miyamoto S, Kou T, Sakai Y. Accumulation of somatic mutations in TP53 in gastric epithelium with Helicobacter pylori infection. Gastroenterology. 2014;147:407-417.e3. [PubMed] [DOI] |
| 22. | Zhao C, Bu X. Promoter methylation of tumor-related genes in gastric carcinogenesis. Histol Histopathol. 2012;27:1271-1282. [PubMed] |
| 23. | Bessède E, Staedel C, Acuña Amador LA, Nguyen PH, Chambonnier L, Hatakeyama M, Belleannée G, Mégraud F, Varon C. Helicobacter pylori generates cells with cancer stem cell properties via epithelial-mesenchymal transition-like changes. Oncogene. 2014;33:4123-4131. [PubMed] [DOI] |
| 24. | Lee DG, Kim HS, Lee YS, Kim S, Cha SY, Ota I, Kim NH, Cha YH, Yang DH, Lee Y. Helicobacter pylori CagA promotes Snail-mediated epithelial-mesenchymal transition by reducing GSK-3 activity. Nat Commun. 2014;5:4423. [PubMed] [DOI] |
| 25. | Chaturvedi R, Asim M, Piazuelo MB, Yan F, Barry DP, Sierra JC, Delgado AG, Hill S, Casero RA, Bravo LE. Activation of EGFR and ERBB2 by Helicobacter pylori results in survival of gastric epithelial cells with DNA damage. Gastroenterology. 2014;146:1739-51.e14. [PubMed] [DOI] |
| 26. | Yan F, Cao H, Chaturvedi R, Krishna U, Hobbs SS, Dempsey PJ, Peek RM, Cover TL, Washington MK, Wilson KT. Epidermal growth factor receptor activation protects gastric epithelial cells from Helicobacter pylori-induced apoptosis. Gastroenterology. 2009;136:1297-1307, e1-e3. [PubMed] [DOI] |
| 27. | McDonald SA, Greaves LC, Gutierrez-Gonzalez L, Rodriguez-Justo M, Deheragoda M, Leedham SJ, Taylor RW, Lee CY, Preston SL, Lovell M. Mechanisms of field cancerization in the human stomach: the expansion and spread of mutated gastric stem cells. Gastroenterology. 2008;134:500-510. [PubMed] [DOI] |
| 28. | Barker N, Huch M, Kujala P, van de Wetering M, Snippert HJ, van Es JH, Sato T, Stange DE, Begthel H, van den Born M. Lgr5(+ve) stem cells drive self-renewal in the stomach and build long-lived gastric units in vitro. Cell Stem Cell. 2010;6:25-36. [PubMed] [DOI] |
| 29. | Hayakawa Y, Jin G, Wang H, Chen X, Westphalen CB, Asfaha S, Renz BW, Ariyama H, Dubeykovskaya ZA, Takemoto Y. CCK2R identifies and regulates gastric antral stem cell states and carcinogenesis. Gut. 2015;64:544-553. [PubMed] [DOI] |
| 30. | Li Q, Jia Z, Wang L, Kong X, Li Q, Guo K, Tan D, Le X, Wei D, Huang S. Disruption of Klf4 in villin-positive gastric progenitor cells promotes formation and progression of tumors of the antrum in mice. Gastroenterology. 2012;142:531-542. [PubMed] [DOI] |
| 31. | Houghton J, Stoicov C, Nomura S, Rogers AB, Carlson J, Li H, Cai X, Fox JG, Goldenring JR, Wang TC. Gastric cancer originating from bone marrow-derived cells. Science. 2004;306:1568-1571. [PubMed] [DOI] |
| 32. | Houghton J, Morozov A, Smirnova I, Wang TC. Stem cells and cancer. Semin Cancer Biol. 2007;17:191-203. [PubMed] [DOI] |
| 33. | Xu G, Shen J, Ou Yang X, Sasahara M, Su X. Cancer stem cells: the 'heartbeat' of gastric cancer. J Gastroenterol. 2013;48:781-797. [PubMed] [DOI] |
| 34. | Varon C, Dubus P, Mazurier F, Asencio C, Chambonnier L, Ferrand J, Giese A, Senant-Dugot N, Carlotti M, Mégraud F. Helicobacter pylori infection recruits bone marrow-derived cells that participate in gastric preneoplasia in mice. Gastroenterology. 2012;142:281-291. [PubMed] [DOI] |
| 35. | Du L, Wang H, He L, Zhang J, Ni B, Wang X, Jin H, Cahuzac N, Mehrpour M, Lu Y. CD44 is of functional importance for colorectal cancer stem cells. Clin Cancer Res. 2008;14:6751-6760. [PubMed] [DOI] |
| 36. | Palapattu GS, Wu C, Silvers CR, Martin HB, Williams K, Salamone L, Bushnell T, Huang LS, Yang Q, Huang J. Selective expression of CD44, a putative prostate cancer stem cell marker, in neuroendocrine tumor cells of human prostate cancer. Prostate. 2009;69:787-798. [PubMed] [DOI] |
| 37. | Zhu Z, Hao X, Yan M, Yao M, Ge C, Gu J, Li J. Cancer stem/progenitor cells are highly enriched in CD133+CD44+ population in hepatocellular carcinoma. Int J Cancer. 2010;126:2067-2078. [PubMed] [DOI] |
| 38. | Wright MH, Calcagno AM, Salcido CD, Carlson MD, Ambudkar SV, Varticovski L. Brca1 breast tumors contain distinct CD44+/CD24- and CD133+ cells with cancer stem cell characteristics. Breast Cancer Res. 2008;10:R10. [PubMed] [DOI] |
| 39. | Takaishi S, Okumura T, Tu S, Wang SS, Shibata W, Vigneshwaran R, Gordon SA, Shimada Y, Wang TC. Identification of gastric cancer stem cells using the cell surface marker CD44. Stem Cells. 2009;27:1006-1020. [PubMed] [DOI] |
| 40. | Han ME, Jeon TY, Hwang SH, Lee YS, Kim HJ, Shim HE, Yoon S, Baek SY, Kim BS, Kang CD. Cancer spheres from gastric cancer patients provide an ideal model system for cancer stem cell research. Cell Mol Life Sci. 2011;68:3589-3605. [PubMed] [DOI] |
| 41. | Han ME, Oh SO. Gastric stem cells and gastric cancer stem cells. Anat Cell Biol. 2013;46:8-18. [PubMed] [DOI] |
| 42. | Fan X, Long A, Goggins M, Fan X, Keeling PW, Kelleher D. Expression of CD44 and its variants on gastric epithelial cells of patients with Helicobacter pylori colonisation. Gut. 1996;38:507-512. [PubMed] |
| 43. | Peng AB, Shi W, Hu SH, Zhao Q. [Expression of CD44v6 in gastric cancer and its correlation with Helicobacter pylori infection]. Ai Zheng. 2003;22:1184-1187. [PubMed] |
| 44. | Bertaux-Skeirik N, Feng R, Schumacher MA, Li J, Mahe MM, Engevik AC, Javier JE, Peek RM, Ottemann K, Orian-Rousseau V. CD44 plays a functional role in Helicobacter pylori-induced epithelial cell proliferation. PLoS Pathog. 2015;11:e1004663. [PubMed] [DOI] |
| 45. | Li HC, Stoicov C, Rogers AB, Houghton J. Stem cells and cancer: evidence for bone marrow stem cells in epithelial cancers. World J Gastroenterol. 2006;12:363-371. [PubMed] [DOI] |
| 46. | Mani SA, Guo W, Liao MJ, Eaton EN, Ayyanan A, Zhou AY, Brooks M, Reinhard F, Zhang CC, Shipitsin M. The epithelial-mesenchymal transition generates cells with properties of stem cells. Cell. 2008;133:704-715. [PubMed] [DOI] |
| 47. | Shuang ZY, Wu WC, Xu J, Lin G, Liu YC, Lao XM, Zheng L, Li S. Transforming growth factor-β1-induced epithelial-mesenchymal transition generates ALDH-positive cells with stem cell properties in cholangiocarcinoma. Cancer Lett. 2014;354:320-328. [PubMed] [DOI] |
| 48. | Raimondi C, Gianni W, Cortesi E, Gazzaniga P. Cancer stem cells and epithelial-mesenchymal transition: revisiting minimal residual disease. Curr Cancer Drug Targets. 2010;10:496-508. [PubMed] [DOI] |
| 49. | Xue Z, Yan H, Li J, Liang S, Cai X, Chen X, Wu Q, Gao L, Wu K, Nie Y. Identification of cancer stem cells in vincristine preconditioned SGC7901 gastric cancer cell line. J Cell Biochem. 2012;113:302-312. [PubMed] [DOI] |
| 50. | Baud J, Varon C, Chabas S, Chambonnier L, Darfeuille F, Staedel C. Helicobacter pylori initiates a mesenchymal transition through ZEB1 in gastric epithelial cells. PLoS One. 2013;8:e60315. [PubMed] [DOI] |
| 51. | Yin Y, Grabowska AM, Clarke PA, Whelband E, Robinson K, Argent RH, Tobias A, Kumari R, Atherton JC, Watson SA. Helicobacter pylori potentiates epithelial: mesenchymal transition in gastric cancer: links to soluble HB-EGF, gastrin and matrix metalloproteinase-7. Gut. 2010;59:1037-1045. [PubMed] [DOI] |
| 52. | Clevers H. Wnt/beta-catenin signaling in development and disease. Cell. 2006;127:469-480. [PubMed] [DOI] |
| 53. | Katoh M. Dysregulation of stem cell signaling network due to germline mutation, SNP, Helicobacter pylori infection, epigenetic change and genetic alteration in gastric cancer. Cancer Biol Ther. 2007;6:832-839. [PubMed] |
| 54. | Klaus A, Birchmeier W. Wnt signalling and its impact on development and cancer. Nat Rev Cancer. 2008;8:387-398. [PubMed] [DOI] |
| 55. | Ling L, Nurcombe V, Cool SM. Wnt signaling controls the fate of mesenchymal stem cells. Gene. 2009;433:1-7. [PubMed] [DOI] |
| 56. | Saitoh T, Mine T, Katoh M. Expression and regulation of WNT8A and WNT8B mRNAs in human tumor cell lines: up-regulation of WNT8B mRNA by beta-estradiol in MCF-7 cells, and down-regulation of WNT8A and WNT8B mRNAs by retinoic acid in NT2 cells. Int J Oncol. 2002;20:999-1003. [PubMed] |
| 57. | Katoh M. Frequent up-regulation of WNT2 in primary gastric cancer and colorectal cancer. Int J Oncol. 2001;19:1003-1007. [PubMed] [DOI] |
| 58. | Saitoh T, Kirikoshi H, Mine T, Katoh M. Proto-oncogene WNT10B is up-regulated by tumor necrosis factor alpha in human gastric cancer cell line MKN45. Int J Oncol. 2001;19:1187-1192. [PubMed] [DOI] |
| 59. | Oshima H, Matsunaga A, Fujimura T, Tsukamoto T, Taketo MM, Oshima M. Carcinogenesis in mouse stomach by simultaneous activation of the Wnt signaling and prostaglandin E2 pathway. Gastroenterology. 2006;131:1086-1095. [PubMed] [DOI] |
| 60. | Ishimoto T, Oshima H, Oshima M, Kai K, Torii R, Masuko T, Baba H, Saya H, Nagano O. CD44+ slow-cycling tumor cell expansion is triggered by cooperative actions of Wnt and prostaglandin E2 in gastric tumorigenesis. Cancer Sci. 2010;101:673-678. [PubMed] [DOI] |
| 61. | Mao J, Fan S, Ma W, Fan P, Wang B, Zhang J, Wang H, Tang B, Zhang Q, Yu X. Roles of Wnt/β-catenin signaling in the gastric cancer stem cells proliferation and salinomycin treatment. Cell Death Dis. 2014;5:e1039. [PubMed] [DOI] |
| 62. | Song X, Xin N, Wang W, Zhao C. Wnt/β-catenin, an oncogenic pathway targeted by H. pylori in gastric carcinogenesis. Oncotarget. 2015;6:35579-35588. [PubMed] [DOI] |
| 63. | Lees C, Howie S, Sartor RB, Satsangi J. The hedgehog signalling pathway in the gastrointestinal tract: implications for development, homeostasis, and disease. Gastroenterology. 2005;129:1696-1710. [PubMed] [DOI] |
| 64. | Waschek JA, Dicicco-Bloom E, Nicot A, Lelievre V. Hedgehog signaling: new targets for GPCRs coupled to cAMP and protein kinase A. Ann N Y Acad Sci. 2006;1070:120-128. [PubMed] [DOI] |
| 65. | Katoh Y, Katoh M. Hedgehog target genes: mechanisms of carcinogenesis induced by aberrant hedgehog signaling activation. Curr Mol Med. 2009;9:873-886. [PubMed] [DOI] |
| 66. | Gonnissen A, Isebaert S, Haustermans K. Targeting the Hedgehog signaling pathway in cancer: beyond Smoothened. Oncotarget. 2015;6:13899-13913. [PubMed] [DOI] |
| 67. | Katoh Y, Katoh M. Hedgehog signaling pathway and gastrointestinal stem cell signaling network (review). Int J Mol Med. 2006;18:1019-1023. [PubMed] |
| 68. | Song Z, Yue W, Wei B, Wang N, Li T, Guan L, Shi S, Zeng Q, Pei X, Chen L. Sonic hedgehog pathway is essential for maintenance of cancer stem-like cells in human gastric cancer. PLoS One. 2011;6:e17687. [PubMed] [DOI] |
| 69. | Yoon C, Park do J, Schmidt B, Thomas NJ, Lee HJ, Kim TS, Janjigian YY, Cohen DJ, Yoon SS. CD44 expression denotes a subpopulation of gastric cancer cells in which Hedgehog signaling promotes chemotherapy resistance. Clin Cancer Res. 2014;20:3974-3988. [PubMed] [DOI] |
| 70. | Nishizawa T, Suzuki H, Nakagawa I, Minegishi Y, Masaoka T, Iwasaki E, Hibi T. Rebamipide-promoted restoration of gastric mucosal sonic hedgehog expression after early Helicobacter pylori eradication. Digestion. 2009;79:259-262. [PubMed] [DOI] |
| 71. | Stepan V, Ramamoorthy S, Nitsche H, Zavros Y, Merchant JL, Todisco A. Regulation and function of the sonic hedgehog signal transduction pathway in isolated gastric parietal cells. J Biol Chem. 2005;280:15700-15708. [PubMed] [DOI] |
| 72. | Ma X, Sheng T, Zhang Y, Zhang X, He J, Huang S, Chen K, Sultz J, Adegboyega PA, Zhang H. Hedgehog signaling is activated in subsets of esophageal cancers. Int J Cancer. 2006;118:139-148. [PubMed] [DOI] |
| 73. | Ma X, Chen K, Huang S, Zhang X, Adegboyega PA, Evers BM, Zhang H, Xie J. Frequent activation of the hedgehog pathway in advanced gastric adenocarcinomas. Carcinogenesis. 2005;26:1698-1705. [PubMed] [DOI] |
| 74. | Berman DM, Karhadkar SS, Maitra A, Montes De Oca R, Gerstenblith MR, Briggs K, Parker AR, Shimada Y, Eshleman JR, Watkins DN. Widespread requirement for Hedgehog ligand stimulation in growth of digestive tract tumours. Nature. 2003;425:846-851. [PubMed] [DOI] |
| 75. | Martin ST, Sato N, Dhara S, Chang R, Hustinx SR, Abe T, Maitra A, Goggins M. Aberrant methylation of the Human Hedgehog interacting protein (HHIP) gene in pancreatic neoplasms. Cancer Biol Ther. 2005;4:728-733. [PubMed] |
| 76. | Shiotani A, Iishi H, Uedo N, Ishihara R, Ishiguro S, Tatsuta M, Nakae Y, Kumamoto M, Hinoi T, Merchant JL. Helicobacter pylori-induced atrophic gastritis progressing to gastric cancer exhibits sonic hedgehog loss and aberrant CDX2 expression. Aliment Pharmacol Ther. 2006;24 Suppl 4:71-80. [PubMed] [DOI] |
| 77. | Shiotani A, Iishi H, Uedo N, Ishiguro S, Tatsuta M, Nakae Y, Kumamoto M, Merchant JL. Evidence that loss of sonic hedgehog is an indicator of Helicobater pylori-induced atrophic gastritis progressing to gastric cancer. Am J Gastroenterol. 2005;100:581-587. [PubMed] [DOI] |
| 78. | Nishizawa T, Suzuki H, Masaoka T, Minegishi Y, Iwasahi E, Hibi T. Helicobacter pylori eradication restored sonic hedgehog expression in the stomach. Hepatogastroenterology. 2007;54:697-700. [PubMed] |
| 79. | Nishizawa T, Suzuki H, Nakagawa I, Minegishi Y, Masaoka T, Iwasaki E, Hibi T. Early Helicobacter pylori eradication restores sonic hedgehog expression in the gastric mucosa of Mongolian gerbils. Digestion. 2009;79:99-108. [PubMed] [DOI] |
| 80. | Donnelly JM, Chawla A, Houghton J, Zavros Y. Sonic hedgehog mediates the proliferation and recruitment of transformed mesenchymal stem cells to the stomach. PLoS One. 2013;8:e75225. [PubMed] [DOI] |
| 81. | Katoh M, Katoh M. Notch signaling in gastrointestinal tract (review). Int J Oncol. 2007;30:247-251. [PubMed] [DOI] |
| 82. | Li DW, Wu Q, Peng ZH, Yang ZR, Wang Y. [Expression and significance of Notch1 and PTEN in gastric cancer]. Ai Zheng. 2007;26:1183-1187. [PubMed] |
| 83. | Zhang H, Wang X, Xu J, Sun Y. Notch1 activation is a poor prognostic factor in patients with gastric cancer. Br J Cancer. 2014;110:2283-2290. [PubMed] [DOI] |
| 84. | Demitrack ES, Gifford GB, Keeley TM, Carulli AJ, VanDussen KL, Thomas D, Giordano TJ, Liu Z, Kopan R, Samuelson LC. Notch signaling regulates gastric antral LGR5 stem cell function. EMBO J. 2015;34:2522-2536. [PubMed] [DOI] |
| 85. | Thiel A, Mrena J, Ristimäki A. Cyclooxygenase-2 and gastric cancer. Cancer Metastasis Rev. 2011;30:387-395. [PubMed] [DOI] |
| 86. | Yeh TS, Wu CW, Hsu KW, Liao WJ, Yang MC, Li AF, Wang AM, Kuo ML, Chi CW. The activated Notch1 signal pathway is associated with gastric cancer progression through cyclooxygenase-2. Cancer Res. 2009;69:5039-5048. [PubMed] [DOI] |
| 87. | Tseng YC, Tsai YH, Tseng MJ, Hsu KW, Yang MC, Huang KH, Li AF, Chi CW, Hsieh RH, Ku HH. Notch2-induced COX-2 expression enhancing gastric cancer progression. Mol Carcinog. 2012;51:939-951. [PubMed] [DOI] |
| 88. | Futagami S, Hamamoto T, Shimpuku M, Nagoya H, Kawagoe T, Horie A, Shindo T, Gudis K, Sakamoto C. Celecoxib inhibits CD133-positive cell migration via reduction of CCR2 in Helicobacter pylori-infected Mongolian gerbils. Digestion. 2010;81:193-203. [PubMed] [DOI] |
| 89. | Katoh M, Nakagama H. FGF receptors: cancer biology and therapeutics. Med Res Rev. 2014;34:280-300. [PubMed] [DOI] |
| 90. | Tiong KH, Mah LY, Leong CO. Functional roles of fibroblast growth factor receptors (FGFRs) signaling in human cancers. Apoptosis. 2013;18:1447-1468. [PubMed] [DOI] |
| 91. | McCubrey JA, Steelman LS, Chappell WH, Abrams SL, Wong EW, Chang F, Lehmann B, Terrian DM, Milella M, Tafuri A. Roles of the Raf/MEK/ERK pathway in cell growth, malignant transformation and drug resistance. Biochim Biophys Acta. 2007;1773:1263-1284. [PubMed] [DOI] |
| 92. | Cohen MM. Molecular dimensions of gastrointestinal tumors: some thoughts for digestion. Am J Med Genet A. 2003;122A:303-314. [PubMed] [DOI] |
| 93. | Katoh M. Cancer genomics and genetics of FGFR2 (Review). Int J Oncol. 2008;33:233-237. [PubMed] [DOI] |
| 94. | Katoh M, Terada M. Overexpression of bone morphogenic protein (BMP)-4 mRNA in gastric cancer cell lines of poorly differentiated type. J Gastroenterol. 1996;31:137-139. [PubMed] |
| 95. | Hatakeyama M, Higashi H. Helicobacter pylori CagA: a new paradigm for bacterial carcinogenesis. Cancer Sci. 2005;96:835-843. [PubMed] |
| 96. | Blitz IL, Cho KW. Finding partners: how BMPs select their targets. Dev Dyn. 2009;238:1321-1331. [PubMed] [DOI] |
| 97. | Bleuming SA, Kodach LL, Garcia Leon MJ, Richel DJ, Peppelenbosch MP, Reitsma PH, Hardwick JC, van den Brink GR. Altered bone morphogenetic protein signalling in the Helicobacter pylori-infected stomach. J Pathol. 2006;209:190-197. [PubMed] [DOI] |
| 98. | Tan TZ, Miow QH, Miki Y, Noda T, Mori S, Huang RY, Thiery JP. Epithelial-mesenchymal transition spectrum quantification and its efficacy in deciphering survival and drug responses of cancer patients. EMBO Mol Med. 2014;6:1279-1293. [PubMed] [DOI] |
| 99. | Xu M, Gong A, Yang H, George SK, Jiao Z, Huang H, Jiang X, Zhang Y. Sonic hedgehog-glioma associated oncogene homolog 1 signaling enhances drug resistance in CD44(+)/Musashi-1(+) gastric cancer stem cells. Cancer Lett. 2015;369:124-133. [PubMed] [DOI] |
| 100. | Yang Z, Guo L, Liu D, Sun L, Chen H, Deng Q, Liu Y, Yu M, Ma Y, Guo N. Acquisition of resistance to trastuzumab in gastric cancer cells is associated with activation of IL-6/STAT3/Jagged-1/Notch positive feedback loop. Oncotarget. 2015;6:5072-5087. [PubMed] [DOI] |
| 101. | Graham DY. Helicobacter pylori update: gastric cancer, reliable therapy, and possible benefits. Gastroenterology. 2015;148:719-731.e3. [PubMed] [DOI] |