修回日期: 2016-04-22
接受日期: 2016-05-03
在线出版日期: 2016-06-08
慢性炎症可以诱导多种肿瘤的发生. 其中, 炎症性肠病是引发结直肠癌的最主要风险因素之一. 上皮间质转化(epithelial-mesenchymal transition, EMT)可以促进包括结直肠癌在内的多种肿瘤细胞的侵袭、转移. 而炎症性肠病慢性炎症中产生的多种炎性细胞因子又能通过一系列途径介导EMT的活化, 从而促进结肠炎相关性结直肠癌的发生、发展. 本文就近年来EMT与炎症性肠病和结肠炎相关性结直肠癌的研究作一综述, 旨在探讨EMT与炎症性肠病和结肠炎相关性结直肠癌之间的关系, 同时为结肠炎相关性结直肠癌的临床治疗提供新的思路和方法.
核心提示: 本文阐述了上皮间质转化(epithelial-mesenchymal transition, EMT)与炎症性肠病和结肠炎相关性结直肠癌的最新研究进展, 探讨了EMT与炎症性肠病和结肠炎相关性结直肠癌之间的关系, 对结肠炎相关性结直肠癌的临床和研究有重要价值.
引文著录: 陈倩云, 张丽娟, 范恒, 杨佳, 徐萌, 彭颖. EMT与炎症性肠病和结肠炎相关性结直肠癌的研究进展. 世界华人消化杂志 2016; 24(16): 2498-2505
Revised: April 22, 2016
Accepted: May 3, 2016
Published online: June 8, 2016
Chronic inflammation can induce the formation of a wide variety of tumors. Inflammatory bowel disease is one of the major risk factors for colorectal cancer. Epithelial-mesenchymal transition (EMT) can promote the invasion and metastasis of a variety of cancer cells, including colorectal cancer cells. Different kinds of inflammatory cytokines produced in inflammatory bowel disease could mediate the activation of EMT through a series of pathways, and thus promote the occurrence and development of colitis associated colorectal cancer. This article explores the relationship among EMT, inflammatory bowel disease and colitis associated colorectal cancer, with an aim to provide new ideas and methods for the clinical treatment of colitis associated colorectal cancer.
- Citation: Chen QY, Zhang LJ, Fan H, Yang J, Xu M, Peng Y. Epithelial-mesenchymal transition, inflammatory bowel disease and colitis associated colorectal cancer. Shijie Huaren Xiaohua Zazhi 2016; 24(16): 2498-2505
- URL: https://www.wjgnet.com/1009-3079/full/v24/i16/2498.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i16.2498
结直肠癌(colorectal cancer, CRC)是世界第三大高发癌症, 在发达国家和我国恶性肿瘤中位列第二, 在全球疾病死因中排列第四[1]. CRC第Ⅰ-ⅡC阶段的5年生存率为59%-74%, 而到晚期第Ⅳ阶段的5年生存率仅为6%[2]. 发生CRC最主要的风险因素包括炎症性肠病(inflammatory bowel disease, IBD), 家族性腺瘤性息肉病和遗传性非息肉性结直肠癌综合征. 其中IBD与结肠炎相关性结直肠癌(colitis associated colorectal cancer, CAC)关系的研究一直备受瞩目[3].
IBD是一种病因尚不十分清楚的慢性非特异性肠道炎症性疾病, 主要包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD). 众所周知, 多种肿瘤的发生都是由慢性炎症性疾病引发, 慢性炎症通过提供细胞因子、趋化因子、生长因子等多种生物活性因子而成为肿瘤的诱导者. IBD相关性肿瘤就是一个从局部的、长期的炎症发展为肿瘤的典型. IBD发展至CRC往往要经历"炎症-不典型增生-癌症"的序列演进. 据统计, 肠道感染和慢性炎症导致结直肠肿瘤的比例达到25%. UC和CD能明显增加患者患CAC的风险, 而相比于CD, UC患者发展为CAC的风险更大, 且IBD男性患者的CAC发病率更高[3]. Eaden等[4]和Rubin等[5]基于116例来自几个不同国家的UC患者, 分析发现其患CAC的比例达到3.7%, 且随着UC病程的延长, 其累计风险增加. UC患者病程10年、20年、30年相对应的患CAC的风险分别增加2%, 8%, 18%, 而CD患者30年病程的累计风险达8%. Jess等[6]报道, UC使CAC的发病率增加2.4倍. 此外, IBD炎症的病变部位也与患CAC的风险密切相关, 相比于直肠炎和直肠乙状结肠炎, 左半结肠炎和全结肠炎患者发展成CAC的风险更大[3].
上皮间质转化(epithelial-mesenchymal transition, EMT)是指上皮细胞通过特定的程序转化为具有间质表型细胞的生物学过程. EMT主要特征是上皮标志物的丢失和间质特性的获得. 表现为上皮细胞极性, 细胞间黏附作用和细胞连接的缺失, 其中最具代表的是维持细胞极性和细胞间紧密连接的E-钙黏蛋白(E-cadherin)表达下调, 细胞角蛋白细胞骨架转化为波形蛋白(vimentin)为主的细胞骨架及形态上具有间质细胞的特征, 从而获得较高的迁移和侵袭、抗凋亡和降解细胞外基质的能力. EMT细胞生物学进程主要参与胚胎发育和器官的形成, 器官的纤维化和组织(创伤)的修复重建, 肿瘤的侵袭转移等. Thiery等[7]认为, EMT过程不仅与慢性间质性炎症密切相关, 其也可能是上皮细胞对微环境改变所作出的适应性反应. 因此, EMT在生理过程和病理性反应中均发挥着重要作用.
EMT过程是由一系列细胞因子和生长因子共同调节完成. 在其进程中, 上游信号通过肿瘤基质的生长因子如表皮生长因子(epidermal growth factor, EGF), 转化生长因子(transforming growth factor, TGF-β), 成纤维细胞生长因子(fibroblast growth factor, FGF), 血管内皮生长因子(vascular endothelial growth factor, VEGF)等, 导致转录因子锌指蛋白E盒(Zeb)、Twist、Snail1/2、Slug等的活化, 直接或间接地抑制E-钙黏蛋白的表达, 从而破坏细胞与细胞间的紧密连接, 细胞骨架和连接支架的稳定性, 促进EMT的发生发展[8-11]. 同时, EMT的发生还涉及一系列信号转导通路的协同作用, 如Wnt/β-连环蛋白(β-catenin)通路, TGF-β/Smad通路, PI3K/AKT通路, 整合素通路, Notch通路, Src通路, IL-6/STAT3通路以及核因子-κB(nuclear factor-κB, NF-κB)通路等[12]. 各种细胞外信号通过与细胞表面的特异性受体结合, 将信号传入胞内, 再通过相应的胞内信号转导通路, 活化核内的转录因子, 调控基因表达, 最终实现EMT.
近年来, EMT在肿瘤中的研究取得了较大进展, 研究[7,13-16]显示, EMT可使肿瘤细胞抵抗凋亡, 获得侵袭和转移能力, 而且能促进肿瘤干细胞的形成和提高肿瘤细胞的耐药性, 最终在肿瘤晚期促进肿瘤的远处侵袭和转移. 然而, EMT是一个瞬时性动态变化的过程, 其可能只在肿瘤细胞中一个微小的部位运行, 这意味着如果未采集到EMT表达过程的肿瘤组织学样本, 将无法识别并检测EMT过程中基因组的改变[7]. Koay等[17]研究显示, 原发性肿瘤和其相应的转移瘤表现出上皮间质的混合表型, 位于肿瘤中心的细胞E-钙黏蛋白和β-catenin的表达阳性, 而外围的肿瘤细胞则呈现出典型的EMT表型特征, 表现为细胞表面E-钙黏蛋白的丢失和波形蛋白的上调. 故目前关于EMT的研究尚集中在体外实验及动物模型中, 主要原因之一在于在临床患者中捕获EMT这一瞬时性的过程仍是一个有待突破的技术性难题.
既然肿瘤的侵袭转移属性与EMT的活化密切相关, 而多种肿瘤的发生又由慢性炎症和感染性疾病所诱发, 如NF-κB、STAT3、肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、TGF-β、白介素(interleukin, IL)-1β、IL-6、IL-10等启动因子均参与了肿瘤相关性炎症(cancer-related inflammation, CRI), 那么UC引起的慢性炎症与EMT之间又有怎样的联系呢? 研究[18]发现, IBD患者的肠黏膜组织中可发现高水平的IL-6、TGF-β; 在UC患者肠黏膜中TNF-α水平与黏膜的肿胀程度呈正相关. 而促炎症性细胞因子TNF-α、IL-6的增强和炎症介质TGF-β均能引发EMT的活化. 其中, TGF-β通过调节EMT参与胚胎形成、纤维化和肿瘤的进展[19-22]; TNF-α、IL-6则通过协同推进TGF-β信号通路, 间接促进EMT进展[23,24]. 同时, TNF-α和IL-6还能促进炎症通路NF-κB的活化, 调节EMT过程中转录因子Zeb1/2、Twist、Snail1/2的表达[25,26]. 此外, TNF-α也能通过刺激IL-8的表达, 从而加快TGF-β诱导EMT[23]. EMT的发生和维持也需要炎症通路NF-κB的活化. NF-κB通过上调转录因子Zeb1/2、Snail等, 从而抑制E-钙黏蛋白, 桥粒蛋白等上皮特定基因的表达, 促进波形蛋白等间质特性基因的表达[27,28]. 因此, 有人认为抑制NF-κB通路通过下调EMT进程, 可能会部分阻断肿瘤的进展, 入侵和转移[12]. 此外, 研究[29]还发现炎症反应过程中产生的活性氧(reactive oxygen species, ROS)亦可以促进EMT的活化, 这可能与ROS诱导TGF-β表达, 活化TGF-β/Smad信号通路有关. 近期Zhao等[30]对29例活动期和非活动期UC患者肠黏膜组织切片进行研究发现, EMT信号通路的标记基因和蛋白仅在UC活动期患者中显著上调, 提示这部分患者有向CAC转化的可能. 由此我们推测, UC慢性炎症过程中炎症因子的上调, 通过激活相关炎症信号通路, 调节EMT相关转录因子, 从而诱导和促进EMT的发生, 这可能是UC向CAC转化的关键环节.
EMT与CD之间亦存在着密切联系. 肠纤维化是CD患者的一个主要并发症. 而研究发现, EMT是激活成纤维细胞的关键因素, 其在心脏、肺、肝、肾、肠等多种器官的纤维化过程中发挥着重要作用[31-35]. Flier等[35]发现, EMT可以直接促进TNBS诱导的CD大鼠模型肠纤维化, 而无论在体外还是TNBS模型大鼠体内, TGF-β拮抗剂均能抑制EMT和肠道纤维化. Scharl等[36]研究显示, EMT参与IBD的发病机制, 尤其是CD引起的肠纤维化和瘘管的形成, 故抑制EMT可能对改善IBD的临床预后有重要意义. 近年来, microRNA在EMT和IBD中的作用备受关注. Gregory等[37]发现miR-200和miR-205能抑制EMT转录因子Zeb1和Zeb2, 从而抑制EMT. 也有研究显示过表达miR-200b, 一方面作用于Zeb1增强E-钙黏蛋白表达, 另一方面通过调节Smad2减少波形蛋白表达, 从而起到显著抑制EMT的作用[38]. Chen等[39]体外实验发现miR-200b能改善TGF-β诱导的EMT和肠上皮细胞纤维化, 而在CD肠纤维化患者血清中可检测到过表达的miR-200b, 提示miR-200b可作为临床CD并发肠纤维化的一个诊断标志物. 目前关于EMT与CD关系的研究尚集中在引起肠纤维化方面, 而EMT是否能介导CD向CAC转化仍不十分清楚.
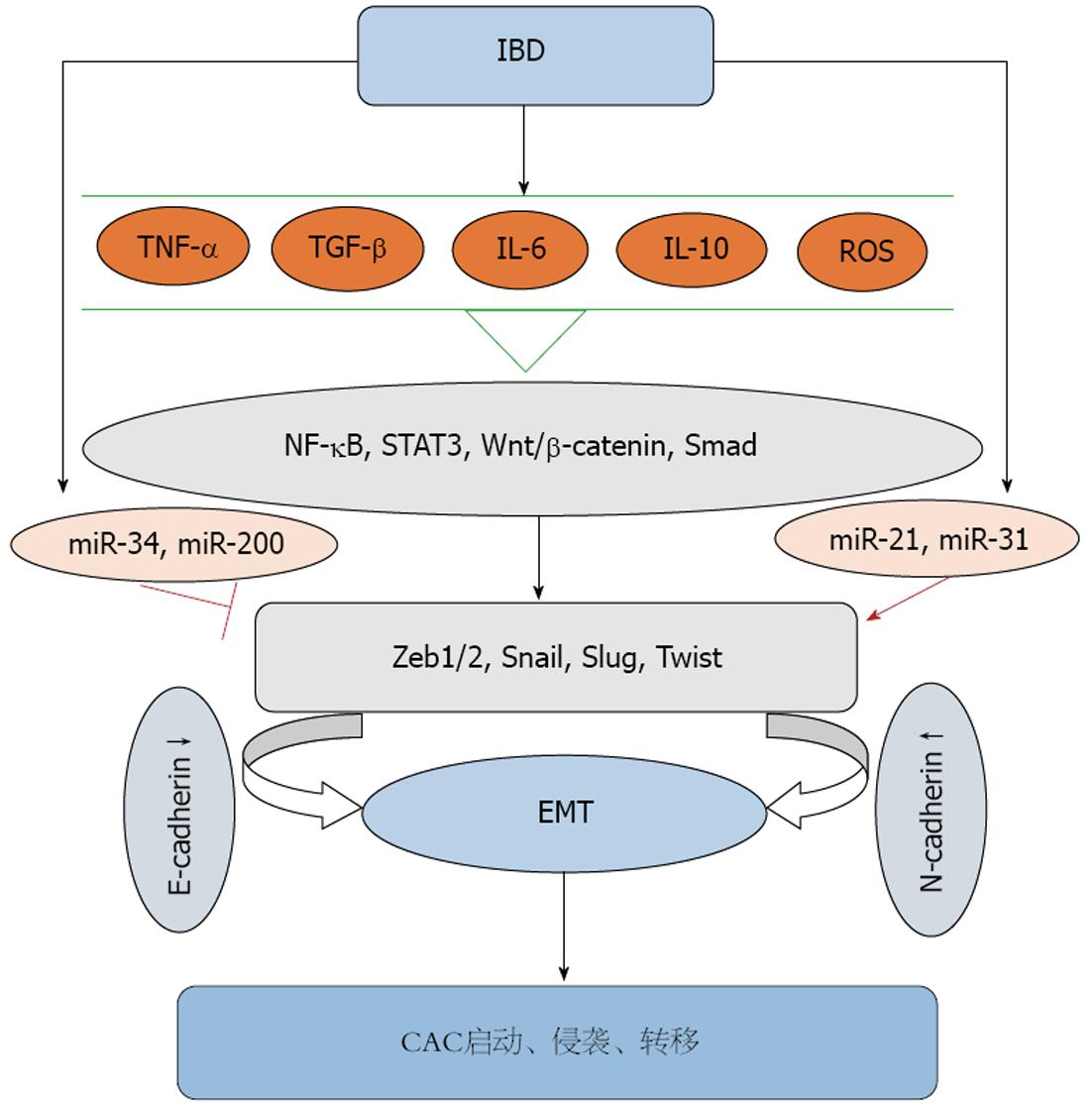
慢性炎症参与了多种肿瘤的启动、增殖、侵袭、转移和凋亡等各个阶段. 而EMT是"炎-癌"链中的重要事件. EMT促进CAC的发生, 发展和转移. 而多种参与炎症的细胞因子在EMT介导的CAC中亦发挥着关键作用. 大量研究[40]证明, TGF-β通过各种直接或间接途径参与EMT, 促进CAC的进展. TGF-β能调控炎症发展, 诱导肿瘤细胞凋亡, 同时也是在炎症微环境中促进上皮细胞向间质细胞转化的潜在诱导因素[41]. 同时, TGF-β能诱导EMT中Zeb1、Zeb2、Snail等转录因子的表达, 参与结肠上皮EMT的启动和发生. Grivennikov等[42]证实, IL-6能通过细胞内TGF-β信号通路增加结肠上皮细胞的恶性转变; 而IL-10在活化STAT3后亦能通过TGF-β信号启动上述转变[43]. 又有研究[44]发现, 在IL-10缺失的CAC小鼠模型中, 结肠癌的发生率仅为65%, 且相比于野生型小鼠, CAC小鼠中TGF-β水平明显增高, 这进一步提示IL-10和TGF-β与CAC的发生密切相关. 在IBD小鼠模型中, TNF-α、IL-6两种促炎性细胞因子均参与了CAC的启动和进展[45,46]. TNF-α一方面能抑制肿瘤细胞凋亡, 促进肿瘤侵袭和转移; 另一方面依赖于细胞内NF-κB信号通路, 促进结肠上皮细胞的增殖分化, 从而在CAC中扮演重要角色[47]. 此外, TNF-α能抑制糖原合成激酶-3β(glycogen synthesis kinase-3β, GSK-3β), 活化Wnt/β-catenin信号通路, 从而促进结肠上皮细胞向间质细胞转化, 而这一转化过程是结肠癌得以进展所必需的. Wang等[48]体外实验证明, TNF-α通过增加转录因子Snail的表达, 促进人结肠癌(human colon tumor, HCT)116细胞E-钙黏蛋白表达的减少和N-钙黏蛋白表达量的增加, 诱导HCT116细胞的EMT过程, 促进结直肠癌的入侵和转移, 这一级联反应说明Snail转录因子对TNF-α诱导EMT的发生至关重要. 由此可见, IBD中的炎性细胞因子可以活化EMT, EMT又能启动CAC, 并在CAC的晚期阶段促进CAC的侵袭和转移(图1).
microRNAs(miRNAs)是一类存在于真核生物中的内源性非编码小分子单链RNAs, 长约19-24个核苷酸. miRNAs主要通过与特定的靶信使RNA(mRNA)的3'非编码区直接结合, 降解靶RNA或抑制其翻译, 进而在转录后水平影响目的基因的表达. miRNAs参与生命过程中一系列重要进程, 包括早期发育、细胞增殖、分化、凋亡和新陈代谢等. 多种miRNAs, 如miR-200家族、miR-205、miR-155等均能参与诱发或逆转EMT过程.
研究[49]发现, miRNAs一方面能调控癌基因和肿瘤抑制因子的表达, 另一方面, 又能自身充当癌基因和肿瘤抑制因子的功能, 从而参与CRC的发病. 部分miRNAs能调节E-钙黏蛋白, 波形蛋白, Zeb的表达, 调控EMT参与CRC的发病. Cai等[50]在体外用TGF-β刺激人结肠癌细胞(HT-29)建立EMT模型, 并采用miRNAs抑制因子敲除miRNAs, 从而监测miRNAs对EMT的影响. 研究证实, 敲除miR-200b能明显减少上皮标志物的表达, 增加间质型细胞标志物的表达, 提示在HT-29细胞中, miR-200b通过抑制Zeb1的表达抑制EMT过程. Cottonham等[51]用TGF-β诱导LIM1863大肠癌细胞株EMT过程, 发现显著升高的miR-21和miR-31能促进这一过程. 此外, miR-9和miR-335通过直接抑制E-钙黏蛋白和SOX4(SRY-related HMG-box4), 促进CRC的转移[52]. 人体抑癌基因p53能明显诱导miR-34家族成员的表达, 而miR-34a和miR-34b/c直接抑制诱导EMT的转录因子Snail, 参与抑制EMT[53,54]. Rokavec等[55]建立氧化偶氮甲烷联合葡聚糖硫酸钠(AOM/DSS)诱导的结肠炎相关性肠道肿瘤模型发现, 相比于野生小鼠, miR-34a缺陷的小鼠中IL-6R、p-STAT3、Snail上调, 肿瘤得以进展. 故p53依赖的miR-34a能通过抑制IL-6R/STAT3/miR-34a反馈环来抑制肿瘤进展.
EMT是IBD与CAC发生发展的中间环节, EMT在IBD与CAC之间搭建了良好的桥梁, 使"炎-癌"序列得以进展. 鉴于EMT在IBD和CAC进程及肿瘤的侵袭转移中扮演的关键角色, 探索新的EMT调节因子, 阻断或抑制EMT的关键调控因素, 可以阻断炎症-肿瘤过程的进展, 对减缓或抑制CAC的发生发展及远处转移有重要临床意义. 同时更好地阐明EMT与IBD和CAC之间的关系, 也能为CAC的治疗提供新的思路和方法. 但EMT是否是CAC发生发展的唯一环节尚未证实, EMT参与结直肠癌变的具体机制仍需进一步探讨研究. 同时, 在人体病变部位捕获EMT这一瞬时性过程的技术性难题有待攻克.
结直肠癌是消化系统常见的恶性肿瘤, 其发病率高, 死亡率亦高. 其中, 炎症性肠病是引发结直肠癌最主要的风险因素之一, 结肠炎相关性结直肠癌的发病机制及临床诊断、治疗思路一直是人们关注的重点.
周彤, 教授, 主任医师, 川北医学院附属医院普通外科
上皮间质转化(epithelial-mesenchymal transition, EMT)在生理过程和病理性反应中均发挥着重要作用. 目前关于EMT的研究热点主要集中在肿瘤方面, EMT活化可促进肿瘤的侵袭和转移. 而慢性炎症环境中的多种炎性因子上调均参与EMT的活化, 这是否是炎症性肠病向结肠炎相关性结直肠癌转化的关键环节, 有待进一步探讨.
EMT在肿瘤发生发展中的作用一直备受瞩目. 本文从EMT活化的一系列途径入手, 探讨了其在炎症性肠病发展为结肠炎相关性结直肠癌过程中可能的作用机制, 为结肠炎相关性结直肠癌的发生、发展及治疗均有较好的指导意义.
本文通过综述EMT与炎症性肠病和结肠炎相关性结直肠癌的研究进展, 探讨EMT可能是炎症性肠病引发结肠炎相关性结直肠癌的关键环节, 设想干预这一环节是否能减少结肠炎相关性结直肠癌的发生发展, 为结直肠癌的治疗提供新思路和方法.
肿瘤相关性炎症: 是指与肿瘤发生、进展具有密切相关性的一类炎症, 尤其是慢性炎症. 其中炎症调节因子及其炎性效应细胞在炎症与肿瘤相互关系中发挥着重要作用.
本文较为详细地探讨了EMT与炎症性肠病和结肠炎相关性结直肠癌之间的关系, 为结直肠癌的进一步深入研究提供了新的理论依据. 文章思路新颖, 文笔流畅, 内容较好.
编辑: 于明茜 电编:闫晋利
| 1. | Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-2917. [PubMed] [DOI] |
| 2. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013. CA Cancer J Clin. 2013;63:11-30. [PubMed] [DOI] |
| 3. | Sobczak M, Fabisiak A, Murawska N, Wesołowska E, Wierzbicka P, Wlazłowski M, Wójcikowska M, Zatorski H, Zwolińska M, Fichna J. Current overview of extrinsic and intrinsic factors in etiology and progression of inflammatory bowel diseases. Pharmacol Rep. 2014;66:766-775. [PubMed] [DOI] |
| 4. | Eaden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut. 2001;48:526-535. [PubMed] [DOI] |
| 5. | Rubin DC, Shaker A, Levin MS. Chronic intestinal inflammation: inflammatory bowel disease and colitis-associated colon cancer. Front Immunol. 2012;3:107. [PubMed] [DOI] |
| 6. | Jess T, Rungoe C, Peyrin-Biroulet L. Risk of colorectal cancer in patients with ulcerative colitis: a meta-analysis of population-based cohort studies. Clin Gastroenterol Hepatol. 2012;10:639-645. [PubMed] [DOI] |
| 7. | Thiery JP, Acloque H, Huang RY, Nieto MA. Epithelial-mesenchymal transitions in development and disease. Cell. 2009;139:871-890. [PubMed] [DOI] |
| 8. | Spaderna S, Schmalhofer O, Wahlbuhl M, Dimmler A, Bauer K, Sultan A, Hlubek F, Jung A, Strand D, Eger A. The transcriptional repressor ZEB1 promotes metastasis and loss of cell polarity in cancer. Cancer Res. 2008;68:537-544. [PubMed] [DOI] |
| 9. | Yang J, Mani SA, Donaher JL, Ramaswamy S, Itzykson RA, Come C, Savagner P, Gitelman I, Richardson A, Weinberg RA. Twist, a master regulator of morphogenesis, plays an essential role in tumor metastasis. Cell. 2004;117:927-939. [PubMed] [DOI] |
| 10. | Friedl P, Alexander S. Cancer invasion and the microenvironment: plasticity and reciprocity. Cell. 2011;147:992-1009. [PubMed] [DOI] |
| 11. | Sánchez-Tilló E, Lázaro A, Torrent R, Cuatrecasas M, Vaquero EC, Castells A, Engel P, Postigo A. ZEB1 represses E-cadherin and induces an EMT by recruiting the SWI/SNF chromatin-remodeling protein BRG1. Oncogene. 2010;29:3490-3500. [PubMed] [DOI] |
| 12. | Zhu QC, Gao RY, Wu W, Qin HL. Epithelial-mesenchymal transition and its role in the pathogenesis of colorectal cancer. Asian Pac J Cancer Prev. 2013;14:2689-2698. [PubMed] [DOI] |
| 13. | Gal A, Sjöblom T, Fedorova L, Imreh S, Beug H, Moustakas A. Sustained TGF beta exposure suppresses Smad and non-Smad signalling in mammary epithelial cells, leading to EMT and inhibition of growth arrest and apoptosis. Oncogene. 2008;27:1218-1230. [PubMed] [DOI] |
| 14. | Mani SA, Guo W, Liao MJ, Eaton EN, Ayyanan A, Zhou AY, Brooks M, Reinhard F, Zhang CC, Shipitsin M. The epithelial-mesenchymal transition generates cells with properties of stem cells. Cell. 2008;133:704-715. [PubMed] [DOI] |
| 15. | Morel AP, Lièvre M, Thomas C, Hinkal G, Ansieau S, Puisieux A. Generation of breast cancer stem cells through epithelial-mesenchymal transition. PLoS One. 2008;3:e2888. [PubMed] [DOI] |
| 16. | Singh A, Settleman J. EMT, cancer stem cells and drug resistance: an emerging axis of evil in the war on cancer. Oncogene. 2010;29:4741-4751. [PubMed] [DOI] |
| 17. | Koay MH, Crook M, Stewart CJ. Cyclin D1, E-cadherin and beta-catenin expression in FIGO Stage IA cervical squamous carcinoma: diagnostic value and evidence for epithelial-mesenchymal transition. Histopathology. 2012;61:1125-1133. [PubMed] [DOI] |
| 18. | Landskron G, De la Fuente M, Thuwajit P, Thuwajit C, Hermoso MA. Chronic inflammation and cytokines in the tumor microenvironment. J Immunol Res. 2014;2014:149185. [PubMed] [DOI] |
| 19. | Xu J, Lamouille S, Derynck R. TGF-beta-induced epithelial to mesenchymal transition. Cell Res. 2009;19:156-172. [PubMed] [DOI] |
| 20. | Willis BC, Liebler JM, Luby-Phelps K, Nicholson AG, Crandall ED, du Bois RM, Borok Z. Induction of epithelial-mesenchymal transition in alveolar epithelial cells by transforming growth factor-beta1: potential role in idiopathic pulmonary fibrosis. Am J Pathol. 2005;166:1321-1332. [PubMed] [DOI] |
| 21. | Morrison CD, Parvani JG, Schiemann WP. The relevance of the TGF-β Paradox to EMT-MET programs. Cancer Lett. 2013;341:30-40. [PubMed] [DOI] |
| 22. | Yamagishi T, Ando K, Nakamura H, Nakajima Y. Expression of the Tgfβ2 gene during chick embryogenesis. Anat Rec (Hoboken). 2012;295:257-267. [PubMed] [DOI] |
| 23. | Bates RC, Mercurio AM. Tumor necrosis factor-alpha stimulates the epithelial-to-mesenchymal transition of human colonic organoids. Mol Biol Cell. 2003;14:1790-1800. [PubMed] [DOI] |
| 24. | Abulaiti A, Shintani Y, Funaki S, Nakagiri T, Inoue M, Sawabata N, Minami M, Okumura M. Interaction between non-small-cell lung cancer cells and fibroblasts via enhancement of TGF-β signaling by IL-6. Lung Cancer. 2013;82:204-213. [PubMed] [DOI] |
| 25. | Maier HJ, Schmidt-Strassburger U, Huber MA, Wiedemann EM, Beug H, Wirth T. NF-kappaB promotes epithelial-mesenchymal transition, migration and invasion of pancreatic carcinoma cells. Cancer Lett. 2010;295:214-228. [PubMed] [DOI] |
| 26. | Kumar M, Allison DF, Baranova NN, Wamsley JJ, Katz AJ, Bekiranov S, Jones DR, Mayo MW. NF-κB regulates mesenchymal transition for the induction of non-small cell lung cancer initiating cells. PLoS One. 2013;8:e68597. [PubMed] [DOI] |
| 27. | Wu ST, Sun GH, Hsu CY, Huang CS, Wu YH, Wang HH, Sun KH. Tumor necrosis factor-α induces epithelial-mesenchymal transition of renal cell carcinoma cells via a nuclear factor kappa B-independent mechanism. Exp Biol Med (Maywood). 2011;236:1022-1029. [PubMed] [DOI] |
| 28. | Tang FY, Pai MH, Chiang EP. Consumption of high-fat diet induces tumor progression and epithelial-mesenchymal transition of colorectal cancer in a mouse xenograft model. J Nutr Biochem. 2012;23:1302-1313. [PubMed] [DOI] |
| 29. | Wang Z, Li Y, Sarkar FH. Signaling mechanism(s) of reactive oxygen species in Epithelial-Mesenchymal Transition reminiscent of cancer stem cells in tumor progression. Curr Stem Cell Res Ther. 2010;5:74-80. [PubMed] [DOI] |
| 30. | Zhao X, Fan J, Zhi F, Li A, Li C, Berger AE, Boorgula MP, Barkataki S, Courneya JP, Chen Y. Mobilization of epithelial mesenchymal transition genes distinguishes active from inactive lesional tissue in patients with ulcerative colitis. Hum Mol Genet. 2015;24:4615-4624. [PubMed] [DOI] |
| 31. | Zeisberg EM, Tarnavski O, Zeisberg M, Dorfman AL, McMullen JR, Gustafsson E, Chandraker A, Yuan X, Pu WT, Roberts AB. Endothelial-to-mesenchymal transition contributes to cardiac fibrosis. Nat Med. 2007;13:952-961. [PubMed] [DOI] |
| 32. | Kim KK, Kugler MC, Wolters PJ, Robillard L, Galvez MG, Brumwell AN, Sheppard D, Chapman HA. Alveolar epithelial cell mesenchymal transition develops in vivo during pulmonary fibrosis and is regulated by the extracellular matrix. Proc Natl Acad Sci USA. 2006;103:13180-13185. [PubMed] [DOI] |
| 33. | Carew RM, Wang B, Kantharidis P. The role of EMT in renal fibrosis. Cell Tissue Res. 2012;347:103-116. [PubMed] [DOI] |
| 34. | Zeisberg M, Yang C, Martino M, Duncan MB, Rieder F, Tanjore H, Kalluri R. Fibroblasts derive from hepatocytes in liver fibrosis via epithelial to mesenchymal transition. J Biol Chem. 2007;282:23337-23347. [PubMed] [DOI] |
| 35. | Flier SN, Tanjore H, Kokkotou EG, Sugimoto H, Zeisberg M, Kalluri R. Identification of epithelial to mesenchymal transition as a novel source of fibroblasts in intestinal fibrosis. J Biol Chem. 2010;285:20202-20212. [PubMed] [DOI] |
| 36. | Scharl M, Weber A, Fürst A, Farkas S, Jehle E, Pesch T, Kellermeier S, Fried M, Rogler G. Potential role for SNAIL family transcription factors in the etiology of Crohn's disease-associated fistulae. Inflamm Bowel Dis. 2011;17:1907-1916. [PubMed] [DOI] |
| 37. | Gregory PA, Bert AG, Paterson EL, Barry SC, Tsykin A, Farshid G, Vadas MA, Khew-Goodall Y, Goodall GJ. The miR-200 family and miR-205 regulate epithelial to mesenchymal transition by targeting ZEB1 and SIP1. Nat Cell Biol. 2008;10:593-601. [PubMed] [DOI] |
| 38. | Chen Y, Xiao Y, Ge W, Zhou K, Wen J, Yan W, Wang Y, Wang B, Qu C, Wu J. miR-200b inhibits TGF-β1-induced epithelial-mesenchymal transition and promotes growth of intestinal epithelial cells. Cell Death Dis. 2013;4:e541. [PubMed] [DOI] |
| 39. | Chen Y, Ge W, Xu L, Qu C, Zhu M, Zhang W, Xiao Y. miR-200b is involved in intestinal fibrosis of Crohn's disease. Int J Mol Med. 2012;29:601-606. [PubMed] |
| 40. | Bates RC, Mercurio AM. The epithelial-mesenchymal transition (EMT) and colorectal cancer progression. Cancer Biol Ther. 2005;4:365-370. [PubMed] [DOI] |
| 41. | López-Novoa JM, Nieto MA. Inflammation and EMT: an alliance towards organ fibrosis and cancer progression. EMBO Mol Med. 2009;1:303-314. [PubMed] [DOI] |
| 42. | Grivennikov S, Karin E, Terzic J, Mucida D, Yu GY, Vallabhapurapu S, Scheller J, Rose-John S, Cheroutre H, Eckmann L. IL-6 and Stat3 are required for survival of intestinal epithelial cells and development of colitis-associated cancer. Cancer Cell. 2009;15:103-113. [PubMed] [DOI] |
| 43. | Hoentjen F, Sartor RB, Ozaki M, Jobin C. STAT3 regulates NF-kappaB recruitment to the IL-12p40 promoter in dendritic cells. Blood. 2005;105:689-696. [PubMed] [DOI] |
| 44. | Sturlan S, Oberhuber G, Beinhauer BG, Tichy B, Kappel S, Wang J, Rogy MA. Interleukin-10-deficient mice and inflammatory bowel disease associated cancer development. Carcinogenesis. 2001;22:665-671. [PubMed] [DOI] |
| 45. | Matsumoto S, Hara T, Mitsuyama K, Yamamoto M, Tsuruta O, Sata M, Scheller J, Rose-John S, Kado S, Takada T. Essential roles of IL-6 trans-signaling in colonic epithelial cells, induced by the IL-6/soluble-IL-6 receptor derived from lamina propria macrophages, on the development of colitis-associated premalignant cancer in a murine model. J Immunol. 2010;184:1543-1551. [PubMed] [DOI] |
| 46. | Popivanova BK, Kitamura K, Wu Y, Kondo T, Kagaya T, Kaneko S, Oshima M, Fujii C, Mukaida N. Blocking TNF-alpha in mice reduces colorectal carcinogenesis associated with chronic colitis. J Clin Invest. 2008;118:560-570. [PubMed] |
| 47. | Greten FR, Eckmann L, Greten TF, Park JM, Li ZW, Egan LJ, Kagnoff MF, Karin M. IKKbeta links inflammation and tumorigenesis in a mouse model of colitis-associated cancer. Cell. 2004;118:285-296. [PubMed] [DOI] |
| 48. | Wang H, Wang HS, Zhou BH, Li CL, Zhang F, Wang XF, Zhang G, Bu XZ, Cai SH, Du J. Epithelial-mesenchymal transition (EMT) induced by TNF-α requires AKT/GSK-3β-mediated stabilization of snail in colorectal cancer. PLoS One. 2013;8:e56664. [PubMed] [DOI] |
| 49. | de Krijger I, Mekenkamp LJ, Punt CJ, Nagtegaal ID. MicroRNAs in colorectal cancer metastasis. J Pathol. 2011;224:438-447. [PubMed] [DOI] |
| 50. | Cai ZG, Zhang SM, Zhang H, Zhou YY, Wu HB, Xu XP. Aberrant expression of microRNAs involved in epithelial-mesenchymal transition of HT-29 cell line. Cell Biol Int. 2013;37:669-674. [PubMed] [DOI] |
| 51. | Cottonham CL, Kaneko S, Xu L. miR-21 and miR-31 converge on TIAM1 to regulate migration and invasion of colon carcinoma cells. J Biol Chem. 2010;285:35293-35302. [PubMed] [DOI] |
| 52. | Sreekumar R, Sayan BS, Mirnezami AH, Sayan AE. MicroRNA Control of Invasion and Metastasis Pathways. Front Genet. 2011;2:58. [PubMed] [DOI] |
| 53. | Siemens H, Jackstadt R, Hünten S, Kaller M, Menssen A, Götz U, Hermeking H. miR-34 and SNAIL form a double-negative feedback loop to regulate epithelial-mesenchymal transitions. Cell Cycle. 2011;10:4256-4271. [PubMed] [DOI] |
| 54. | Kim NH, Kim HS, Li XY, Lee I, Choi HS, Kang SE, Cha SY, Ryu JK, Yoon D, Fearon ER. A p53/miRNA-34 axis regulates Snail1-dependent cancer cell epithelial-mesenchymal transition. J Cell Biol. 2011;195:417-433. [PubMed] [DOI] |
| 55. | Rokavec M, Öner MG, Li H, Jackstadt R, Jiang L, Lodygin D, Kaller M, Horst D, Ziegler PK, Schwitalla S. IL-6R/STAT3/miR-34a feedback loop promotes EMT-mediated colorectal cancer invasion and metastasis. J Clin Invest. 2014;124:1853-1867. [PubMed] [DOI] |