修回日期: 2016-04-08
接受日期: 2016-04-25
在线出版日期: 2016-05-28
乙型肝炎病毒(hepatitis B virus, HBV)是全球公众健康的首要危险因素, 目前现有的抗病毒治疗方案只能抑制HBV复制, 不能完全根除HBV. 由于抗丙型肝炎病毒(hepatitis C virus, HCV)的直接抗病毒药物(direct anti-viral agents, DAAs)陆续上市, 国外许多大的制药公司转向投入抗HBV药物研制. 近两年登陆http://www.hepb.org/professionals/hbf_drug_watch.htm网站, 抗HBV药物研制更新较以前明显增快. 本文将在上述网站上可以查证到的已上市和在研究的抗HBV药物种类、作用机制及未来市场前景进行简要述评及总结.
核心提示: 各大制药公司重新高度重视抗乙型肝炎病毒(hepatitis B virus, HBV)药物的研发, 通过各类新药的研发与上市, 改变现有抗HBV治疗方案效果欠佳的局面, 对HBV感染者从预防至治疗阶段全面指导治疗, 提高治愈率.
引文著录: 冷雪君, 颜学兵. 从"HBF drug watch"看抗HBV药物研制的现状及进展. 世界华人消化杂志 2016; 24(15): 2336-2346
Revised: April 8, 2016
Accepted: April 25, 2016
Published online: May 28, 2016
Hepatitis B virus (HBV) infection is a major public health threat globally. Present therapies can only suppress viral replication instead of viral elimination. With the application of direct anti-viral agents (DAAs) to hepatitis C virus (HCV) infection, many pharmaceutical industries pay their attention to investigating anti-HBV drugs. As a result, the update of anti-HBV drugs at the website http://www.hepb.org/professionals/hbf_drug_watch.htm speeds up. In this review, we summarize all the drugs available in the market and those in clinical trials based on this website.
- Citation: Leng XJ, Yan XB. Status and development of anti-HBV drugs based on "HBF drug watch". Shijie Huaren Xiaohua Zazhi 2016; 24(15): 2336-2346
- URL: https://www.wjgnet.com/1009-3079/full/v24/i15/2336.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i15.2336
乙型肝炎病毒(hepatitis B virus, HBV)感染是全球公众健康的首要危险因素, 目前现有的抗病毒治疗方案均只能抑制HBV复制, 不能完全根除HBV感染, 抗病毒效果欠佳[1]. 随着近3年抗丙型肝炎病毒(hepatitis C virus, HCV)直接抗病毒药物(direct anti-viral agents, DAAs)陆续上市, 国外大的制药公司继而投入抗HBV的治疗药物的研制, 以前登陆http://www.hepb.org/professionals/hbf_drug_watch.htm网站, 药物研制的pipeline更新较慢, 但近两年该网站上抗HBV药物更新较以前明显增快. 最近一次更新于2015-11-12. 根据网站上pipeline, 目前抗HBV药物分为4大类: (1)干扰素类(interferon, IFN); (2)核苷类似物(nucleoside analogues, NAs); (3)非核苷类抗病毒药物(non-nucleoside antivirals, NNAs); (4)非IFN的免疫增强剂(non-interferon immune enhancers). 本文将在上述网站上可以查证到的已上市和在研的抗HBV药物的种类、作用机制及未来市场前景进行简要述评及总结.
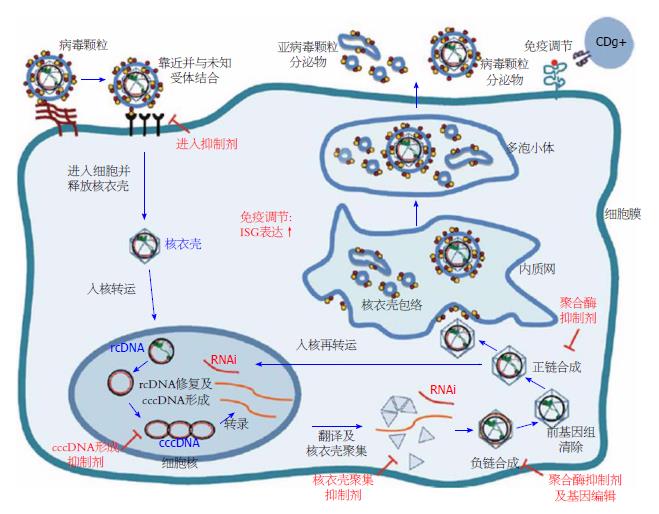
HBV在细胞内的生命周期大致包括: 病毒与受体结合, 进入细胞并释放核衣壳, 病毒转入进细胞核, 转录并翻译合成共价闭合环状DNA(covalently closed circular DNA, cccDNA), 在内质网中形成核衣壳包膜, 多泡小体形成且最后分泌亚病毒颗粒和病毒颗粒. 抗HBV药物研制靶点主要是针对HBV复制各期的抑制剂, 如: HBV进入抑制剂, 抑制HBV cccDNA形成, 抑制聚集, HBV聚合酶抑制和目标基因编辑及针对细胞表面受体的免疫调节, 增加免疫血清球蛋白(immune serum globulin, ISG)表达[2](图1). 慢性乙型肝炎(chronic hepatitis B, CHB)感染的动态自然过程涉及到宿主免疫系统和病毒之间的复杂相互作用. 慢性HBV感染者部分发展为肝硬化, 发展为肝细胞肝癌(hepatocellular carcinoma, HCC)风险比正常人高出100倍[3-5].
HBV疾病进展的临床表现多样, 从亚临床非活动携带状态, 到进展性慢性肝炎、失代偿性肝硬化, 并最终发展为HCC. 约超过5亿人口持续感染HBV或HCV, 并且最终极有可能发展为慢性肝脏疾病、肝硬化和HCC. 美国美国食品和药品管理局(Food and Drug Administration, FDA)批准了一些抗病毒药物, 如IFN-α和NAs用于抗HBV. 仅2015年1年, 国外共更新了4版关于抗HBV治疗的指南[6-9], 而国内也于2015-10更新了关于HBV防治指南[10]. 在这些指南中, 因良好的抑制病毒效果与低耐药性风险, 恩替卡韦(entecavir, ETV)和富马酸替诺福韦酯(tenofovir disoproxil fumarate, TDF)均被推荐为一线抗HBV药物[11].
在FDA目前只批准Interon A和Pegasys两种IFN用于抗HBV治疗, 其他公司生产的IFN[包括Wellferon、Roferon和Intergen及在此HBF drug watch上没有聚乙二醇IFN-2b(polyethylene glycol interferon 2b, PEG-IFN-2b)]可以用于抗HCV治疗, 而没有被FDA批准用于抗HBV治疗.
上市的5个药物, 按照上市的时间顺序分别拉米夫定(lamivudine, LAM)(1998年)、阿德福韦酯(adefovir dipivoxil, ADV)(2002年)、ETV(2005年)、替比夫定(telbivudine, LdT)(2006年)、TDF(2008年), 2006年在韩国内上市的1个为(L-FMAU, clevudine, levovir).
还有3个分别处于临床Ⅰ、Ⅱ和Ⅲ不同研制周期的药物均为替诺福韦的前体药物, 分别为来自不同的研制公司的替诺福韦艾拉酚胺富马酸(tenofovir alafenamide, TAF, GS7340)、CMX157和AGX-1009, 最早出现在pipeline中在中国进行的Ⅰ期临床试验的AGX-1009, 目前网站上标注停留在Ⅰ期, 但实际上已经步入了Ⅲ期, 研制公司为澳大利亚Agenix. Gilead公司研制的TAF已于2015-11-05被批准与恩曲赛他滨等药联合, 即Genvoya, 主要是TAF替代其中的TDF用于人类免疫缺陷病毒(human immunodeficiency virus, HIV)感染的暴露前预防(pre-exposure prophylaxis, PrEP), 即在抗HIV预防治疗中TAF已经替代了TDF. TAF与TDF相比, TAF具有更小的肾脏和骨骼毒性[12]. Gilead公司预计今年第一季度申请TAF单药用于抗HBV的治疗.
纵观这类药物研制的历史和进程, 预计将来出现新药物的可能性不大. 我们在以往的研究[13]中描述了在模拟4种碱基的NAs均有药物上市后, 抗HBV治疗就已经步入后NAs时代了. 模拟腺嘌呤(A)的药物(上市的有ADV、TDF及TAF, 还有2个在研的: CMX157和AGX-1009)一直存在程度不同的肾脏及骨骼损伤, 主要是肾近端小管的损害, 导致磷、钙重吸收减少, 骨生成和密度减低, 长期运用后还会导致体内的肉毒碱减少, 模拟U的核苷酸类似物抗HCV的索非布韦可能也有类似的不良反应[14].
在2014-10以前的抗HBV药物研制pipeline可以见到LB80380(为韩国LG生物科学公司研制), 后更名为Besifovir. 在2013年亚太肝病研究学会中报道该药物的抗HBV作用可以与ETV比美, 但目前该药物在完成Ⅲ期临床试验的pupeline中消失, 药物研制已被终止, 或许是因其肾毒性和易致肉毒碱减少所致.
我们也曾将NAs类药物据其模拟碱基的基本结构分为第一代、第二代和第三代, 其实每一代更新的目的有两个, 即抗病毒作用增强和不良反应降低. 只有模拟鸟嘌呤(G)的ETV没有更新的产品, 可能有两方面的原因: (1)ETV的抗HBV作用已很强, 不良反应也比较低, 故没有必要进一步研制新的替代产品; (2)目前各大指南推荐的一线抗HBV药物均为嘌呤类似物, 即ETV和TDF, 而模拟A的NA上市药物不良反应较大且在研药物多处于临床试验阶段, 故首选ETV作为抗HBV一线药物更为可靠和安全(表1).
| 模拟碱基 | 嘧啶类 | 嘌呤类 | ||
| C | T | G | A | |
| 第一代 | 拉米夫定(LAM) | 替比夫定(LdT) | 恩替卡韦(ETV) | 阿德福韦酯(ADV) |
| 第二代 | 嗯曲赛他滨(F基化的LAM) | 克拉夫定(F基化的LdT) | 无 | 替偌福韦酯(TDF) |
| 第三代 | 无 | 无 | 无 | TAF、CMX157和AGX-1009 |
其抗HBV的机制为干扰病毒复制中病毒蛋白的生成. NAAs是CHB未来特异性治疗的重要基石, 且在目前临床试验中取得了巨大的成功. 至2015-06-22在pipeline中可见15种药物, 具体分期: Ⅱ-Ⅲ期的有6种, Ⅰ期的2种, 临床前期的有7种(表2).
| 序号 | 药物 | 靶点 | 研制分期 |
| 1 | Myrcludex B | 病毒入侵: NTCP | Ⅱa-Ⅲ |
| 2 | ARC-520 | HBV逆转录前, 基因沉默法 | Ⅱ/Ⅲ |
| 3 | NVR-1221(NVR 3-778) | 核心蛋白抑制剂 | Ⅱa |
| 4 | SB 9200 | SMNH小分子核酸杂交 | Ⅱ |
| 5 | Rep2139(REP 9AC) | HBsAg释放抑制剂 | Ⅱ |
| 6 | Birinapant(TL32711) | SMAC抑制剂 | Ⅱ |
| 7 | Bay 41-4109 | 抑制病毒核心蛋白 | Ⅰ |
| 8 | TKM-HBV | HBsAg抑制剂 | Ⅰ |
| 9 | Alinia(Nitazoxanide) | 小分子病毒入侵 | 临床前期 |
| 10 | dd-RNAi compound | 基因沉默 | 临床前期 |
| 11 | BIBS-25 | cccDNA抑制剂 | 临床前期 |
| 12 | CpAMS | 核心蛋白 | 临床前期 |
| 13 | NVP018 | 亲环素抑制剂 | 临床前期 |
| 14 | ALN-HBV | RNAi基因沉默 | 临床前期 |
| 15 | CPI-431-32 | 亲环素抑制剂 | 临床前期 |
3.1.1 Myrcludex B: Myrcludex B属于针对HBV病毒黏附及侵入抑制剂或称为病毒入侵的新型阻断剂(entry inhibitors), 可灭活HBV/HDV受体中的钠离子/牛磺胆酸共转运蛋白(sodium taurocholate co-transporting polypeptide, NTCP)[15]. 血液循环中的HBV进入肝脏间隙, 首先经由病毒L蛋白的前S区和S蛋白的抗原环介导, 与肝细胞表面的硫酸乙酰蛋白聚糖(heparan sulfate proteoglycans, HSPG)相互作用[16,17]. 然后, HBV与肝细胞膜上的NTCP结合, 后者被认为是介导HBV特异性感染肝细胞的功能性受体[18-21]. 在经历临床前期及临床Ⅰ期的成功后, Myrcludex B已顺利完成临床Ⅱa期, 且目前有证据显示, 抑制HBV肝内传播或许成为未来治疗HBV的重要机制.
3.1.2 ARC-520: ARC-520通过RNA干扰(RNA interference, RNAi)阻断肝细胞中HBV的某些蛋白表达进而抑制HBV增殖, 利用人体免疫系统对剩余病毒进行清除, 实现免疫清除状态. 其作用特征为乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg)血清学转阴或血清学转换. Arrowhead公司有3种基于RNAi的药物处于临床开发阶段, 其中ARC-520是进度较快的一个项目, 目前, 临床Ⅱa期试验相关数据显示, 该药物能够大幅降低CHB患者血液HBsAg水平, 具有功能性治愈CHB的潜力, 是最有希望先上市的药物之一[22].
3.1.3 NVR-1221(NVR 3-778): NVR-1221(NVR 3-778)为HBV核心蛋白合成阻断剂, 是一种小分子复合物, 可以与HBV核心蛋白的寡聚体(如二聚体)结合, 从而影响120二聚体核心蛋白的合成, 由Novira公司研发且目前正在开展Ⅱa临床试验. 相关研究显示, 在研的4种核心蛋白抑制剂即使在高浓度的情况下, 也无细胞毒性作用, 而与HBV核心蛋白的疏水结合位点具有高度的亲和力. 该药物对HBV所有基因型均有效, 且对NA耐药患者亦有效, 可以单独运用或者联合NA及pegylated interferon治疗CHB.
3.1.4 SB 9200: SB 9200属于免疫调节剂, 通过激活机体先天性的细胞免疫反应, 激发体内IFN产生, 调控宿主免疫反应, 致受感染肝细胞死亡从而清除病毒, 同时使未感染肝细胞建立抗病毒状态. 该药物是从Spring Bank制药公司的小分子核苷酸杂交(small molecule nucleic hybrids, SMNH)技术平台筛选获得的, 为口服的二核苷酸前体药物, 属新型免疫调节剂抗病毒制剂. SB 9200独特的抗病毒机制是通过激活宿主细胞内抗病毒应答蛋白, 即胞浆病毒应答器, 前卫蛋白RIG-I和NOD2, 他们对调节宿主先天性免疫应答和激活细胞对病毒RNA发出的IFN信号通路非常重要. SB 9200作为可联合NA或其他在研的抗病毒制剂的新兴药物, 初期研究[23]显示其抗病毒效果与IFN相似, 但无IFN类流感样综合征等系统性不良反应. SB 9200对HCV、HBV及其他病毒均有作用, 在治疗HCV时可与抗HCV的直接抗病毒药物联用.
3.1.5 Rep 2193(REP 9CA): Rep 2193(REP 9CA)是一种核酸聚合物(nucleic acid polymers, NAPs), 影响HBsAg装配. 在以感染HBV的鸭及人为研究对象的临床前期研究中显示, Rep 2193与免疫调节剂, 如PEG-IFN-α-2a或胸腺素α-1联用可协同恢复宿主免疫进而控制HBV感染. HBsAg是丁型肝炎病毒(hepatitis D virus, HDV)的重要组成部分, REP2139可以去除血清HBsAg, 与PEG-IFN-α-2a联用可协同增强抗HDV感染的疗效. NAPs利用硫代磷酸酯寡核苷酸的非依赖特性与HBsAg的载脂蛋白相互作用, 而载脂蛋白与HBV亚病毒颗粒(subviral particles, SVPs)形成密切相关, SVPs是组成HBsAg的主要成份, 故NAPs可阻止感染肝细胞里SVPs的形成及分泌, 最终影响HBsAg形成. HBsAg有重要的免疫抑制作用, 能够阻止机体的先天及获得性免疫. 前期研究证明利用REP 2139可快速有效的清除HBV感染者血液中HBsAg, 而迅速恢复机体的抗HBV免疫应答. 因此, 清除血液中的HBsAg能够大大提高的免疫治疗.
3.1.6 Birinapant(TL32711): Birinapant(TL32711)为胱天蛋白酶激活剂(second mitochondria-derived activator of caspases, SMAC)类似物, 通过模仿内源性SMAC功能, 从而拮抗细胞凋亡抑制蛋白(cellular inhibitor of apoptosis proteins, cIAPs), 可以迅速降低HBV DNA和HBsAg水平, 并促使HBV感染肝细胞的清除. 目前cIAPs抑制剂类药物研制主要用于肿瘤治疗, 可促使肿瘤坏死因子(tumor necrosis factor, TNF)介导的肿瘤细胞清除作用. 与单药相比, Birinapant与ETV联用后能更加迅速清除HBV DNA, 且在动物试验中耐受性良好. 目前研究提示, Birinapant及其他SMAC类似物有可能作为CHB治疗的新药物, 且能够与现有抗HBV药物联合使用从而增强疗效.
3.2.1 GLS4: 近期发现了一种针对HBV核衣壳的新型化合物, 其原型即BAY 41-4109, 基于大量研究结果, 目前发展了一系列BAY 41-4109类似物, 而GLS4作为一种BAY 41-4109类似物, 在体外培养中发现其能够在HepG2.2.15细胞内产生抗病毒效应, 且一项临床前期研究的体外培养数据显示较原型化合物BAY 41-4109相比, GLS4在HBV治疗方面更有效且毒性更低. 所有的化合物均为含杂环嘧啶成分的药物, 由HBV核心蛋白二聚体以及干扰HBV核酸功能及合成的成分组成. 与传统的核苷酸类似物相比, GLS4在抑制HBV复制上更高效. Ⅰ期临床实验研究[24]表明: GLS4安全有效, 无明显药物间的相互作用, 是理想的临床抗HBV候选药物. 包括BAY 41-4109或GLS4的联合治疗方案能够抑制HBV DNA体内复制, 进而减少HCC的发生风险.
3.2.2 TKM-HBV: 由Tekmira公司采用RNAi方法作用于HBV基因组的三个靶点, 从而使所有病毒mRNA转录模板降解. 这三个独特且高度保守的靶点, 对于所有基因型的HBV病毒抗原编码表达均有影响, 实现在CHB患者基因型A到H的所有HBV病毒株都有效的"万能"药物, 从而导致HBV对其发生耐药的门槛明显提高, 同时还可以减少其他抗HBV药物耐药的产生. 脂质纳米颗粒转运技术(Tekmira's lipid nanoparticle, LNP)是当今最为广泛接受的RNAi转运技术, Tekmira公司的两个在研产品的LNP成分不同, 其中一个采用第三代LNP, 另一个采用新的第四代LNP, 参入了新的脂质化学成分因而增强了抗HBV的能力. 运用TKM-HBV治疗HBV可致肝组织和血清中HBV DNA, cccDNA及HBsAg、乙型肝炎e抗原(hepatitis B e antigen, HBeAg)和乙型肝炎核心抗原(hepatitis B core antigen, HBcAg)迅速明显减少. 通过抑制HBsAg和亚病毒颗粒的组件, TKM-HBV也能通过激活体液和T细胞免疫机制进而减轻免疫系统对HBV和cccDNA的再激活[25].
3.3.1 Thiazolides: 是新一类治疗HBV和HCV的药物. 硝唑尼特(nitazoxanide, NTS)是新型Thiazolide类抗感染药物[26]. NTS起初是用于治疗隐孢子虫感染, 在治疗获得性免疫缺乏综合征(acquired immune deficiency syndrome, AIDS)合并HBV和HCV感染引起的隐孢子腹泻时意外发现其具有抗病毒作用. 在初期开放性临床试验中发现NTS具有抑制血清HBV DNA水平, 且在CHB患者中发现了多数的e抗原转换和1/4的s抗原转换. 用NTS联合PEG-IFN-α-2a及利巴韦林(ribavirin, RBV), 可增加基因4型HCV感染持久应答率至79%-80%, 而对照组联合PEG-IFN及RBV的标准化治疗方案持久应答率仅为50%. NTS对LAM和ADV耐药变异株有一定作用, 且能够与LMV或ADV协同抑制HBV.
3.3.2 dd-RNAi复合物: 即DNA-directed RNAi, 通过机体自身产生RNAi与直接转运设计构造一个iRNA. 原始RNAi的缺点是转运过程中易被降解, 而不能有效通过体内到达靶细胞, 如果加以修饰而使其在转运过程中不降解, 其选择性和整合等效能也会同时降低. 使RNAi到达特定靶组织和细胞具有一定困难, 尤其是如何使其到达具有吸取功能细胞表面的合适位置. 小干扰RNA(small interfering RNA, siRNA)穿透细胞能力与剂量成正比, 但剂量越高对人体产生的毒性越大. RNAi扭曲转运技术设计能够运用一个转运载体或者将RNAi复合物装进另一药物, 借助另一药物将其转运到靶细胞或靶点. 由此Benitec设计了ddRNAi, 短发夹RNA(short hairpin RNA, shRNA)与DNA编码同时直接运送到细胞核. 当设计的ddRNAi成份被转运到靶细胞核后, 利用细胞自身产生siRNA分子. 这种设计构造iRNA机制, 只需要小剂量的下调基因(封闭基因), 例如小到5拷贝的DNA分子可以持续表达数年. 故dd-RNAi即使运用一次小剂量药物, 可以持续发挥数年作用, 从而治愈疾病.
3.3.3 BSBI-25: 属HBV的cccDNA的阻滞剂, 目的是在治疗结束后能够通过去除cccDNA的保护, 阻止HBV复发. 该药物目前由Baruch S Blumberg集团正在研制. 通常肝细胞受感染后, 会在肝细胞内形成cccDNA, 后者作为病毒转录模板使HBV感染持续存在. 现有抗病毒药物虽可抑制HBV复制, 但很难清除cccDNA. 研究发现TNF超家族成员-淋巴毒素β(lymphotoxin-β, LTβ)是淋巴细胞受抗原或有丝分裂等刺激活化后及某些肿瘤、自身免疫病的情况下产生分泌的蛋白, 研究显示, 刺激LTβ受体(LTβ receptor, LTβR)不仅能抑制HBsAg、HBeAg及HBV DNA的释放, 还能促进细胞内cccDNA的降解, 彻底清除体内病毒. 但遗憾的是在最新的pipeline中没有BSBI-25的报道, 是否已经被终止有待于进一步证实.
3.3.4 CpAMS: 核心蛋白变构调节剂(core protein allosteric modulators, CpAMs)属于小分子抗病毒的种类, 可改变对HBV生存至关重要的核心蛋白的活性. 通过对HBV核心蛋白装组机制的研究, 发现了多种能够有效选择性降低HBV病毒载量和病毒主要抗原的同族小分子CpAMs. CpAMs也可通过干扰HBV复制的多个环节包括cccDNA发挥抗病毒作用, 而HBV cccDNA隐藏在HBV感染者肝细胞核内, 作为病毒库为HBV病毒蛋白的组装和病毒基因组复制提供模板, 导致HBV持续感染, 而目前可用的抗HBV治疗都不影响cccDNA. CPAMs通过引起衣壳蛋白突变, 使HBV抑制得以实现, 进而影响HBV分子组装、逆转录和包装. 目前公司正在为选择第一代CpAMs而努力.
3.3.5 NVP018: 又名OCB-030, 与其他亲环蛋白抑制剂相比, NVP018是一种临床前期分化良好的, 基于Sangamide(是天然产生的萨菲菌素A聚酮化合物类似物, 且由新型特殊的聚酮作用机制分化而来)的第二代口服型亲环蛋白抑制剂. 亲环素是一组负责控制病毒感染后先天免疫反应的蛋白. 亲环素与干扰素信号通路相互作用的机制之一是阻断病毒控制宿主天然免疫应答. OCB-030在体外通过2个机制抑制HBV的复制: (1)OCB-030可直接抑制肝细胞内病毒复制的几个阶段; (2)他能通过干扰素调节因子(interferon regulatory factors, IRFs)来增强宿主的免疫反应从而间接的起到抗病毒作用. 与目前其他抗HBV治疗易发生耐药相比, OCB-030治疗HBV的耐药发生率较低. Tekmira公司计划向FDA提供一份临床研究申请文件, 或者2015年在另一国家的同等机构启动该药物的Ⅰ期临床试验.
3.3.6 ALN-HBV: 采用RNAi的方法作用于HBV基因组, 从而阻止HBV复制周期中所有步骤, 包括装配、病毒复制、病毒颗粒的分泌. 一个候选的目标是发展ALnylam制药公司Chemistry-GaINA共轭技术, 这项技术能够通过升级效能、安全性、持久性及广泛的药物治疗指数来监控皮下注射剂量[27]. 这项技术在HBV的RNA靶向治疗中得到很好的运用. 该药的前期临床实验表明该药物治疗能够大幅降低HBV病毒滴度及HBsAg水平. ALnylam制药公司希望在2015年创建一个以ALN-HBV为基础的候选药物或创建一个IND或与其等同的药物项目. ALN-HBV可介导强力持久的HBV沉默并以HBV基因组为靶点的RNAi, 有望通过降低所有病毒基因产物, 包括HBsAg等病毒抗原表达, 实现HBV感染的"功能性治愈"[28]. 同样研究[29]发现, 针对肝细胞siRNA偶联物: ALN-HBV以HBV基因组内的高度保守区为靶点, 可介导特异、强力和持久的HBV病毒转录沉默和HBsAg表达沉默. ALN-HBV的化学稳定性强, 其靶点为乙型肝炎病毒X蛋白(hepatitis B virus X protein, HBx)开放阅读框(open reading frame, ORF)的一个位点, 因此, 可针对所有4种HBV RNA转录体, 通过RNA干扰发挥降解作用.
3.3.7 CPI-431-32: 是由Ciclofilin制药研制的一种能够抑制宿主亲环素A(cyclophilin A, CyPA)的新型药物. CyPA对激活HCV、HIV-1、HBV病毒蛋白起关键作用. 为了更好地理解亲环素类如何抑制病毒复制, 该公司已经研制出宿主靶向抗病毒药物: CPI-431-32, 该药物可用于HCV、HIV-1、HBV及一种以上病毒的联合感染. CPI-431-32是Ciclofilin制药公司用于难治性肝炎的领先医药候选人. 与许多抗病毒剂直接针对病毒(直接作用的抗病毒剂DAA)不同, CPI-431-32靶向宿主亲环, 因此具有较高的屏障耐药性. CPI-431-32还显示出对所有HCV基因型均高度有效, 包括HCV基因3型优势.
根据作用机制或靶标可以分为7小类: (1)病毒入侵的阻断剂1种: Myrcludex B; (2)针对HBsAg的HBsAg释放抑制剂、HBsAg抑制剂2种: Rep 2193(REP 9AC)、TKM-HBV; (3)针对核心蛋白的3种: 衣壳蛋白抑制剂[NVR-1221(NVR 3-778)]、Bay 41-4109和CpAMS; (4)针对HBV cccDNA抑制剂1种(BSBI-25); (5)RNAi、小分子核酸杂交剂SMNH、基因沉默dd-RNAi复合物、RNAi的4种: ARC-520、SB 9200、dd-RNAi compound、ALN-HBV; (6)SMAC模拟剂1种: Birinapant(TL32711); (7)亲环素阻断剂小分子2种、Alinia(Nitazoxanide) 1种, 在抗HCV非特异性治疗中也有. 在pipeline中归于这类的药物中其实也有属于非特异性药物, 即将来也可能用于抗其他病毒的感染, 也有属于免疫调节的药物. 但为何drug watch为何将其归于此类有待于进一步探讨.
其作用机制为通过增强机体内抗感染的免疫细胞和天然IFN的产生. 列出的药物6种, 分别为ABX 203、GS-4774、GS-9620、INO-1800、CYT107和TG 1050. 目前各种免疫调节策略仍处于研究阶段, 有待进一步优化和评估[30](表3).
| 药物 | 作用机制 | 研制分期 |
| ABX 203 | 治疗性疫苗 | Ⅱb/Ⅲ |
| GS-4774 | 治疗性疫苗 | Ⅱ |
| GS-9620 | TLR-7激动剂 | Ⅱ |
| CYT107(Interleukin-7) | 免疫调节剂 | Ⅰ/Ⅱa |
| TG 1050 | 免疫治疗剂 | Ⅰ |
| INO-1800 | 治疗性疫苗 | Ⅰ |
ABX 203是法国ABIVAX和古巴CIGB的第一个合作成果. 为了缩短目前抗HBV治疗疗程, ABX 203被认为是能够提供持久控制HBV病毒载量的治疗性疫苗. 他由HBsAg和HBcAg共同组成, 即两种病毒蛋白的混合物. 该疫苗已进入一个多中心临床Ⅱ/Ⅲ期试验, 预计能够在2017年完成[31,32]. ABX 203已被设计为中和血清抗体及诱导机体产生强效细胞应答. 该药物可配制成鼻喷雾溶液, 或作为皮下注射溶液. 已有试验研究表明, ABX 203具有较好的耐受性, 其与PEG-IFN-α具有类似的抗病毒效果, 但抗病效果与PEG-IFN-α相比, 可持续至停药后6 mo, 这就意味着ABX 203可提供优于现有CHB标准治疗的疗效.
GS-4774是一种治疗性疫苗, 主要通过联合其他抗HBV治疗, 激发针对含HBV抗原细胞的T细胞免疫反应, 旨在提高CHB患者治疗的应答率. GS-4774是一种能够对HBV表达的特异性抗原进行灭活、重组、基于酵母菌的免疫疗法. GS-4774利用包含世界范围内4个主要HBV基因型的HBV序列, 来表达融合蛋白, 目的是确保该产品在多个地区的市场均具有一定的适用性. GS-4774是GlobeImmune和Gilead公司合作开发的药物, 含有热灭活的酵母细胞, 可以表达HBsAg的高度保守区域、HBcAg和HBx[33]. Gilead在2014-07对目前未行治疗的CHB患者进行了GS-4774的Ⅱ期临床试验研究. 初步试验表明GS-4774在健康受试者中是安全且可耐受的. 每周和每月的GS-4774使用方案都能提供HBV特异性免疫反应. 因此, GS-4774在抗HBV治疗中可能具有一定的前景. GS-4774是一种基于酵母的疫苗(Tarmogen), 表达嵌合蛋白, 其包含来自X蛋白的60个氨基酸以及整个L型HBsAg和核心蛋白[34]. 目前, GlobeImmune宣布GS-4774在治疗CHB感染患者的Ⅱ期临床试验中未能到达目标终点, 这表明GS-4774未能有效减少HBsAg的血清水平.
GS-9620是Toll样受体-7(Toll-like receptor 7, TLR-7)的口服激动剂, 目前正处于针对CHB个体治疗的临床Ⅱ期试验阶段. 在先前进行的临床前期研究中, 在HBV动物模型中GS-9620能够持久抑制HBV抗原和HBV DNA血清学水平. 在CHB临床前模型中, 由GS-9620建立的抗病毒反应可增强CD8+ T细胞杀伤活性. 肝内强烈的B细胞反应可能在HBsAg血清学转换中起了至关重要的作用. TLR-7是由浆细胞样树突状细胞(plasmacytoid dendritic cell, pDC)和B淋巴细胞表达的一种模式识别受体, 刺激TLR-7可以诱导pDCs分泌IFN-α和其他淋巴细胞[35]. 临床前期的研究[36]提示, 在黑猩猩身上3次/wk的应用剂量为1 mg/kg的GS-9620, 连续应用4 wk, 间隔1 wk后再连续应用4 wk剂量为2 mg/kg, 病毒载量和HBV感染的肝细胞数量都明显减少. 平均病毒最大减少2.2 logs, 同时病毒减少>1 log持续数月. 目前Gilead已经启动Ⅱ期临床试验进一步评估GS-9620的安全性和有效性.
重组人白介素-7(CYT-107)是免疫T细胞的恢复及扩增的免疫调节剂. 白介素-7(interleukin 7, IL-7)是由胸腺和骨髓基质细胞及其他上皮细胞产生的生长因子和细胞因子. IL-7能够通过来自下游功能性胸腺产生的T淋巴细胞精确而不重复的刺激T淋巴细胞增殖从而扩增外周T细胞[37]. 第一代rhIL-7的重复剂量试验在临床前期和Ⅰ期研究中显示, 肿瘤学和HIV感染患者的复发性剂量试验均有良好耐受性, 且能够长期增加CD4和CD8 T细胞数量. CYT-107是第二代rhIL-7, 由Cytheris公司生产, 该公司是处于临床阶段的生物制药公司. 一项在欧洲、台湾和北美招募超过120例患者的临床试验已证实了IL-7对CD4+和CD8+ T细胞的增殖及保护能力[38,39]. 在通过初步安全性评估后, 目前CYT-107已成功进入临床试验Ⅰ/Ⅱa期评估阶段, 评估CYT-107联合标准化抗病毒治疗及疫苗针对e抗原阴性CHB患者的功效.
TG-1050是以腺病毒为基础的CHB靶向免疫疗法的候选. TG-1050的临床前期包装是能够支持TG-1050诱导产生大量有活力的、持久的具有类似于在受感染者体内发现的具有抗感染、抗病毒活性的T细胞. 重要的是, 受诱导的TG-1050 T细胞有能力识别来自于所有HBV基因型的免疫因子, 包括基因B型和C型[40,41]. 此外, 一项联合研究显示CHB患者和健康人群其产生的腺病毒抗体数量相类似. 预计该公司在未来数月将计划启动首次人类临床评估.
目前市场上在研的抗HBV药物种类繁多, 且已经对这些药物进行了大量试验研究[46-48], 一旦药物上市之后, 有希望改变当前抗HBV治疗效果欠佳的僵局[49,50]. 在这四类药物中, 最有值得期待的是第三大类药物, 因为第一大类IFN没有在研的新的药物, 而第二大类的NAs, 即使TAF近期获批单药用于抗HBV治疗, 也只是减少ADV、TDF这类核苷酸类似物在肾及骨骼方面的不良反应. 而非IFN的免疫增强剂第四大类药物, 是针对于T淋巴细胞, 导致体内天然IFN的产生增加, 这类药物上市后治疗作用能否超过体外直接给与IFN还有待于进一步验证, 且多数属于非特异性的抗HBV的药物, 故这类药物不良反应可能会比特异性作用于HBV复制周期的药物高.
对于慢性HBV感染, 理论上理想的抗HBV的治疗方案可能是: (1)不同靶点的联合, 以病毒成分关键靶点为主的联合, 如在研的抗HBV药物将来可能都基于与现有的抗HBV的NUC的联合; (2)对于病毒构成必需的成分的同一靶点的不同方法的联合, 如针对HBV核心蛋白的基因治疗、直接抑制及免疫治疗; (3)特异性抗HBV药物与非特异性的联合. 对于慢性HBV感染, 要彻底清除病毒, 需要依赖于细胞内的HBV清除, 同时也需要没有被HBV病毒侵犯的细胞(主要是肝细胞)建立抗病毒状态, 即最佳的抗HBV病毒方案应该是既要含有相对特异性作用于HBV复制环节的药物, 也要含有带有免疫增强作用及非特异性的抗病毒药物(如IFN及非特异性针对病毒入侵的药物), 理论上可能含有IFN的方案更有利于彻底控制或清除体内HBV.
由于抗丙型肝炎病毒(hepatitis C virus, HCV)直接抗病毒药物陆续上市, 国外大的制药公司将逐渐转向加上抗乙型肝炎病毒(hepatitis B virus, HBV)药物的研制, 为此, 在抗HBV药物研制drug watch网站上更新更快, 有鉴于此, 对于抗HBV药物研制的最新进展作一总结. 随着抗HBV药物研制进展, 各类新药将陆续上市, 如何根据不同的患者制定切实可行而且经济的治疗方案变得更为复杂.
阴赪宏, 研究员, 首都医科大学附属北京友谊医院感染与急救医学
由于抗HBV新药多处于临床试验阶段, 仍有许多问题尚未解决, 如果对各类药物作用机制及其相应特点不熟悉, 盲目用药可能会给患者以后的治疗带来众多问题, 同时也不利于未来HBV治疗的发展.
鉴于抗HBV药物研制进展迅速, 针对抗HBV治疗的指南更新也非常迅速. 仅2015年一年, 国外共更新了4版关于抗HBV治疗的指南, 而国内也于2015-10更新了HBV防治指南. 多种抗HBV新药的产生为患者提供了新的治疗方案.
抗HBV新药种类繁多, 建议对于新的指南在还没有十分明确的情况下, 加上大部分药物目前仍处于临床试验阶段, 详细了解各类药物的作用机制, 掌握未来抗HBV治疗前沿技术.
本文对已上市和在研的抗HBV药物的种类、作用机制及未来市场前景进行简要述评及总结, 同时为HBV研究者或从事卫生保健工作的专家提供最新的HBV治疗进展.
本文对目前在研的抗乙型肝炎药物进行了综述, 内容新颖, 较为前沿. 按照四大类抗病毒药物: 干扰素类、核苷(酸)类似物、非核苷类抗病毒药物及非干扰素的免疫增强剂进行分类具体阐述, 并就未来药物研制进展方向提出个人见解.
编辑: 于明茜 电编:都珍珍
| 1. | Pérez-Cameo C, Pons M, Esteban R. New therapeutic perspectives in HBV: when to stop NAs. Liver Int. 2014;34 Suppl 1:146-153. [PubMed] [DOI] |
| 2. | Manzoor S, Saalim M, Imran M, Resham S, Ashraf J. Hepatitis B virus therapy: What's the future holding for us? World J Gastroenterol. 2015;21:12558-12575. [PubMed] [DOI] |
| 3. | Liaw YF, Tai DI, Chu CM, Chen TJ. The development of cirrhosis in patients with chronic type B hepatitis: a prospective study. Hepatology. 1988;8:493-496. [PubMed] [DOI] |
| 4. | Fattovich G, Stroffolini T, Zagni I, Donato F. Hepatocellular carcinoma in cirrhosis: incidence and risk factors. Gastroenterology. 2004;127:S35-S50. [PubMed] [DOI] |
| 5. | Arzumanyan A, Reis HM, Feitelson MA. Pathogenic mechanisms in HBV- and HCV-associated hepatocellular carcinoma. Nat Rev Cancer. 2013;13:123-135. [PubMed] [DOI] |
| 6. | Terrault NA, Bzowej NH, Chang KM, Hwang JP, Jonas MM, Murad MH. AASLD guidelines for treatment of chronic hepatitis B. Hepatology. 2016;63:261-283. [PubMed] [DOI] |
| 7. | Sarin SK, Kumar M, Lau GK, Abbas Z, Chan HL, Chen CJ, Chen DS, Chen HL, Chen PJ, Chien RN. Asian-Pacific clinical practice guidelines on the management of hepatitis B: a 2015 update. Hepatol Int. 2016;10:1-98. [PubMed] [DOI] |
| 8. | Available from: http://www.who.int/topics/hepatitis/en/. |
| 9. | World Gastroenterology Organisation Global Guideline: Hepatitis B(Version 2. 0) (EB/OL). Available from: http://www.worldgastroenterology.org/guidelines/global-guidelines/hepatitis-b/hepatitis-b-english. |
| 11. | Wang YJ, Yang L, Zuo JP. Recent developments in antivirals against hepatitis B virus. Virus Res. 2016;213:205-213. [PubMed] |
| 12. | Tawada A, Kanda T, Yokosuka O. Current and future directions for treating hepatitis B virus infection. World J Hepatol. 2015;7:1541-1552. [PubMed] [DOI] |
| 13. | 颜 学兵, 石 银月, 武 桂萍, 孔 玮晶. 从核苷(酸)类似物的基本结构及分类探讨联合应用的合理性. 中华实验和临床感染病杂志. 2011;5:364-371. |
| 14. | 颜 学兵, 徐 娟, 周 培培, 郝 俊贵, 李 胜开, 侯 先存. 阿德福韦酯治疗慢性乙型肝炎后多处骨痛、骨密度降低伴血清肌酐升高、血磷降低1例. 中华肝脏病杂志. 2011;19:383-384. |
| 15. | Watashi K, Urban S, Li W, Wakita T. NTCP and beyond: opening the door to unveil hepatitis B virus entry. Int J Mol Sci. 2014;15:2892-2905. [PubMed] [DOI] |
| 16. | Barrera A, Guerra B, Notvall L, Lanford RE. Mapping of the hepatitis B virus pre-S1 domain involved in receptor recognition. J Virol. 2005;79:9786-9798. [PubMed] [DOI] |
| 17. | Glebe D, Urban S, Knoop EV, Cag N, Krass P, Grün S, Bulavaite A, Sasnauskas K, Gerlich WH. Mapping of the hepatitis B virus attachment site by use of infection-inhibiting preS1 lipopeptides and tupaia hepatocytes. Gastroenterology. 2005;129:234-245. [PubMed] [DOI] |
| 18. | Petersen J, Dandri M, Mier W, Lütgehetmann M, Volz T, von Weizsäcker F, Haberkorn U, Fischer L, Pollok JM, Erbes B. Prevention of hepatitis B virus infection in vivo by entry inhibitors derived from the large envelope protein. Nat Biotechnol. 2008;26:335-341. [PubMed] [DOI] |
| 19. | Schulze A, Schieck A, Ni Y, Mier W, Urban S. Fine mapping of pre-S sequence requirements for hepatitis B virus large envelope protein-mediated receptor interaction. J Virol. 2010;84:1989-2000. [PubMed] |
| 20. | Volz T, Allweiss L, Ben MBarek M, Warlich M, Lohse AW, Pollok JM, Alexandrov A, Urban S, Petersen J, Lütgehetmann M. The entry inhibitor Myrcludex-B efficiently blocks intrahepatic virus spreading in humanized mice previously infected with hepatitis B virus. J Hepatol. 2013;58:861-867. [PubMed] [DOI] |
| 22. | Gish RG, Yuen MF, Chan HL, Given BD, Lai CL, Locarnini SA, Lau JY, Wooddell CI, Schluep T, Lewis DL. Synthetic RNAi triggers and their use in chronic hepatitis B therapies with curative intent. Antiviral Res. 2015;121:97-108. [PubMed] [DOI] |
| 23. | Spring Bank Pharmaceuticals, Inc. Press Release: Spring Bank Pharmaceuticals Completes $22 Million Financing-Proceeds to Support Phase II Clinical Development of SB 9200 Against Hepatitis B 2015. Available from: http: // springbankpharm. com/press-releases/. |
| 24. | Wu G, Liu B, Zhang Y, Li J, Arzumanyan A, Clayton MM, Schinazi RF, Wang Z, Goldmann S, Ren Q. Preclinical characterization of GLS4, an inhibitor of hepatitis B virus core particle assembly. Antimicrob Agents Chemother. 2013;57:5344-5354. [PubMed] [DOI] |
| 25. | Gagnon KT, Watts JK. 10th Annual Meeting of the Oligonucleotide Therapeutics Society: San Diego, California; October 12-15, 2014; Session Summaries. Nucleic Acid Ther. 2014;24:428-434. [DOI] |
| 26. | Keeffe EB, Rossignol JF. Treatment of chronic viral hepatitis with nitazoxanide and second generation thiazolides. World J Gastroenterol. 2009;15:1805-1808. [PubMed] [DOI] |
| 27. | Sepp-Lorenzino L, Abrams M, Carayannopoulos L, Koser M, Ludmerer S, Charisse KB, Freedman D, Jadhav V, Rajeev KG, Hinkle G. ALN-HBV, a GalNAc-siRNA Enhanced Stabilization Chemistry RNAi Therapeutic for the Treatment of Chronic Hepatitis B Virus Infection. Proceedings of the HEPATOLOGY. 2014; Available from: http://investors.alnylam.com/releasedetail.cfm?ReleaseID=847055. |
| 28. | Lin D, Nguyen NH, Hoang J, Vu VD, Trinh HN, Li J, Zhang JQ, Nguyen HA, Nguyen K, Nguyen MH. Incidence of hepatocellular carcinoma (HCC) in a US cohort of chronic hepatitis B (CHB) patients by age, gender, cirrhosis and antiviral treatment status. Hepatology. 2014;60:315A. |
| 29. | Alnylam Pharmaceuticals Inc. Investors 2015. Available from: http://investors.alnylam.com/. |
| 30. | Minami M. Future therapy for hepatitis B virus infection. Clin J Gastroenterol. 2015;8:167-171. [PubMed] [DOI] |
| 31. | Available from: http://www.Abivax.com/en/com-abivax-title-medias/development-products/abx203.html. |
| 32. | US National Institutes of Health. Clinical Efficacy of ABX203 Therapeutic Vaccine in HBeAg Negative Patients with Chronic Hepatitis B, 2013. Available from: https://clinicaltrials.gov/ct2/show/NCT02249988. |
| 33. | van Campenhout MJ, Janssen HL. How to achieve immune control in chronic hepatitis B? Hepatol Int. 2015;9:9-16. [PubMed] [DOI] |
| 34. | Gaggar A, Coeshott C, Apelian D, Rodell T, Armstrong BR, Shen G, Subramanian GM, McHutchison JG. Safety, tolerability and immunogenicity of GS-4774, a hepatitis B virus-specific therapeutic vaccine, in healthy subjects: a randomized study. Vaccine. 2014;32:4925-4931. [PubMed] [DOI] |
| 35. | Lanford RE, Guerra B, Chavez D, Giavedoni L, Hodara VL, Brasky KM, Fosdick A, Frey CR, Zheng J, Wolfgang G. GS-9620, an oral agonist of Toll-like receptor-7, induces prolonged suppression of hepatitis B virus in chronically infected chimpanzees. Gastroenterology. 2013;144:1508-1517, 1508-1517. [PubMed] [DOI] |
| 36. | Menne S, Tumas DB, Liu KH, Thampi L, AlDeghaither D, Baldwin BH, Bellezza CA, Cote PJ, Zheng J, Halcomb R. Sustained efficacy and seroconversion with the Toll-like receptor 7 agonist GS-9620 in the Woodchuck model of chronic hepatitis B. J Hepatol. 2015;62:1237-1245. [PubMed] [DOI] |
| 37. | Perales MA, Goldberg JD, Yuan J, Koehne G, Lechner L, Papadopoulos EB, Young JW, Jakubowski AA, Zaidi B, Gallardo H. Recombinant human interleukin-7 (CYT107) promotes T-cell recovery after allogeneic stem cell transplantation. Blood. 2012;120:4882-4891. [PubMed] [DOI] |
| 38. | Reimann J, Schirmbeck R. Alternative pathways for processing exogenous and endogenous antigens that can generate peptides for MHC class I-restricted presentation. Immunol Rev. 1999;172:131-152. [PubMed] [DOI] |
| 39. | Hellström UB, Madalinski K, Sylvan SP. PreS1 epitope recognition in newborns after vaccination with the third-generation Sci-B-Vac vaccine and their relation to the antibody response to hepatitis B surface antigen. Virol J. 2009;6:7. [PubMed] [DOI] |
| 40. | Yang HC, Kao JH. Viral hepatitis. HBV cure--can we pin our hopes on immunotherapy? Nat Rev Gastroenterol Hepatol. 2015;12:129-131. [PubMed] [DOI] |
| 41. | Martin P, Dubois C, Jacquier E, Dion S, Mancini-Bourgine M, Godon O, Kratzer R, Lelu-Santolaria K, Evlachev A, Meritet JF. TG1050, an immunotherapeutic to treat chronic hepatitis B, induces robust T cells and exerts an antiviral effect in HBV-persistent mice. Gut. 2015;64:1961-1971. [PubMed] [DOI] |
| 42. | Cartwright H. Roche Looks to Combination Immunotherapies with Inovio DNA Vaccine Collaboration. PharmaDeals Review. 2013;2013(9) Available from: http://ojs.pharmadeals.net: 5555/index.php/pdr/article/viewFile/1979/pdf. |
| 43. | Inovio Pharmaceuticals Inc. HBV 2014. Available from: http://ir.inovio.com/news/news-releases/news-releasesdetails/2015/Inovio-Pharmaceuticals-and-Roche-Initiate-ClinicalTrial-for-Inovios-DNA-Immunotherapy-to-Treat-ChronicHepatitis-B-Infection/default.aspx. |
| 44. | Phyo WW, Soh AY, Lim SG, Lee GH. Search for a cure for chronic hepatitis B infection: How close are we? World J Hepatol. 2015;7:1272-1281. [PubMed] [DOI] |
| 45. | Orlando R, Foggia M, Maraolo AE, Mascolo S, Palmiero G, Tambaro O, Tosone G. Prevention of hepatitis B virus infection: from the past to the future. Eur J Clin Microbiol Infect Dis. 2015;34:1059-1070. [PubMed] [DOI] |
| 46. | Liang TJ, Block TM, McMahon BJ, Ghany MG, Urban S, Guo JT, Locarnini S, Zoulim F, Chang KM, Lok AS. Present and future therapies of hepatitis B: From discovery to cure. Hepatology. 2015;62:1893-1908. [PubMed] [DOI] |
| 47. | Kang L, Pan J, Wu J, Hu J, Sun Q, Tang J. Anti-HBV Drugs: Progress, Unmet Needs, and New Hope. Viruses. 2015;7:4960-4977. [PubMed] [DOI] |
| 48. | Bhat M, Ghali P, Deschenes M, Wong P. Prevention and Management of Chronic Hepatitis B. Int J Prev Med. 2014;5:S200-S207. [PubMed] |
| 49. | Lin CL, Yang HC, Kao JH. Hepatitis B virus: new therapeutic perspectives. Liver Int. 2016;36 Suppl 1:85-92. [PubMed] [DOI] |
| 50. | Koumbi L. Current and future antiviral drug therapies of hepatitis B chronic infection. World J Hepatol. 2015;7:1030-1040. [PubMed] [DOI] |