修回日期: 2016-03-31
接受日期: 2016-04-06
在线出版日期: 2016-05-18
目的: 本文旨在寻找一种更经济的方式来监测结直肠癌肝转移, 我们尝试使用硝酸纤维素膜富集结直肠癌肝转移患者和结直肠癌患者尿蛋白, 并在尿蛋白中检测Cathepsin D是否可以作为结直肠癌肝转移尿蛋白标志分子.
方法: 收集结直肠癌肝转移患者及结直肠癌患者随机中段尿, 经抽滤法将尿蛋白富集在硝酸纤维素膜上. 用蛋白免疫印迹方法检测硝酸纤维素膜上洗脱下来的尿蛋白中的Cathepsin D含量, 并通过尿肌酐校正尿蛋白中的Cathepsin D含量.
结果: 硝酸纤维素膜可以富集到质量较好的尿蛋白, 并可用于后续研究. 与健康对照和结直肠癌患者相比, Cathepsin D在结直肠癌肝转移患者尿蛋白中表达升高. 经尿肌酐校正后, 结直肠癌肝转移患者样本中Cathepsin D含量显著高于健康对照和结直肠癌患者样本(P<0.01).
结论: 硝酸纤维素膜富集法可以快速富集到高质量的尿蛋白. 经尿肌酐校正后, 结直肠癌肝转移患者尿蛋白中Cathepsin D含量显著高于健康个体和结直肠癌患者, 提示Cathepsin D可能是潜在的结直肠癌肝转移标志物.
核心提示: Cathepsin D在结直肠癌肝转移患者尿液样本中含量显著上升, 提示其可能是结直肠癌肝转移潜在标志物, 对于临床监测结直肠癌肝转移有一定的价值.
引文著录: 蔡梦, 李薇, 高佳佳, 王征, 周志祥, 韩玥, 孙玉琳, 赵晓航. 结直肠癌肝转移患者尿蛋白Cathepsin D的检测和意义. 世界华人消化杂志 2016; 24(14): 2170-2177
Revised: March 31, 2016
Accepted: April 6, 2016
Published online: May 18, 2016
AIM: To find a more economical method for monitoring colorectal carcinoma liver metastasis by detecting whether cathepsin D can be used as a urinary biomarker of colorectal carcinoma liver metastasis.
METHODS: Random mid-stream urine samples were collected from patients with colorectal carcinoma with or without liver metastasis. The urine protein was enriched on NC membrane through pumping filtration, and Western blot was used to detect the concentration of cathepsin D after elution. Urine creatine was used to normalise the result.
RESULTS: The enriched protein showed a good quality and Western blot results indicated that the concentration of cathepsin D in urine of patients with colorectal carcinoma liver metastasis was significantly higher than those of healthy controls and CRC patients without metastasis.
CONCLUSION: The method of urine protein enrichment allows to obtain high quality urine protein quickly, and urinary cathepsin D may serve as a potential biomarker of colorectal carcinoma liver metastasis.
- Citation: Cai M, Li W, Gao JJ, Wang Z, Zhou ZX, Han Y, Sun YL, Zhao XH. Significance of detection of urinary cathepsin D in patients with colorectal cancer liver metastasis. Shijie Huaren Xiaohua Zazhi 2016; 24(14): 2170-2177
- URL: https://www.wjgnet.com/1009-3079/full/v24/i14/2170.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i14.2170
结直肠癌最常见的消化系恶性肿瘤之一, 在我国发病率居第5位[1], 超过1/3的患者会出现肝转移, 其中至少2/3会导致死亡[2]. 目前对于结直肠癌肝转移的诊断方法主要是肝脏的超声和CT检测[3]. 但这两种方法对于长期监测结直肠癌肝转移花费较高, 需要频繁进出医院. 另外, 也可以通过检测血液中癌胚抗原(carcino-embryonic antigen, CEA)来诊断结直肠癌肝转移, 但该方法敏感性较低(58%-89%)[4]. 因此, 找到一种经济的、无侵入性的监测方法对结直肠癌的诊断是非常必要的.
癌症的发展是癌基因活化和抑癌基因失活不断累积造成的, 这些变化造成了正常细胞和癌细胞之间基因、蛋白和代谢物的一系列差异. 其中一些可以在体液中捕获到, 捕获到的这些差异分子可以用于监测体内肿瘤的状态[5]. 在人体所有的体液中, 尿液是唯一一种可以在任意时间点通过非侵入性的方式大量收集的体液[6]. 而尿液的生成包括至少两个连续的生理过程, 首先是肾小球对血浆的"滤过", 形成原尿; 随后是肾小管对原尿的"重吸收". 此外, 肾小管、尿道或男性的前列腺还会分泌或释放一些物质入尿. 因此, 尿液中携带了大量的信息, 不仅反映了肾脏和泌尿系统的变化, 由于肾小球对血浆的滤过作用, 尿液还可以反映身体其他脏器、器官的生理或病理变化[7]. 这使得尿液成为疾病诊断、监测和预后判断的生物标志物的重要来源. 但是, 由于尿液中缺少内参, 收集随机尿样本无法校正因尿液体积改变而带来的影响, 而尿蛋白和肌酐在尿中的稀释程度是相似的, 所以若1 d中肌酐的排泄率相对恒定且个体差异较小, 则尿肌酐可以用于尿蛋白含量的校正[8]. 美国NKF K/DOQI指南中认为, 尿肌酐校正可以排除尿液浓度变化的影响[9], 所以尿液中标志分子研究过程中, 需要测量尿液中尿肌酐的含量, 然后利用尿肌酐的含量校正尿液体积改变对尿蛋白浓度的影响.
Cathepsin是蛋白酶中最大的家族[10], 特定的蛋白酶在肿瘤发展过程中的作用还不明确. 但肿瘤的侵袭与肿瘤细胞表面的蛋白酶活性相关[11]. Cathepsin D是一个天冬氨酸肽链内切酶, 可以水解包含芳香族, 尤其是含疏水氨基酸的肽键[12]. 此外, 通过激活蛋白酶原3和8参与细胞凋亡[13]及肿瘤的侵袭和转移[14]. 2012年, Kirana等[15]利用免疫组织化学在119例结直肠癌患者中检测了Cathepsin D的表达, 结果显示, Cathepsin D在侵袭前沿和肝转移灶中的表达水平高于原发灶, 原发灶中的Cathepsin D含量在晚期患者中显著提高, 与远端转移和不良预后相关. 但是其是否存在于结直肠癌肝转移患者尿液中, 以及是否可以作为一个诊断结直肠癌肝转移的尿液标志分子, 目前并没有研究. 因此, 本研究尝试使用硝酸纤维素膜富集的方法来富集结直肠癌肝转移患者、结直肠癌患者及健康个体尿液中的蛋白质, 得到质量较好的尿蛋白, 用于后续研究. 通过比较结直肠癌肝转移患者与结直肠癌患者和健康个体相同尿液量富集到的蛋白质中Cathepsin D的含量, 初步得到Cathepsin D在结直肠癌肝转移患者尿蛋白中含量高于结直肠癌患者和健康个体. 经尿肌酐校正后仍发现, Cathepsin D在结直肠癌肝转移患者尿蛋白中含量显著高于结直肠癌患者和健康个体. 所以, 尿液Cathepsin D可能是潜在的结直肠癌肝转移诊断标志物.
结直肠癌患者尿液样本来自中国医学科学院肿瘤医院腹部外科, 共17例(男12例, 女5例, 平均年龄54.4岁±11.2岁, 2015-07/2015-10收集), 结直肠癌肝转移患者尿液样本来自中国医学科学院肿瘤医院介入治疗科, 共19例(男10例, 女9例, 平均年龄56.2岁±7.6岁, 2015-08/2015-12收集). 小鼠抗人Cathepsin D单克隆抗体购自R&D(Minneapolis, USA)公司; 辣根过氧化物酶标记山羊抗鼠二抗购自中杉金桥生物技术公司(北京, 中国); LAS4000图像分析仪为GE公司产品.
1.2.1 结直肠癌肝转移患者、结直肠癌患者和健康个体尿液的收集: 使用无菌的50 mL离心管收集随机中段尿, 取2 mL尿液分别放入2个1.5 mL离心管中, -80 ℃冰箱保存, 用于尿肌酐检测; 剩余样本立即置于-80 ℃冰箱保存.
1.2.2 尿蛋白的富集和洗脱: 收集的尿液5000 g离心45 min, 加入1/2体积的磷酸盐缓冲液, 混匀后将样本倒入含有1层硝酸纤维素膜和4层滤纸的抽滤装置中, 调节真空泵压力使样本逐滴滴下, 直到过滤完成. 取出硝酸纤维素膜, 晾干, 封装于真空袋中, 置于-80 ℃冰箱保存.
将吸附有尿蛋白的硝酸纤维素膜裁剪, 置于2 mL离心管中, 依次加入1.7 mL丙酮, 250 μL 0.5%碳酸氢铵水溶液, 强烈振荡10 min, 4 ℃放置1 h. 14000 g离心15 min, 弃上清, 室温放置30 min, 晾干. 加入400 μL裂解液吹打后强烈振摇10 min后重悬. 14000 g离心15 min后取上清, 分装后 -80 ℃冰箱保存.
1.2.3 考马斯亮蓝染色: 取相同体积尿蛋白, 10%SDS-PAGE电泳, 置于R250染料中于摇床上染色过夜, 经脱色液脱色后采集图像.
1.2.4 蛋白免疫印迹分析: 考马斯亮蓝法测定蛋白质浓度, 10%SDS-PAGE电泳, 110 V恒压转膜, 10%脱脂牛奶室温封闭3 h, 加入稀释抗体于4 ℃摇床上孵育过夜, 经TBST洗膜后加入二抗室温孵育1 h, 加入ECL化学发光试剂显色并在LAS4000图像分析仪中曝光和采集图像.
1.2.5 尿肌酐校正: 通过尿液中的肌酐与苦味酸盐作用, 生成黄红色的苦味酸肌酐复合物, 再通过测定其吸光度值, 最终得到尿肌酐的浓度值. 蛋白免疫印迹经Image J软件对蛋白免疫印迹结果进行灰度扫描, 用灰度值与相应样本肌酐值的比值进行统计分析.
统计学处理 应用SPSS16.0对计量资料进行ROC曲线分析, 应用Prism5统计软件对计量资料采用秩和检验, 计量资料选择Student's t检验、Mann-Whitney检验, 以P<0.05为差异有统计学意义.
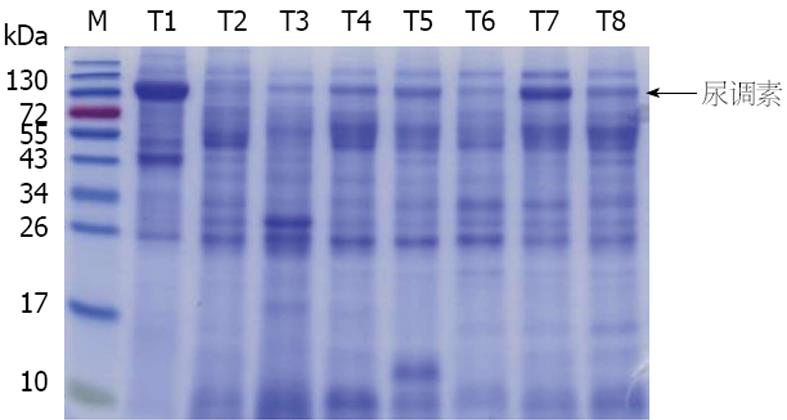
传统尿蛋白的提取是使用丙酮沉淀法, 该方法耗时长, 并且使用的试剂对环境和人体有害. 所以需要改善尿蛋白的富集方法. 通过使用真空装置将尿液中的蛋白质吸附在硝酸纤维素膜上, 然后将蛋白洗脱用于后续研究, 可以节省人力物力, 并减少对环境和人体的危害. 提取硝酸纤维素膜上富集到的尿蛋白质, 进行SDS-PAGE分析鉴定尿蛋白的质量. 结果显示, 在20-130 kDa之间, 蛋白条带清晰锐利, 其中110 kDa左右的尿液蛋白质中标志性蛋白分子尿调素多聚体条带明显, 且20 kDa以下的小分子量蛋白含量较少, 证明该种方法富集的尿蛋白质量较高, 可以用于后续研究(图1).
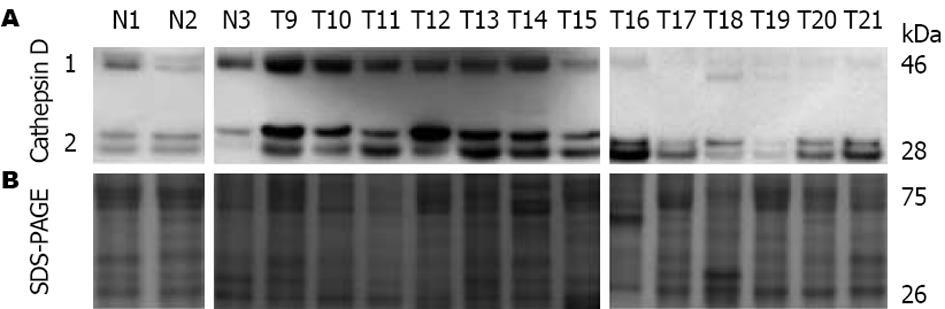
为了检测结直肠癌肝转移患者尿蛋白、结直肠癌患者尿蛋白和健康个体尿蛋白中Cathepsin D的表达, 采用蛋白免疫印迹分析相同尿液量富集到的结直肠癌肝转移患者尿蛋白、结直肠癌患者尿蛋白和健康个体尿蛋白中Cathepsin D的含量. 结果显示, 在19例结直肠癌肝转移患者、17例结直肠癌患者和15例健康个体相同尿液量富集到的尿蛋白中, Cathepsin D在结直肠癌肝转移患者尿蛋白中的表达量高于结直肠癌患者和健康对照样本中的表达量(图2).
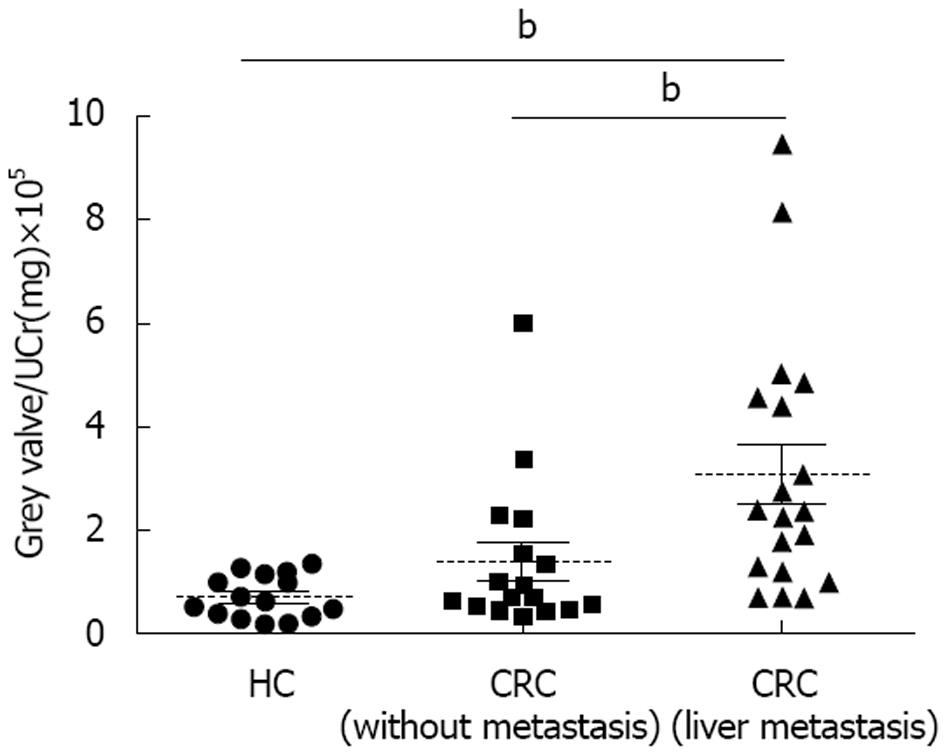
由于尿液中缺少内参, 无法校正因尿液体积改变而带来的影响, 所以用苦味酸法测量尿液样本中尿肌酐含量, 通过尿肌酐校正由尿液体积改变带来蛋白含量的变化, 先对蛋白免疫印迹结果进行灰度扫描, 然后与尿肌酐值相比. 分析结果显示, 经校正后, Cathepsin D[Grey valve/UCr(mg)]在结直肠癌肝转移患者、结直肠癌患者及健康个体中的中位数分别为237500(范围为70880-944200), 72690(范围为31730-599400), 64030(范围为13900-136900), 经Mann-Whitney检验发现, Cathepsin D在结直肠癌肝转移患者尿蛋白中含量高于结直肠癌患者尿蛋白及健康个体尿蛋白中的含量, 且在统计学上具有显著差异(P<0.01)(图3), 结果提示Cathepsin D可能是结直肠癌肝转移诊断的潜在尿液标志分子.
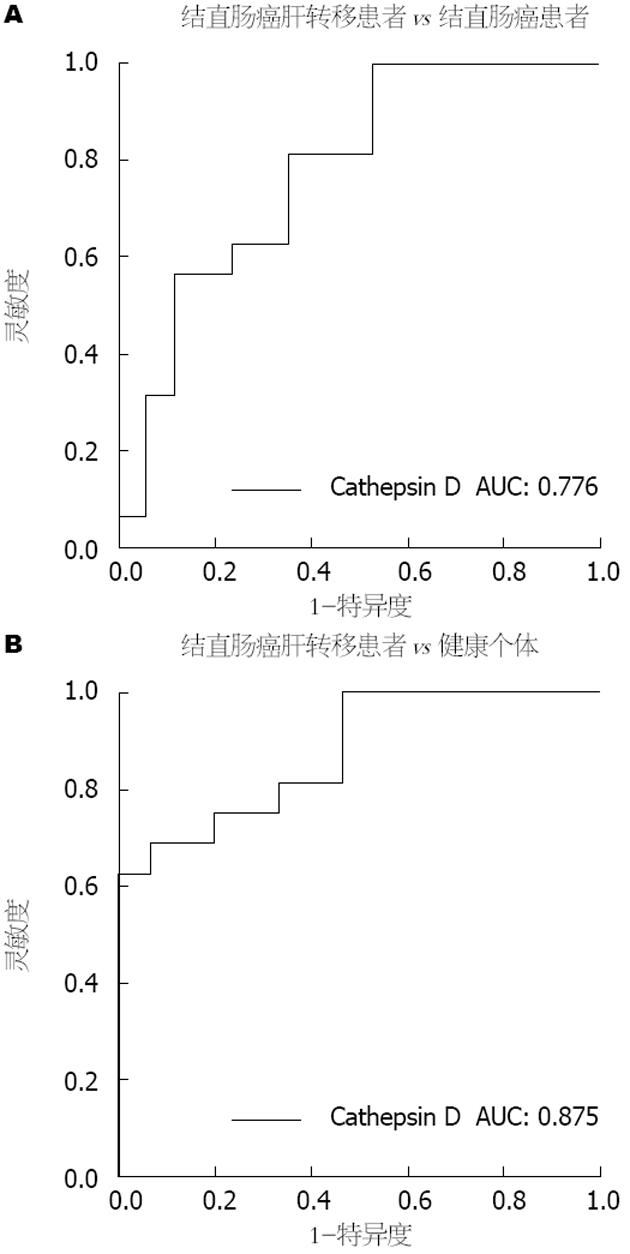
对19例结直肠癌肝转移、17例结直肠癌和15例健康个体样本进行尿液Cathepsin D含量辅助诊断结直肠癌肝转移效果的受试者工作特征(receiver operating characteristic, ROC)曲线分析(图4), 结果显示曲线下面积(area under curve, AUC)分别为0.776和0.875, 灵敏度和特异度分别为100%、53%和69%、93%, 提示尿液中Cathepsin D可能能够作为检测结直肠癌肝转移的参考因素.
在发达国家中, 结直肠癌的发病率居第3位, 死亡率居第2位, 其预后与疾病进程具有显著相关性[16]. 其中, DNA检测是结直肠癌的诊断中最有效的方法[17], 但这种方法并不适用于大规模筛查. 而在血液标志分子检测中, 多种标志物的敏感性都较低. 因此, 需要找到一种更有效且更易于操作的方法来辅助结直肠癌的诊断.
目前, 在疾病标志物的研究中, 其样本主要来源于血液, 但是基于血液蛋白质组学生物标志物的发现, 目前还存在一些弊端. 例如, 在血液收集的过程中, 一些蛋白酶仍处于活化状态, 会进一步降解血液中的蛋白, 产生水解产物; 另外, 血液中高丰度蛋白占总蛋白的99%, 影响低丰度蛋白的鉴定; 尤为重要的是, 为了维持机体内环境的稳定, 血液有严格的自稳态系统, 虽然各个器官的标志物都会进入到血液中, 但由于蛋白的水解和尿液的生成, 各个器官的标志分子可能会很快被清除, 从而影响血液中标志分子的发现[18]. 从实践的角度, 血液的收集是侵入性的, 且不适用于连续收集, 这就为后续标志分子的研究增加了难度[19]. 与之相比, 尿液是血液经肾脏滤过后的产物, 可以简单、连续、无侵入性地收集到大量的样本. 相比于血液, 蛋白水解作用可能在尿液收集之前已经完成, 所以尿液中的蛋白更加稳定; 并且, 尿液在4 ℃储存3 d或室温储存6 h, 尿蛋白不会发生明显变化, 这就为后续研究提供了更有利的条件[20]. 另外, 与血液中蛋白的变化相比, 机体的生理和病理改变, 更容易在尿液中得到体现. 例如, 2013年Li等[21]用6只成年♀SD大鼠测试抗凝血药物给血液及尿液带来的影响. 结果发现, 肝素使大鼠尿液中27个蛋白发生变化, 而血液中只有3个蛋白发生变化. 另一种抗凝药阿加曲班的试验结果与之相似, 尿蛋白中61个蛋白产生变化, 而血液中只有其中1个蛋白发生变化[21]. 另外, Wu等[22]用ELISA的方法检测了狼疮性肾炎患者血液和尿液中血管抑素的变化. 结果发现, 与健康对照相比, 狼疮性肾炎患者尿液中血管抑素浓度明显升高, 而在血清中血管抑素浓度并没有变化. 最近, Santucci等[23]利用超速离心分离的囊泡、组合肽配体文库和有机溶剂抽提等预分离方法, 结合LTQ-Orbitrap Velos Pro质谱, 从12例健康个体的尿液中鉴定到3429个蛋白, 其中1724个蛋白未在以往的尿蛋白质组研究中鉴定到. 所以, 尿液可能是更好的疾病标志物来源.
关于尿液蛋白质富集, 传统的方法包括沉淀法、超滤法、透析冻干法和超速离心法等, 而其中最常用的方法是沉淀法. 沉淀法需要先对收集到的样本进行离心, 然后加入丙酮、甲醇等有机试剂沉淀过夜(16-18 h)得到蛋白质沉淀, 再经过重溶后进行后续实验[24]. 虽然这些方法都能够有效富集到大量的尿蛋白质, 但需要耗费大量的有机试剂和时间. 为了节省人力物力, 并减少对环境和人体的危害, 本研究采用硝酸纤维素膜富集的方法得到尿蛋白, 这种方法通过抽滤装置使尿液以适当的速度通过硝酸纤维素膜, 其中蛋白质会吸附到膜上; 再经过洗脱就能够方便、快速的获得高质量的尿蛋白[25], 为后续尿液中蛋白标志分子的研究提供了便利条件.
目前科学家们对Cathepsin D进行了大量的研究. Cathepsin D是普遍存在的溶酶体天冬氨酸内切酶, 参与多种生理进程, 在屏障功能、细胞凋亡和上皮分化等过程中有重要的作用[26]. 并且Cathepsin D与许多肿瘤的发生具有相关性. 有研究[27]证明, Cathepsin D可以刺激前列腺癌细胞的增殖. 在乳腺癌中, Cathepsin D过表达与不良预后相关, 还可能增加肿瘤转移[28]. 相似的, 在结肠癌组织中, Cathepsin D的表达与不良预后呈正相关, 可以独立的作为预后预测标志分子[29]. 此外, 在肺癌、骨癌等恶性肿瘤中均能检测到Cathepsin D的高表达[30,31]. 关于Cathepsin D的大部分工作都是在细胞系、组织或血清的基础上完成的, 并且证明了Cathepsin D的高表达可能与多种恶性肿瘤的侵袭转移有关. 目前, 关于尿液中结直肠癌肝转移标志分子的研究还比较少, 也没有关于Cathepsin D是否可以作为结直肠癌肝转移患者尿液标志物的研究. 本研究选择结直肠癌肝转移患者作为研究对象, 研究其尿液中Cathepsin D的表达是否会发生变化, 是否可以作为结直肠癌肝转移患者诊断的标志物, 为结直肠癌肝转移患者的诊断提供便利条件. 本研究通过硝酸纤维素膜富集到的质量较好的尿蛋白, 可以用于后续的研究. 通过蛋白免疫印迹分析17例结直肠癌肝转移患者、19例结直肠癌患者和15例健康个体相同尿量中提取的蛋白质中Cathepsin D的含量. 结果发现, 结直肠癌肝转移患者尿蛋白中Cathepsin D的含量高于结直肠癌患者和健康个体尿蛋白中蛋白含量. 对蛋白免疫印迹结果进行灰度扫描, 然后与尿肌酐含量进行对比. 结果仍发现, 经尿肌酐校正后Cathepsin D在结直肠癌肝转移患者尿蛋白中的含量仍高于结直肠癌患者和健康个体尿蛋白中的含量, 且具有统计学意义(P<0.01). ROC曲线分析同样发现Cathepsin D作为诊断结直肠癌肝转移的标志物效果良好. 以上结果证明, 尿液中Cathepsin D的含量可能是潜在的结肠癌肝转移诊断标志物. 但进一步应用于临床, 仍需扩大样本量来验证.
结直肠癌是常见的消化系肿瘤, 易发生肝脏转移. 目前对于结直肠癌肝转移的监测方式花费较高且需要频繁进出医院. 尿液中含有大量非泌尿系统相关蛋白, 可用于生物标志物的研究.
贾云鹤, 教授, 主任医师, 哈尔滨医科大学附属肿瘤医院结直肠外科; 肖秀英, 副主任医师, 上海交通大学医学院附属仁济医院肿瘤科; 崔杰峰, 副研究员, 硕士生导师, 复旦大学附属中山医院肝癌研究所
Cathepsin D是一种天冬氨酸水解酶, 目前已有其在组织水平与结直肠癌肝转移关系的研究. 但对于其是否能在尿液中检测到, 并且是否能作为监测结直肠癌肝转移的潜在标志物的相关研究较少.
有研究发现Cathepsin D与多种肿瘤的形成和发育密切相关, 在结直肠癌侵袭前沿和肝转移灶中的表达水平高于原发灶, 在晚期患者原发灶中的含量显著升高, 与远端转移和不良预后相关.
本研究在尿液中检测了之前在组织水平研究发现的结直肠癌肝转移潜在标志物Cathepsin D, 通过与健康对照和结直肠癌患者样本比较, 发现在结直肠癌肝转移患者尿液样本中Cathepsin D含量显著上升, 可能是监测结直肠癌肝转移的潜在尿液标志物.
本研究发现结直肠癌肝转移患者尿液中Cathepsin D含量显著高于结直肠癌患者和健康对照, 提示尿液中Cathepsin D可能是结直肠癌肝转移的潜在标志物, 为结直肠癌肝转移的监测提供了新的思路.
发展经济、无侵入性的监测方法诊断结直肠癌肝转移具有明显的临床价值, 本文以硝酸纤维素膜富集法快速富集到高质量的尿蛋白, 经尿肌酐校正后, 发现结直肠癌肝转移患者尿蛋白中Cathepsin D含量显著高于健康对照组, 提示尿液Cathepsin D可能是潜在的结直肠癌肝转移标志物, 对结直肠癌肝转移的临床诊断有一定参考价值.
编辑: 郭鹏 电编:闫晋利
| 1. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 2. | Stangl R, Altendorf-Hofmann A, Charnley RM, Scheele J. Factors influencing the natural history of colorectal liver metastases. Lancet. 1994;343:1405-1410. [PubMed] |
| 3. | Bröker ME, Lalmahomed ZS, Roest HP, van Huizen NA, Dekker LJ, Calame W, Verhoef C, Ijzermans JN, Luider TM. Collagen peptides in urine: a new promising biomarker for the detection of colorectal liver metastases. PLoS One. 2013;8:e70918. [PubMed] [DOI] |
| 4. | Hara M, Kanemitsu Y, Hirai T, Komori K, Kato T. Negative serum carcinoembryonic antigen has insufficient accuracy for excluding recurrence from patients with Dukes C colorectal cancer: analysis with likelihood ratio and posttest probability in a follow-up study. Dis Colon Rectum. 2008;51:1675-1680. [PubMed] [DOI] |
| 5. | Zhang H, Cao J, Li L, Liu Y, Zhao H, Li N, Li B, Zhang A, Huang H, Chen S. Identification of urine protein biomarkers with the potential for early detection of lung cancer. Sci Rep. 2015;5:11805. [PubMed] [DOI] |
| 6. | Olszowy P, Buszewski B. Urine sample preparation for proteomic analysis. J Sep Sci. 2014;37:2920-2928. [PubMed] [DOI] |
| 7. | Casado-Vela J, Gómez del Pulgar T, Cebrián A, Alvarez-Ayerza N, Lacal JC. Human urine proteomics: building a list of human urine cancer biomarkers. Expert Rev Proteomics. 2011;8:347-360. [PubMed] [DOI] |
| 8. | 邹 勇华, 杜 新. 点时间尿蛋白与尿肌酐比值与24h尿蛋白定量对应关系的研究. 南京医科大学学报(自然科学版). 2008;28:798-800. |
| 9. | National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis. 2002;39:S1-266. [PubMed] |
| 10. | Chambers AF, Matrisian LM. Changing views of the role of matrix metalloproteinases in metastasis. J Natl Cancer Inst. 1997;89:1260-1270. [PubMed] |
| 11. | Waszkiewicz N, Zalewska-Szajda B, Szajda SD, Kępka A, Waszkiewicz M, Roszkowska-Jakimiec W, Wojewódzka-Żeleźniakowicz M, Milewska AJ, Dadan J, Szulc A. Lysosomal exoglycosidases and cathepsin D in colon adenocarcinoma. Pol Arch Med Wewn. 2012;122:551-556. [PubMed] |
| 12. | Davies DR. The structure and function of the aspartic proteinases. Annu Rev Biophys Biophys Chem. 1990;19:189-215. [PubMed] [DOI] |
| 14. | Winchester B. Lysosomal metabolism of glycoproteins. Glycobiology. 2005;15:1R-15R. [PubMed] [DOI] |
| 15. | Kirana C, Shi H, Laing E, Hood K, Miller R, Bethwaite P, Keating J, Jordan TW, Hayes M, Stubbs R. Cathepsin D Expression in Colorectal Cancer: From Proteomic Discovery through Validation Using Western Blotting, Immunohistochemistry, and Tissue Microarrays. Int J Proteomics. 2012;2012:245819. [PubMed] [DOI] |
| 16. | Hewitson P, Glasziou P, Irwig L, Towler B, Watson E. Screening for colorectal cancer using the faecal occult blood test, Hemoccult. Cochrane Database Syst Rev. 2007;CD001216. [PubMed] [DOI] |
| 17. | Moshkowitz M, Arber N. Emerging technologies in colorectal cancer screening. Surg Oncol Clin N Am. 2005;14:723-746. [PubMed] [DOI] |
| 18. | Gao Y. Urine is a better biomarker source than blood especially for kidney diseases. Adv Exp Med Biol. 2015;845:3-12. [PubMed] [DOI] |
| 19. | Pedroza-Díaz J, Röthlisberger S. Advances in urinary protein biomarkers for urogenital and non-urogenital pathologies. Biochem Med (Zagreb). 2015;25:22-35. [PubMed] [DOI] |
| 20. | Schaub S, Wilkins J, Weiler T, Sangster K, Rush D, Nickerson P. Urine protein profiling with surface-enhanced laser-desorption/ionization time-of-flight mass spectrometry. Kidney Int. 2004;65:323-332. [PubMed] [DOI] |
| 21. | Li M, Zhao M, Gao Y. Changes of proteins induced by anticoagulants can be more sensitively detected in urine than in plasma. Sci China Life Sci. 2014;57:649-656. [PubMed] [DOI] |
| 22. | Wu T, Du Y, Han J, Singh S, Xie C, Guo Y, Zhou XJ, Ahn C, Saxena R, Mohan C. Urinary angiostatin--a novel putative marker of renal pathology chronicity in lupus nephritis. Mol Cell Proteomics. 2013;12:1170-1179. [PubMed] [DOI] |
| 23. | Santucci L, Candiano G, Petretto A, Bruschi M, Lavarello C, Inglese E, Righetti PG, Ghiggeri GM. From hundreds to thousands: Widening the normal human Urinome (1). J Proteomics. 2015;112:53-62. [PubMed] [DOI] |
| 24. | Liu X, Shao C, Wei L, Duan J, Wu S, Li X, Li M, Sun W. An individual urinary proteome analysis in normal human beings to define the minimal sample number to represent the normal urinary proteome. Proteome Sci. 2012;10:70. [PubMed] [DOI] |
| 25. | Jia L, Liu X, Liu L, Li M, Gao Y. Urimem, a membrane that can store urinary proteins simply and economically, makes the large-scale storage of clinical samples possible. Sci China Life Sci. 2014;57:336-339. [PubMed] [DOI] |
| 26. | Egberts F, Heinrich M, Jensen JM, Winoto-Morbach S, Pfeiffer S, Wickel M, Schunck M, Steude J, Saftig P, Proksch E. Cathepsin D is involved in the regulation of transglutaminase 1 and epidermal differentiation. J Cell Sci. 2004;117:2295-2307. [PubMed] [DOI] |
| 27. | Vetvicka V, Vetvickova J, Fusek M. Effect of procathepsin D and its activation peptide on prostate cancer cells. Cancer Lett. 1998;129:55-59. [PubMed] |
| 28. | Rochefort H, Garcia M, Glondu M, Laurent V, Liaudet E, Rey JM, Roger P. Cathepsin D in breast cancer: mechanisms and clinical applications, a 1999 overview. Clin Chim Acta. 2000;291:157-170. [PubMed] |
| 29. | Shin IY, Sung NY, Lee YS, Kwon TS, Si Y, Lee YS, Oh ST, Lee IK. The expression of multiple proteins as prognostic factors in colorectal cancer: cathepsin D, p53, COX-2, epidermal growth factor receptor, C-erbB-2, and Ki-67. Gut Liver. 2014;8:13-23. [PubMed] [DOI] |
| 30. | Gemoll T, Epping F, Heinrich L, Fritzsche B, Roblick UJ, Szymczak S, Hartwig S, Depping R, Bruch HP, Thorns C. Increased cathepsin D protein expression is a biomarker for osteosarcomas, pulmonary metastases and other bone malignancies. Oncotarget. 2015;6:16517-16526. [PubMed] [DOI] |
| 31. | Mimae T, Tsuta K, Maeshima AM, Okada M, Asamura H, Kondo T, Tsuda H. Cathepsin D as a potential prognostic marker for lung adenocarcinoma. Pathol Res Pract. 2012;208:534-540. [PubMed] [DOI] |