修回日期: 2016-04-14
接受日期: 2016-04-20
在线出版日期: 2016-05-18
目的: 探讨甲醛对小鼠肝脏miRNA-21及其下游基质金属蛋白酶组织抑制因子-3(the tissue inhibitors of metalloproteinase 3, TIMP-3)和伴有Kazal基序富含半胱氨酸的逆转诱导蛋白(reversion-inducing cysteine-rich protein with Kazal motifs, RECK)的影响.
方法: 将40只♀昆明小鼠随机分为甲醛染毒组(高浓度组、中浓度组、低浓度组)和对照组, 每组10只. 每日上午10时给予染毒组腹腔注射不同浓度的甲醛溶液, 给予对照组注射等量的生理盐水, 持续30 d. 应用实时荧光定量多聚核苷酸链式反应(RT-PCR)检测各组小鼠肝组织中miRNA-21的表达量, 同时用Western blot、免疫组织化学二步法检测各组小鼠肝组织中TIMP-3和RECK蛋白的表达情况.
结果: 低浓度组、中浓度组、高浓度组中的miRNA-21相对于对照组的表达量分别是1.16±0.18、1.61±0.29、2.48±0.49, 组间有明显差异(F = 38.02, P<0.0001). 对照组、低浓度组、中浓度组、高浓度组中的TIMP-3蛋白的相对表达量分别是1.30±0.058、1.04±0.083、0.85±0.070、0.23±0.067, 组间有明显差异(F = 125.8, P<0.0001). 对照组、低浓度组、中浓度组、高浓度组中的RECK蛋白的相对表达量分别是1.24±0.057、1.11±0.056、0.68±0.042、0.35±0.066, 组间有明显差异(F = 158.7, P<0.0001). 随着染毒溶液浓度的增加, miRNA-21相对表达量与TIMP-3相对表达量呈负相关(r = -0.990, P = 0.01), 与RECK相对表达量亦呈负相关(r = -0.974, P = 0.026).
结论: 甲醛染毒可以升高miRNA-21在肝脏中的表达, 且呈浓度依赖关系. 同时可降低TIMP-3和RECK蛋白的表达, 亦呈浓度依赖关系.
核心提示: 一定浓度的甲醛可以上调肝脏miRNA-21的表达, 且呈浓度依赖关系; miRNA-21的过表达可下调基质金属蛋白酶组织抑制因子-3和伴有Kazal基序富含半胱氨酸的逆转诱导蛋白的表达, 从而发挥其促进肿瘤发生发展的作用.
引文著录: 闫杨, 孙学国, 陈力, 孙莉娟, 路艳艳, 姜志荣, 李玲, 刘希双. 甲醛对肝脏miRNA-21及其下游TIMP-3和RECK蛋白的影响. 世界华人消化杂志 2016; 24(14): 2143-2151
Revised: April 14, 2016
Accepted: April 20, 2016
Published online: May 18, 2016
AIM: To investigate the effect of formaldehyde on miRNA-21 and its downstream proteins tissue inhibitor of metalloproteinase 3 (TIMP-3) and reversion-inducing cysteine-rich protein with Kazal motifs (RECK) in the liver of mice.
METHODS: Forty female Kunming mice were randomly divided into three formaldehyde groups (low-, medium- and high-concentration groups) and a control group. The three formaldehyde groups were intraperitoneally injected with different concentrations of formaldehyde at 10:00 am daily. The control group was injected with equal volume of normal saline. Real-time quantitative PCR (RT-PCR) was used to detect the changes of expression of miRNA-21 after 30 d. Immunohistochemistry and Western blot were used to test the expression of TIMP-3 and RECK in the liver.
RESULTS: The relative expression levels of miRNA-21 in the low-, medium-, and high-concentration groups, compared with that in the control group, were 1.16 ± 0.18, 1.61 ± 0.29 and 2.48 ± 0.49, respectively. There were significant differences in miRNA-21 expression among different groups (F = 38.02, P < 0.0001). The expression values of TIMP-3 in the control group, low-, medium-, and high-concentration groups were 1.30 ± 0.058, 1.04 ± 0.083, 0.85 ± 0.070 and 0.23 ± 0.067, respectively, and there were significant differences among different groups (F = 125.8, P < 0.0001). The expression values of RECK in the control group, low-, medium-, and high-concentration groups were 1.24 ± 0.057, 1.11 ± 0.056, 0.68 ± 0.042 and 0.35 ± 0.066, respectively, and there were also significant differences among different groups (F = 158.7, P < 0.0001). The relative expression of miRNA-21 showed a negative association with expression of TIMP-3 and RECK (r = -0.990, P = 0.01; r = -0.974, P = 0.026, respectively).
CONCLUSION: The expression of miRNA-21 in the liver is significantly increased by formaldehyde in a dose-dependent manner. Formaldehyde can decrease the expression of TIMP-3 and RECK in the same dose-dependent manner.
- Citation: Yan Y, Sun XG, Chen L, Sun LJ, Lu YY, Jiang ZR, Li L, Liu XS. Effect of formaldehyde on miRNA-21 and its downstream proteins TIMP-3 and RECK in the liver. Shijie Huaren Xiaohua Zazhi 2016; 24(14): 2143-2151
- URL: https://www.wjgnet.com/1009-3079/full/v24/i14/2143.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i14.2143
甲醛是一种高挥发性有机化合物, 作为化学原料, 被广泛应用于室内装修和工业领域, 研究表明, 甲醛可导致人类鼻咽癌、白血病, 并具有多系统毒性, 特别是中枢神经系统、生殖系统和呼吸系统的不良反应[1-4], 世界卫生组织(World Health Organization, WHO)已将甲醛列为人类致癌物. 尽管如此, 在人类的生产生活过程中, 甲醛仍无处不在, 例如食品(如水产品)自身固有, 或在其加工储藏过程中自身产生的内源性甲醛[5,6], 尤其近年来一些不法厂商利用甲醛的杀菌、防腐的特性, 为改善食品感官, 延长食品保存时间, 而将其添加到食品中, 都明显增加了人体接触甲醛的可能性. 进入人体的甲醛需要经过肝脏代谢, 所以其对肝脏的损伤以及与多种高发肝脏疾病之间的关系也受到广泛关注. 1993年由Lee等[7]在研究线虫时首次发现的微小RNA(microRNA, miRNA), 作为一类内源性非编码蛋白质的小分子单链RNA, 通过与靶基因mRNA分子的3'端非编码区完全或部分互补配对, 使相应的mRNA分子降解或抑制其翻译过程, 从而可以对基因进行转录后水平的调控[8]. 到目前为止, 已在人类基因组内发现了上千种miRNA, 调控至少30%以上的基因[9]. 近年研究证实miRNAs表达异常与肿瘤的发生发展关系密切, 其主要通过上述方式调节特异靶基因的表达, 影响后者在体内的生物学作用, 包括细胞的增殖、凋亡、侵袭和转移等生物学过程, 从而在肿瘤的发生和发展过程中扮演重要角色. 作为较早发现的人类miRNA之一, miRNA-21已被证实在肝细胞癌等的多种肿瘤组织中的表达量存在明显升高的现象[10-15], 甚至有研究提出, 当miRNA-21高表达时, 可能发挥与原癌基因类似的作用. 本研究中, 我们用RT-PCR检测miRNA-21, 用Western blot、免疫组织化学二步法检测其下游因子基质金属蛋白酶组织抑制因子-3(the tissue inhibitors of metalloproteinase 3, TIMP-3)和伴有Kazal基序富含半胱氨酸的逆转诱导蛋白(reversion-inducing cysteine-rich protein with Kazal motifs, RECK)蛋白, 分析甲醛溶液浓度与以上三者在肝脏组织中表达量之间的关系, 探讨甲醛对肝脏miRNA-21及其下游蛋白TIMP-3和RECK表达量的影响, 在miRNA及蛋白水平上解释甲醛对肝脏的致癌作用.
♀昆明小鼠40只, 2周龄, 体质量为20 g±2 g, 购自青岛派特福德白鼠养殖合作社. 试验期间小鼠自由进食、饮水. TRIzol提取液(Invitrogen公司); miRcute miRNA cDNA第一链合成试剂盒、miRcute miRNA荧光定量检测试剂盒、BCA蛋白质定量试剂盒(天根生化科技有限公司); miRNA-21引物、U6引物(广州易锦生物技术有限公司); 兔抗鼠TIMP-3多克隆抗体、兔抗鼠RECK多克隆抗体(北京博奥森生物技术有限公司); PV6001免疫组织化学试剂盒、DAB显色液(北京中杉金桥生物技术有限公司); 辣根过氧化物酶标记的羊抗兔IgG(赛默飞世尔科技); PVDF膜(罗氏); ECL显色液(武汉博士德生物工程有限公司). 主要仪器: 荧光PCR仪、低温高速离心机(Eppendorf公司); 电泳仪、电泳槽、转膜槽(Bio-Red公司); 化学发光、多色荧光及活体成像系统(VILBER公司); 切片机、电热恒温水温箱、摇床.
1.2.1 分组染毒: 试验前观察1 wk, 然后随机将小鼠随机分为对照组和3个染毒组, 每组10只, 对照组为9 g/L生理盐水, 染毒组甲醛浓度分别为20 mg/kg(低浓度组)、40 mg/kg(中浓度组)和80 mg/kg(高浓度组). 在无菌条件下, 采用腹腔注射的方法, 每天上午10时注射1次, 每次注射0.1 mL/10 g. 染毒组注射不同浓度甲醛溶液, 对照组注射为生理盐水. 注射30 d后处死小鼠. 小鼠肝脏取出后取100 mg用于提取总RNA, 取100 mg用于提取蛋白, 剩余组织经40 g/L甲醛溶液固定、常规石蜡包埋、切片.
1.2.2 提取肝组织总RNA: 取新鲜肝组织100 mg置入研磨器内, 加入1 mL TRIzol提取液, 冰上快速彻底研磨, 收集匀浆, 剧烈震荡15 s后于30 ℃温箱孵育5 min. 加入1/5匀浆体积的氯仿, 漩涡混匀15 s, 30 ℃温箱孵育5 min, 离心(12000 r/min, 15 min, 4 ℃). 取上清液并记录上清液体积, 加入等体积的异丙醇, 上下颠倒混匀, 30 ℃温箱孵育5 min, 离心(12000 r/min, 10 min, 4 ℃). 弃上清, 加预冷的750 mL/L乙醇1 mL. 4 ℃离心, 7500 r/min, 5 min. 弃上清, 空气干燥5-10 min, 紫外分光光度计测定总RNA浓度与纯度.
1.2.3 miRNA的逆转录与RT-PCR: 将总RNA溶于DEPC处理水中至20 μL. 按miRcute miRNA cDNA第一链合成试剂盒说明进行miRNA 3'末端加Poly(A)处理及逆转录反应. 选择U6 snRNA作为内参, 按miRcute miRNA荧光定量检测试剂盒说明书对各样本进行miRNA-21含量检测, miRNA-21上游引物序列5'-UAGCUUAUCAGACUGAUGUUGA-3', U6上游引物序列为5'-GCTTCGGCAGCACATATACTAAAAT-3', 反应条件: 起始模板变性94 ℃ 2 min, 变性和退火、延伸94 ℃ 20 s, 60 ℃ 34 s, 45个循环. 用2-△△Ct法整理数据, △Ct = CtmiRNA-21-Ctu6, △△Ct = Ct实验组-Ct对照组.
1.2.4 免疫组织化学检测: 按PV6001免疫组织化学试剂盒说明对切片进行脱腊、抗原修复、血清封闭、加一抗、加二抗、显色、复染、脱水和封片操作. 各样本切片在400×光镜下随机观察3个不同的视野, 每个视野记数200个细胞, TIMP-3与RECK均以细胞质出现黄色颗粒为阳性. 结果判定: (1)根据阳性染色强度计分: 细胞无染色记0分; 细胞呈浅黄色, 为弱阳性, 计1分; 细胞染成棕黄色, 为中等阳性, 计2分; 细胞呈深棕色无背景着色, 为强阳性, 计3分; (2)根据阳性细胞比例计分: 阳性细胞表达≤5%, 计0分; 阳性细胞表达≤25%, 计1分; 25%<阳性细胞≤50%, 计2分; 阳性表达数在50%以上, 计3分. 上述两种判定标准计分相乘为评定该视野目的蛋白表达量的最终计分.
1.2.5 提取肝组织总蛋白: 取新鲜肝组织100 mg置入研磨器内, 加入1 mL细胞裂解液(RIPA∶PMSF∶cocktail = 98∶1∶1), 冰上快速彻底研磨, 收集匀浆, 离心(12000 r/min, 15 min, 4 ℃), 取上清液并计量体积. 按BCA蛋白质定量试剂盒说明书测定各样本总蛋白浓度.
1.2.6 Western blot检测: TIMP-3蛋白分子量21 kDa, 选择分离胶浓度为12%, RECK蛋白分子量104 kDa, 选择分离胶浓度为8%, 浓缩胶浓度均为5%. 样本蛋白含量为40 μg/孔, 上样体积10 μL. 根据各样本蛋白浓度向上清液中加入相应 loading和裂解液, 煮蛋白(95 ℃, 5 min). 电泳恒压80 V, 待条带进入分离胶后转电压为120 V, 待目的条带完全跑开. 选择GAPDH蛋白作为内参, 进行细化. 转膜电流为恒流130 mA, 时间TIMP-3为30 min, GAPDH为60 min, RECK为110 min. 脱脂奶粉封闭2 h, TBST洗膜10 min×3次, 敷一抗, 4 ℃过夜. TBST洗膜10 min×3次, 敷二抗, 常温2 h. TBST洗膜10 min×3次, 进行荧光CCD检测, 用FusionCapt Advance软件对所得条带定量分析, 获得数据.
统计学处理 用GraphPad Prism5软件进行统计学分析, 其定量资料以mean±SD形式表示, 多样本均数比较采用单因素方差分析, 多组样本均数间的两两比较采用LSD法进行分析, 相关性分析采用Pearson法, 处理结果以P<0.05为差异有统计学意义.
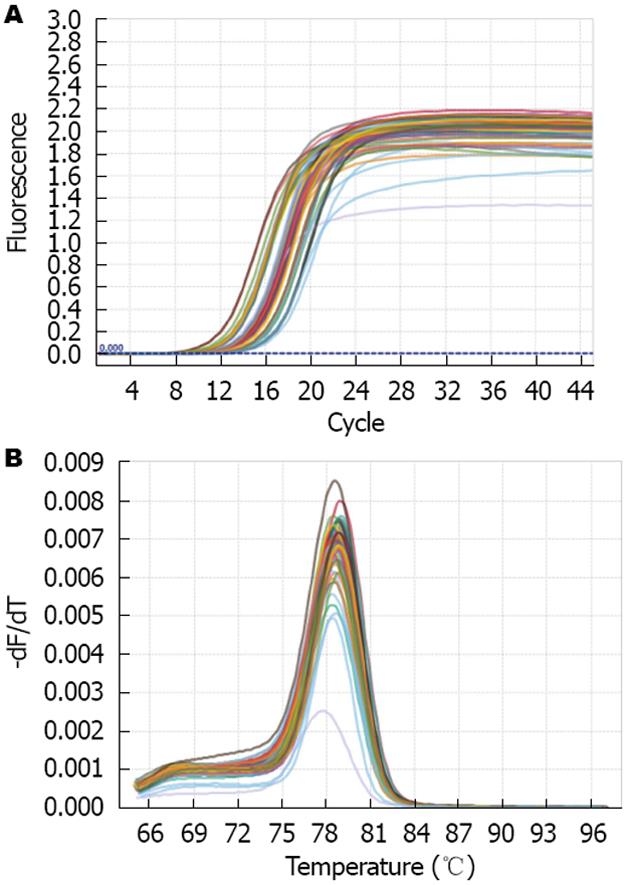
扩增曲线表明对数期阶段模板拷贝数与荧光累计值之间存在线性关系, 以此形成定量的基础(图1A). 在PCR反应完毕后进行融解曲线分析, miRNA-21的融解曲线均为单峰, 说明扩增产物单一, 同时也进一步验证了引物的特异性与可信性(图1B).
用单因素方差分析统计经2-△△Ct方法处理所得各实验组数据值, 低浓度组、中浓度组、高浓度组中的miRNA-21相对于对照组的表达量分别是1.16±0.18、1.61±0.29、2.48±0.49, 组间有明显差异(F = 38.02, P<0.0001). LSD法检验各组间miRNA-21表达量差异, 结果显示高浓度组与中浓度组、低浓度组相比, miRNA-21表达均明显升高, 差异有统计学意义(P<0.001、P<0.001), 且中浓度组与低浓度组相比, miRNA-21表达量升高, 差异具有统计学意义(P<0.01).
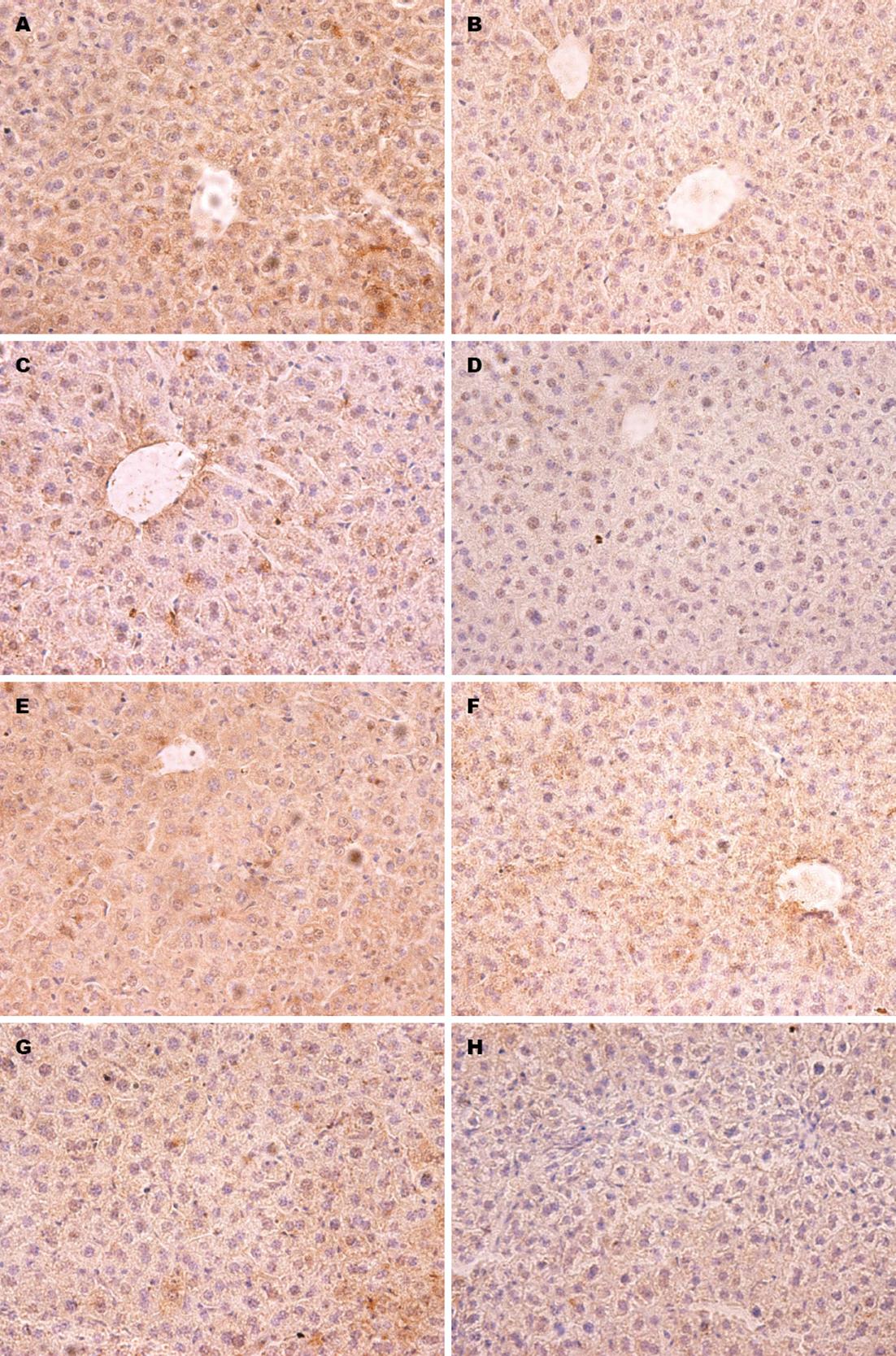
如图2所示, 镜下观察肝组织切片, TIMP-3和RECK蛋白均表达于肝细胞的胞质中, 染色呈浅黄色至深棕色. 用单因素方差分析统计各组样本镜下视野目的蛋白表达量计分. 对照组、低浓度组、中浓度组、高浓度组中的TIMP-3蛋白的表达量分别是7.72±1.55、6.42±1.82、5.02±1.98、3.41±1.59, 组间有明显差异(F = 67.52, P<0.0001). LSD法检验各组间TIMP-3表达量差异, 结果显示对照组、低浓度组、中浓度组、低高度组4组TIMP-3表达量呈阶梯样减少, 相邻两组间差异均有统计学意义(P<0.05、P<0.05、P<0.05). 对照组、低浓度组、中浓度组、高浓度组中的RECK蛋白的表达量分别是8.00±1.44、6.73±1.76、5.50±1.85、3.83±1.66, 组间有明显差异(F = 33.37, P<0.0001). LSD法检验各组间RECK表达量差异, 结果显示对照组、低浓度组、中浓度组、低高度组4组RECK表达量呈阶梯样减少, 相邻两组间差异均有统计学意义(P<0.05、P<0.05、P<0.05).
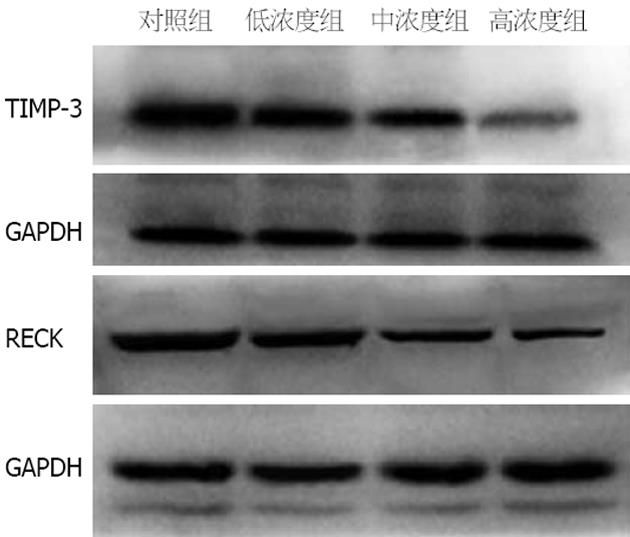
如图3所示, TIMP-3和RECK蛋白在肝脏组织中的表达量对染毒浓度的升高而减少. 用单因素方差分析统计经FusionCapt Advance软件处理所得各组数据值. 对照组、低浓度组、中浓度组、高浓度组中的TIMP-3蛋白的相对表达量分别是1.30±0.058、1.04±0.083、0.85±0.070、0.23±0.067, 组间有明显差异(F = 125.8, P<0.0001). LSD法检验各组间TIMP-3表达量差异, 结果显示高浓度组、中浓度组、低浓度组与对照组相比, TIMP-3表达均减少, 差异有统计学意义(P<0.001、P<0.001、P<0.05), 且高浓度组与中浓度组、低浓度组相比, TIMP-3表达明显减少, 差异有统计学意义(P<0.001、P<0.001), 中浓度组与低浓度组相比, TIMP-3表达无统计学差异(P>0.05). 对照组、低浓度组、中浓度组、高浓度组中的RECK蛋白的相对表达量分别是1.24±0.057、1.11±0.056、0.68±0.042、0.35±0.066, 组间有明显差异(F = 158.7, P<0.0001). LSD法检验各组间RECK表达量差异, 结果显示高浓度组、中浓度组与对照组相比, RECK表达均明显减少, 差异有统计学意义(P<0.001、P<0.001), 且低浓度组、中浓度组、低高度组3组RECK表达呈阶梯样减少, 相邻组间差异均有统计学意义(P<0.001、P<0.001), 低浓度组与对照组相比, RECK表达无统计学差异(P>0.05).
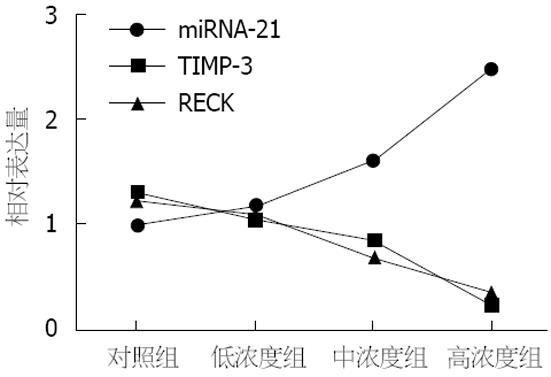
随着染毒溶液浓度的增加, miRNA-21相对表达量与TIMP-3相对表达量呈负相关(r = -0.990, P = 0.01), 与RECK相对表达量亦呈负相关(r = -0.974, P = 0.026)(图4).
甲醛作为一种具有多系统多器官毒性的人类致癌物, 对人体重要的解毒器官肝脏存在不可避免的不良反应, 可以导致肝功能损害, 甚至诱发肝癌, 国外曾经就有居住在含有甲醛建筑材料的建筑中发生急性中毒性肝炎的报告[16]. 研究[17,18]发现甲醛可以使人体内的氧自由基生成增多以及抗氧化酶活性降低, 而过多的自由基通过作用于脂质发生过氧化反应生成终产物丙二醛(malonaldehyde, MDA), 最终导致蛋白质、核酸等生物大分子的交联聚合. 有专家曾用小鼠做实验, 静式吸入甲醛, 持续28 d, 测定肝脏组织中超氧化物歧化酶(superoxide dismutase, SOD)活力、谷胱甘肽(glutathione, GSH)及MDA含量, 结果显示甲醛染毒能引起肝脏中抗氧化无GSH含量减少, 抗氧化酶SOD活力降低, 以及脂质过氧化产物MDA含量增加, 说明氧化损伤是甲醛肝毒性的机制之一. 尽管如此, 目前关于甲醛的肝脏毒性机制以及诱发肝癌的机制, 研究尚不完善.
miRNAs因其能参与调控多种细胞活动, 包括生长、代谢、增殖、分化和凋亡, 已经成为近年来研究的热点. 研究发现, 甲醛可以导致动物鼻黏膜上皮细胞以及肺细胞中的miRNA表达紊乱, 并对人类呼吸系统的miRNA同样具有扰乱作用[19-21], 这为甲醛诱发肝癌的机制研究提供了新的思路. 现有研究显示, miRNA-21在肝再生早期可能参与基因表达调控[22], 也可作用于靶基因程序性细胞死亡因子4(programmed cell death protein-4, PDCD4)而抑制乳腺癌细胞凋亡[11]. 另有学者证实miRNA-21在肝癌组织中的表达上调[12,23,24], 与正常肝脏相比, miRNA-21在肝癌细胞株(HepG2, PLC、Huh7)中的克隆指数明显升高[25], 且通过多种机制促进肝癌的发生, 并和细胞的增殖及肿瘤的侵袭转移密切相关. miRNA-21与肝癌有关的下游因子包括TIMP-3、RECK、PTEN等. 其中TIMP-3是基质金属蛋白酶(matrix metalloproteinases, MMPs)组织抑制因子家族中的一员, 通过减少MMPs对细胞外基质和基底膜的降解, 以及干扰其对原发和继发肿瘤的生长调节, 起到防止新生血管形成、抑制肿瘤侵袭和转移的作用[26,27]. RECK作为新发现的MMPs抑制剂, 也可在转录后水平下调多种MMPs(例如MMP-2、MMP-9、MMP-14)的有效表达[28,29], 其中MMP-2和MMP-9是肿瘤侵袭转移过程中涉及到的主要蛋白水解酶[30]. RECK是miRNA-21的直接靶基因, TIMP-3也作为miRNA-21信号通路的下游效应器发挥作用[31], miRNA-21上调能抑制RECK和TIMP-3的表达, 导致MMPs的表达升高, 从而增强肝癌细胞的侵袭性和迁移能力.
本研究中用RT-PCR法检测各浓度甲醛染毒组与对照组小鼠肝脏组织miRNA-21的表达量, 结果显示, 各染毒组与对照组相比, 表达量均有所增加, 而且染毒浓度越高, 表达量增加越明显. 提示甲醛可以上调肝脏组织中miRNA-21的表达, 且染毒浓度越高, 上调作用越明显. 对TIMP-3和RECK蛋白的检测, 我们分别采用了免疫组织化学法和Western blot法. 免疫组织化学法结果显示染毒组较对照组两种蛋白表达均减少, 且随染毒浓度升高, 表达均呈递减趋势. 此处的免疫组织化学法对各样本目的蛋白表达量的计分判定不仅考虑到其表达强度, 同时结合阳性细胞百分比分进行计分, 使最终统计结果更加可信[32]. Western blot检测结果显示, TIMP-3在中浓度组与低浓度组之间的差异不明显, RECK在低浓度组与对照组之间的差异不明显, 此外所得结果与免疫组织化学结果一致, 两种蛋白的表达随染毒浓度升高呈递减趋势. 将Western blot检测所得各组TIMP-3和RECK表达量结果与miRNA-21表达量进行相关性分析, 结果显示miRNA-21与TIMP-3、RECK的表达均呈负相关, 具有统计学意义.
免疫组织化学及Western blot所得结果均符合上调的miRNA-21对TIMP-3和RECK蛋白表达的下调作用, 说明甲醛可以影响肝脏组织miRNA-21及其下游因子的表达, 从而发挥其促进肿瘤发生发展的作用, 也从miRNA水平阐释了甲醛导致肝癌发生发展的一条可能的信号通路, 进一步完善了甲醛的肝脏毒性学说.
甲醛作为一种常见的化学性污染物, 已被列为人类致癌物. 但其对肝脏的致癌作用尚未明确. miRNA-21高表达时, 可能发挥与原癌基因类似的作用, 与肝癌的发生关系密切. 本文以甲醛对肝脏miRNA-21及其下游蛋白的影响为研究方向, 讨论甲醛诱发肝癌的可能性.
李瑜元, 教授, 广州市第一人民医院内科; 毛华, 教授, 主任医师, 南方医科大学(原第一军医大学)珠江医院消化内科
目前普遍认为miRNA-21的高表达及其下游因子的表达紊乱是导致肝癌等肿瘤发生发展的重要原因, miRNA-21与肝癌的关系已成为当今研究热点. 外部化学物质能否影响miRNA-21的表达需要进一步研究.
Rager等的研究发现甲醛可以使人类细胞中miRNA的表达受到影响. 通过分析这些发生改变的miRNA以及其下游因子可以发现, miRNA的表达紊乱最终可与癌症发生关联. 即甲醛可能会通过影响miRNA的表达而致癌.
本研究通过观察甲醛对小鼠肝脏miRNA-21的影响来探讨甲醛促进肝癌发生发展可能性, 并进一步检测了与肝癌相关的两种蛋白: 基质金属蛋白酶组织抑制因子-3(the tissue inhibitors of metalloproteinase 3, TIMP-3)和伴有Kazal基序富含半胱氨酸的逆转诱导蛋白(reversion-inducing cysteine-rich protein with Kazal motifs, RECK), 在多个层次上探讨甲醛促进肝癌发生发展的可能机制.
本研究证实甲醛扰乱了肝脏miRNA-21的表达, 同时下调了下游致癌基因的表达, 证实了miRNA-21有类似原癌基因的作用, 也进一步验证了甲醛可促进肝癌发生发展的假说. 对避免接触过量甲醛, 预防肝癌提供了理论依据, 也为治疗及控制肝癌提供了潜在靶点.
RECK蛋白: 由RECK基因编码, 含971个氨基酸, 其中半胱氨酸含量高达9.2%, 含有3个中心的丝氨酸水解酶抑制剂区域, 2个与表皮生长因子重复序列同源性区域, 能在转录后水平抑制多种MMP的表达.
甲醛对肝损害和致癌作用已有报告, 但机制未完全明确. 本文是动物研究, 探讨miRNA-21在发病中的作用, 发现甲醛染毒可以升高miRNA-21在肝脏中的表达, 下调TIMP-3和RECK蛋白. 论文有创新性, 研究方法合理.
编辑: 郭鹏 电编:闫晋利
| 1. | Swenberg JA, Moeller BC, Lu K, Rager JE, Fry RC, Starr TB. Formaldehyde carcinogenicity research: 30 years and counting for mode of action, epidemiology, and cancer risk assessment. Toxicol Pathol. 2013;41:181-189. [PubMed] [DOI] |
| 2. | Zhang L, Freeman LE, Nakamura J, Hecht SS, Vandenberg JJ, Smith MT, Sonawane BR. Formaldehyde and leukemia: epidemiology, potential mechanisms, and implications for risk assessment. Environ Mol Mutagen. 2010;51:181-191. [PubMed] [DOI] |
| 3. | Gentry PR, Rodricks JV, Turnbull D, Bachand A, Van Landingham C, Shipp AM, Albertini RJ, Irons R. Formaldehyde exposure and leukemia: critical review and reevaluation of the results from a study that is the focus for evidence of biological plausibility. Crit Rev Toxicol. 2013;43:661-670. [PubMed] [DOI] |
| 4. | Zhang L, Steinmaus C, Eastmond DA, Xin XK, Smith MT. Formaldehyde exposure and leukemia: a new meta-analysis and potential mechanisms. Mutat Res. 2009;681:150-168. [PubMed] [DOI] |
| 7. | Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell. 1993;75:843-854. [PubMed] |
| 8. | Lytle JR, Yario TA, Steitz JA. Target mRNAs are repressed as efficiently by microRNA-binding sites in the 5' UTR as in the 3' UTR. Proc Natl Acad Sci USA. 2007;104:9667-9672. [PubMed] [DOI] |
| 9. | Kent OA, Mendell JT. A small piece in the cancer puzzle: microRNAs as tumor suppressors and oncogenes. Oncogene. 2006;25:6188-6196. [PubMed] [DOI] |
| 10. | Li Y, Li W, Yang Y, Lu Y, He C, Hu G, Liu H, Chen J, He J, Yu H. MicroRNA-21 targets LRRFIP1 and contributes to VM-26 resistance in glioblastoma multiforme. Brain Res. 2009;1286:13-18. [PubMed] [DOI] |
| 11. | Frankel LB, Christoffersen NR, Jacobsen A, Lindow M, Krogh A, Lund AH. Programmed cell death 4 (PDCD4) is an important functional target of the microRNA miR-21 in breast cancer cells. J Biol Chem. 2008;283:1026-1033. [PubMed] [DOI] |
| 12. | Karakatsanis A, Papaconstantinou I, Gazouli M, Lyberopoulou A, Polymeneas G, Voros D. Expression of microRNAs, miR-21, miR-31, miR-122, miR-145, miR-146a, miR-200c, miR-221, miR-222, and miR-223 in patients with hepatocellular carcinoma or intrahepatic cholangiocarcinoma and its prognostic significance. Mol Carcinog. 2013;52:297-303. [PubMed] [DOI] |
| 13. | Shibuya H, Iinuma H, Shimada R, Horiuchi A, Watanabe T. Clinicopathological and prognostic value of microRNA-21 and microRNA-155 in colorectal cancer. Oncology. 2010;79:313-320. [PubMed] [DOI] |
| 14. | Motoyama K, Inoue H, Mimori K, Tanaka F, Kojima K, Uetake H, Sugihara K, Mori M. Clinicopathological and prognostic significance of PDCD4 and microRNA-21 in human gastric cancer. Int J Oncol. 2010;36:1089-1095. [PubMed] |
| 15. | 刘 琳, 王 月玲, 王 江芬. miR-21、miR-126、miR-143和miR-373在正常宫颈组织、宫颈癌组织及Hela细胞中的表达差异. 四川大学学报(医学版). 2012;43:536-539. |
| 16. | Seifert B, Becker K, Helm D, Krause C, Schulz C, Seiwert M. The German Environmental Survey 1990/1992 (GerES II): reference concentrations of selected environmental pollutants in blood, urine, hair, house dust, drinking water and indoor air. J Expo Anal Environ Epidemiol. 2000;10:552-565. [PubMed] [DOI] |
| 17. | Ozen OA, Kus MA, Kus I, Alkoc OA, Songur A. Protective effects of melatonin against formaldehyde-induced oxidative damage and apoptosis in rat testes: an immunohistochemical and biochemical study. Syst Biol Reprod Med. 2008;54:169-176. [PubMed] [DOI] |
| 18. | Bakar E, Ulucam E, Cerkezkayabekir A. Investigation of the protective effects of proanthocyanidin and vitamin E against the toxic effect caused by formaldehyde on the liver tissue. Environ Toxicol. 2015;30:1406-1415. [PubMed] [DOI] |
| 19. | Rager JE, Smeester L, Jaspers I, Sexton KG, Fry RC. Epigenetic changes induced by air toxics: formaldehyde exposure alters miRNA expression profiles in human lung cells. Environ Health Perspect. 2011;119:494-500. [PubMed] [DOI] |
| 20. | Rager JE, Moeller BC, Doyle-Eisele M, Kracko D, Swenberg JA, Fry RC. Formaldehyde and epigenetic alterations: microRNA changes in the nasal epithelium of nonhuman primates. Environ Health Perspect. 2013;121:339-344. [PubMed] [DOI] |
| 21. | Rager JE, Moeller BC, Miller SK, Kracko D, Doyle-Eisele M, Swenberg JA, Fry RC. Formaldehyde-associated changes in microRNAs: tissue and temporal specificity in the rat nose, white blood cells, and bone marrow. Toxicol Sci. 2014;138:36-46. [PubMed] [DOI] |
| 22. | Marquez RT, Wendlandt E, Galle CS, Keck K, McCaffrey AP. MicroRNA-21 is upregulated during the proliferative phase of liver regeneration, targets Pellino-1, and inhibits NF-kappaB signaling. Am J Physiol Gastrointest Liver Physiol. 2010;298:G535-G541. [PubMed] [DOI] |
| 23. | Kutay H, Bai S, Datta J, Motiwala T, Pogribny I, Frankel W, Jacob ST, Ghoshal K. Downregulation of miR-122 in the rodent and human hepatocellular carcinomas. J Cell Biochem. 2006;99:671-678. [PubMed] [DOI] |
| 24. | Connolly E, Melegari M, Landgraf P, Tchaikovskaya T, Tennant BC, Slagle BL, Rogler LE, Zavolan M, Tuschl T, Rogler CE. Elevated expression of the miR-17-92 polycistron and miR-21 in hepadnavirus-associated hepatocellular carcinoma contributes to the malignant phenotype. Am J Pathol. 2008;173:856-864. [PubMed] [DOI] |
| 25. | Landgraf P, Rusu M, Sheridan R, Sewer A, Iovino N, Aravin A, Pfeffer S, Rice A, Kamphorst AO, Landthaler M. A mammalian microRNA expression atlas based on small RNA library sequencing. Cell. 2007;129:1401-1414. [PubMed] [DOI] |
| 26. | Visse R, Nagase H. Matrix metalloproteinases and tissue inhibitors of metalloproteinases: structure, function, and biochemistry. Circ Res. 2003;92:827-839. [PubMed] [DOI] |
| 27. | Spurbeck WW, Ng CY, Vanin EF, Davidoff AM. Retroviral vector-producer cell-mediated in vivo gene transfer of TIMP-3 restricts angiogenesis and neuroblastoma growth in mice. Cancer Gene Ther. 2003;10:161-167. [PubMed] [DOI] |
| 28. | Rhee JS, Coussens LM. RECKing MMP function: implications for cancer development. Trends Cell Biol. 2002;12:209-211. [PubMed] [DOI] |
| 29. | Oh J, Takahashi R, Kondo S, Mizoguchi A, Adachi E, Sasahara RM, Nishimura S, Imamura Y, Kitayama H, Alexander DB. The membrane-anchored MMP inhibitor RECK is a key regulator of extracellular matrix integrity and angiogenesis. Cell. 2001;107:789-800. [PubMed] [DOI] |
| 30. | Oshima T, Kunisaki C, Yoshihara K, Yamada R, Yamamoto N, Sato T, Makino H, Yamagishi S, Nagano Y, Fujii S. Clinicopathological significance of the gene expression of matrix metalloproteinases and reversion-inducing cysteine-rich protein with Kazal motifs in patients with colorectal cancer: MMP-2 gene expression is a useful predictor of liver metastasis from colorectal cancer. Oncol Rep. 2008;19:1285-1291. [PubMed] [DOI] |
| 31. | Gabriely G, Wurdinger T, Kesari S, Esau CC, Burchard J, Linsley PS, Krichevsky AM. MicroRNA 21 promotes glioma invasion by targeting matrix metalloproteinase regulators. Mol Cell Biol. 2008;28:5369-5380. [PubMed] [DOI] |