修回日期: 2016-03-30
接受日期: 2016-04-05
在线出版日期: 2016-05-08
目的: 研究生长激素(growth hormone, GH)慢性刺激对肝脏Janus激酶2(Janus kinase 2, JAK2)-信号转导及转录激活因子5(signal transducer and activator of transcription 5, STAT5)信号通路的影响.
方法: 动物实验使用健康BALB/c ♂小鼠, 分为GH慢性刺激组与对照组, 每日分别予GH或PBS刺激共2 wk; 检测肝脏P-STAT5、信号转导抑制因子(suppressor of cytokine signaling, SOCS)-3 mRNA及生长激素受体(growth hormone receptor, GHR)水平. 细胞实验使用大鼠肝癌细胞H4-II-E, 分为GH慢性刺激组与对照组, 每日分别予GH或PBS刺激共4 d; 检测细胞P-STAT5水平及P-STAT5与DNA的结合水平.
结果: 动物试验中, 小鼠接受GH慢性刺激后, 肝脏P-STAT5水平降低, SOCS-3 mRNA水平升高(P<0.05), 而GHR水平无变化. 细胞实验中, GH慢性刺激同样导致P-STAT5水平下降(P<0.05), 同时P-STAT5与DNA的结合水平亦降低(P<0.05).
结论: GH慢性刺激可抑制肝脏JAK2-STAT5信号通路, 其机制可能是SOCS-3基因的表达增加, 从而抑制了STAT5的磷酸化.
核心提示: 生长激素慢性刺激可抑制肝脏Janus激酶2-信号转导及转录激活因子5(signal transducer and activator of transcription 5, STAT5)信号通路, 其机制可能与SOCS-3基因的表达增加抑制了STAT5的磷酸化有关.
引文著录: 赵巧飞, 徐扬志, 邹婧, 何济满. 生长激素慢性刺激对肝脏JAK2-STAT5信号通路的影响. 世界华人消化杂志 2016; 24(13): 2032-2037
Revised: March 30, 2016
Accepted: April 5, 2016
Published online: May 8, 2016
AIM: To investigate the effect of chronic administration of growth hormone (GH) on the JAK2-STAT5 signaling pathway in the liver.
METHODS: Healthy male BALB/c mice were treated with recombinant human growth hormone (r-hGH) daily for two weeks, or with equal amount of sterile phosphate buffered saline (PBS). Then the expression levels of tyrosine phosphorylated signal transducer and activator of transcription 5 (P-STAT5), and suppressor of cytokine signaling 3 (SOCS-3) mRNA and growth hormone receptor (GHR) were examined. H4-II-E cells were treated with r-hGH daily for 4 d, or with equal amount of PBS. Then the expression level of P-STAT5 and the DNA binding activity of P-STAT5 were examined.
RESULTS: After chronic administration of GH, liver P-STAT5 level decreased, SOCS-3 mRNA increased (P < 0.05), and no change was observed for GHR expression. Similar results were observed in the cell culture experiments. Chronic administration of GH caused an inhibition of P-STAT5 expression and also its DNA binding activity (P < 0.05).
CONCLUSION: Chronic administration of GH inhibits the JAK2-STAT5 signaling pathway in the liver via mechanisms possibly associated with increasing the expression of SOCS-3 gene.
- Citation: Zhao QF, Xu YZ, Zou J, He JM. Effect of chronic administration of growth hormone on JAK2-STAT5 signaling pathway in the liver. Shijie Huaren Xiaohua Zazhi 2016; 24(13): 2032-2037
- URL: https://www.wjgnet.com/1009-3079/full/v24/i13/2032.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i13.2032
生长激素(growth hormone, GH)是人体重要的生长调节因子, 对机体代谢与生长发育有多种影响[1,2]. GH缺乏可造成儿童生长发育障碍、成人代谢紊乱等疾病. 临床上常使用重组人生长激素(recombinant human growth hormone, r-hGH)治疗GH缺乏症(growth hormone deficiency, GHD), 以及儿童慢性肾功能不全、先天性卵巢发育不全综合征(turner syndrome, TS)、HIV/AIDS的消耗与恶病质、炎症性肠病、烧伤、重症胰腺炎等[3-9]. 但长期使用易产生GH不敏感, 而其机制还很多都不清楚.
Janus激酶2(Janus kinase 2, JAK2)-信号转导及转录激活因子5(signal transducer and activator of transcription 5, STAT5)通路是GH重要的信号通路. GH与生长激素受体(growth hormone receptor, GHR)结合后激活JAK2与自身的磷酸化, 进一步激活STAT5磷酸化产生P-STAT5, P-STAT5结合于DNA上GH调控基因的启动区域, 激活一系列基因表达, 从而产生各种细胞效应[1,2,10]. 信号转导抑制因子(suppressor of cytokine signaling, SOCS)家族被认为对该通路有调控作用, 其中SOCS-2、SOCS-3及CIS被认为是该信号通路的抑制性调控因子[10-12]. 肝脏是人体GH重要的靶器官, 本研究从在体水平(健康BALB/c ♂小鼠)及细胞水平(大鼠肝癌细胞系H4-II-E), 研究GH慢性刺激对肝脏JAK2-STAT5信号转导通路的影响机制.
8周龄BALB/c ♂小鼠16只, SPF级标准饲养于南方医院动物实验中心, 大鼠肝癌细胞系H4-II-E, 冻存于南方医院广东省消化病研究所. 注射用重组人生长激素(安苏萌)(20141229)[安徽安科生物工程(集团)股份有限公司], P-Stat 5b抗体(Tyr694)(D47E7)(美国Cell Signaling公司), P-Stat 5b抗体(Tyr694)(C71E5)(美国Cell Signaling公司), 辣根过氧化物酶标记的山羊抗兔IgG/Alexa Flor 488(ZF0511)(北京中杉金桥公司), GHR抗体(B-10)(SC-137185)(美国Santa Cruz公司), β-Actin抗体(MG3)(RM2001)(锐抗生物), 辣根过氧化物酶标记的山羊抗小鼠IgG(ZB2305)(北京中杉金桥公司), 辣根过氧化物酶标记的山羊抗兔IgG(ZB2301)(北京中杉金桥公司), SHP-1抗体(Y476)(ab32559)(美国Santa Cruz公司), BCA蛋白检测试剂盒(#23228, #1859078)(美国Thermo公司), 化学发光增强剂(ECL)试剂盒(P0018-1, P0018-2)(上海碧云天公司), EMSA试剂盒(#20148)(美国Thermo公司). Miles 4622全自动组织脱水机(德国Miles公司), 正置荧光显微镜(BX50)(日本奥林巴斯公司), BeckmanCS-15R低温高速离心机(美国Beckman公司), Power Pac-HC164-5052电泳仪(美国BIO.RAD公司), 硝酸纤维素薄膜(美国Millipore公司), X-OMAT BT医用X射线胶片[锐珂(厦门)医疗器材有限公司], GDS7500光密度扫描仪(美国UVT公司), Surecycler8800PCR仪(美国Agilent Technologies公司), Light Cycler 480II PCR仪(瑞士Roche公司), ImageJ光密度分析软件, SPSS20.0软件.
1.2.1 动物实验: 将16只6-8周龄的健康♂BALB/c小鼠随机分为GH慢性刺激组和对照组, 每组8只. GH慢性组按3 μg/g体质量剂量予2次/d腹腔注射r-hGH(1 mg/mL), 对照组予等量0.1 mol/L的PBS液, 共2 wk; 末次注射后16 h于次日上午8:00处死. 处死前使用水合氯醛充分麻醉, 然后快速摘取肝脏冻存于液氮中, 再移至-80℃低温冰箱长期保存. 制作冰冻组织切片, 免疫荧光法检测小鼠肝组织中P-STAT5的表达水平; 提取组织RNA, RT-PCR检测SOCS-3基因mRNA的表达水平; 提取组织蛋白, 蛋白印迹法(Western blot)检测GHR的表达水平.
1.2.2 细胞培养实验: H4-II-E细胞均匀铺12孔细胞培养板, 分为GH慢性刺激组与对照组, 每组6孔, 予含4%胎牛血清的DMEM培养基培养. 每日分别予等量r-hGH(500 ng/mL)与PBS(0.1 mmol/L)刺激, 共4 d, 末次刺激后24 h予血清及GH饥饿6 h, 之后每组3孔予1次单剂量r-hGH刺激, 3孔予等量PBS, 30 min后裂解. 提取细胞蛋白, Western blot检测P-STAT5的表达水平; 提取细胞DNA, 凝胶迁移实验(EMSA)检测P-STAT5与DNA的结合水平.
统计学处理 实验数据使用Microsoft Excel2010软件记录, 采用SPSS20.0统计软件进行统计学分析, 两组间比较采用两独立样本t检验(Independent-Samples t Test)或Satterthwaite近似t检验(符合或不符合方差齐性), 实验结果以mean±SD表示, 以P<0.05为差异有统计学意义.
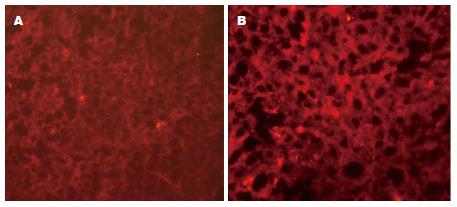
STAT5是JAK2-STAT5信号通路重要的信号因子, 磷酸化之后才可激活相应的基因表达. 故本实验检测了GH慢性刺激下肝脏STAT5磷酸化水平的变化. 图1为组织免疫荧光实验, 结果显示相较于对照组, GH慢性刺激组小鼠肝脏的P-STAT5水平降低, 提示该信号通路受到了抑制(图1).
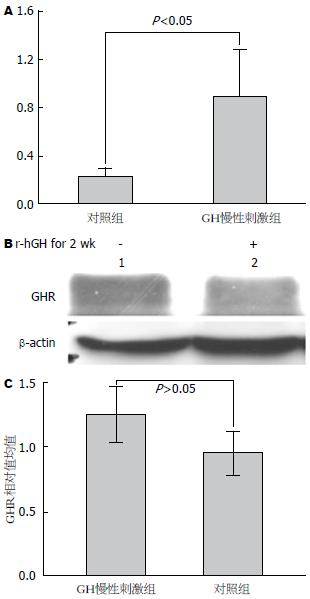
RT-PCR实验结果显示, 与对照组相比, GH慢性刺激后, 小鼠肝脏的SOCS-3 mRNA水平显著升高(P<0.05)(表1, 图2). GHR的表达水平直接影响GH信号调节, Western blot实验结果显示, GH慢性刺激组和对照组小鼠肝脏GHR表达水平无显著性差异(P<0.05)(表1, 图2).
| 项目 | GH慢性刺激组 | 对照组 | t值 | P值 |
| SOCS-3 mRNA相对值 | 0.88±0.40a | 0.23±0.07 | 2.803 | 0.049 |
| GHR灰度相对值 | 0.95±0.17 | 1.25±0.22 | 1.874 | 0.134 |
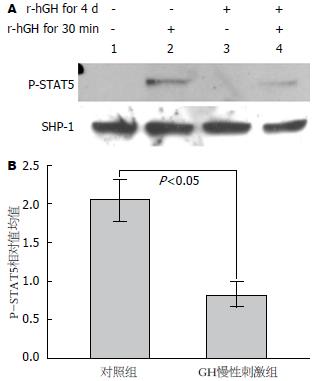
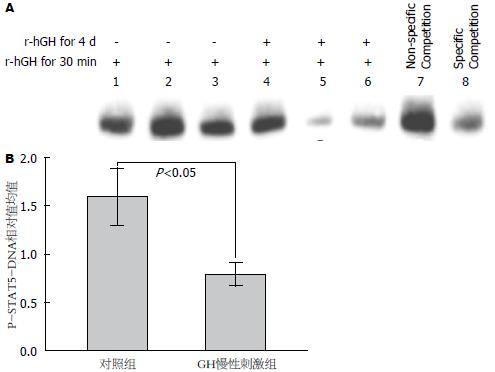
Western blot实验结果显示GH慢性刺激组的P-STAT5水平显著降低(P<0.05). 该结果印证了小鼠肝脏的实验结果, 提示肝脏对GH的敏感性降低(表2, 图3). EMSA实验结果显示相较于对照组, GH慢性刺激组P-STAT5与DNA结合水平显著降低(表2, 图4)(P<0.05).
| 项目 | GH慢性刺激组 | 对照组 | t值 | P值 |
| P-STAT5灰度相对值 | 0.83±0.16a | 2.04±0.27 | 6.682 | 0.003 |
| P-STAT5-DNA结合灰度相对值 | 0.80±0.12a | 1.59±0.30 | 4.298 | 0.013 |
本研究通过体内(健康小鼠)和体外(H4-II-E细胞系)实验检测了GH慢性刺激对肝脏的GH敏感性的影响机制. GH慢性刺激可导致肝脏STAT5的磷酸化水平降低, 降低肝脏对GH的敏感性. 其机制可能是GH慢性刺激导致了肝脏SOCS-3基因的转录水平升高.
由于GHR水平直接影响GH的信号转导效率, 有研究报道外科重症患者GHR合成减少且降解增加, 是GH不敏感的机制之一, 并且认为应用外源性GH可以增加GHR的表达水平[13]. 本研究中, 外源性GH慢性刺激并未影响健康小鼠肝脏GHR的表达水平, 这提示不同生理状态下GH敏感性降低的机制可能不同.
SOCS-2、SOCS-3和CIS基因被认为是JAK2-STAT5信号通路的3个抑制性因子[10,12,14,15]. 其中SOCS-2基因对该通路的调控既可抑制也可增强[16-18]. 本研究前期实验曾检测了GH慢性刺激下SOCS-2和CIS信号的变化及其机制, 发现GH慢性刺激后, 肝脏SOCS-2表达没有变化, 但CIS表达确有增加[19]. 本实验又进一步检测了SOCS-3的作用. 结果显示, GH慢性刺激导致的肝脏对GH的敏感性降低可能与SOCS-3也有关.
内源性GH的分泌是脉冲式的, 睡眠醒来之前分泌最为活跃. 由于内源性GH和外源性注射激素可能相互影响而干扰研究结果, 为保证实验的重复性, 小鼠每天注射r-hGH的时间是固定的, 处死时间也是一致的.
本研究使用了6-8周龄的健康小鼠. 由于GH对人体最主要的作用为促进个体生长, 故儿童缺乏GH可导致生长障碍与发育迟缓, 目前临床上主要使用外源性GH替代疗法治疗儿童GHD. 因此本研究选择6-8周龄健康小鼠. 研究结果说明, 长期的GH替代疗法虽然有效, 但易产生不良反应即GH不敏感. 因此, 如何处理GH的临床治疗和不良反应之间的平衡是急需探索的另一个课题.
生长激素(growth hormone, GH)在临床上广泛应用于各种疾病, 而GH不敏感是其重要的不良反应. 肝脏是GH在人体最重要的靶器官, Janus激酶2(Janus kinase 2, JAK2)-信号转导及转录激活因子5(signal transducer and activator of transcription 5, STAT5)是GH在肝脏最重要的信号通路, STAT5的磷酸化水平直接影响了GH的生物学效应.
唐世刚, 教授, 湖南省人民医院; 陆伦根, 主任医师, 上海交通大学附属第一人民医院消化科
JAK2-STAT5通路是GH重要的信号转导通路, 可介导细胞的生长、增殖、代谢与凋亡. 该通路中STAT5磷酸化水平的抑制与GH不敏感效应直接相关, 其中SOCS基因家族的抑制性调节作用受到广泛的关注. 而其发挥调节作用的机制仍有许多不清楚.
GH-JAK2-STAT5信号通路的抑制与生长激素受体(growth hormone receptor, GHR)水平下调及STAT5的磷酸化水平降低直接相关. SOCS基因家族对该通路可产生抑制性调节作用.
本文研究了GH长期刺激抑制肝脏JAK2-STAT55信号通路是否与SOCS-3基因表达水平及GHR表达水平有关. 研究结果显示, GH慢性刺激可致SOCS-3基因表达水平增加, 而不影响GHR的表达水平, 同时致STAT5磷酸化水平降低, 提示SOCS-3表达水平增加可能与STAT5的磷酸化水平降低有关.
GH慢性刺激致SOCS-3基因表达水平增加, 可能抑制了STAT5的磷酸化水平, 进而抑制了肝脏JAK2-STAT5信号通路. 提示GH慢性刺激确可致GH不敏感效应, 可能对GH的临床应用方式有一定的指导意义.
本文研究通过动物实验和体外细胞实验探讨了GH慢性刺激对肝脏P-STAT5、SOCS-3 mRNA及GHR水平以及P-STAT5与DNA的结合水平的影响, 比较详实地证实了长期的GH替代疗法虽然有效, 但易产生GH不敏感. 全文设计合理可行, 方法较为先进可靠, 结论可信, 对于临床的GH的应用有较为客观的实际指导意义.
编辑: 于明茜 电编:都珍珍
| 1. | Sotelo AI, Miquet JG, González L, Bartke A, Turyn D. Vitamin D3 cannot revert desensitization of growth hormone (GH)-induced STAT5-signaling in GH-overexpressing mice non-calcemic tissues. Growth Horm IGF Res. 2008;18:148-156. [PubMed] [DOI] |
| 2. | Martinez CS, Piazza VG, Ratner LD, Matos MN, González L, Rulli SB, Miquet JG, Sotelo AI. Growth hormone STAT5-mediated signaling and its modulation in mice liver during the growth period. Growth Horm IGF Res. 2013;23:19-28. [PubMed] [DOI] |
| 3. | Hodson EM, Willis NS, Craig JC. Growth hormone for children with chronic kidney disease. Cochrane Database Syst Rev. 2012;2:CD003264. [PubMed] [DOI] |
| 4. | Rogol AD. Clinical and humanistic aspects of growth hormone deficiency and growth-related disorders. Am J Manag Care. 2011;17 Suppl 18:eS4-e10. [PubMed] |
| 5. | Cook DM, Rose SR. A review of guidelines for use of growth hormone in pediatric and transition patients. Pituitary. 2012;15:301-310. [PubMed] [DOI] |
| 6. | Gelato M, McNurlan M, Freedland E. Role of recombinant human growth hormone in HIV-associated wasting and cachexia: pathophysiology and rationale for treatment. Clin Ther. 2007;29:2269-2288. [PubMed] [DOI] |
| 7. | Mauras N, George D, Evans J, Milov D, Abrams S, Rini A, Welch S, Haymond MW. Growth hormone has anabolic effects in glucocorticosteroid-dependent children with inflammatory bowel disease: a pilot study. Metabolism. 2002;51:127-135. [PubMed] [DOI] |
| 9. | Mulligan K, Tai VW, Schambelan M. Effects of chronic growth hormone treatment on energy intake and resting energy metabolism in patients with human immunodeficiency virus-associated wasting--a clinical research center study. J Clin Endocrinol Metab. 1998;83:1542-1547. [PubMed] [DOI] |
| 10. | Tollet-Egnell P, Flores-Morales A, Stavréus-Evers A, Sahlin L, Norstedt G. Growth hormone regulation of SOCS-2, SOCS-3, and CIS messenger ribonucleic acid expression in the rat. Endocrinology. 1999;140:3693-3704. [PubMed] |
| 11. | Davey HW, McLachlan MJ, Wilkins RJ, Hilton DJ, Adams TE. STAT5b mediates the GH-induced expression of SOCS-2 and SOCS-3 mRNA in the liver. Mol Cell Endocrinol. 1999;158:111-116. [PubMed] [DOI] |
| 12. | Ram PA, Waxman DJ. SOCS/CIS protein inhibition of growth hormone-stimulated STAT5 signaling by multiple mechanisms. J Biol Chem. 1999;274:35553-35561. [PubMed] [DOI] |
| 14. | Greenhalgh CJ, Bertolino P, Asa SL, Metcalf D, Corbin JE, Adams TE, Davey HW, Nicola NA, Hilton DJ, Alexander WS. Growth enhancement in suppressor of cytokine signaling 2 (SOCS-2)-deficient mice is dependent on signal transducer and activator of transcription 5b (STAT5b). Mol Endocrinol. 2002;16:1394-1406. [PubMed] [DOI] |
| 15. | Nicholson SE, Hilton DJ. The SOCS proteins: a new family of negative regulators of signal transduction. J Leukoc Biol. 1998;63:665-668. [PubMed] |
| 16. | Greenhalgh CJ, Metcalf D, Thaus AL, Corbin JE, Uren R, Morgan PO, Fabri LJ, Zhang JG, Martin HM, Willson TA. Biological evidence that SOCS-2 can act either as an enhancer or suppressor of growth hormone signaling. J Biol Chem. 2002;277:40181-40184. [PubMed] [DOI] |
| 17. | Favre H, Benhamou A, Finidori J, Kelly PA, Edery M. Dual effects of suppressor of cytokine signaling (SOCS-2) on growth hormone signal transduction. FEBS Lett. 1999;453:63-66. [PubMed] [DOI] |