修回日期: 2016-03-29
接受日期: 2016-04-05
在线出版日期: 2016-05-08
目的: 探讨肾上腺髓质素(adrenomedullin, AM)改善溃疡性结肠炎(ulcerative colitis, UC)大鼠模型肠黏膜通透性的作用机制.
方法: 清洁级♂SD大鼠24只(180-200 g), 随机分成3组: AM组、模型组和正常组, 每组8只. 模型组及AM组均给予TNBS灌肠, 以建立UC大鼠模型. 正常组给予生理盐水灌肠. 造模后注意观察大鼠毛发、活动及大便情况的变化, 记录每组大鼠体质量. 48 h后AM组给予1 mL AM灌肠, 而模型组、正常组则给予1 mL生理盐水灌肠, 连续灌肠7 d后, 腹腔注射10%水合氯醛麻醉大鼠, 留取大鼠血液, 离心后分离上层血清于无菌EP管中冻存, 留取大鼠结肠组织, 部分立即用4%多聚甲醛固定, 余下组织冻存于-80 ℃. HE染色评估大鼠结肠病理变化, Western blot测定肠道黏膜RhoA、Rho激酶1(Rho associated kinase 1, ROCK1)、肌球蛋白轻链激酶(myosin light-chain kinase, MLCK)、核因子-κB(nuclear factor-κB, NF-κB) p65及紧密连接(tight junction, TJ)蛋白Occludin的表达, 酶联免疫吸附测定法(ELISA)试剂盒检测血清肿瘤坏死因子-α(tumor necrosis factor α, TNF-α), 干扰素-γ(interferon-γ, IFN-γ)表达的水平.
结果: TNBS造模后的大鼠出现腹泻及黏液脓血便, 体质量明显减轻, 肠管扩张, 肠壁变薄, 部分结肠黏膜可见散在溃疡, 与正常组比较, 模型组大鼠血清中TNF-α、IFN-γ的表达明显升高(P<0.05), 结肠组织中RhoA、ROCK1、MLCK及NF-κB p65蛋白的表达显著增高(P<0.05), 而TJ蛋白Occludin的表达较正常组明显降低(P<0.05), 与模型组比较, 给予AM治疗后的大鼠TNF-α、IFN-γ表达降低(P<0.05), 结肠组织中RhoA、ROCK1、MLCK及NF-κB p65蛋白的表达显著下降(P<0.05), 而TJ蛋白Occludin的表达明显升高(P<0.05)有统计学意义.
结论: AM可能通过调节RhoA介导的NF-κB p65/MLCK信号通路, 改善UC肠道黏膜屏障功能.
核心提示: 本研究探讨了肾上腺髓质素(adrenomedullin, AM)对溃疡性结肠炎(ulcerative colitis, UC)大鼠肠黏膜通透性的影响以及RhoA介导的核因子-κB p65/肌球蛋白轻链激酶信号通路在其中的作用, 进一步阐明了AM的作用机制, 为UC的临床治疗提供了新的方向.
引文著录: 彭颖, 范恒. 肾上腺髓质素对溃疡性结肠炎大鼠肠黏膜通透性的影响. 世界华人消化杂志 2016; 24(13): 1968-1975
Revised: March 29, 2016
Accepted: April 5, 2016
Published online: May 8, 2016
AIM: To investigate the possible mechanism of adrenomedullin (AM) to protect the intestinal epithelial barrier function in a rat model of ulcerative colitis (UC).
METHODS: Twenty-four male Sprague-Dawley rats were randomly divided into three groups: a normal control group, a model group and an AM group. Each group contained 8 rats. All the rats except those in the normal control group were administered with TNBS to induce colitis. Rats in the normal control group was given physiological saline instead. Forty-eight hours after inducing colitis, in the AM group, AM (1.0 μg of AM diluted in 1.0 mL of saline) was injected into the lumen of the colon. Rats in the normal control group and model group were given 1.0 mL of saline instead. All of them were treated for seven consecutive days. Blood samples were collected to measure serum tumor necrosis factor-α (TNF-α) and interferon-γ (IFN-γ) levels by ELISA. Colon tissues were taken to detect the protein expression of RhoA, Rho associated kinase 1 (ROCK1), MLCK, nuclear factor-κB (NF-κB) p65 and Occludin by Western blot analysis.
RESULTS: All the rats induced with TNBS developed symptoms such as profound and sustained weight loss, bradykinesia and purulent and bloody stools. The levels of serum TNF-α and IFN-γ in model rats were significantly higher than those in the normal group (P < 0.05), however, serum TNF-α and IFN-γ were significantly decreased after AM treatment (P < 0.05). The expression levels of RhoA, ROCKI, MLCK and NF-κB p65 showed a significant increase in the model group compared with the normal group (P < 0.05), while treatment with AM clearly reduced their expression. The expression of Occludin in model rats was significantly decreased (P < 0.05), while in the AM group, the reduced Occludin expression appeared to resume (P < 0.05).
CONCLUSION: AM improves intestinal mucosal barrier function in UC possibly by regulating the NF-κB p65/MLCK signal pathway mediated by RhoA.
- Citation: Peng Y, Fan H. Effect of adrenomedullin on intestinal permeability in rats with ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2016; 24(13): 1968-1975
- URL: https://www.wjgnet.com/1009-3079/full/v24/i13/1968.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i13.1968
炎症性肠病的发生被认为和感染、免疫、遗传和环境等诸多因素相关, 越来越多的研究表明肠道黏膜免疫功能紊乱引起的肠道黏膜屏障损伤是导致结肠炎发生和发展的主要机制[1,2]. 因此, 恢复被破坏的肠黏膜屏障功能有利于缓解甚至消除肠道的炎症及免疫反应, 达到治疗溃疡性结肠炎(ulcerative colitis, UC)的目的.
肠黏膜屏障功能主要依赖于肠上皮细胞之间的紧密连接(tight junction, TJ)来维持上皮细胞的极性和凝聚力, TJ包括多种黏附和TJ蛋白, 如ZO-1、Occludin等[3]. 大量研究表明纤维肌动蛋白细胞骨架的收缩和结构重排, 在控制TJ的结构和功能中起着重要作用, 而这种收缩和结构重排主要是由Rho激酶(Rho associated kinase, ROCK)和肌球蛋白轻链激酶(myosin light-chain kinase, MLCK)来调控的[4,5]. 细胞骨架张力的主要调控者是小G蛋白RhoA和他的下游效应分子ROCK, ROCK可以通过直接磷酸化肌球蛋白轻链(myosin light-chain, MLC), 来产生细胞收缩力, 使TJ分布改变, 进而影响肠黏膜屏障功能[6].
RhoA/ROCK通路可以调控多种细胞功能, 包括细胞迁移、细胞收缩、黏附等[7]. 有研究[8,9]表明RhoA/ROCK也可以激活核因子-κB(nuclear factor-κB, NF-κB). NF-κB是一种核转录蛋白, 在UC的发病中发挥着重要作用[10,11]. 以前的研究[12]表明NF-κB p65信号通路包含在MLCK依赖的肠黏膜屏障功能的调节过程中. 而肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)诱导的MLCK蛋白表达的增加也被认为主要由NF-κB p65信号通路来调节[13,14]. MLCK基因启动子的活性可以由NF-κB的活化来刺激调控, 而抑制NF-κB也可以防止MLCK蛋白表达的增加[15,16].
肾上腺髓质素(adrenomedullin, AM)是一种从人嗜铬细胞瘤中提取出来的血管活性肽, 在新生血管的形成、抑制炎症和凋亡等多种生理过程中发挥着重要作用[17,18]. 以前的研究[19]表明, AM可以显著降低肠黏膜通透性, 然而, 潜在的作用机制仍不十分清楚. Ashizuka等[20]认为AM可以通过抑制炎症因子、激活肠上皮淋巴细胞中的细胞因子以及保护细胞间的TJ, 从而对结肠炎动物模型产生作用. 基于这些研究结果, 我们可以知道, AM对UC肠黏膜屏障功能发挥着重要的保护作用. 本研究用2,4,6-三硝基苯磺酸(2,4,6-trinitro-benzene-sulfonic, TNBS)建立UC大鼠模型, 给予AM灌肠治疗, 研究RhoA介导的NF-κB p65/MLCK信号通路在AM治疗过程中的作用, 从而为UC的治疗提供新的途径和方法.
清洁级♂SD大鼠24只, 180-200 g, 购自湖南斯莱克景达实验动物有限公司[实验动物许可证号: SCXK(湘)2013-0004], 饲养于华中科技大学实验动物中心[实验单位许可证号: SYXK(鄂)2010-0057], 标准饮食, 自由饮水. TNBS购自Sigma公司, AM购自Sigma公司, 大鼠TNF-α酶联免疫吸附测定法(ELISA)试剂盒(货号: ERC102a)和干扰素-γ(interferon-γ, IFN-γ) ELISA试剂盒(货号: ERC101g)购自NeoBioscience公司, RhoA抗体(货号: ab187027)、ROCK1抗体(货号: ab45171)、MLCK抗体(货号: ab76092)、Occludin抗体(货号: ab167161)均购自Abcam公司, NF-κB p65抗体购自CST公司(货号: 8242p).
1.2.1 动物分组与UC模型建立: 24只♂SD大鼠随机分为3组: 正常组、模型组和AM组, 每组8只, 体质量差异无统计学意义(P>0.05). 适应性喂养1 wk后, 根据Morris等[21]提出的方法采用TNBS灌肠建立大鼠UC模型, 各组大鼠禁食不禁水24 h后, 用10%的水合氯醛0.3 mL/100 g体质量腹腔注射麻醉, 取直径2 mm的橡胶管, 用甘油润滑后, 经肛门缓慢插入约8 cm, 将5%的TNBS 0.6 mL溶于500 mL/L的乙醇0.25 mL, 经该橡胶软管缓慢注入大鼠结肠. 正常组则用相同方法注入同体积生理盐水, 提起大鼠尾巴倒置30 s, 防止药液外流, 造模结束后使大鼠平躺, 自然苏醒后自由饮食.
1.2.2 药物干预及标本处理: 建立模型后的48 h, 注意观察各组大鼠皮毛、精神、饮食及大便情况的变化, 记录大鼠体质量改变, 评估模型建立成功后, 正常组和模型组给予生理盐水1 mL/只灌肠, AM组予以AM 1.0 μg/(mL•只)灌肠, 连续灌肠7 d. 第8天各组大鼠禁食不禁水24 h后, 用10%的水合氯醛腹腔注射麻醉大鼠, 腹主动脉取血留取大鼠血液标本, 静置4-6 h后, 4000 r/min离心10 min, 取上层血清, 冻存于-20 ℃. 留取病变明显的结肠组织标本, 部分结肠组织用4%多聚甲醛固定, 余下冻存于-80 ℃备用.
1.2.3 结肠组织病理学检测: 将大鼠结肠组织置于4%多聚甲醛中固定, 常规石蜡包埋, 4 μm切片. 苏木素伊红染色, 光学显微镜下进行组织病理学观察.
1.2.4 ELISA检测血清TNF-α、IFN-γ表达: 操作步骤参照大鼠TNF-α、IFN-γ ELISA试剂盒的说明书进行, 操作完成后以450 nm的波长测量各孔的OD值, 根据OD值和标准品的浓度得出标准曲线方程, 代入OD值计算样品浓度.
1.2.5 Western blot检测结肠组织RhoA、ROCK1、MLCK、NF-κB p65及Occludin蛋白表达: 提取结肠组织总蛋白, 各样品取50 μg蛋白上样, 根据蛋白分子量配制SDS-PAGE凝胶电泳. 浓缩胶电压75 V, 进入分离胶后, 电压设定为120 V. 当溴酚蓝刚跑出即可终止电泳, 转膜至PVDF膜. 将PVDF膜上加入5%的脱脂牛奶(0.5%TBST配), 摇动封闭1 h; 按比例加入稀释好的一抗, 4 ℃孵育过夜, 加入稀释好的二抗, 室温下孵育2 h; ECL化学发光法显影定影, 分析胶片灰度值.
统计学处理 应用SPSS20.0统计软件处理数据并进行统计学分析, 计量资料结果用mean±SD表示, 多样本间比较采用单因素方差分析(ANOVA), P<0.05表示差异有统计学意义.
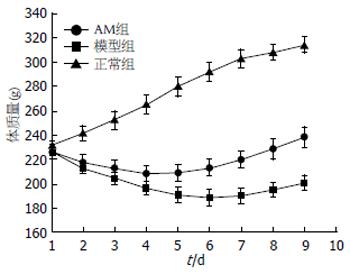
TNBS造模后, 大鼠精神变差, 活动减少, 体质量减轻, 肛门处可见稀便, 严重者可见黏液脓血便. 根据各组大鼠体质量变化, 绘制体质量曲线, 从图1中可以看出, AM组在给药治疗后大鼠体质量减轻情况较模型组有明显改善.
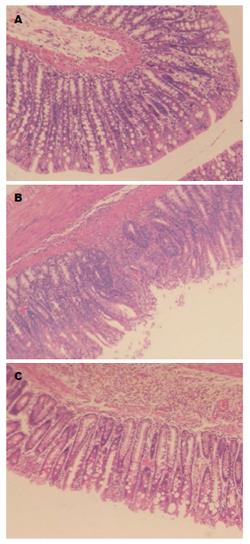
从图2中可以看出, 正常组大鼠结肠组织黏膜结构完整, 腺体排列规则, 模型组大鼠可见结肠黏膜破坏, 杯状细胞减少, 大量炎性细胞浸润, 而AM组黏膜轻度水肿, 腺体排列尚整齐, 炎性细胞浸润较模型组明显减轻(图2).
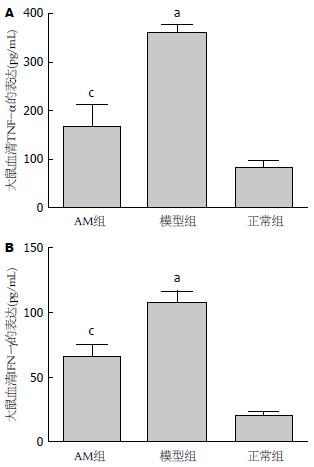
采用酶联免疫吸附法测定血清TNF-α和IFN-γ的含量, 结果表明, 与正常组相比, TNF-α和IFN-γ在模型组大鼠血清中高表达(P<0.05), 而在AM组, 与模型组比较, 两者的表达明显降低(P<0.05)(图3).
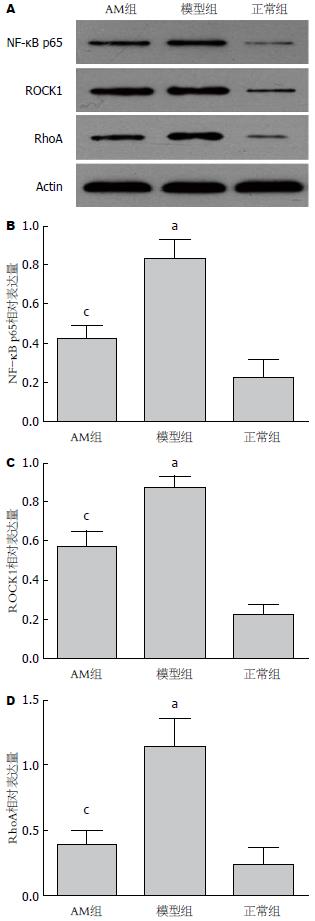
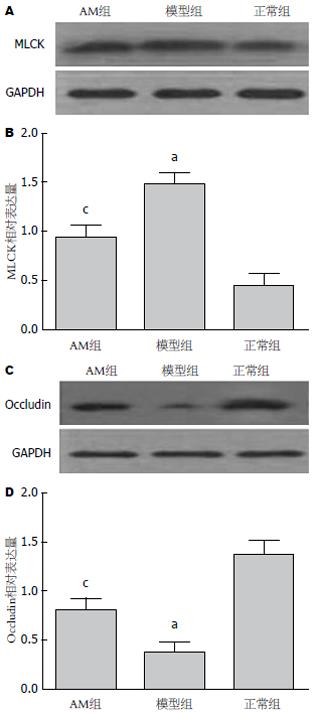
模型组大鼠结肠黏膜RhoA、ROCK1的表达较正常组明显升高(P<0.05), 而AM组大鼠RhoA、ROCK1的表达较模型组降低(P<0.05)(图4). 与正常组相比, 模型组大鼠MLCK蛋白表达明显增加(P<0.05), 而给予AM治疗后, MLCK蛋白表达较模型组下降(P<0.05)(图5). NF-κB p65的表达在模型组大鼠明显增加(P<0.05), 而在AM治疗组, 他的表达则较模型组降低(P<0.05)(图4). 与正常组相比, 模型组大鼠肠黏膜Occludin蛋白表达明显下降(P<0.05), 而AM组, Occludin蛋白表达较模型组上调(P<0.05)(图5).
MLCK信号通路在肠黏膜屏障功能的病理生理调节中发挥着重要的作用[22,23]. 为了明确AM是否是通过阻断MLC的磷酸化来减轻肠上皮屏障损害, 我们对MLCK蛋白的表达进行检测. NF-κB p65通路被认为可以调控TNF-α诱导的MLCK蛋白的表达上调[13,24]. TJ蛋白表达水平的降低被认为是肠上皮屏障功能损伤的关键环节[25,26], Occludin蛋白作为TJ蛋白的一个定位标记, 被用来检测并评价肠上皮功能损伤情况.
炎症性肠病是一种慢性非特异性肠道疾病, 病因及发病机制尚不十分明确, 但是肠黏膜屏障损伤, 引起致病菌及毒素入侵肠道, 是炎症性肠病的一个重要致病因素[27,28]. 一些研究[29,30]表明, 许多炎性细胞因子, 如TNF-α和IFN-γ, 在肠黏膜屏障损伤过程中起到推动作用. 有研究[31,32]进一步指出, TNF-α和IFN-γ可以通过激活RhoA, 进而引起肌球蛋白磷酸化, 导致细胞骨架改变, 细胞间通透性增加, 从而破坏肠黏膜屏障, 加重肠道炎症. 在TNBS诱导的结肠炎动物模型中, TNF-α和IFN-γ的表达水平明显升高, 同样地, RhoA及其下游效应分子ROCK1的蛋白表达也是增高的, 而给予AM治疗后, 这种升高趋势受到抑制, 这表明TNF-α和IFN-γ可以激活RhoA, 而AM可以抑制这个过程.
MLCK信号通路也在肠上皮通透性的调节过程中发挥着重要作用[33]. 先前的研究[30]表明上调MLCK的蛋白表达, 可以诱导MLC的磷酸化, 进而导致肠黏膜屏障损伤. 而作为RhoA下游效应分子的ROCK, 则可以通过直接磷酸化MLC和MLC肌球蛋白结合亚基, 来产生细胞收缩力, 引起肠黏膜屏障功能改变[6]. 除此之外, 一些研究[34]也显示, RhoGTP酶的激活与可以调节多种细胞功能的NF-κB p65的活化是息息相关的. RhoA被称为NF-κB p65的关键调节器[35]. 在UC中, TNF-α诱导的肠上皮通透性增加, 是由NF-κB p65信号通路调控的[36], 同样地, TNF-α和IFN-γ诱导的MLCK通路的激活也受到NF-κB p65的调控. 在本实验中, 与正常组相比, 模型组大鼠的MLCK和NF-κB p65蛋白的表达明显增高, 而TJ蛋白Occludin的表达减少, 削弱了TJ, 致使肠黏膜通透性增加, 然而, 给予AM治疗后, 这种趋势得到抑制, MLCK和NF-κB p65的表达下调, 而Occludin的表达增加, 从而加强了TJ, 改善了肠黏膜屏障功能.
AM是一种血管活性肽, 鉴于其在胃和结肠组织中高浓度表达, AM被认为可以通过抑制炎性细胞因子的活性、保护细胞间TJ以及发挥抗菌作用来治疗实验性结肠炎[37]. AM可以下调促炎因子如TNF-α的表达, 除此之外, 先前的研究[38]也证实AM可以改善UC的肠黏膜屏障功能. 然而, 具体的作用机制却鲜有报道. 在我们的实验中, TNF-α、IFN-γ、RhoA、MLCK及NF-κB p65的表达在模型组明显升高, 而TJ蛋白Occludin的表达减少, 给予AM治疗后, 这种趋势随之降低, 这表明, AM可以通过下调TNF-α, IFN-γ的表达, 抑制RhoA激活, 下调MLCK和NF-κB p65的表达, 进而上调Occludin的表达, 使肠黏膜通透性降低.
总之, 这个实验表明AM对TNBS诱导的实验性结肠炎的肠黏膜屏障损害有一定的保护作用, 而抑制RhoA介导的NF-κB p65/MLCK信号通路的活化可能是其机制之一. 我们的实验只是对AM调节UC肠黏膜通透性的的作用机制进行了初步的探讨, 还有待于更深入和缜密的实验去进一步研究和证实. 但是这些发现阐释了UC可能的发病机制, 给UC的治疗提供了新的思路和理论依据.
肠黏膜屏障损伤, 引起致病菌及毒素入侵肠道, 是溃疡性结肠炎(ulcerative colitis, UC)的一个重要致病因素, 肾上腺髓质素(adrenomedullin, AM)作为一种血管活性肽, 被认为可以通过抑制炎性细胞因子的活性、保护细胞间紧密连接(tight junction, TJ)以及发挥抗菌作用来治疗实验性结肠炎.
张燕, 主任医师, 四川大学华西医院消化内科
UC的病因和发病机制至今尚未明确, 临床治疗上主要采用氨基水杨酸制剂、激素以及免疫抑制剂, 费用昂贵且疗效一般, AM被认为能改善UC肠黏膜通透性, 为UC的治疗提供了新的方向.
Minamino等发现AM可以通过抑制炎性细胞因子的活性、保护细胞间TJ来治疗实验性结肠炎, 本课题组前期研究发现AM可以改善UC肠黏膜通透性, 其作用机制与肌球蛋白轻链激酶(myosin light-chain kinase, MLCK)信号通路具有一定的相关性.
本文采用AM灌肠给药的方式, 通过检测大鼠结肠组织RhoA、核因子-κB(nuclear factor-κB, NF-κB) p65、MLCK蛋白的表达, 探讨AM调节UC大鼠肠黏膜通透性的可能机制.
应用要点 本文研究发现AM可以通过抑制RhoA介导的NF-κB p65/MLCK信号通路, 下调TJ蛋白的表达, 改善UC肠黏膜屏障功能, 为临床应用AM治疗UC提供了一定的实验依据.
Rho激酶: 属于丝氨酸/苏氨酸蛋白激酶家族成员, 是最为关键的RhoA下游靶效应分子, 可以调控多种细胞功能, 包括细胞迁移、细胞收缩、黏附等.
本文具有一定的创新性, 实验思路清晰, 研究设计合理, 探讨了AM调节UC肠黏膜通透性的可能机制, 为临床进一步研究提供了一定的依据.
编辑: 于明茜 电编:都珍珍
| 1. | Mizoguchi A, Mizoguchi E. Inflammatory bowel disease, past, present and future: lessons from animal models. J Gastroenterol. 2008;43:1-17. [PubMed] [DOI] |
| 2. | Zimmerman NP, Vongsa RA, Wendt MK, Dwinell MB. Chemokines and chemokine receptors in mucosal homeostasis at the intestinal epithelial barrier in inflammatory bowel disease. Inflamm Bowel Dis. 2008;14:1000-1011. [PubMed] [DOI] |
| 3. | Tsukita S, Furuse M, Itoh M. Multifunctional strands in tight junctions. Nat Rev Mol Cell Biol. 2001;2:285-293. [PubMed] [DOI] |
| 4. | Ivanov AI, Parkos CA, Nusrat A. Cytoskeletal regulation of epithelial barrier function during inflammation. Am J Pathol. 2010;177:512-524. [PubMed] [DOI] |
| 5. | Nusrat A, Giry M, Turner JR, Colgan SP, Parkos CA, Carnes D, Lemichez E, Boquet P, Madara JL. Rho protein regulates tight junctions and perijunctional actin organization in polarized epithelia. Proc Natl Acad Sci U S A. 1995;92:10629-10633. [PubMed] [DOI] |
| 6. | Kimura K, Ito M, Amano M, Chihara K, Fukata Y, Nakafuku M, Yamamori B, Feng J, Nakano T, Okawa K. Regulation of myosin phosphatase by Rho and Rho-associated kinase (Rho-kinase). Science. 1996;273:245-248. [PubMed] [DOI] |
| 7. | Loirand G, Guérin P, Pacaud P. Rho kinases in cardiovascular physiology and pathophysiology. Circ Res. 2006;98:322-334. [PubMed] [DOI] |
| 8. | Rodriguez PL, Sahay S, Olabisi OO, Whitehead IP. ROCK I-mediated activation of NF-kappaB by RhoB. Cell Signal. 2007;19:2361-2369. [PubMed] [DOI] |
| 9. | Anwar KN, Fazal F, Malik AB, Rahman A. RhoA/Rho-associated kinase pathway selectively regulates thrombin-induced intercellular adhesion molecule-1 expression in endothelial cells via activation of I kappa B kinase beta and phosphorylation of RelA/p65. J Immunol. 2004;173:6965-6972. [PubMed] [DOI] |
| 10. | Schreiber S, Nikolaus S, Hampe J. Activation of nuclear factor kappa B inflammatory bowel disease. Gut. 1998;42:477-484. [PubMed] [DOI] |
| 11. | Li J, Gran B, Zhang GX, Ventura ES, Siglienti I, Rostami A, Kamoun M. Differential expression and regulation of IL-23 and IL-12 subunits and receptors in adult mouse microglia. J Neurol Sci. 2003;215:95-103. [PubMed] [DOI] |
| 12. | Al-Sadi R, Guo S, Ye D, Dokladny K, Alhmoud T, Ereifej L, Said HM, Ma TY. Mechanism of IL-1β modulation of intestinal epithelial barrier involves p38 kinase and activating transcription factor-2 activation. J Immunol. 2013;190:6596-6606. [PubMed] [DOI] |
| 13. | Ye D, Ma I, Ma TY. Molecular mechanism of tumor necrosis factor-alpha modulation of intestinal epithelial tight junction barrier. Am J Physiol Gastrointest Liver Physiol. 2006;290:G496-G504. [PubMed] [DOI] |
| 14. | He F, Peng J, Deng XL, Yang LF, Camara AD, Omran A, Wang GL, Wu LW, Zhang CL, Yin F. Mechanisms of tumor necrosis factor-alpha-induced leaks in intestine epithelial barrier. Cytokine. 2012;59:264-272. [PubMed] [DOI] |
| 15. | Ma TY, Tran D, Hoa N, Nguyen D, Merryfield M, Tarnawski A. Mechanism of extracellular calcium regulation of intestinal epithelial tight junction permeability: role of cytoskeletal involvement. Microsc Res Tech. 2000;51:156-168. [PubMed] [DOI] |
| 16. | Meng F, Liu L, Chin PC, D'Mello SR. Akt is a downstream target of NF-kappa B. J Biol Chem. 2002;277:29674-29680. [PubMed] [DOI] |
| 17. | Kitamura K, Kangawa K, Kawamoto M, Ichiki Y, Nakamura S, Matsuo H, Eto T. Adrenomedullin: a novel hypotensive peptide isolated from human pheochromocytoma. 1993. Biochem Biophys Res Commun. 2012;425:548-555. [PubMed] [DOI] |
| 18. | Kataoka Y, Miyazaki S, Yasuda S, Nagaya N, Noguchi T, Yamada N, Morii I, Kawamura A, Doi K, Miyatake K. The first clinical pilot study of intravenous adrenomedullin administration in patients with acute myocardial infarction. J Cardiovasc Pharmacol. 2010;56:413-419. [PubMed] [DOI] |
| 19. | Temmesfeld-Wollbrück B, Brell B, zu Dohna C, Dorenberg M, Hocke AC, Martens H, Klar J, Suttorp N, Hippenstiel S. Adrenomedullin reduces intestinal epithelial permeability in vivo and in vitro. Am J Physiol Gastrointest Liver Physiol. 2009;297:G43-G51. [PubMed] [DOI] |
| 20. | Ashizuka S, Inagaki-Ohara K, Kuwasako K, Kato J, Inatsu H, Kitamura K. Adrenomedullin treatment reduces intestinal inflammation and maintains epithelial barrier function in mice administered dextran sulphate sodium. Microbiol Immunol. 2009;53:573-581. [PubMed] [DOI] |
| 21. | Morris GP, Beck PL, Herridge MS, Depew WT, Szewczuk MR, Wallace JL. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 1989;96:795-803. [PubMed] |
| 22. | Turner JR. Intestinal mucosal barrier function in health and disease. Nat Rev Immunol. 2009;9:799-809. [PubMed] [DOI] |
| 23. | Shen L, Weber CR, Raleigh DR, Yu D, Turner JR. Tight junction pore and leak pathways: a dynamic duo. Annu Rev Physiol. 2011;73:283-309. [PubMed] [DOI] |
| 24. | Ma TY, Boivin MA, Ye D, Pedram A, Said HM. Mechanism of TNF-{alpha} modulation of Caco-2 intestinal epithelial tight junction barrier: role of myosin light-chain kinase protein expression. Am J Physiol Gastrointest Liver Physiol. 2005;288:G422-G430. [PubMed] [DOI] |
| 25. | Ma TY, Hoa NT, Tran DD, Bui V, Pedram A, Mills S, Merryfield M. Cytochalasin B modulation of Caco-2 tight junction barrier: role of myosin light chain kinase. Am J Physiol Gastrointest Liver Physiol. 2000;279:G875-G885. [PubMed] |
| 26. | Qasim M, Rahman H, Ahmed R, Oellerich M, Asif AR. Mycophenolic acid mediated disruption of the intestinal epithelial tight junctions. Exp Cell Res. 2014;322:277-289. [PubMed] [DOI] |
| 27. | Arrieta MC, Madsen K, Doyle J, Meddings J. Reducing small intestinal permeability attenuates colitis in the IL10 gene-deficient mouse. Gut. 2009;58:41-48. [PubMed] [DOI] |
| 28. | Hollander D. Intestinal permeability, leaky gut, and intestinal disorders. Curr Gastroenterol Rep. 1999;1:410-416. [PubMed] [DOI] |
| 29. | Beaurepaire C, Smyth D, McKay DM. Interferon-gamma regulation of intestinal epithelial permeability. J Interferon Cytokine Res. 2009;29:133-144. [PubMed] [DOI] |
| 30. | Wang F, Graham WV, Wang Y, Witkowski ED, Schwarz BT, Turner JR. Interferon-gamma and tumor necrosis factor-alpha synergize to induce intestinal epithelial barrier dysfunction by up-regulating myosin light chain kinase expression. Am J Pathol. 2005;166:409-419. [PubMed] [DOI] |
| 31. | Kakiashvili E, Speight P, Waheed F, Seth R, Lodyga M, Tanimura S, Kohno M, Rotstein OD, Kapus A, Szászi K. GEF-H1 mediates tumor necrosis factor-alpha-induced Rho activation and myosin phosphorylation: role in the regulation of tubular paracellular permeability. J Biol Chem. 2009;284:11454-11466. [PubMed] [DOI] |
| 32. | Utech M, Ivanov AI, Samarin SN, Bruewer M, Turner JR, Mrsny RJ, Parkos CA, Nusrat A. Mechanism of IFN-gamma-induced endocytosis of tight junction proteins: myosin II-dependent vacuolarization of the apical plasma membrane. Mol Biol Cell. 2005;16:5040-5052. [PubMed] [DOI] |
| 33. | Cunningham KE, Turner JR. Myosin light chain kinase: pulling the strings of epithelial tight junction function. Ann N Y Acad Sci. 2012;1258:34-42. [PubMed] [DOI] |
| 34. | Nakayamada S, Kurose H, Saito K, Mogami A, Tanaka Y. Small GTP-binding protein Rho-mediated signaling promotes proliferation of rheumatoid synovial fibroblasts. Arthritis Res Ther. 2005;7:R476-R484. [PubMed] [DOI] |
| 35. | Etienne-Manneville S, Hall A. Rho GTPases in cell biology. Nature. 2002;420:629-635. [PubMed] [DOI] |
| 36. | Ma TY, Iwamoto GK, Hoa NT, Akotia V, Pedram A, Boivin MA, Said HM. TNF-alpha-induced increase in intestinal epithelial tight junction permeability requires NF-kappa B activation. Am J Physiol Gastrointest Liver Physiol. 2004;286:G367-G376. [PubMed] [DOI] |
| 37. | Minamino N, Kikumoto K, Isumi Y. Regulation of adrenomedullin expression and release. Microsc Res Tech. 2002;57:28-39. [PubMed] [DOI] |
| 38. | Yi Z, Fan H, Liu X, Tang Q, Zuo D, Yang J. Adrenomedullin improves intestinal epithelial barrier function by downregulating myosin light chain phosphorylation in ulcerative colitis rats. Mol Med Rep. 2015;12:3615-3620. [PubMed] |