修回日期: 2016-03-14
接受日期: 2016-03-22
在线出版日期: 2016-04-28
目的: 探讨MDR1 G2677T基因多态性与紫杉醇为主的化疗方案治疗晚期消化系难治性恶性肿瘤疗效的关系.
方法: 97例晚期消化系难治性恶性肿瘤患者给予以紫杉醇为主的化疗方案(130 mg/m2, 静脉滴注, d1、8, 21 d为1周期), 评价疗效, 于治疗前抽取患者外周血提取DNA, 采用PCR扩增目的基因片段, 直接测序法测定MDR1 G2677T基因多态性, 分析MDR1 G2677T基因多态性与疗效关系.
结果: 最终有94例患者完成了本研究, 其中完全缓解(complete response, CR): 2例, 部分缓解(partial response, PR): 24例, 疾病稳定(stable disease, SD): 54例, 疾病进展(progressive disease, PD): 14例, 总缓解率为27.66%. MDR1 G2677T基因野生型G/G有32例, 突变型中有62例(A/A有6例, T/T有14例, G/A有10例, G/T有12例, A/T有20例), 两类基因型与肿瘤发生部位无明显相关性. MDR1 G2677T基因多态性与疗效相关(P<0.05), 其中仅MDR1 G2677T野生型G/G对疗效的影响有统计学意义(P<0.01).
结论: MDR1 G2677T基因多态性可作为遗传学标志预测紫杉醇对晚期消化系难治性恶性肿瘤患者的化疗敏感性, 野生型G/G基因携带者化疗疗效优于其他基因型携带者.
核心提示:MDR1 G2677T与紫杉醇类疗效有关, 其高表达可导致紫杉醇类耐药性增高. 本文通过研究测定晚期消化系难治性恶性肿瘤患者外周血MDR1 G2677T基因多态性, 分析其与紫衫类药物疗效关系.
引文著录: 汪铁军, 谢中华, 郑元秀, 黄芳芳, 沈靖. MDR1 G2677T基因多态性在预测紫杉醇为主的化疗方案治疗晚期消化系难治性恶性肿瘤疗效中的价值. 世界华人消化杂志 2016; 24(12): 1931-1937
Revised: March 14, 2016
Accepted: March 22, 2016
Published online: April 28, 2016
AIM: To investigate the correlation of the MDR1 G2677T genetic polymorphism with efficacy of paclitaxel-based chemotherapy in patients with refractory advanced gastrointestinal malignancies.
METHODS: Ninety-seven patients with refractory advanced gastrointestinal malignancies received paclitaxel-based chemotherapy (130 mg/m2, d1, 8, every 3 wk). Efficacy was evaluated after treatment. The MDR1 G2677T genetic polymorphism was detected by amplifying the gene fragments using PCR and direct sequencing. The correlation of the MDR1 G2677T genetic polymorphism with efficacy was then analyzed.
RESULTS: Totally 94 patients completed the study. Two cases had complete response, 24 cases had partial response, 54 cases had stable disease, and 14 cases had progression disease. The overall response rate was 27.66%. The MDR1 G2677T wild-type genotype G/G was detected 32 cases, and mutant genotypes were detected in 62 cases (A/A, 6 cases; T/T, 14 cases; G/A, 10 cases; G/T, 12 cases; A/T, 20 cases). There was no significant correlation between tumor location and genotypes. There was a significant correlation between MDR1 G2677T genetic polymorphism and efficacy (P < 0.05). A significant correlation was observed only between the MDR1 G2677T wild-type genotype G/G and chemotherapeutic effects (P < 0.01).
CONCLUSION: The MDR1 G2677T genetic polymorphism can be used to predict response to paclitaxel-based chemotherapy in patients with refractory advanced gastrointestinal malignancies. The MDR1 G2677T wild-type genotype G/G may be associated with a better treatment response compared with other genotypes.
- Citation: Wang TJ, Xie ZH, Zheng YX, Huang FF, Shen J. Value of MDR1 G2677T genetic polymorphism in predicting efficacy of aclitaxel-based chemotherapy in refractory advanced gastrointestinal malignancies. Shijie Huaren Xiaohua Zazhi 2016; 24(12): 1931-1937
- URL: https://www.wjgnet.com/1009-3079/full/v24/i12/1931.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i12.1931
多数晚期恶性肿瘤不能被目前的治疗所治愈, 因此缓解病情和延长生命是治疗的主要目的. 晚期恶性肿瘤的治疗很棘手, 因此类患者往往接受过多次化疗, 易产生耐药性而成为难治性恶性肿瘤, 这无疑给家庭和社会造成极大的危害和负担. 越来越多的研究[1-3]发现, 肿瘤多药耐药性(multi-drugs resistance, MDR)是肿瘤化疗失败的关键因素, 因其对一种抗肿瘤药物产生耐药性, 对结构和作用机制完全不同多种抗肿瘤药物亦可产生耐药性. 已被证实MDR1基因有50多个单核苷酸多态性(single nucleotide polymorphism, SNP), 其中21外显子G2677T与MDR1的功能和表达密切相关[3]. 最近有研究[4]发现, MDR1 G2677T与紫杉醇类疗效有关, 其高表达可导致紫杉醇类耐药性增高. 紫杉醇为多种晚期难治性恶性肿瘤的一线治疗方案[5,6]. 本研究通过测定晚期消化系难治性恶性肿瘤患者外周血MDR1 G2677T基因多态性, 分析其与紫衫类药物疗效关系, 筛选预测晚期消化系难治性恶性肿瘤化疗疗效的基因型, 以期为消化系难治性恶性肿瘤患者个体化用药提供理论及实验依据.
选择2014-04/2015-05杭州市余杭区第二人民医院肿瘤内科住院的消化系难治性恶性肿瘤患者97例, 其中男43例, 女54例, 平均年龄为61.12岁±3.06岁. 入组对象中, 食管癌34例, 其中肝转移8例, 骨转移10例, 头颅转移6例; 胰腺癌14例, 肝转移4例, 淋巴结转移6例; 肝癌16例, 头颅转移4例, 骨转移4例; 胃癌20例, 淋巴结转移12例, 肝转移6例; 结肠癌16例, 肝转移6例. 入组患者均有既往治疗情况(表1). 纳入标准: (1)年龄18-75岁, 均经病理和/或细胞学检查证实为恶性肿瘤; (2)有可评价的客观病灶, 并经CT/MR检查证实, ECOG评分≤2分, 预计生存期≥3 mo; 分期为Ⅲ-Ⅳ期; (3)因转移性肿瘤接受过2个以上化疗方案, 因病情进展停药, 距末次化疗时间均在3 wk以上; (4)血常规检查正常: 白细胞(white blood cell, WBC)≥3.0×109/L, 中性粒细胞≥1.5×109/L, 血红蛋白(hemoglobin, Hb)≥90 g/L; 血小板(platelet, PLT)≥80.0×109/L; 心肝肾功能无明显异常; (5)患者或家属签署知情同意书. 本课题已经杭州市余杭区第二人民医院医学伦理委员会批准进行. 离心机(湘仪离心机仪器有限公司提供); PCR仪(东胜创新生物科技有限公司提供); GeXP Genetic analysis system (Beckman公司提供); Nano Drop分光光度计(Thermo公司提供).
| 肿瘤类型 | n | 既往治疗 | 化疗方案 |
| 食管癌 | 34 | 一线、二线 | NF、伊立替康等 |
| 胰腺癌 | 14 | 一线、二线 | 健择、多西他赛、卡培他滨等 |
| 肝癌 | 16 | 一线、二线 | 吉西他滨、CAFI、FOLFOX4等 |
| 胃癌 | 20 | 一线、二线 | ELF、FOLFOX、DCF、EOX |
| 结肠癌 | 16 | 一线、二线 | FOLFIRI、XELOX、FOLFOX等 |
1.2.1 治疗: 所有入组患者均紫杉醇单药或者紫杉醇联合顺铂方案化疗. 给药途径及剂量: 紫杉醇(扬子江药业有限公司提供, 批号14072211)130 mg/m2, 静脉滴注, d1、8, 21 d为1周期, 顺铂(齐鲁制药有限公司, 批号1501002A)75 mg/m2, d1-3, 21 d为1周期. 每2周期为1疗程, 每疗程结束后复查CT或核磁共振成像(magnetic resonance imaging, MRI)用以评价疗效, 记录实体病灶变化情况, 并予每周复查血常规、肝肾功能等基本情况.
1.2.2 观察指标及方案: (1)MDR1 G2677T基因型测定: 采用直接测序法PCR扩增MDR1 2677T基因目的片段, 方法如下: 所有入组患者于首次化疗前采集外周静脉血5 mL, 置于EP管内, 抗凝后室温下放置0.5 h后, 采用DNA测序试剂盒(Beckman公司, 批号NA009-2)严格按照试剂盒说明书操作进行提取基因组DNA, 并测定其浓度. PCR扩增MDR1 2677T基因的目的片段, 扩增引物序列为: 正向引物: TGTTGTCTGGACAAGCACTGA, 反向引物: GTCCAAGAACTGGCTTTGCT(引物由上海英俊生物技术有限公司合成). 反应体系包括rTaq、10×rTaq Buffer(25 μL)、dNTP(25 mmol/L)、6×Loading Buffer(均由上海博彩生物科技有限公司提供). 反应条件: 首先95 ℃变性2 min, 然后95 ℃ 30 s, 57 ℃退火30 s, 72 ℃ 30 s, 40个循环, 72 ℃延伸5 min. 电泳观察PCR产物, 符合标准后送至上海英俊生物技术有限公司直接进行测序, 测序结果采用DNAStar软件校对分析MDR1 2677T基因型; (2)近期疗效评定: 所有入组患者均需完成上述治疗方案至少2个周期的化疗才可进行疗效评定. 通过对比化疗前后的影像学、实验室指标(生化功能、肿瘤标志物指标等)对患者化疗疗效进行评定, 并记录肿瘤进展时间. 标准按照2009欧洲癌症研究与治疗协会、加拿大国立癌症研究所及美国国立癌症研究所共同制定的实体瘤疗效评价标准1.1版(Response Evaluation Criteria in Solid Tumors 1.1, RECIST 1.1)[7]. 对于可评价病灶采用16排螺旋CT用5 mm层面连续扫描, 对于浅表淋巴结采用彩色超声波测量. 具体标准如下: 完全缓解(complete response, CR): 所有可见病灶均消失, 持续4 wk以上; 部分缓解(partial response, PR): 双径可测病灶取各病灶最大两垂直径乘积总和减少50%以上, 单径可测病灶则取各病灶最大径之和减少50%以上, 持续4 wk以上; 疾病稳定(stable disease, SD): 双径可测病灶取各病灶最大两垂直径乘积之总和增大<25%或减少<50%, 单径可测病灶则取各病灶直径之总和增大<25%或减少<50%, 持续4 wk以上. 判定NC至少须经2周期(6 wk)治疗; 疾病进展(progressive disease, PD): 至少有一个病灶, 双径乘积或(在单径可测病灶)单径增大25%以上, 或出现新病灶. 判定PD必须经6 wk以上的治疗. 至少每两周期评定疗效1次, 病情进展则评价疗效, 若疗效为PD患者则需终止实验, 改为其他治疗方案支持治疗, 疗效为PR的患者继续应用原方案化疗直至SD, 巩固化疗2周期后随访并评定疗效, 疗效为SD的患者巩固化疗2周期后随访并评定疗效, CR患者巩固化疗2周期后随访并评定疗效, 所有未继续化疗患者每月评估病灶1次. 疾病缓解率 = (CR例数+PR例数)/总例数.
统计学处理 采用SPSS11.5软件进行统计, 基因多态性与疗效之间的相关性采用χ2检验及Fisher确切概率法进行, 采用多元Logistic回归分析法分析不同基因型及其他可能影响疗效的因素之间的关系. P<0.05表示差异有统计学意义.
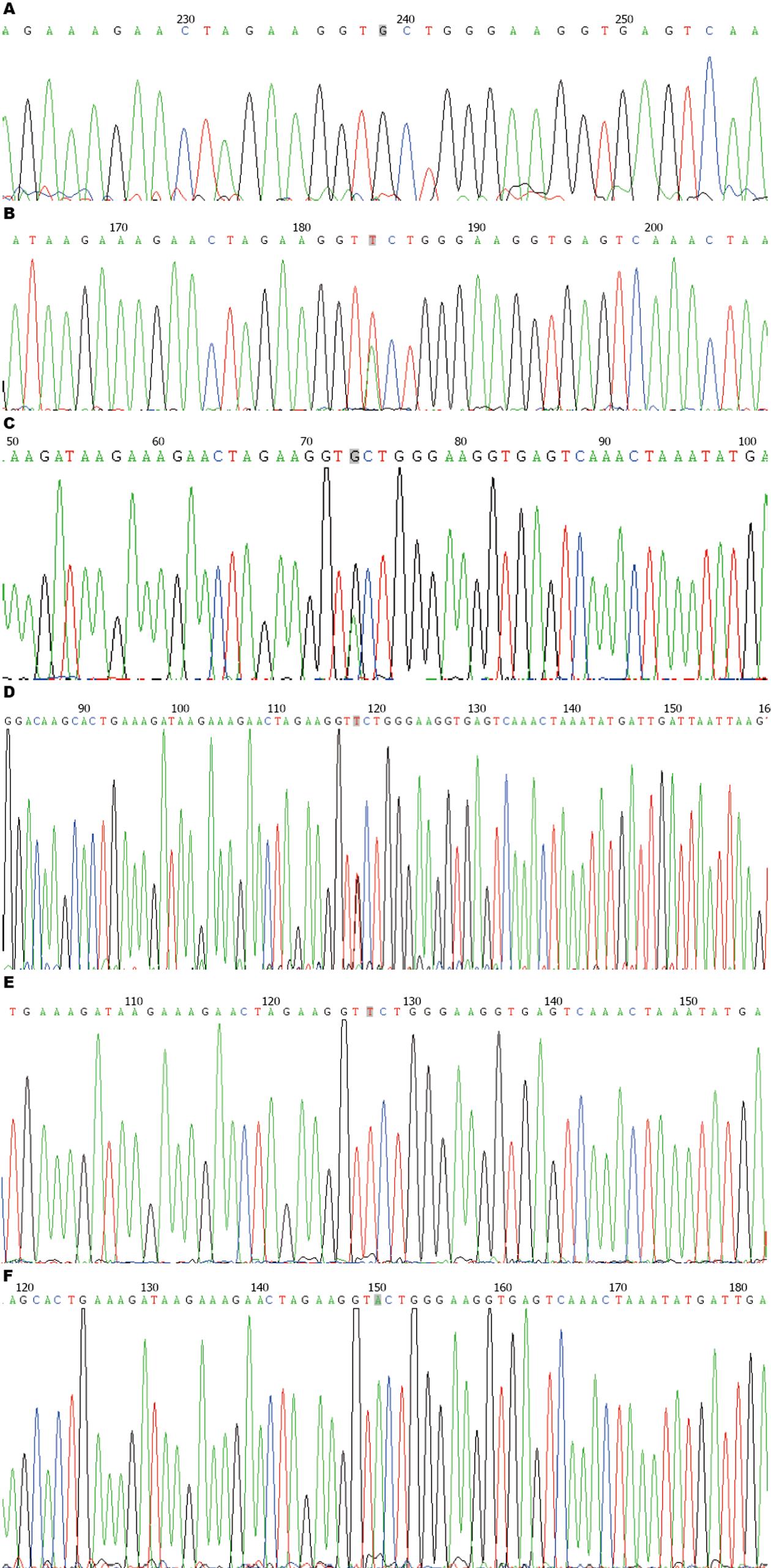
最终有94例患者完成了本研究(其中1例胃癌患者转院退出研究, 2例肺癌患者未完成治疗疗程退出研究). 94例样本共6个基因位点的序列测定结果如图1. 根据基因有无突变, 将基因型分为野生型(G/G)和突变型(A/A、T/T、G/T、G/A、A/T)两类. 经Hardy-Weinberg定律进行遗传平衡检测, 6个位点的基因型分布情况均来自同一孟德尔群体, 达到基因平衡: A/A: 6例, G/G: 32例, T/T: 14例, G/T: 10例, G/A: 12例, A/T: 20例(χ2 = 0.084, P = 0.796). 两类基因型与肿瘤发生部位无明显相关性(P = 0.747)(表2).
| 肿瘤类型 | n | 基因型(n) | χ2值 | P值 | |
| 野生型 | 突变型 | ||||
| 食管癌 | 30 | 10 | 20 | -6.46 | 0.747 |
| 胰腺癌 | 14 | 6 | 8 | ||
| 肝癌 | 16 | 8 | 8 | ||
| 胃癌 | 18 | 4 | 14 | ||
| 结肠癌 | 16 | 4 | 12 | ||
97例入组患者中除退出研究的3例患者外, 可进行疗效评价的有94例. 其中CR 2例, PR 24例, SD 54例, PD 14例, 总缓解率为27.66%. 其中肝患者2例CR, 6例PR, 胰腺癌患者2例PR, 胃癌患者6例PR, 结肠癌患者4例PR, 食管癌患者6例PR.
分析疗效与MDR1 G2677T基因多态性及其他可能影响疗效因素(年龄、性别、PS评分)之间的关系, 结果显示, 患者年龄、性别及PS评分对疗效的影响无明显显著性差异(均P>0.05), 仅MDR1 G2677T基因多态性与疗效相关(P<0.05)(表3). 进一步分析基因型与疗效关系, 结果显示, MDR1 G2677T野生型G/G对疗效的影响有统计学意义(P<0.01)(表4).
| 分组 | 疗效 | χ2值 | P值 | |||
| CR | PR | SD | PD | |||
| 性别 | 0.495 | 0.712 | ||||
| 男 | 0 | 16 | 22 | 6 | ||
| 女 | 2 | 8 | 30 | 10 | ||
| 年龄(岁) | 0.102 | 0.822 | ||||
| ≤60 | 2 | 10 | 20 | 8 | ||
| >60 | 0 | 14 | 32 | 8 | ||
| PS评分(分) | 0.090 | 0.826 | ||||
| 0 | 0 | 6 | 10 | 2 | ||
| 1 | 2 | 12 | 30 | 8 | ||
| 2 | 0 | 6 | 12 | 6 | ||
| 基因型 | 6.346 | 0.023 | ||||
| 野生型 | 2 | 8 | 16 | 6 | ||
| 突变型 | 0 | 16 | 36 | 10 | ||
| 疗效 | 基因型(n) | χ2值 | P值 | |
| 野生型 | 突变型 | |||
| CR+PR | 24 | 8 | 18.12 | 0.0043 |
| SD+PD | 8 | 54 | ||
在当前晚期难治性恶性肿瘤的治疗中, 20%-40%患者可能接受了错误的药物治疗[8], 这也是成为难治性恶性肿瘤的主要原因. 为了达到更佳的治疗效果, 减少对化疗药物不敏感的患者所承受的不良反应, 在化疗前根据可靠的指标预测化疗药物的疗效已变得尤为重要. 已被证实, MDR1及其编码产物P-糖蛋白(P-glycoprotein, P-gp)的异常表达与肿瘤发生多药耐药有明显相关性[2,9]. P-gp的主要生理功能为调节细胞膜通透性, 影响药物在细胞内的浓聚, 增强药物及X线的外排能力[2,10], 保护细胞免受药物或毒物的损害, 是耐药的经典途径, 因此MDR1/P-gp是肿瘤化疗失败的关键因素. MDR1基因具有高度多态性, 已发现其有50多个SNP, 其中21外显子G2677T与MDR1及P-gp的功能和表达密切相关[3,11]. MDR1 exon 21 2677位置G转变为T可导致氨基酸发生变化, 即丙氨酸转变为丝氨酸, 使得P-gP的表达和功能发生改变. 国内于庆忠等[1]学者研究发现MDR1 G2677T各类基因类型中, 带有T基因的患者对化疗药物的疗效明显低于其他基因类型的患者. 国外Kim等[12]研究发现携带有MDR1 G2677T基因的患者地高辛浓度是MDR1/2677G基因患者的1/2. 临床上已有报道[13,14]指出, MDR1 G2677T基因多态性可用作于鼻咽癌放疗疗效及急性淋巴细胞白血病预测指标, 由此可见, 了解患者或不同人群的MDR1 G2677T基因型特点, 对于预测化疗药物的疗效, 制定个体化治疗方案具有重要意义.
紫杉醇为广谱抗肿瘤药, 已被广泛应用于多种恶性肿瘤的临床治疗. 越来越多的研究[6,15]显示, 紫杉醇对晚期胃肠道肿瘤、乳腺恶性肿瘤、前列腺癌、胰腺癌等肿瘤均有较好疗效, 可控制部分晚期难治性恶性肿瘤患者病情. 本研究中入组的97例患者既往均接受过反复多次化疗, 病情进展, 为消化系难治性恶性肿瘤. 在接受了以紫杉醇为主的化疗后, 可进行疗效评价的有94例, 其中CR2例, PR 24例, SD 54例, 疾病缓解率为27.66%, 这与国内梅静峰等[5]学者报道接近. 采用多元Logistic回归分析影响疗效的相关因素(包括年龄、性别、PS评分及MDR1 G2677T基因型), 发现MDR1 G2677T基因多态性与疗效相关. 进一步研究MDR1 G2677T基因型, 发现共有两类基因型(野生型G/G, 突变型A/T、T/T、G/T、G/A、A/A), 其中MDR1 G2677T野生型G/G对疗效的影响有统计学意义, 提示野生型G/G基因携带者化疗疗效优于其他基因型携带者, 结果与国内王志远等[14]报道类似. 由此我们推测, MDR1 G2677 T基因多态性可作为遗传学标志预测紫杉醇对晚期消化系难治性恶性肿瘤患者的化疗敏感性, 可为其化疗药物的个体化选择提供一定的参考. 本研究的不足之处在于没有检测P-gp的蛋白含量, 无法直接验证MDR1 G2677T基因多态性对P-gp蛋白的影响, 且由于研究经费限制, 研究的样本量偏少, 仍需进一步增加样本量深入研究.
晚期恶性肿瘤的治疗很棘手, 因此类患者往往接受过多次化疗, 易产生耐药性而成为难治性恶性肿瘤, 肿瘤多药耐药性(multi-drugs resistance, MDR)是肿瘤化疗失败的关键因素, 其21外显子G2677T与MDR1的功能和表达密切相关, 本研究初步探讨MDR1 G2677T基因多态性与紫衫类药物疗效关系.
文碧秀, 教授, 中山大学附属第一医院放射治疗科; 田华, 副研究员, 上海交通大学医学院附属仁济医院上海市肿瘤研究所
在当前的晚期肿瘤治疗中, 药物对患者治疗的有效性低, 十分有必要建立个体化用药配套的检测技术, 用于指导临床用药, 追踪病患用药后药效, 从而避免不必要的化疗对患者机体的损伤, 目前鲜有MDR1 G2677T基因预测衫类疗效的报道.
本文研究显示MDR1 G2677T基因多态性可作为遗传学标志预测紫杉醇对晚期消化系难治性恶性肿瘤患者的化疗敏感性, 为其化疗药物的个体化选择提供一定的参考.
通过测定MDR1 G2677T基因多态性预测紫杉醇疗效, 从而避免不必要的化疗对患者机体的损伤, 节省有限的医疗资源, 使患者得到最优化的治疗.
本文研究有一定的学术价值及实用价值.
编辑: 于明茜 电编:闫晋利
| 2. | Marzolini C, Paus E, Buclin T, Kim RB. Polymorphisms in human MDR1 (P-glycoprotein): recent advances and clinical relevance. Clin Pharmacol Ther. 2004;75:13-33. [PubMed] [DOI] |
| 4. | Chang H, Rha SY, Jeung HC, Im CK, Ahn JB, Kwon WS, Yoo NC, Roh JK, Chung HC. Association of the ABCB1 gene polymorphisms 2677G& gt; T/A and 3435C& gt; T with clinical outcomes of paclitaxel monotherapy in metastatic breast cancer patients. Ann Oncol. 2009;20:272-277. [PubMed] [DOI] |
| 6. | Kolevska T, Ryan CJ, Huey V, Weisberg L, Wang S, Baer D, Ghadialy A, Goldstein D, Fireman B, Fehrenbacher L. Phase II trial of nabpaclitaxel as first line therapy of hormone refractory metastatic prostate cancer(HRPC). J Clin Oncol. 2009;27:5152. |
| 7. | Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R, Dancey J, Arbuck S, Gwyther S, Mooney M. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer. 2009;45:228-247. [PubMed] [DOI] |
| 8. | Ross JS, Schenkein DP, Kashala O, Linette GP, Stec J, Symmans WF, Pusztai L, Hortobagyi GN. Pharmacogenomics. Adv Anat Pathol. 2004;11:211-220. [PubMed] |
| 9. | Hoffmeyer S, Burk O, von Richter O, Arnold HP, Brockmöller J, Johne A, Cascorbi I, Gerloff T, Roots I, Eichelbaum M. Functional polymorphisms of the human multidrug-resistance gene: multiple sequence variations and correlation of one allele with P-glycoprotein expression and activity in vivo. Proc Natl Acad Sci USA. 2000;97:3473-3478. [PubMed] [DOI] |
| 10. | 陈 俊, 张 积仁, 肖 明星. P糖蛋白抑制x射线诱导凋亡及对线粒体膜电位的影响. 中华放射医学与防护杂志. 2004;24:297-299. |
| 11. | Ambudkar SV, Kimchi-Sarfaty C, Sauna ZE, Gottesman MM. P-glycoprotein: from genomics to mechanism. Oncogene. 2003;22:7468-7485. [PubMed] [DOI] |
| 12. | Kim RB, Leake BF, Choo EF, Dresser GK, Kubba SV, Schwarz UI, Taylor A, Xie HG, McKinsey J, Zhou S. Identification of functionally variant MDR1 alleles among European Americans and African Americans. Clin Pharmacol Ther. 2001;70:189-199. [PubMed] |
| 15. | Teneriello MG, Tseng PC, Crozier M, Encarnacion C, Hancock K, Messing MJ, Boehm KA, Williams A, Asmar L. Phase II evaluation of nanoparticle albumin-bound paclitaxel in platinum-sensitive patients with recurrent ovarian, peritoneal, or fallopian tube cancer. J Clin Oncol. 2009;27:1426-1431. [PubMed] [DOI] |