修回日期: 2016-03-02
接受日期: 2016-03-08
在线出版日期: 2016-04-28
目的: 研究维生素D3衍生物MART-10对人胰腺癌BxPC-3细胞的生长及survivin mRNA、c-myc蛋白、P21蛋白表达的影响, 以期探讨其抑癌机制.
方法: 四甲基谷氮咪盐(methyl-thiazolyl-tetrazolium, MTT)比色法检测MART-10对BxPC-3细胞生长的影响; 流式细胞术检测细胞周期, 观察细胞的生长情况; 逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR)法检测BxPC-3细胞中survivin mRNA的表达; Western blot法检测BxPC-3细胞中c-myc蛋白和P21蛋白的表达.
结果: MTT结果显示, MART-10可显著抑制人胰腺癌BxPC-3细胞的生长, 其抑制50%细胞生长的给药浓度(IC50)为10-7 mmol/L; 流式细胞术结果显示, 癌细胞在MART-10的作用下, G0/G1期的细胞比例上升而S期的细胞比例则下降; RT-PCR及Western blot结果表明, 随着MART-10作用时间的延长及给药浓度的增加, 胰腺癌BxPC-3细胞中survivin mRNA和c-myc蛋白的表达量逐渐减低, 而P21蛋白的表达量则逐渐增强.
结论: 维生素D3衍生物MART-10对人胰腺癌BxPC-3细胞的生长具有显著抑制作用, 其作用的机制可能与其调节survivin、c-myc及P21的表达有关.
核心提示: 本研究使用四甲基谷氮咪盐检测生长抑制率, 流式细胞术分析细胞周期, 逆转录-聚合酶链反应与Western blot法检测survivin mRNA、c-myc蛋白和P21蛋白的表达, 探讨了MART-10对人胰腺癌BxPC-3细胞的抗肿瘤机制, 认为MART-10有望成为临床上治疗胰腺癌的一种新型靶向基因治疗药物.
引文著录: 杨晟, 林军. 维生素D3衍生物MART-10对人胰腺癌BxPC-3细胞的生长及survivin mRNA、c-myc蛋白、P21蛋白表达的影响. 世界华人消化杂志 2016; 24(12): 1860-1865
Revised: March 2, 2016
Accepted: March 8, 2016
Published online: April 28, 2016
AIM: To analyze the effect of MART-10, a new kind of vitamin D3 derivative, on cell growth and proliferation and the expression of survivin mRNA, c-myc protein and P21 protein in BxPC-3 cells.
METHODS: After BxPC-3 cells were treated with MART-10, the growth of BxPC-3 cells was assessed by MTT assay, cell cycle was analyzed by flow cytometry, survivin mRNA level was detected by reverse transcription-polymerase chain reaction (RT-PCR), and c-myc and P21 protein expression was detected by Western blot.
RESULTS: Treatment with MART-10 significantly inhibited the growth of BxPC-3 cells, and the IC50 concentration was 10-7 mmol/L. Flow cytometry results suggested that the proportion of S phase cells was decreased and the proportion of cells in G0/G1 phase was increased after treatment with MART-10. RT-PCR results showed that MART-10 significantly downregulated the mRNA level of survivin gene. Western blot results indicated that MART-10 significantly increased the protein levels of P21 but decreased the protein expression of c-myc.
CONCLUSION: Our results suggest that MART-10 can effectively inhibit the growth and proliferation of BxPC-3 cells, and the mechanism may be related with its influence on the expression of survivin, c-myc and P21.
- Citation: Yang S, Lin J. Effect of vitamin D3 derivative MART-10 on cell growth and expression of survivin mRNA, c-myc protein and P21 protein in BxPC-3 cells. Shijie Huaren Xiaohua Zazhi 2016; 24(12): 1860-1865
- URL: https://www.wjgnet.com/1009-3079/full/v24/i12/1860.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i12.1860
Norman等于1991年首次合成了一种名为EB1089的维生素D衍生物[1], 自此, 多种维生素D的衍生物相继被合成出来. MART-10是一种新型的维生素D3衍生物, 其具有显著抑制肿瘤细胞的生长、增殖, 促进肿瘤细胞的分化等作用[2], 除此之外, 有研究[3]报道, MART-10可显著提高患者的血钙水平, 具有诸多抗癌及防癌的药学活性, 国内外医师已将其初步运用于部分恶性肿瘤(如乳腺癌、肝癌、前列腺癌、结肠癌)的临床预防及治疗等方面, 但其对人体胰腺癌的临床应用效果还未报道[4]. 本研究通过采用不同浓度的MART-10对体外培养的人胰腺癌BxPC-3细胞进行干预, 分析其对BxPC-3细胞的生长、增殖等方面的影响, 研究其抗胰腺癌的可能机制, 为人类胰腺癌的防治提供新思路.
人胰腺癌BxPC-3细胞系购自美国菌种保藏中心(American Tissue Type Culture Collection, ATCC). MART-10(购自Christina Mk Hansen, M. Sc.药业公司), 于-20 ℃冰箱内避光保存, 使用时采用RPMI 1640培养基和二甲基亚砜(DMSO)进行稀释. 将细胞置于37 ℃、50 mL/L CO2的细胞培养箱内, 使用含10%胎牛血清、2 g NaHCO3及80000 U/L庆大霉素的RPMI 1640培养基(购自Gibico, UK)进行培养、传代, 取处于对数生长期的细胞进行实验, 以2×105个细胞/mL的密度接种到96孔细胞培养板上, 50 μL/孔, 其中实验组按照MART-10给药浓度的不同分为5组, 且每组均设5个复孔. 分别向每孔中加入50 μL MART-10, 使其终浓度分别为10-11 mmol/L、10-10 mmol/L、10-9 mmol/L、10-8 mmol/L和10-7 mmol/L, 而对照组中则加入等量的RPMI 1640培养基和DMSO(<0.1% V/V), 以上所有操作均需在避光、无菌环境下进行.
1.2.1 四甲基谷氮咪盐(methyl-thiazolyl-tetrazolium, MTT)实验检测生长抑制率: 将细胞置于37 ℃、50 mL/L CO2细胞培养箱中培养72 h后, 吸取上清, 每孔按照1:10的比例加入100 μL 5 g/L的MTT(购自华美生物公司)孵育4 h后, 加入DMSO以终止反应, 震荡30 min后采用酶标仪(型号为: SLP SPECTRA-1)于575 nm波长处测定其吸光度(A)值, 并计算各浓度MART-10对胰腺癌细胞生长的抑制率, 其中抑制率的计算公式为: 抑制率 = (阴性对照组的A值-空白对照组的A值-观察组的A值)/(阴性对照组的A值-空白对照组的A值).
1.2.2 流式细胞法分析细胞周期: 使用1×10-7 mmol/L的MART-10处理人胰腺癌BxPC-3细胞72 h后, 0.25%的胰蛋白酶对其进行消化并收集细胞, 经PBS洗涤后采用70%冷乙醇固定24 h, 后经PBS洗涤并制备单细胞悬液, 采用50 μg/mL的RNA酶在37 ℃条件下反应30 min, 50 μg/mL的PI于4 ℃条件下进行避光染色1 h, 将细胞的浓度调节为106个/mL后上流式细胞仪检测, 根据其DNA的含量对细胞周期的变化进行分析.
1.2.3 逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR)检测survivin基因的表达: TRIzol法提取细胞总RNA, 逆转录合成cDNA, RT-PCR法检测survivin mRNA的表达. cDNA扩增survivin基因的引物序列为: 5'-GGACCTCCGCACCTCTACAT-3'(上游)和5'-GCACTTTCTTCGCAGTTTCC-3'(下游); 内参为: β-肌动蛋白(β-action), 其引物序列为: 5'-CGCTGCGCTGGTCGTCGACA-3'和5'-GTCACGCACGATTTCCCGCT-3'. PCR反应体系如下: 1 μL的cDNA, 2 μL 2.5 mmol/L的dNTP, 0.5 μL 20 pmol/L的上下游引物, 0.25 μL 1.25 U的Pfu DNA聚合酶, 2.5 μL 5×Pfu DNA聚合酶缓冲液, 反应的条件为: 94 ℃, 40 s; 60 ℃, 1 min; 72 ℃, 1 min; 共计32个循环. 以β-actin为内参对其转录效率进行检测. PCR的产物采用2%的琼脂糖凝胶进行电泳分析, 采用溴化乙锭(EB)对其进行显色并拍照.
1.2.4 Western blot法检测c-myc蛋白和P21蛋白的表达: 收集各组细胞, 提取蛋白, 酚试剂法检测蛋白含量, 取50 μg蛋白上样进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE), 后将蛋白转印至硝酸纤维素膜(NC)上, 小牛血清封闭后分别采用一抗(1:2000的稀释比)和辣根过氧化物酶标记的二抗(1:1000的稀释比)进行孵育, 并采用化学发光试剂进行增强反应, 采用X光片进行压片曝光, 凝胶成像仪对其结果进行分析.
统计学处理 采用统计学软件SPSS17.0进行统计分析, 其中计量资料采用mean±SD表示, 而计数资料采用百分率(%)表示, 组间比较采用方差分析, 采用Q检验进行显著性检验, 将P<0.05定义为差异有统计学意义.
本研究中, 对照组胰腺癌细胞生长状态良好, 而实验组BxPC-3细胞的生长抑制率随MART-10药物的浓度上升而逐渐提高, 其中最大抑制率可达54.7%(表1), 各药物浓度组的组间F值为12.38, 经统计分析, 具有显著性差异(P<0.05).
| 指标 | 空白对照 | 阴性对照 | 给药浓度(mmol/L) | ||||
| 10-11 | 10-10 | 10-9 | 10-8 | 10-7 | |||
| 吸光度值 | 0.04±0.01 | 1.40±0.01 | 1.27±0.03 | 1.17±0.03 | 1.13±0.01 | 1.02±0.02 | 0.74±0.02 |
| 生长抑制率(%) | 9.75±2.81 | 17.32±0.27 | 20.10±0.80 | 28.82±1.26 | 55.75±2.05 | ||
| P值 | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | ||
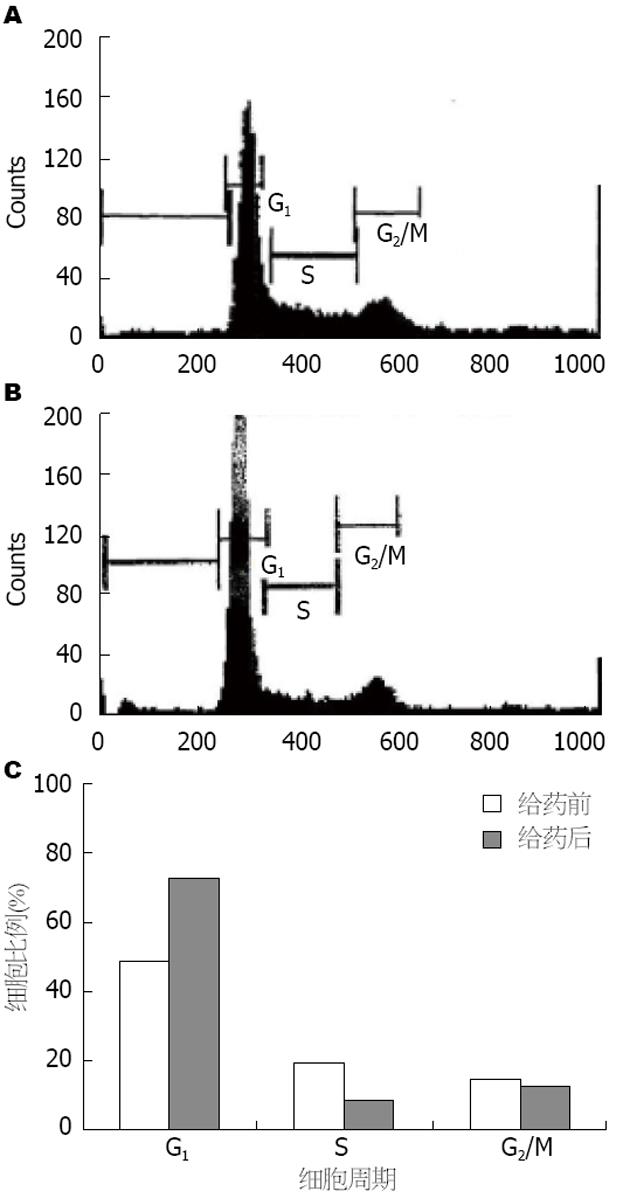
流式细胞术结果提示, 对照组癌细胞的周期分布比例为: G1期: 47%, S期: 18%, G2/M期: 14%; 实验组(1×10-7 mmol/L)的细胞周期分布比例: G1期: 72%, S期: 7%, G2/M期: 11%(图1). 给药后其G1期的细胞比例上升, DNA合成较活跃的S期其细胞比例则下降, 产生了G1期细胞的阻滞效应.
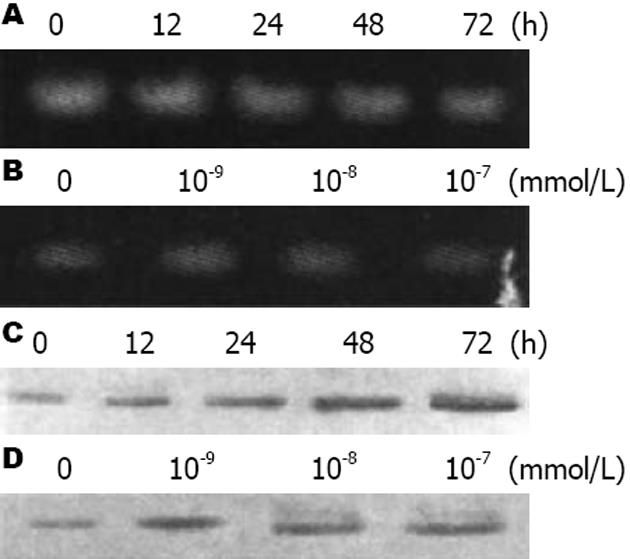
RT-PCR结果表明, MART-10可显著抑制人胰腺癌BxPC-3细胞中survivin基因的表达, 且其表达量均随给药浓度的增加及作用时间的延长而逐渐下降(图2).
维生素D3及其衍生物已在多种恶性疾病中得到应用[5]. 肿瘤发生的根本原因在于基因组不稳定, 使本来应停止增殖或生理性凋亡的细胞不停地进入细胞周期, 因而造成恶性增生. 研究[6]表明, 维生素D具有抗肿瘤的药理活性, 体外实验发现其抗肿瘤的效应主要是与其细胞内的高亲和力受体, 即维生素D受体(vitamin D receptor, VDR)发生结合. 该受体属于类固醇受体超家族成员, 这种配体-受体复合物可作为一种影响DNA特定序列转录的反应元件(vitamin D response element, VDRE), 在特定基因转录及翻译过程中起作用, 使其基因的转录过程被激活或受到抑制[7,8]. 人体内约有50多种基因对维生素D具有敏感性, 其中很大一部分为VDRE. 国内外研究表明, 维生素D对胆囊、结肠、垂体、甲状腺、前列腺、乳腺肿瘤或白血病等均具有不同程度地抑制细胞生长、促进细胞分化等作用. 但维生素D的提高血钙水平的不良反应使其在抗肿瘤的临床应用中受到了限制[9]. 本次研究中采用的药物MART-10是合成维生素D3的衍生物之一, 其能显著抑制肿瘤细胞的生长、促进其分化, 还可提高患者的血钙水平, 其对肿瘤细胞周期的调节作用是1,25(OH)2维生素D3的200倍之多, 而对血钙含量的影响仅是1,25(OH)2维生素D3的50%左右[10]. 通过采用MTT法检测发现, 给药72 h后, 胰腺癌细胞的生长抑制率达55%, 可见胰腺癌细胞对MART-10具有一定程度的敏感性, MART-10对胰腺癌细胞具有明显的生长抑制效应, 且这一效应具有剂量依赖性.
细胞凋亡对于多细胞生物体的发育和稳态的维持是至关重要的, 细胞凋亡异常在许多人体恶性肿瘤的发病学上占有十分重要的地位[11,12]. 凋亡抑制蛋白(inhibitor of apoptosis protein, IAP)家族是抑制细胞凋亡的重要成分, 其作用远远大于B淋巴细胞瘤-2家族. survivin是IAP家族的新成员, 作用于凋亡途径的终末效应蛋白酶Caspase3和Caspase7活性, 具有强大的抑制凋亡功能[13]. survivin基因在胰腺癌组织中表达上调, 提示survivin基因可能通过抑制胰腺癌细胞凋亡, 对胰腺癌的发生发展起重要作用, c-myc基因具有促进细胞增殖和凋亡的双重作用, c-myc蛋白可能通过促进survivin基因表达来抑制胰腺癌细胞的凋亡[14].
本次研究通过采用流式细胞法对MART-10作用于各期细胞的比例进行观察, 发现G1期细胞显著增多而S期细胞则显著减少, 细胞周期在G1期发生阻滞. 细胞周期的变化与细胞的生长、分化、衰老或癌变均具有密切的关系[15]. 本次研究也表明, MART-10可使人体胰腺癌细胞的细胞周期发生阻滞, 而细胞在非DNA合成期发生阻滞时, 可使其错误过程暂停, 待损伤修复后即可恢复至正常细胞周期, 这可能是MART-10的抗肿瘤机制[16].
P21是cyclin-CDK中的一种普遍的抑制因子, P21能抑制细胞周期蛋白A或E与CDK2的结合, 从而使细胞周期停滞于G1期[17]. Chiang等[18]报道MART-10可抑制头颈部鳞状细胞癌的生长, 使头颈部鳞状细胞癌细胞系SCC-25发生G1期细胞周期阻滞, 并伴随着P21蛋白表达的上调. 本次研究发现MART-10可使BxPC-3细胞的P21蛋白的表达增强, 由此可见MART-10诱导人体胰腺癌细胞周期的阻滞与P21的表达上调相关.
总之, 在本次实验应用MART-10后, survivin基因在胰腺癌细胞系中的表达受到明显抑制, 提示MART-10可能通过作用于VDRE后, 抑制survivin基因和c-myc基因的激活, 同时上调P21蛋白的表达, 促进胰腺癌细胞系的凋亡, 因此, MART-10有望成为临床上治疗胰腺癌的一种新型靶向基因治疗药物.
胰腺癌的病因尚未明确, 临床表现多变, 没有特异性, 发现时多为中晚期, 已失去手术机会, 化疗药物不良反应大. 维生素D及其衍生物有望成为临床上治疗胰腺癌的一种辅助药物治疗方法, 对于降低患者病死率, 提高患者生存率, 改善患者的生活质量有一定作用.
韩双印, 主任医师, 郑州大学人民医院消化内科
MART-10在多种恶性肿瘤中表现出强大的抗肿瘤作用, 且可提高患者的血钙水平, 具有诸多抗癌及防癌的药学活性, 国内外医师已将其初步运用于临床预防及治疗等方面, 但其对人体胰腺癌的临床应用效果还未报道.
维生素D及其衍生物对多种恶性肿瘤有抗肿瘤作用. 已有研究报道, 其与细胞内的高亲和力受体结合, 调节有关基因和蛋白的表达, 使细胞周期发生阻滞, 促进细胞凋亡, 抑制肿瘤细胞生长, 在乳腺癌、肝癌、前列腺癌、结肠癌、基底细胞癌等肿瘤中发挥抑癌作用, 随着认识的深入, 将会发现其对更多的肿瘤有抑瘤作用.
MART-10可抑制人胰腺癌BxPC-3细胞的生长, 通过调节survivin、c-myc及P21的表达使其发生细胞周期阻滞, 促进其凋亡, 对其涉及的可能机制进行了深入分析.
维生素D导致的高钙血症不良反应使其在抗肿瘤的临床应用中受到了限制. MART-10是合成维生素D3的衍生物之一, 其能显著抑制肿瘤细胞的生长、促进其分化, 还可提高患者的血钙水平, 其有望产生更强大的抗肿瘤作用和更小的不良反应.
维生素D受体(VDR): 即维生素D受体, 是一种核转录因子, 通过与配体特异结合, 调控多种基因的表达, 从而调节多种生命活动的进行.
本文通过研究维生素D3衍生物MART-10对人胰腺癌BxPC-3细胞系的生长抑制作用及可能的分子机制. 选题有一定的新颖性, 研究方法采用正确, 结论基本可靠, 对探索胰腺癌的治疗有一定参考意义.
编辑: 于明茜 电编:闫晋利
| 1. | Chiang KC, Yeh CN, Hsu JT, Yeh TS, Jan YY, Wu CT, Chen HY, Jwo SC, Takano M, Kittaka A. Evaluation of the potential therapeutic role of a new generation of vitamin D analog, MART-10, in human pancreatic cancer cells in vitro and in vivo. Cell Cycle. 2013;12:1316-1325. [PubMed] [DOI] |
| 4. | Sherman MH, Yu RT, Engle DD, Ding N, Atkins AR, Tiriac H, Collisson EA, Connor F, Van Dyke T, Kozlov S. Vitamin D receptor-mediated stromal reprogramming suppresses pancreatitis and enhances pancreatic cancer therapy. Cell. 2014;159:80-93. [PubMed] [DOI] |
| 5. | Kennel KA, Drake MT. Vitamin D in the cancer patient. Curr Opin Support Palliat Care. 2013;7:272-277. [PubMed] [DOI] |
| 7. | Weinstein SJ, Stolzenberg-Solomon RZ, Kopp W, Rager H, Virtamo J, Albanes D. Impact of circulating vitamin D binding protein levels on the association between 25-hydroxyvitamin D and pancreatic cancer risk: a nested case-control study. Cancer Res. 2012;72:1190-1198. [PubMed] [DOI] |
| 9. | Feldman D, Krishnan AV, Swami S, Giovannucci E, Feldman BJ. The role of vitamin D in reducing cancer risk and progression. Nat Rev Cancer. 2014;14:342-357. [PubMed] [DOI] |
| 10. | Chiang KC, Yeh CN, Hsu JT, Jan YY, Chen LW, Kuo SF, Takano M, Kittaka A, Chen TC, Chen WT. The vitamin D analog, MART-10, represses metastasis potential via downregulation of epithelial-mesenchymal transition in pancreatic cancer cells. Cancer Lett. 2014;354:235-244. [PubMed] [DOI] |
| 11. | Zhu X, Yi F, Chen P, Chen L, Zhang X, Cao C, Tan W. 5-Aza-2'-Deoxycytidine and CDDP Synergistically Induce Apoptosis in Renal Carcinoma Cells via Enhancing the APAF-1 Activity. Clin Lab. 2015;61:1821-1830. [PubMed] |
| 12. | Chen TC, Chien CC, Wu MS, Chen YC. Evodiamine from Evodia rutaecarpa induces apoptosis via activation of JNK and PERK in human ovarian cancer cells. Phytomedicine. 2016;23:68-78. [PubMed] [DOI] |
| 13. | Sam MR, Ahangar P, Nejati V, Habibian R. Treatment of LS174T colorectal cancer stem-like cells with n-3 PUFAs induces growth suppression through inhibition of survivin expression and induction of caspase-3 activation. Cell Oncol (Dordr). 2016;39:69-77. [PubMed] [DOI] |
| 14. | Wang YW, Wu X, Zhou Y, Jiang H, Pan S, Sun B. Piperlongumine suppresses growth and sensitizes pancreatic tumors to gemcitabine in a xenograft mouse model by modulating the NF-kappaB pathway. Cancer Prev Res (Phila). 2015; Dec 14. [Epub ahead of print]. [PubMed] |
| 16. | Chiang KC, Kuo SF, Chen CH, Ng S, Lin SF, Yeh CN, Chen LW, Takano M, Chen TC, Juang HH. MART-10, the vitamin D analog, is a potent drug to inhibit anaplastic thyroid cancer cell metastatic potential. Cancer Lett. 2015;369:76-85. [PubMed] [DOI] |
| 18. | Chiang KC, Yeh CN, Hsu JT, Chen LW, Kuo SF, Sun CC, Huang CC, Pang JH, Flanagan JN, Takano M. MART-10, a novel vitamin D analog, inhibits head and neck squamous carcinoma cells growth through cell cycle arrest at G0/G1 with upregulation of p21 and p27 and downregulation of telomerase. J Steroid Biochem Mol Biol. 2013;138:427-434. [PubMed] [DOI] |