修回日期: 2016-03-19
接受日期: 2016-03-28
在线出版日期: 2016-04-28
目的: 探讨白介素28B(interleukin-28B, IL-28B)在天津汉族人群乙型肝炎相关性肝癌组织中的表达情况, 并分析IL-28B的表达与乙型肝炎相关性肝癌临床病理因素之间的关系, 探讨其在乙型肝炎相关性肝癌发生发展中的作用及其临床意义.
方法: 收集96例乙型肝炎相关性肝癌患者与84例乙型肝炎伴发肝脏良性肿瘤患者的血清, 采用酶联免疫吸附法检测IL-28B水平、免疫组织化学法检测IL-28B在肝癌组织及肝脏良性肿瘤组织中的表达情况.
结果: 在乙型肝炎相关性肝癌患者血清中IL-28B的水平明显高于乙型肝炎伴发肝脏良性肿瘤组, 免疫组织化学显示IL-28B在乙型肝炎相关性肝癌中的表达阳性率为83.33%, 在乙型肝炎伴发肝脏良性肿瘤组织中的表达阳性率为66.66%, 两者间的差异具有统计学意义(P<0.05). IL-28B在乙型肝炎相关性肝癌组织中的表达与年龄、性别、HBV DNA、肿瘤分化程度均无相关性(P>0.05), 但与甲胎蛋白(α-fetoprotein, AFP)、肿瘤最大径、TNM分期相关(χ2 = 6.653、6.732、8.642, P<0.05).
结论: 血清IL-28B的水平对于乙型肝炎相关性肝癌的诊断有到一定价值, 其在乙型肝炎相关性肝癌组织中的表达显著升高与肝癌患者的AFP、肿瘤最大径、TNM分期相关, 提示IL-28B的表达失调可能参与了乙型肝炎相关性肝癌的发生、发展.
核心提示: 本文研究发现, 白介素-28B不仅与HBV、HCV抗病毒治疗的免疫应答及预后有关, 而且对于乙型肝炎相关性肝癌的早期诊断及治疗有一定价值, 其表达失调可能参与乙型肝炎相关性肝癌的发生、发展.
引文著录: 徐峰, 于莹, 杨永红, 刘华, 王娟. IL-28B在乙型肝炎相关性肝癌中的表达及其临床意义. 世界华人消化杂志 2016; 24(12): 1812-1818
Revised: March 19, 2016
Accepted: March 28, 2016
Published online: April 28, 2016
AIM: To detect the expression of interleukin-28B (IL-28B) gene in human HBV related hepatocellular carcinoma, and analyze the relationship between IL-28B expression and clinicopathologic features of HBV related hepatocellular carcinoma.
METHODS: Serum samples were collected from 96 patients with HBV related hepatocellular carcinoma and 84 patients with HBV related benign hepatic nodules. Serum levels of IL-28B were measured by enzyme-linked immunosorbant assay (ELISA). The expression of IL-28B in HBV related hepatocellular carcinoma tissues was detected by immunohistochemistry.
RESULTS: The mean level of serum IL-28B was significantly higher in the HBV related hepatocellular carcinoma group than in the HBV related benign hepatic nodules group. Immunohistochemistry showed that the positive expression rate of IL-28B was significantly higher in HBV related hepatocellular carcinoma tissues than in HBV related hepatic benign nodule tissues (83.33% vs 66.66%, P < 0.05). IL-28B expression was not correlated with age, gender, HBV DNA, or tumor differentiation, but it was significantly related to AFP, tumor maximum diameter and clinical TNM stage (χ2 = 6.653, 6.732, and 8.642, P < 0.05 for all).
CONCLUSION: The level of IL-28B has certain value in the diagnosis of HBV related hepatocellular carcinoma. The expression of IL-28B in HBV related hepatocellular carcinoma tissues significantly increases, which correlates with AFP, tumor maximum diameter and clinical TNM stage. The dysregulated expression of IL-28B might participate in the genesis and development of HBV related hepatocellular carcinoma.
- Citation: Xu F, Yu Y, Yang YH, Liu H, Wang J. Clinical significance of IL-28B expression in HBV related hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2016; 24(12): 1812-1818
- URL: https://www.wjgnet.com/1009-3079/full/v24/i12/1812.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i12.1812
原发性肝癌(primary hepatocellular carcinoma, PHC)是临床最常见的恶性肿瘤之一, 2015年在我国其发生率和死亡率位居肿瘤相关死亡的第3位, 60岁以下男性人群肿瘤相关死亡的首位[1], 乙型肝炎病毒感染是引起肝癌的最主要原因[2,3], 乙型肝炎相关性肝癌发病的隐匿性强, 亚临床期没有特异性表现, 影像学异常或出现相应临床症状通过肝穿刺明确诊断大多已到晚期[4]. 因此, 对于乙型肝炎相关性肝癌的发生、发展及早期诊断的研究具有重要意义.
白介素28B(interleukin-28B, IL-28B)是近年来新发现的Ⅲ型干扰素家族(interferon lambda, IFN-λs)成员之一, 其编码基因位于人的第19号染色体(19q13.13)的AC011445.6基因群上, 长度1.34 kb, 包含6个外显子和5个内含子, 其蛋白由22个氨基酸的信号肽和174个氨基酸的成熟肽组成, 含有3个二硫键, 分子质量约22 ku[5,6]. IL-28B通过其与受体结合, 发挥免疫调节、抗病毒、抗细胞增殖等功能[7,8]. 目前对IL-28B的研究大多局限在其单核苷酸多态性与丙型肝炎IFN抗病毒治疗及预后方面[9], 也有少量有关IL-28B多态性与乙型肝炎IFN应答及病毒清除方面的研究[10], 而对IL-28B与肝炎后肝癌相关性的研究罕见报道. 本研究通过检测IL-28B在乙型肝炎相关性肝癌血液及组织中表达情况, 以揭示IL-28B在乙型肝炎相关性肝癌发生、发展过程中的作用.
观察组和对照组共180例均为天津市第三中心医院及分院2014-01/2016-01住院治疗的乙型肝炎患者, 所有患者诊断均符合中华医学会肝病学分会和中华医学会感染病学分会于2015年发布的《慢性乙型肝炎诊断标准(2015年版)》[11]及卫生部于2011年发布的《原发性肝癌诊疗规范(2011年版)》中的"原发性肝癌的临床诊断标准"[12], 并排除丙型病毒性肝炎、酒精性肝病、自身免疫性肝病及药物性肝损害. 患者年龄为38-72岁, 平均年龄为54.67岁±13.71岁, 乙型肝炎相关性肝癌患者96例(男54例, 女42例)为观察组, 乙型肝炎伴发肝脏良性肿瘤患者84例(男48例, 女36例)为对照组(肝血管瘤56例, 肝腺瘤9例, 肝脏炎性假瘤11例, 肝局灶性结节性增生8例), 均经临床化验、B超、CT及手术病理及肝穿刺活检确诊, 临床资料完整, 标本采集前患者均未有放化疗、长期口服避孕药、雌激素及抗肿瘤药物使用记录, 两组性别、年龄等资料均匹配. 两组人群均系天津市汉族人群, 个体之间均无血缘关系. 调查和取样均征得受试者本人知情同意, 并签署之情同意书, 本课题由天津市第三中心医院分院伦理委员会通过. IL-28B的酶联免疫吸附试验(ELISA)试剂盒购自上海生物工程有限公司, 美国Thermo Multiskan Ascent酶标仪, IL-28B兔抗人多克隆抗体购于美国ALEXIS公司, 通用型SP免疫组织化学试剂盒购自上海研卉生物科技有限公司, DAB显色剂购于德国罗氏诊断公司.
1.2.1 标本收集: 患者于术前抽取清晨空腹全血标本5 mL, 室温自然凝固15 min, 在4 ℃以3000 r/min离心20 min, 收集血清, 置于-80 ℃冰箱冻存, 保存过程中如有沉淀形成, 应再次离心. 肝癌组织及肝脏良性肿瘤组织取自术后肿瘤及肝穿组织, 避开坏死组织, 标本液氮中保存, 再置于-80 ℃冰箱冻存, 部分标本经过40 g/L甲醛固定, 石蜡包埋, 4 μm厚度连续切片, 待免疫组织化学染色. 标本使用均经患者授权同意, 并通过医院伦理委员会审核批准.
1.2.2 ELISA检测: 取-80 ℃保存的血清自然解冻, 采用双抗体夹心ELISA法检测所有研究对象中血清IL-28B的水平, 检测步骤严格按照是试剂盒说明书进行操作.
1.2.3 免疫组织化学: 取组织标本4 μm连续切片3张, 2张行免疫组织化学染色, 1张备用. 采用免疫组织化学SP法检测两组IL-28B, 具体操作为烤片、脱蜡、水化、阻断、灭活内源性过氧化物酶、抗原修复、滴加抗体、PBS冲洗、显色、冲洗、复染、脱水、透明、封片. 设置PBS代替一抗做阴性对照, 已知阳性标本做阳性对照.
1.2.4 结果判定: IL-28B染色阳性为细胞质和细胞核见棕黄色颗粒, 均衡分布. 计数方法为低倍镜下选择细胞密集的3个视野, 在高倍镜下进行细胞计数, 取其平均值. IL-28B的判定标准: (1)阳性细胞数百分比按四舍五入精确到个位数, ≤5%为0分; 6%-25%为1分; 26%-50%为2分; 51%-75%为3分; >75%为4分; (2)阳性强度: 无特异性染色为0分, 淡黄色为1分, 棕黄色为2分, 棕褐色为3分. 将(1)、(2)两者积分相乘为最后结果: 0分为阴性(-), 1-4分为弱阳性(+), 5-8分为阳性(++), 9-12分为强阳性(+++), 若两位病理专家结果相差3分以上则重新判定. 应用计算机图像分析技术对免疫组织化学结果进行定量分析.
统计学处理 应用SPSS19.0软件进行统计分析, 正态分布的计量资料采用mean±SD的方式表示, 比较采用方差分析; 计数资料以率表示, 比较采用χ2检验, P<0.05表示差异有统计学意义.
乙型肝炎相关性肝癌患者血清中IL-28B明显高于乙型肝炎伴发良性肿瘤患者(18.21 pg/mL±0.37 pg/mL vs 3.82 pg/mL±0.12 pg/mL), 两组的差异有统计学意义(P<0.05), 因此IL-28B对鉴别乙型肝炎相关性肝癌和乙型肝炎伴发良性肿瘤有重要意义.
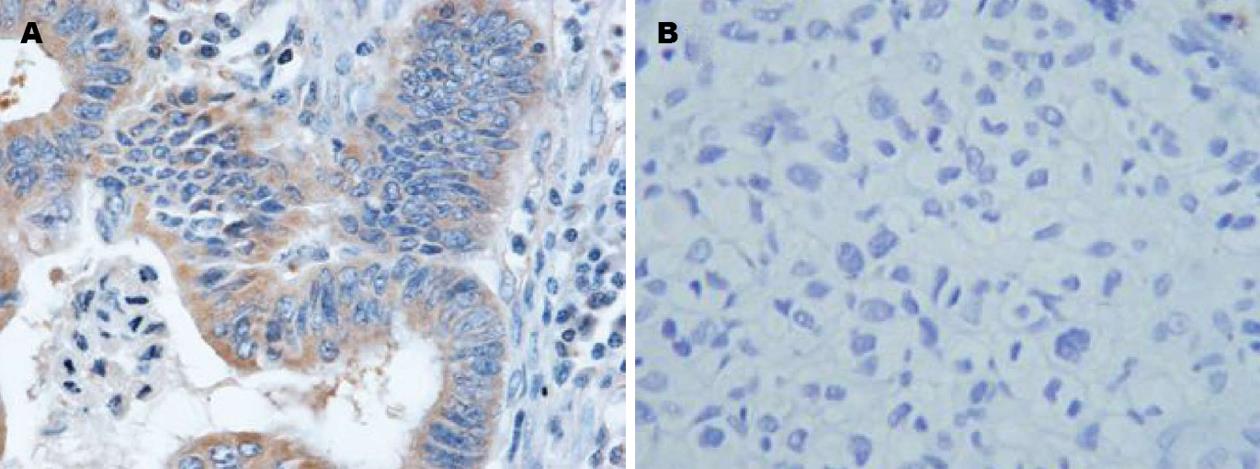
免疫组织化学染色显示, 乙型肝炎相关性肝癌组织中IL-28表达的阳性率为83.33%, 而在乙型肝炎伴发肝脏良性结节组织中IL-28B表达的阳性率为66.66%, 表明IL-28B在乙型肝炎相关性肝癌组织中的表达率明显高于在乙型肝炎伴发肝脏良性结节中的表达(图1), 二者之间相比具有显著差异性, 表明IL-28B在乙型肝炎相关性肝癌组织和乙型肝炎伴发肝脏良性结节组织之间阳性率差异有统计学意义(χ2 = 6.738, P = 0.009)(表1).
| 分组 | n | IL-28B表达 | 阳性表达率(%) | |||
| - | + | ++ | +++ | |||
| 观察组 | 96 | 16 | 9 | 23 | 48 | 83.33 |
| 对照组 | 84 | 28 | 13 | 15 | 28 | 66.66 |
在乙型肝炎相关性肝癌的临床病理因素中, 观察组IL-28B的阳性表达在年龄、性别、HBV DNA、肿瘤分化程度上均无明显相关性(均P>0.05). 但与其血清甲胎蛋白(α-fetoprotein, AFP)、肿瘤最大径及临床TMM分期相关, 差异有统计学意义(均P<0.05)(表2). 观察组IL-28B表达与血清AFP高水平(AFP>400 μg/L)有关, 且血清AFP水平与肝癌组织中IL-28B阳性程度呈正相关. IL-28B在肿瘤最大径≤3 cm组的表达阳性率为69.7%(23/33), 低于肿瘤最大径>5 cm组90.5%(57/63). 在TNM分期Ⅲ、Ⅳ期组病例中, IL-28B表达阳性率为91.8%(56/61), 显著高于Ⅰ、Ⅱ组68.6%(24/35), 差异有统计学意义.
| 临床病理特征 | n | IL-28B | χ2值 | P值 | |
| 阳性 | 阴性 | ||||
| 年龄(岁) | 0.078 | 0.780 | |||
| ≤50 | 39 | 32(82.1) | 7(17.9) | ||
| >50 | 57 | 48(84.2) | 9(15.8) | ||
| 性别 | 0.305 | 0.581 | |||
| 男 | 54 | 46(85.2) | 8(14.8) | ||
| 女 | 42 | 34(81.0) | 8(19.0) | ||
| HBV DNA | 0.534 | 0.465 | |||
| 阳性 | 46 | 37(80.4) | 9(19.6) | ||
| 阴性 | 50 | 43(86.0) | 7(14.0) | ||
| AFP(ng/mL) | 6.563 | 0.023 | |||
| ≤400 | 11 | 6(54.5) | 5(45.5) | ||
| >400 | 85 | 73(85.9) | 12(14.1) | ||
| 肿瘤最大径(cm) | 6.732 | 0.009 | |||
| ≤3 | 33 | 23(69.7) | 10(30.3) | ||
| >3 | 63 | 57(90.5) | 6(9.5) | ||
| 分化程度 | 1.191 | 0.551 | |||
| 高分化 | 32 | 26(81.3) | 6(18.8) | ||
| 中分化 | 47 | 41(87.2) | 6(12.8) | ||
| 低分化 | 17 | 13(76.5) | 4(23.5) | ||
| TNM分期 | 8.642 | 0.003 | |||
| Ⅰ/Ⅱ | 35 | 24(68.6) | 11(31.4) | ||
| Ⅲ/Ⅳ | 61 | 56(91.8) | 5(8.2) | ||
肝癌是严重危害人类健康的消化系统疾病, 每年造成超过70万例患者死亡, 最新研究证明, 肝癌在中国60岁以下男性人群肿瘤相关死亡中占据首位, 由于其恶性度高, 起病隐匿, 早期诊断率低, 确诊时往往已到中晚期, 失去了手术切除病变组织的机会, 且术后复发的几率也很高, 故预后极差. 因此, 加强肝癌的生物学特性的研究, 深入探讨乙型肝炎相关性肝癌的发生、发展机制并寻求有效的早期诊断指标和治疗方法, 对于改善乙型肝炎相关性的疗效和预后具有重要意义.
在众多诱发肝癌的因素中, 乙型肝炎病毒感染占据很大的比例, 而其确切的致癌机制尚不明确. IL-28B基因最早由Zymo Genetics公司于2003年发现, 位于染色体19q13.13的ACO11445.6基因群上, 属于Ⅲ型IFN家族, 编码IFN-λ3[5]. 这类细胞因子由病毒或双链RNA诱导外周血单个核细胞中的树突状细胞、巨噬细胞、上皮细胞和内皮细胞等多种细胞产生, 通过诱导受体异二聚体化, 激活JAK-STATS和MAPK的信号通路, 进而发挥抗病毒、调节免疫及抗肿瘤等生物学作用, 所不同的是IFN-λs是通过诱导其独特的Ⅱ型细胞因子受体IFN-λR1与IL-10Rβ异源二聚体化从而发挥信号转导作用的[13,14]. 其中IFN-λR1是Ⅲ型IFN所专有的受体亚单位, 在正常人类肝组织及人类肝癌来源的细胞系中均有IFN-λR1 mRNA的表达[15], 而IFN-λs的应答有组织依赖性, 与其受体的表达一致[16]. 最新研究[17]发现, IFN-λs包括Ⅰ型IFN、Ⅲ型IFN及IFNλ1(IL-29)均具有有效的抗病毒活性, 在HCV感染患者中, 病毒清除与IFNλ3(IL-28B)基因附近的遗传变异有关. 目前在人体的临床研究多致力于IL-28B基因多态性与乙型肝炎或丙型肝炎IFN治疗应答之间的相关性分析[18,19], 特别集中于rs12979860和rs8099917等几个位点, 其基因多态性与病毒感染性疾病[20]、免疫性疾病[21]、肿瘤[22]的发生发展都存在着关联, 在与HBV、HCV感染及相关肝病的研究者, 研究结果有较大差异, 而且缺乏对HBV感染及感染后导致的慢性乙型肝炎、肝纤维化、肝硬化、肝癌的系统性研究, 事实上, 这四种疾病发生发展是逐步推进的, 甚至在部分条件下是互相重叠和交错发生的. 而对于血清或组织中IL-28B表达与肝癌的相关性研究则更是罕见报道.
石晓东[23]、刘元妮[24]、Li等[25]学者研究发现, 慢性乙型肝炎组患者血清IL-28B水平低于健康对照组, 提示在乙型肝炎患者体内, 受乙型肝炎病毒或双链RNA(dsRNA)刺激外周血单核细胞和树突状细胞等产生由22个氨基酸的信号肽和174个氨基酸的成熟肽组成的IL-28B, 引起胞内反应, 在抗病毒过程中起到免疫防御作用, P21活化蛋白激酶4(PAK4)位于IL-28B基因上游64 kb处, 属于P21活化蛋白激酶家族, Rac和Cdc42的效应蛋白. 他是肌动蛋白细胞支架、神经轴突生长、细胞存活、激素信号系统和基因转录的重要调节器, PAK4特定作用于三磷酸鸟苷(GTP), 形成GTP结合蛋白Cdc42Hs, 并且微弱作用于MAP激酶的c-Jun氨基末端激酶家族, 参与丝状伪足形成的调节, 在肌动蛋白细胞骨架重组中起着一定作用. He等[26]通过Meta分析发现IL-28B多态性可以增加HCC的发病风险, 在白种人群尤其明显. Suo等[27]研究也证实IL-28B多态性为肝炎病毒相关肝硬化和肝癌的因此易感因素. 全基因组关联研究在美国、日本和澳大利亚分别证实IL-28B附近的基因突变与肝炎病毒感染后转归和治疗应答有关.
本研究结果显示, 在乙型肝炎相关性肝癌患者及乙型肝炎伴发良性肿瘤患者血清中均可以通过酶联免疫吸附实验检测到一定水平的IL-28B的表达, 在肝癌组中IL-28B的表达水平显著偏高, 这与Suo等[27]、李星逾等[28]学者的研究结果一致, 提示IL-28B的血清学的检测对于乙型肝炎相关性肝癌的诊断有一定的参考价值, 另外, 通过免疫组织化学, IL-28B在乙型肝炎相关肝癌组的表达也明显高于对照组. 本研究发现IL-28B在乙型肝炎相关性肝癌组织中的表达与年龄、性别、HBV DNA、肿瘤分化程度均无相关性, 但与AFP、肿瘤最大径、TNM分期相关. 原发性肝癌患者血清IL-28B的表达与肿瘤最大径及TNM分期之间有较大的关联, 提示IL-28B可能对乙型肝炎相关性肝癌的预后有提示意义, 结合AFP检测, 或许在一定程度上弥补AFP检测的敏感性差、存在30%假阴性的缺陷, 进一步提高对乙型肝炎相关性肝癌的早期诊断价值, 值得进一步深入探索及研究. 本研究中AFP阴性肝癌比例偏低, 考虑与受试对象样本数量有关, 且受乙型肝炎相关性肝癌患者的遗传异质性及来源地域限制, 以后需要进一步加大样本量, 并进行不同地域不同层面的多中心研究.
乙型肝炎相关性肝癌作为乙型肝炎病毒诱发的多基因变异疾病, 分析DNA甲基化、microRNA[29]、lncRNA[30]及免疫应答等多方面基因表达与乙型肝炎相关性癌的关系, 从而确立乙型肝炎相关性肝癌高危人群的基因水平筛选指标, 这是进一步研究需要证实的问题, 同时需要检测肝功能、cccDNA、HBeAg转换等风险因素对乙型肝炎相关性肝癌的发生率的影响. 因此, 乙型肝炎相关性肝癌发病的多基因, 多位点, 多方面的危险因素还有待于进一步研究, 以利于更全面的阐述人群乙型肝炎相关性肝癌的发病机制.
白介素-28B(interleukin-28B, IL-28B)是Ⅲ型干扰素家族(interferon lambda, IFN-λs)成员之一, 通过与受体结合, 发挥免疫调节、抗病毒、抗细胞增殖等功能, 研究表明, IL-28B基因单核苷酸多态性与感染性疾病、免疫性疾病、肿瘤的发生、发展都存在着关联, 特别是对乙型肝炎和丙型肝炎的干扰素治疗的应答反应及预后有关, 但IL-28B与乙型肝炎相关性肝癌的相关性研究罕见报道.
顾生旺, 主任医师, 江苏省淮安市解放军第八二医院感染内科
IL-28B在乙型肝炎相关性肝癌及肝脏良性结节血清及组织中的表达是否存在差异, 目前研究较少. 本研究通过ELISA和免疫组织化学的方法研究IL-28B在乙型肝炎相关性肝癌中的表达及其与临床病例特征的关系, 为进一步明确IL-28B在乙型肝炎相关性肝癌发生、发展中的意义提供依据.
多项研究报道IL-28B多态性的基因分型与乙型肝炎或丙型肝炎的干扰素治疗反应及预后密切相关, 且定位rs12979860位点的T/C多态性增加了肝炎相关性肝硬化和HCC的发病风险, 被认定为遗传危险因素, 在白种人中尤其明显.
本文以IL-28B在血清及组织中的表达为研究对象, 检测其在乙型肝炎相关性肝癌及肝脏良性结节中的表达差异, 并结合临床病理特征分析, 有助于进一步明确IL-28B在乙型肝炎相关性肝癌发生、发展中的作用, 相关报道较少.
本文研究IL-28B在乙型肝炎相关性肝癌患者血清及组织中的表达情况及其与临床病理特征的关系, 有助于进一步明确IL-28B在乙型肝炎相关性肝癌发生、发展中的作用, 为乙型肝炎相关性肝癌的早期诊断及治疗提供一定理论依据.
白介素28B(IL-28B): 一类属于IFN-λ家族的新型白介素, 编码基因位于19号染色体上, 宿主基因型与抗HCV治疗应答显著相关, 目前证实其基因型可预测HBV、HCV感染者抗病毒治疗的疗效及预后.
本文设计的研究国内相关报道较少, 设计合理, 创新性强, 具有一定的临床意义, 建议进一步细化及深入研究.
编辑: 于明茜 电编:闫晋利
| 1. | Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, Jemal A, Yu XQ, He J. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66:115-132. [PubMed] [DOI] |
| 2. | Rivière L, Ducroux A, Buendia MA. The oncogenic role of hepatitis B virus. Recent Results Cancer Res. 2014;193:59-74. [PubMed] [DOI] |
| 3. | Cooke GS, Lemoine M, Thursz M, Gore C, Swan T, Kamarulzaman A, DuCros P, Ford N. Viral hepatitis and the Global Burden of Disease: a need to regroup. J Viral Hepat. 2013;20:600-601. [PubMed] [DOI] |
| 4. | Bruix J, Reig M, Sherman M. Evidence-based diagnosis, staging, and treatment of patients with hepatocellular carcinoma. Gastroenterology. 2016;150:835-853. [PubMed] [DOI] |
| 5. | Sheppard P, Kindsvogel W, Xu W, Henderson K, Schlutsmeyer S, Whitmore TE, Kuestner R, Garrigues U, Birks C, Roraback J. IL-28, IL-29 and their class II cytokine receptor IL-28R. Nat Immunol. 2003;4:63-68. [PubMed] [DOI] |
| 6. | Cooper S, Erickson AL, Adams EJ, Kansopon J, Weiner AJ, Chien DY, Houghton M, Parham P, Walker CM. Analysis of a successful immune response against hepatitis C virus. Immunity. 1999;10:439-449. [PubMed] [DOI] |
| 7. | Dumoutier L, Tounsi A, Michiels T, Sommereyns C, Kotenko SV, Renauld JC. Role of the interleukin (IL)-28 receptor tyrosine residues for antiviral and antiproliferative activity of IL-29/interferon-lambda 1: similarities with type I interferon signaling. J Biol Chem. 2004;279:32269-32274. [PubMed] [DOI] |
| 8. | Meager A, Visvalingam K, Dilger P, Bryan D, Wadhwa M. Biological activity of interleukins-28 and -29: comparison with type I interferons. Cytokine. 2005;31:109-118. [PubMed] [DOI] |
| 9. | Nadia K, Hicham E, Reda TM, Nadia T, Elarbi B, Saâd E, Mimoun Z, Saâd M. The complete title: The effect of interleukin-28B rs12979860 polymorphism on the therapeutic response of Moroccan patients with chronic hepatitis C. Gene. 2015;568:31-34. [PubMed] [DOI] |
| 10. | Domagalski K, Pawłowska M, Zaleśna A, Tyczyno M, Skorupa-Kłaput M, Tretyn A, Halota W. The relationship between IL-28B polymorphisms and the response to peginterferon alfa-2a monotherapy in anti-HBe-positive patients with chronic HBV infection. Eur J Clin Microbiol Infect Dis. 2014;33:2025-2033. [PubMed] [DOI] |
| 13. | Maher SG, Sheikh F, Scarzello AJ, Romero-Weaver AL, Baker DP, Donnelly RP, Gamero AM. IFNalpha and IFNlambda differ in their antiproliferative effects and duration of JAK/STAT signaling activity. Cancer Biol Ther. 2008;7:1109-1115. [PubMed] [DOI] |
| 14. | Alase AA, El-Sherbiny YM, Vital EM, Tobin DJ, Turner NA, Wittmann M. IFNλ Stimulates MxA Production in Human Dermal Fibroblasts via a MAPK-Dependent STAT1-Independent Mechanism. J Invest Dermatol. 2015;135:2935-2943. [PubMed] [DOI] |
| 15. | Brand S, Zitzmann K, Dambacher J, Beigel F, Olszak T, Vlotides G, Eichhorst ST, Göke B, Diepolder H, Auernhammer CJ. SOCS-1 inhibits expression of the antiviral proteins 2',5'-OAS and MxA induced by the novel interferon-lambdas IL-28A and IL-29. Biochem Biophys Res Commun. 2005;331:543-548. [PubMed] [DOI] |
| 16. | Sommereyns C, Paul S, Staeheli P, Michiels T. IFN-lambda (IFN-lambda) is expressed in a tissue-dependent fashion and primarily acts on epithelial cells in vivo. PLoS Pathog. 2008;4:e1000017. [PubMed] [DOI] |
| 17. | de Groen RA, Mcphee F, Friborg J, Janssen HL, Boonstra A. Endogenous IFNλ in viral hepatitis patients. J Interferon Cytokine Res. 2014;34:552-556. [PubMed] [DOI] |
| 18. | Jiao XL, Gao YT, Jing L, Liu T, Shi WX, Guo H, Yang B, DU Z. [Studies on the relationship between polymorphism of IL-28B rs8099917 and the outcome of HBV infection]. Zhonghua Liuxing Bingxue Zazhi. 2011;32:1143-1147. [PubMed] [DOI] |
| 19. | Khubaib B, Saleem S, Idrees M, Afzal S, Wasim M. The genotype CC of IL-28B SNP rs12979860 is significantly associated with a sustained virological response in chronic HCV-infected Pakistani patients. J Dig Dis. 2015;16:293-298. [PubMed] [DOI] |
| 20. | Grzegorzewska AE, Jodłowska E, Mostowska A, Jagodziński P. Effect of interferon λ3 gene polymorphisms, rs8099917 and rs12979860, on response to hepatitis B virus vaccination and hepatitis B or C virus infections among hemodialysis patients. Pol Arch Med Wewn. 2015;125:894-902. [PubMed] |
| 21. | Akay E, Patel M, Conibear T, Chaggar T, Haque T. Interleukin 28B gene polymorphisms and Epstein-Barr virus-associated lymphoproliferative diseases. Intervirology. 2014;57:112-115. [PubMed] [DOI] |
| 22. | Asahina Y, Tsuchiya K, Nishimura T, Muraoka M, Suzuki Y, Tamaki N, Yasui Y, Hosokawa T, Ueda K, Nakanishi H. Genetic variation near interleukin 28B and the risk of hepatocellular carcinoma in patients with chronic hepatitis C. J Gastroenterol. 2014;49:1152-1162. [PubMed] [DOI] |
| 23. | 石 晓东. IL-28B基因多态性及其表达与HCV、HBV感染转归的相关性研究. 长春: 吉林大学 2011; . |
| 24. | 刘 元妮. 慢性乙型肝炎患者IL-28B与抗病毒治疗的相关研究. 大连: 大连医科大学 2014; . |
| 25. | Li W, Jiang Y, Jin Q, Shi X, Jin J, Gao Y, Pan Y, Zhang H, Jiang J, Niu J. Expression and gene polymorphisms of interleukin 28B and hepatitis B virus infection in a Chinese Han population. Liver Int. 2011;31:1118-1126. [PubMed] [DOI] |
| 26. | He J, Yu G, Li Z, Liang H. Influence of interleukin-28B polymorphism on progression to hepatitis virus-induced hepatocellular carcinoma. Tumour Biol. 2014;35:8757-8763. [PubMed] [DOI] |
| 27. | Suo GJ, Zhao ZX. Association of the interleukin-28B gene polymorphism with development of hepatitis virus-related hepatocellular carcinoma and liver cirrhosis: a meta-analysis. Genet Mol Res. 2013;12:3708-3717. [PubMed] [DOI] |
| 28. | 李 星逾, 王 天朝, 孙 志为, 余 旭亚, 董 虹, 董 坤, 冯 幸子, 罗 瑛, 王 军. 乙型肝炎病毒相关肝癌患者血清白介素28B的表达研究. 中华医院感染学杂志. 2014;24:2880-2884. |
| 29. | Hayes CN, Chayama K. MicroRNAs as Biomarkers for Liver Disease and Hepatocellular Carcinoma. Int J Mol Sci. 2016;17:pii E280. [PubMed] [DOI] |
| 30. | Dickson I. Hepatocellular carcinoma: A role for lncRNA in liver cancer. Nat Rev Gastroenterol Hepatol. 2016;13:122-123. [PubMed] [DOI] |