修回日期: 2016-03-07
接受日期: 2016-03-13
在线出版日期: 2016-04-18
目的: 本文旨在通过检测在不同条件下结肠癌耐药细胞HCT-8/VCR及其敏感株细胞HCT-8中葡萄糖神经酰胺合成酶(glucosylceramide synthase, GCS)、bcl-2及细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)的表达, 探讨其相互关系及可能的作用机制.
方法: 将细胞分为3组, A组: 结肠癌敏感细胞HCT-8常规培养; B组: 耐药细胞HCT-8/VCR加VCR 1 μg/mL培养, 维持其耐药性; C组: GCS抑制剂PPMP处理耐药细胞HCT-8/VCR. Western blot检测各组细胞中GCS、bcl-2及ERK蛋白水平的表达. 实时定量PCR检测(real-time quantitative PCR, qRT-PCR)检测GCS、ERK、bcl-2基因表达情况.
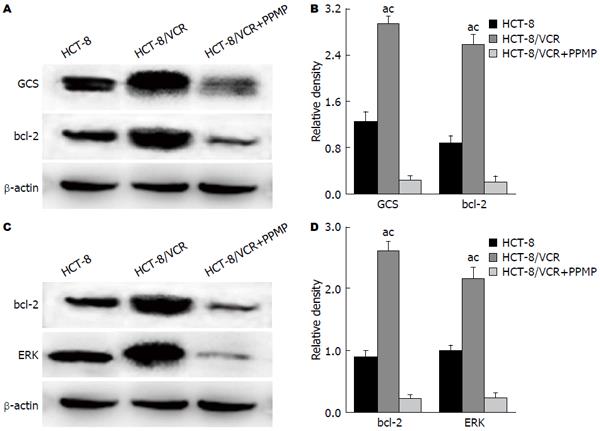
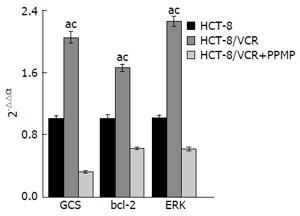
结果: 与敏感细胞相比, 多药耐药(multidrug resistance, MDR)细胞中GCS与bcl-2的mRNA和蛋白表达量明显升高(P<0.05), PPMP处理HCT-8/VCR细胞, GCS蛋白和mRNA的表达受到明显抑制(P<0.05), 同时bcl-2蛋白及mRNA的表达也明显下降(P<0.05), ERK蛋白的表达量在加入PPMP后也较前下降(P<0.05).
结论: GCS通过影响抗凋亡蛋白bcl-2的表达, 从而介导结肠癌细胞MDR, 这一过程可能是通过ERK信号通路完成的. 加入GCS抑制剂PPMP, 可抑制bcl-2的表达, 逆转细胞耐药.
核心提示: 肿瘤细胞的多药耐药(multidrug resistance, MDR)与细胞中葡萄糖神经酰胺合成酶(glucosylceramide synthase, GCS)含量的变化有着密切的关系, 实验通过干预并观察耐药组与非耐药组细胞中GCS、bcl-2、细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)蛋白及基因表达的变化, 推断GCS通过ERK信号通路调节bcl-2的表达, 从而介导细胞耐药, 为进一步研究肿瘤MDR提供理论依据.
引文著录: 宋敏, 韩雪, 任秀花, 孟宇, 张顺同. GCS通过影响bcl-2的表达介导结肠癌细胞的多药耐药. 世界华人消化杂志 2016; 24(11): 1708-1713
Revised: March 7, 2016
Accepted: March 13, 2016
Published online: April 18, 2016
AIM: To investigate the relationship between glucosylceramide synthase (GCS) and bcl-2 in human colon cell line HCT-8 and multidrug resistant (MDR) cell line HCT-8/VCR, in order to explore their role in multidrug resistance of colon cancer cells.
METHODS: The study contained three groups: normally cultured HCT-8 cells (group A), HCT-8/VCR cells treated with VCR to maintain the drug resistance (group B), and HCT-8/VCR cells treated with VCR and inhibitor of GCS (PPMP) (group C). Expression of GCS, bcl-2, and extracellular regulated protein kinases (ERK) proteins was detected by Western blot. Expression of GCS, bcl-2, and ERK mRNAs was tested by real-time quantitative PCR (qRT-PCR).
RESULTS: Compared with HCT-8 cell line, expression of GCS, ERK and bcl-2 proteins and mRNAs was higher in MDR cell line. After treatment with PPMP, expression of those proteins and mRNAs were obviously restrained in HCT-8/VCR cell line.
CONCLUSION: GCS induces multidrug resistance by regulating the expression of bcl-2, and this process may involve ERK signaling pathway. The inhibitor of GCS (PPMP) can inhibit the expression of bcl-2 and reverse multidrug resistance in human colon cancer cell line.
- Citation: Song M, Han X, Ren XH, Meng Y, Zhang ST. Glucosylceramide synthase induces multidrug resistance by regulating bcl-2 expression in human colon cancer cells. Shijie Huaren Xiaohua Zazhi 2016; 24(11): 1708-1713
- URL: https://www.wjgnet.com/1009-3079/full/v24/i11/1708.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i11.1708
结直肠癌是最常见的消化系恶性肿瘤之一, 在我国的发病率和死亡率分别位于第3位和第4位, 且呈逐年上升的趋势[1,2]. 化疗是终末期结肠癌的治疗的主要方法, 然而, 肿瘤细胞的多药耐药(multidrug resistance, MDR)是化疗失败的主要原因之一. 近年来, 神经酰胺途径在肿瘤MDR形成中的作用越来越受到关注, 葡萄糖神经酰胺合成酶(glucosylceramide synthase, GCS)是一种葡萄糖转移酶, 能使神经酰胺糖基化形成葡萄糖神经酰胺(GlcCer), 从而使肿瘤细胞逃避由神经酰胺途径介导的凋亡作用. GCS与肿瘤MDR的关系已在乳腺癌、肺癌、胰腺癌、结肠癌及白血病等多种肿瘤细胞中得到证实. 细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)信号通路在调节细胞生存方面发挥重要作用, 与bcl-2关系密切, ERK信号通路异常可导致细胞凋亡减少, 引起细胞的耐药.
人结肠癌耐长春新碱细胞株HCT-8/VCR购自中南大学湘雅医学院细胞中心, 郑州大学人体解剖学教研室传代培养. HCT-8细胞由郑州大学人体解剖学教研室保存. RPMI-1640培养基购自日本Hyclone公司. 特级胎牛血清购自美国GEMINI公司. bcl-2、β-actin一抗及羊抗兔IgG、兔抗鼠IgG均购自北京中杉金桥生物技术有限公司. GCS一抗购自Abcam公司. ERK1/2一抗购自Proteintech公司. PPMP购自Sigma公司.
1.2.1 细胞培养: HCT-8/VCR及HCT-8细胞置于含10%胎牛血清的RPMI-1640培养液(含青霉素、链霉素各100 U/mL)中, 在37 ℃、50 mL/L CO2、饱和湿度培养箱中常规培养. HCT-8/VCR细胞的长春新碱维持浓度为1.0 μg/mL. 实验在脱药培养2 wk, 取对数期生长良好的细胞进行.
1.2.2 PPMP处理细胞: 将PPMP溶解成10 mmol/L的初始溶液, -20 ℃保存. 使用时用RPMI-1640培养基稀释成终浓度为20 μmol/L的溶液, 加入细胞中, 再培养48 h.
1.2.3 Western blot分析相关蛋白的表达: 蛋白提取: 取对数期HCT-8及HCT-8/VCR细胞, RIPA裂解液提取细胞总蛋白, BCA法检测蛋白含量, 作为Western blot实验材料备用. Western blot: 蛋白经12%SDS-PAGE分离, 转移到PVDF膜上. 用含5%脱脂奶粉的TBST封闭, 室温1 h. 加入适当浓度一抗, 4 ℃孵育过夜. TBST清洗3遍, 用适当浓度二抗孵育, 室温2 h. TBST清洗后ECL发光显影.
1.2.4 实时定量PCR检测检测相关mRNA表达: 根据GenBank中所查GCS、bcl-2、ERK和β-actin的序列设计引物, 经BLAST对比确认后, 由上海生工合成. 各引物序列如表1所示. RNA提取及实时定量PCR检测(real-time quantitative PCR, qRT-PCR): 用TRIzol法提取各组细胞总RNA, 测浓度, -80 ℃保存备用. 取5 μL RNA用1%琼脂糖凝胶进行电泳检测RNA的完整性. 用TIANScript RT KIT进行反转录, 实验操作按产品说明书进行. 用qRT-PCR仪, 采用2-△△Ct法进行数据的相对定量分析. 反应体系: 预变性阶段: 95 ℃ 15 min; PCR反应阶段: 变性95 ℃ 10 s; 退火58 ℃ 30 s; 延伸72 ℃ 30 s. 40个循环. 分别用目的基因引物和内参基因引物进行扩增. 同时在60 ℃-95 ℃进行溶解曲线分析.
| 引物名称 | 序列 | 产物长度(bp) |
| GCS | FP: 5'-CACCCGATTACACCTCAA-3' | 414 |
| RP: 5'-CCGTGAACCAAGCCTACT-3' | ||
| Bcl-2 | FP: 5'-CAGAGGGGATACGAGTG-3' | 85 |
| RP: 5'-GCTGCGAGGAGAAGATG-3' | ||
| ERK | FP: 5'-CTTCTCGCCTCAGTTCGC-3' | 148 |
| RP: 5'-GTCCAGGATCACGCCATT-3' | ||
| β-actin | FP: 5'-TGACGTGGACATCCGCAAAG-3' | 205 |
| RP: 5'-CTGGAAGGTGGACAGCGAGG-3' |
统计学处理 采用SPSS17.0软件进行统计学分析, 统计图采用Origin7.5绘制. 所有数据均用mean±SD来表示. 多组数据之间的比较采用单因素方差分析(ANOVA), 若不符合正态性或者方差齐性, 则用非参数检验(Kruskal-Wallis test), 若有统计学意义, 再用LSD-t检验, P<0.05表示差异有统计学意义.
亲本细胞HCT-8常规培养, MDR细胞HCT-8/VCR加VCR培养, PPMP处理HCT-8/VCR细胞48 h后提取蛋白, Western blot检测3组细胞中GCS与bcl-2的蛋白表达量(图1A). 与敏感细胞相比, 耐药细胞HCT-8/VCR中GCS及抗凋亡蛋白bcl-2的表达明显升高(P<0.05). PPMP作用48 h后, GCS的表达受到明显抑制(P<0.05), 同时bcl-2的表达也较前下降(P<0.05)(图1B). Western blot检测3组细胞ERK及抗凋亡蛋白bcl-2的表达其情况(图1C), 结果显示, 耐药细胞ERK及bcl-2表达明显高于亲本(P<0.05), PPMP处理后, ERK及bcl-2的表达均较前下调(P<0.05)(图1D).
HCT-8结肠癌敏感细胞株常规培养, MDR细胞HCT-8/VCR加VCR培养, 另一组HCT-8/VCR细胞PPMP处理48 h, 提取RNA, qRT-PCR测3组细胞中GCS和bcl-2 mRNA表达情况, 结果显示, 耐药细胞中GCS、bcl-2及ERK基因表达量明显高于敏感细胞株(P<0.05), PPMP处理后, 3组基因表达较前下降(P<0.05)(图2).
时至今日, 全身化疗仍是晚期结肠癌的主要治疗手段, 而MDR的发生是导致恶性肿瘤化疗失败的主要原因之一. 肿瘤细胞的MDR可以是先天性的, 也可以是获得性的, 而MDR的形成也是由多种因素共同参与, 如ABC转运蛋白P-gp等对化疗药物的转运作用、谷胱甘肽S转移酶对药物的灭活和解毒作用、信号通路中蛋白的异常或凋亡抑制等.
近年来, 神经酰胺在肿瘤发生发展中的作用越来越受到关注. 神经酰胺不仅是鞘脂类代谢的重要中间产物, 也作为重要的细胞内信号分子, 参与细胞的生长增殖及凋亡. 普遍认为, 在肿瘤细胞中, 神经酰胺的抑制细胞增殖和促进细胞凋亡的作用具有重要意义. 治疗肿瘤的常用手段放疗及化疗, 能使细胞内神经酰胺合成增加, 从而增强放化疗的抗肿瘤作用[3], 一些化疗药物, 如顺铂、阿霉素等, 与神经酰胺具有协同作用, 共同促进肿瘤细胞的凋亡. 研究[4]证明, 索拉菲尼可增加肝细胞中神经酰胺的含量, 同时使神经酰胺相关代谢酶的表达上调.
GCS是神经酰胺代谢的一种常见酶, 催化UDP-葡萄糖上的葡萄糖基与神经酰胺结合, 形成葡萄糖神经酰胺(GlcCer), GlcCer失去了神经酰胺抗凋亡的作用, 并参与合成不同种类的鞘糖酯(GSLs), 这些GSLs参与调节细胞的增殖、分化以及细胞间相互作用, 在肿瘤细胞转移扩散中起着重要作用[5,6]. 若减少细胞内UDP-葡萄糖的含量, 能有效增加神经酰胺介导的细胞凋亡[7]. 细胞内GCS水平提高与肿瘤细胞MDR之间的关系越来越受到关注, 越来越多研究[8,9]表明: 细胞内GCS水平的提升是肿瘤细胞逃避化疗药物毒性的重要途径之一. 在肺癌、胃癌、结肠癌、乳腺癌和白血病等多种耐药肿瘤细胞中, 均检测到GCS表达的升高[10], 且伴有耐药基因MDR1及P-gp表达的升高[11,12].
化疗药物引起的细胞凋亡是正常的程序性死亡, 作为最早发现的抗凋亡蛋白, bcl-2作用于细胞凋亡的下游共同通路, 是调控细胞凋亡的关键蛋白. 在细胞中, 抗凋亡蛋白与凋亡蛋白的比例(即bcl-2/bax), 决定着细胞的发展方向: 凋亡或生长[13,14]. 因此, 各种原因引起的细胞中bcl-2的表达的变化, 均能影响肿瘤细胞的凋亡, 肿瘤细胞中bcl-2的过表达也是导致细胞MDR的原因之一, 用siRNA沉默乳腺癌细胞中的bcl-2 mRNA, 可增加细胞对他莫昔芬的敏感性[15], Wang等[16]的研究也证明, 在白血病耐药细胞中, bcl-2的表达明显升高, 且与GCS的表达也具有一致性.
ERK信号通路是细胞内常见信号转导通路, 参与调解肿瘤细胞的生长、分化及转移. ERK的高表达, 可以诱导bcl-2、bcl-xl等抗凋亡基因的表达, 并可以促进bcl-2的磷酸化而发挥抗凋亡作用[17]. 吉西他滨能促进胰腺癌细胞中ERK的活化, 引起细胞凋亡减少, 通过抑制ERK蛋白, 可增加凋亡蛋白bax的表达, 同时抗凋亡蛋白bcl-2表达下调, 促进由吉西他滨引起的细胞凋亡[13].
本研究为探讨结肠癌细胞中GCS与抗凋亡蛋白的相互关系及可能的机制, 选择了结肠癌细胞株HCT-8及其耐药株HCT-8/VCR, 检测两组细胞GCS及bcl-2的表达情况, 结果显示, 在HCT-8细胞及其MDR细胞HCT-8/VCR中均有GCS的表达, 但在耐药细胞株中, GCS的表达量明显高于其敏感株(P<0.05), 同时, bcl-2在耐药株的表达量也明显高于亲本, 与GCS的表达具有一致性. qRT-PCR结果显示, GCS mRNA与bcl-2 mRNA在耐药株HCT-8/VCR的表达量也高于敏感株细胞, 差异显著(P<0.05). 加入GCS抑制剂PPMP后, 使HCT-8/VCR细胞中GCS基因及蛋白表达量下降, 相应地, bcl-2基因和蛋白表达也显著下调. 结果提示, 抗凋亡蛋白bcl-2受到细胞中GCS表达的影响, 调控细胞凋亡. 同时对细胞中ERK蛋白进行检测, 结果显示, 在耐药细胞株中, ERK蛋白表达量明显高于敏感株, 加入PPMP后, ERK蛋白表达量较前下降, 与GCS及bcl-2表达一致, 提示ERK蛋白参与GCS调节bcl-2表达的过程.
结合本实验研究结果, 我们推测, GCS能够调节ERK信号通路, 并影响抗凋亡蛋白bcl-2的表达, 或许可以通过抑制ERK信号通路下调抗凋亡蛋白bcl-2的表达, 逆转肿瘤细胞耐药, 这一推测还有待进一步验证.
结直肠癌是最常见的消化系恶性肿瘤之一, 化疗是终末期结肠癌的治疗的主要方法, 但肿瘤细胞的多药耐药(multidrug resistance, MDR)是化疗失败的主要原因之一. 葡萄糖神经酰胺合成酶(glucosylceramide synthase, GCS)与MDR的形成关系密切, 通过多种途径参与耐药的形成.
许庆文, 主任医师, 广东医学院附属医院普通外科
GCS参与的肿瘤细胞MDR是近年来肿瘤MDR研究的热点问题, 但关于结直肠肿瘤中GCS与凋亡相关蛋白间相互作用的研究甚.
已有研究证实白血病耐药细胞中, GCS与bcl-2的表达升高, 且表达具有相关性; Wang等发现通过抑制细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)蛋白, 可增加凋亡蛋白bax的表达, 同时抗凋亡蛋白bcl-2表达下调, 促进由吉西他滨引起的细胞凋亡.
本文着重研究结肠癌耐药细胞中GCS与bcl-2的作用关系、可能涉及的信号通路及其与MDR的关系. 研究结果表明, GCS通过ERK信号通路调节bcl-2的表达, 从而介导细胞耐药.
肿瘤细胞MDR是终末期结肠癌患者化疗失败的重要原因, 导致预后不良, 而GCS参与MDR的形成. 本研究阐述了GCS引起耐药的一条途径, 为进一步研究肿瘤MDR提供理论依据.
GCS: 催化UDP-葡萄糖上的葡萄糖基与神经酰胺结合,使其转变成无细胞毒性的葡萄糖神经酰胺(GlcCer); MDR: 是指肿瘤细胞对一种化疗药物产生耐药的同时对其他从未接触的, 结构不同, 机制各异的其他化疗药物产生耐药.
本文研究结肠癌耐药细胞中GCS与bcl-2的作用关系和涉及的信号通路, 能较好地反映我国结直肠癌基础研究的先进水平.
编辑: 于明茜 电编:都珍珍
| 3. | Henry B, Möller C, Dimanche-Boitrel MT, Gulbins E, Becker KA. Targeting the ceramide system in cancer. Cancer Lett. 2013;332:286-294. [PubMed] [DOI] |
| 4. | Stefanovic M, Tutusaus A, Martinez-Nieto GA, Bárcena C, de Gregorio E, Moutinho C, Barbero-Camps E, Villanueva A, Colell A, Marí M. Targeting glucosylceramide synthase upregulation reverts sorafenib resistance in experimental hepatocellular carcinoma. Oncotarget. 2016; Jan 22. [Epub ahead of print]. [PubMed] [DOI] |
| 5. | Kartal Yandım M, Apohan E, Baran Y. Therapeutic potential of targeting ceramide/glucosylceramide pathway in cancer. Cancer Chemother Pharmacol. 2013;71:13-20. [PubMed] [DOI] |
| 6. | Liu YY, Hill RA, Li YT. Ceramide glycosylation catalyzed by glucosylceramide synthase and cancer drug resistance. Adv Cancer Res. 2013;117:59-89. [PubMed] [DOI] |
| 7. | Turáková K, Pavlíková L, Messingerová L, Lakatoš B, Breier A, Sulová Z. Reduced UDP-glucose Levels Are Associated with P-glycoprotein Over-expression in L1210 Cells and Limit Glucosylceramide Synthase Activity. Anticancer Res. 2015;35:2627-2634. [PubMed] |
| 8. | Liu YY, Gupta V, Patwardhan GA, Bhinge K, Zhao Y, Bao J, Mehendale H, Cabot MC, Li YT, Jazwinski SM. Glucosylceramide synthase upregulates MDR1 expression in the regulation of cancer drug resistance through cSrc and beta-catenin signaling. Mol Cancer. 2010;9:145. [PubMed] [DOI] |
| 9. | Reynolds CP, Maurer BJ, Kolesnick RN. Ceramide synthesis and metabolism as a target for cancer therapy. Cancer Lett. 2004;206:169-180. [PubMed] [DOI] |
| 10. | Wang C, Liu JN, Xu L, Mu YL, Sun P. Expression and significance of glucosylceramide synthase in colorectal carcinoma tissues. Eur Rev Med Pharmacol Sci. 2014;18:3632-3637. [PubMed] |
| 11. | Song M, Zang W, Zhang B, Cao J, Yang G. GCS overexpression is associated with multidrug resistance of human HCT-8 colon cancer cells. J Exp Clin Cancer Res. 2012;31:23. [PubMed] [DOI] |
| 12. | Tyler A, Johansson A, Karlsson T, Gudey SK, Brännström T, Grankvist K, Behnam-Motlagh P. Targeting glucosylceramide synthase induction of cell surface globotriaosylceramide (Gb3) in acquired cisplatin-resistance of lung cancer and malignant pleural mesothelioma cells. Exp Cell Res. 2015;336:23-32. [PubMed] [DOI] |
| 13. | Wang M, Lu X, Dong X, Hao F, Liu Z, Ni G, Chen D. pERK1/2 silencing sensitizes pancreatic cancer BXPC-3 cell to gemcitabine-induced apoptosis via regulating Bax and Bcl-2 expression. World J Surg Oncol. 2015;13:66. [PubMed] [DOI] |
| 15. | Raha P, Thomas S, Thurn KT, Park J, Munster PN. Combined histone deacetylase inhibition and tamoxifen induces apoptosis in tamoxifen-resistant breast cancer models, by reversing Bcl-2 overexpression. Breast Cancer Res. 2015;17:26. [PubMed] [DOI] |
| 16. | Wang Q, Zou J, Zhang X, Mu H, Yin Y, Xie P. Glucosylceramide synthase promotes Bcl-2 expression via the ERK signaling pathway in the K562/A02 leukemia drug-resistant cell line. Int J Hematol. 2014;100:559-566. [PubMed] [DOI] |
| 17. | Alejandro EU, Johnson JD. Inhibition of Raf-1 alters multiple downstream pathways to induce pancreatic beta-cell apoptosis. J Biol Chem. 2008;283:2407-2417. [PubMed] [DOI] |