修回日期: 2016-02-13
接受日期: 2016-02-29
在线出版日期: 2016-04-08
目的: 探究miR-143在胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC)组织中的表达与临床参数、预后的相关性.
方法: 收集70例PDAC患者的癌组织及配对癌旁组织石蜡切片, 应用锁定核酸原位杂交(locked nucleic acids-in situ hybridization, LNA-ISH)法检测组织中miR-143的表达水平, 收集相关临床资料, 并对患者的预后进行随访, 采用SPSS16.0进行统计学分析.
结果: PDAC癌组织中miR-143阳性表达率明显低于癌旁组织(25.71% vs 68.57%, P = 0.001), miR-143的表达与淋巴结转移相关, 差异有统计学意义(P = 0.045). 生存分析结果显示, miR-143阳性者的预后较好(P = 0.026).
结论: PDAC患者癌组织中miR-143呈低表达, 且与不良预后相关.
核心提示: 本研究采用锁定核酸原位杂交的方法, 检测出人胰腺癌组织中miR-143低表达, 且其表达与胰腺癌的淋巴结转移相关, miR-143阳性者的预后较好. 提示胰腺导管腺癌患者癌组织中miR-143呈低表达, 且与不良预后相关.
引文著录: 王志红, 周琳, 王春峰, 张连峰. miR-143在胰腺癌组织中的表达及临床意义. 世界华人消化杂志 2016; 24(10): 1520-1525
Revised: February 13, 2016
Accepted: February 29, 2016
Published online: April 8, 2016
AIM: To investigate the expression of miR-143 in human pancreatic ductal adenocarcinoma (PDAC) and to explore the relation between miRNA-143 expression and prognosis of patients with PDAC.
METHODS: We collected 70 PDAC specimens from patients treated at the First Affiliated Hospital of Zhengzhou University, including cancer tissues and paired cancer-adjacent tissues. The expression of miR-143 was examined by locked nucleic acids-in situ hybridization (LNA-ISH). Then the relation between the expression of miR-143 and clinical parameters was analyzed with SPSS16.0.
RESULTS: The expression rate of miR-143 was lower in cancerous tissues than in paired non-cancerous pancreatic tissues (25.71% vs 68.57%, P = 0.001). The expression of miR-143 in cancerous tissues was associated with lymph node metastasis (P = 0.045). The median survival of patients with low miR-143 expression was significantly shorter than that of patients with high miR-143 expression (P = 0.026).
CONCLUSION: The expression of miR143 is low in cancer tissue, and its low expression is associated with poor prognosis in patients with PDAC.
- Citation: Wang ZH, Zhou L, Wang CF, Zhang LF. Clinical significance of expression of miR-143 in pancreatic carcinoma. Shijie Huaren Xiaohua Zazhi 2016; 24(10): 1520-1525
- URL: https://www.wjgnet.com/1009-3079/full/v24/i10/1520.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i10.1520
胰腺癌是一种常见的严重威胁人类健康的消化系恶性肿瘤, 约90%为起源于腺管上皮的导管腺癌, 其恶性度极高、发展快、预后差, 尽管临床上手术和各种综合治疗方法有所改进, 但患者的5年生存率仍只有5%左右[1]. 而且, 胰腺癌早期诊断及治疗效果不理想, 多数患者确诊时已伴有局部和/或远处的侵袭、转移, 而错失最佳手术时机[2]. 因此, 探讨胰腺癌的发生发展机制有利于提高胰腺癌的临床防治水平. miRNA由于性质稳定, 易于检测, 可能成为更加敏感的肿瘤标志物[3]. 既往研究[4-9]显示miRNA-143在多种肿瘤中表达均明显下调, 包括结肠癌、胃癌、前列腺癌、膀胱癌、宫颈癌等, 其通过调节一系列肿瘤相关基因参与肿瘤的发生发展. 有研究[10]表明miR-143的低表达影响了胰腺癌的组织学特性及生物学行为. 但目前尚无其在人体胰腺癌组织中的相关研究, 因此本研究旨在探讨人体胰腺癌组织中miR-143的表达特点, 并分析其与临床指标、预后的关系, 为胰腺癌的诊断提供新的思路.
收集2010-01/2014-12在郑州大学第一附属医院初治的胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC)患者70例(均有病理学诊断), 收集石蜡包埋癌组织及癌旁组织, 其中27例为细针穿刺抽吸(fine needle aspiration, FNA)获取, 余43例为手术切除标本. 70例PDAC患者均具有完整临床资料和随访资料. 经郑州大学第一附属医院道德伦理委员会批准, 患者均签署知情同意书. 通过电话进行随访, 最终时间为2015-05-01. 记录每例患者的总生存时间(overall survival, OS), OS定义为确诊胰腺癌至死亡时间. 杂交has-mir-143探针购自Exiqon公司; 抗地高辛碱性磷酸酶标记二抗anti-DIG-AP Fab来自Panpath公司; 酵母RNA购自美国Ambion公司; 兔抗人KRAS单克隆抗体、SP试剂盒、DAB、苏木素、甲酰胺、柠檬酸盐、肝素、DEPC、核固红NBT/BCIP等购自北京中杉金桥公司.
1.2.1 锁定核酸原位杂交(locked nucleic acids-in situ hybridization, LNA-ISH)检测miR-143的表达: 所有实验步骤按照制造商(Exiqon)的说明进行. 将厚度约为3 μm的石蜡包埋标本在二甲苯中脱蜡, 梯度乙醇脱蜡至水, 切片用蛋白酶K在37 ℃下消化10 min, 在40 g/L多聚甲醛中固定切片10 min; 在不含探针的杂交缓冲液中预杂交2 h, 再加入含探针的杂交液, 专用盖玻片封闭过夜, 严格洗涤切片, 用含2%山羊血清的地高辛封闭试剂室温封闭1 h, 加入封闭液稀释的anti-DIG-AP Fab抗体, 4 ℃过夜; 加高敏感显色底物(NBT/BCIP)显色1-48 h, 核固红复染5-10 min, 梯度乙醇脱水、二甲苯透明后封片.
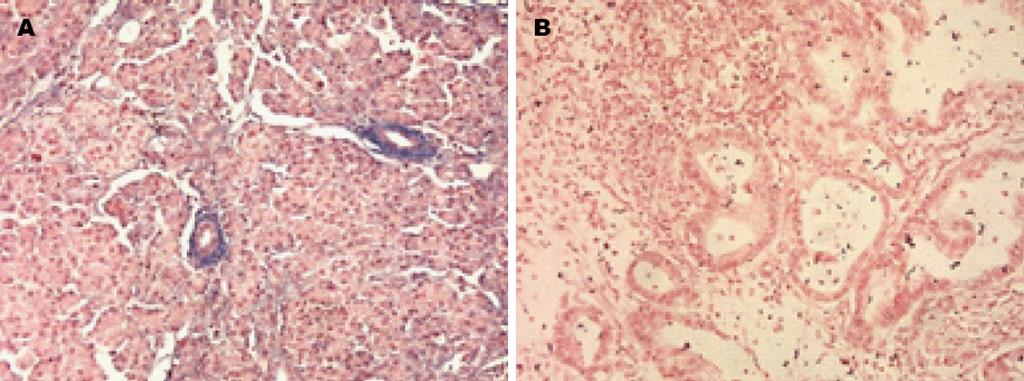
1.2.2 结果判定: 结果由2位病理科医师独立评分: 以胞浆蓝染为阳性细胞的判断标准, 每张片子在200倍显微镜下随机选取5个视野, 计算阳性细胞数的百分比及染色强度. 按照阳性细胞数百分比, 阴性即阳性细胞<5%, 阳性即阳性细胞数≥5%.
统计学处理 采用SPSS16.0软件进行统计分析, 阳性率的比较采用配对χ2检验, 相关性采用Spearman相关分析, 生存情况以Kaplan-Meier曲线表示, 生存率比较采用Log-rank检验. P<0.05为差异有统计学意义.
miR-143染色定位于细胞的胞浆中, 呈蓝色(图1). 结果显示, 癌组织中miR143的表达阳性率(25.71%, 18/70)低于癌旁组织(68.57%, 48/70), 差异有统计学意义(χ2 = 18.283, P = 0.001).
表1显示, 70例PDAC中miR-143的表达在年龄、性别、肿瘤部位、病理分级、TNM分期、远处转移均无显著相关性(P>0.05), 但在是否有淋巴结转移间有显著差异(χ2 = 4.024, P = 0.045).
| 临床参数 | n | miR-143表达情况 | χ2值 | P值 | |
| 阴性表达 | 阳性表达 | ||||
| 性别 | 0.833 | 0.362 | |||
| 男 | 24 | 18 | 6 | ||
| 女 | 46 | 34 | 12 | ||
| 年龄(岁) | 2.382 | 0.123 | |||
| >60 | 42 | 30 | 12 | ||
| ≤60 | 28 | 22 | 6 | ||
| 肿瘤部位 | 0.962 | 0.327 | |||
| 体尾部 | 46 | 36 | 10 | ||
| 胰头部 | 24 | 16 | 8 | ||
| 病理分级 | 0.321 | 0.571 | |||
| 高中分化 | 48 | 36 | 12 | ||
| 低分化 | 22 | 16 | 6 | ||
| TNM分期 | 1.361 | 0.243 | |||
| Ⅰ, Ⅱ期 | 44 | 30 | 14 | ||
| Ⅲ, Ⅳ期 | 26 | 22 | 4 | ||
| 淋巴转移 | 4.024 | 0.045 | |||
| 有 | 32 | 28 | 4 | ||
| 无 | 38 | 24 | 14 | ||
| 远处转移 | 0.033 | 0.855 | |||
| 有 | 16 | 14 | 2 | ||
| 无 | 54 | 38 | 16 | ||
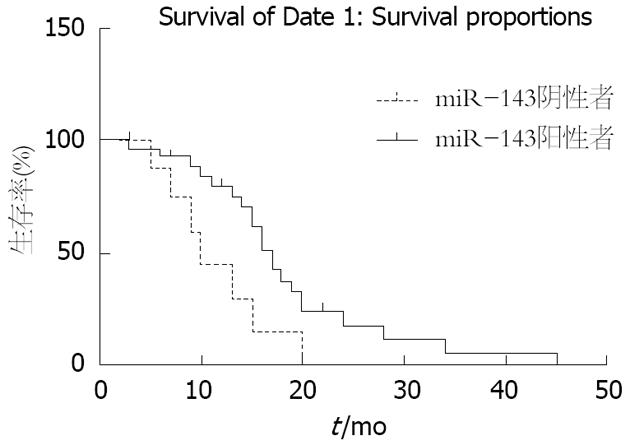
将PDAC患者分为miR-143阴性组和阳性组, 进行生存分析显示, 癌组织中miR-143阳性组患者的预后优于阴性组(中位生存时间17 mo vs 10 mo, P = 0.026, 图2).
MicroRNA(miRNA)是一种长度约22个核苷酸的内源性非编码单链RNA分子, 他们基于与靶mRNA的3'非编码区以互补配对的方式进行结合, 从而造成靶mRNA翻译的抑制和/或导致靶mRNA降解, 进而抑制基因的表达[11]. 大量研究[12]显示, miRNA在细胞增殖、分化、发育和凋亡等方面起着重要的作用, 并参与肿瘤的发生发展. miRNAs的表达有很强的组织特异性, 表达谱与肿瘤类型相关, 不同种类的肿瘤具有不同的miRNAs表达谱. miRNA的表达水平及活性在不同组织及不同时间内表现出差异, 且肿瘤细胞的侵犯、转移以及血管生成等同样受miRNA调控[13]. miRNA常以"一对多"的方式, 同时调控多条肿瘤进展相关分子通道, 所以从理论上讲, 靶向miRNA比传统肿瘤相关蛋白更能有效地控制、反转涉及多基因改变的肿瘤表型[14].
miR-143在多种肿瘤中的表达降低, Michael等[15]首先报道了miR-143在结直肠癌、乳腺癌、前列腺癌、宫颈癌、淋巴瘤等恶性肿瘤细胞中低表达. 更有研究者[16]认为miR-143表达的降低很有可能是腺癌本身的特征. Chen等[5]通过生物信息学筛选出miR-143的靶基因KRAS, 并通过实验证实, miR-143和KRAS蛋白的表达与结肠癌的转移和预后相关. miR-143在结直肠癌Lovo细胞中的过表达可降低KRAS蛋白的表达, 从而抑制细胞的增殖; 相反, miR-143的低表达可使KRAS的表达增强, 从而促进细胞增殖. Kulda等[17]对46例结直肠癌样本肿瘤和周围邻近正常组织中miR-143表达的研究发现, 肿瘤中miR-143表达下降; 同时, 这些患者中28例在术后进行了以氟尿嘧啶为基础联合其他化疗药物的规范化疗后发现, miR-143低表达的患者无病生存时间较短. 过表达miR-143可降低结直肠癌HCT116细胞活性约60%, 联合应用抗肿瘤药物5-氟尿嘧啶可增加Caspase3、Caspase8、Caspase9活性和细胞核碎裂, 引起细胞死亡, 这一过程由细胞外调节蛋白激酶5/核因子-κB(extracellular regulated protein kinases 5/nuclear factor-κB, ERK5/NF-κB)信号通路调控. 以上研究结果提示, 单独使用或者联合应用miR-143和抗肿瘤药物有望成为未来新的肿瘤化疗方案. Clapé等[18]报道miR-143在前列腺癌中表达亦明显下调, 此表达量与肿瘤类型呈负相关. miR-143的靶基因涉及抑癌基因ERK5[18]、Bcl-2[19]、KRAS[5]、DNA甲基转移酶A2[20]、大肠癌转移相关基因(metastasis-associated in colon cancer-1, MACC1)[21]、hexokinase己糖激酶[21].
miR-143的失表达在许多类型的癌症中被报道, 包括胰腺癌, 而恢复miR-143的表达已被证明能阻止肿瘤再生[22,23]. 研究[24]发现, 胰腺癌细胞系BXPC-3以及HPAF-II中miR-143呈低表达, 恢复miR-143的表达可抑制胰腺癌细胞系中环氧合酶-2(cyclooxygenase-2, COX-2)的表达, 从而进一步阻止胰腺癌细胞的增殖. 基础研究显示, KRAS基因突变的胰腺癌组织中miR-143的表达缺失或降低, 若恢复miR-143的表达, 肿瘤的形成可受到抑制[25]. 在胰腺癌中, miR-143的靶基因为EGF1、EGF2和KRAS, 其与肿瘤的侵袭和转移相关, 这提示miR143可能成为胰腺癌治疗的靶点[26]. 有研究者通过静脉注射含有miR-143的载体可减缓小鼠皮下胰腺癌MiaPaCa-2细胞移植物的生长, 若胰内注射, 则产生的减缓效应更为明显; 伴随着肿瘤生长的减慢还有凋亡的增加和增殖的抑制, 这一作用通过其靶基因KRAS2和RAS反应元件结合蛋白1(RREB1)实现[4]: 该研究结果为胰腺癌的发病机制提供了新的认识. 另有研究[27]表明miR-143对人胰腺癌PANC-1细胞的迁移能力有抑制作用.
然而, 这些研究多从细胞或动物水平证实miR-143参与胰腺癌的发生发展, 关于miR-143在人胰腺癌组织中的研究鲜有报道, 因此本研究通过人PDAC癌组织和癌旁组织以研究胰腺癌患者中miR143的表达特点. miRNA能耐受核糖核酸酶的降解, 石蜡包埋组织中的miRNA水平基本不变, LNA-ISH不仅可以提供miRNA在细胞和组织中表达的丰度以及定位信息[28], 且探针与靶miRNA有较好的亲和力, 敏感性及特异性较强. 本研究应用LNA-ISH法检测人胰腺癌蜡块组织中miR-143的表达, 结果显示miR-143定位于胰腺癌及癌旁组织的细胞胞浆中, 胰腺癌组织中的miR-143的阳性率明显低于癌旁组织; 临床资料分析显示, 淋巴结转移者的miR-143阳性表达率降低, 无淋巴结转移者miR-143阳性表达率高, 这提示miR-143的表达缺失或下调与胰腺癌恶性生物学行为相关; 结合随访资料, 胰腺癌组织中miR-143的表达与患者术后的生存期呈正相关, 即阴性表达者, 平均生存期短, 阳性表达者, 平均生存期长, 这间接证实miR-143的表达水平可作为胰腺癌预后判断的指标.
KRAS突变的胰腺癌组织[29]和胰腺癌细胞系[30]中miR-143无表达或低表达, 若恢复miR-143的表达可抑制肿瘤的形成. 我们推测miR-143可能通过抑制靶基因KRAS的表达, 间接作用于miR-143所在序列的启动子, 减少miR-143的转录, 从而调控KRAS蛋白的表达; 而在KRAS突变的细胞中, miR-143的表达减少, 这减少了对靶基因的抑制作用, 从而通过调节下游的一系列反应而促进胰腺癌的发生. 但胰腺癌的发生机制错综复杂, 且miR-143的靶基因种类较多, 具体的机制有待进一步的深入研究.
总之, PDAC患者癌组织中miR-143呈低表达, 且与不良预后相关, 可能通过调节靶基因发挥功能, 这提示miR-143可成为研究胰腺癌发病机制的切入点之一, 且可能成为进行胰腺癌诊断、判断预后的新指标.
MicroRNA(miRNA)是一种内源性非编码单链RNA分子, 基于与靶mRNA的3'非编码区以互补配对的方式进行结合, 从而造成靶mRNA翻译的抑制和/或导致靶mRNA降解, 进而抑制基因的表达, 大量研究表明, miRNA参与肿瘤的发生发展.
郭晓钟, 教授, 中国人民解放军沈阳军区总医院消化内科; 张海蓉, 教授, 主任医师, 昆明医科大学第一附属医院消化内科
胰腺癌恶性度极高、发展快、预后差, 且其早期诊断及治疗效果不理想. miRNA由于性质稳定, 易于检测, 可能成为更加敏感的肿瘤标志物. 然而miRNAs的种类众多, 寻找出与胰腺癌密切相关的miRNA, 并通过此靶点早期诊断并治疗胰腺癌是亟待研究的问题.
miR-143可能通过抑制靶基因KRAS的表达, 间接作用于miR-143所在序列的启动子, 减少miR-143的转录, 从而调控KRAS蛋白的表达; 而在KRAS突变的细胞中, miR-143的表达减少, 这减少了对靶基因KRAS的抑制作用, 从而通过调节下游的一系列反应而促进胰腺癌的发生. 但胰腺癌的发生机制错综复杂, 且miR-143的靶基因种类较多, 具体的机制有待进一步的深入研究.
miR-143在人胰腺癌组织中的研究鲜有报道, 本文采用锁定核酸原位杂交的方法检测胰腺癌组织中的miR-143的表达情况, 该方法不仅可以提供miRNA在细胞和组织中表达的丰度以及定位信息, 且探针与靶miRNA有较好的亲和力, 敏感性及特异性较强, 能较真实的反映组织中的miR-143水平. 本文还通过生存分析发现miR-143与胰腺癌患者的预后相关.
本文研究通过锁定核酸原位杂交的方法检测出胰腺癌组织中的miR-143低表达, 且与不良预后相关, 为临床提供一种新的胰腺癌预后指标. 另外, miR-143有可能成为治疗胰腺癌的一种新的辅助治疗靶点.
锁定核酸原位杂交(LNA-ISH): 是一种原位杂交的方法, 可以提供miRNA在细胞和组织中表达的定位信息以及miRNA表达的丰度. LNA单体是一个二环的高亲和RNA类似物, 其中核糖磷酸骨架的呋喃糖环由于引入了2'-O, 4'-O次亚基桥而被锁定在N构型, 从而增加了碱基的堆积及磷酸骨架的重组, 与靶分子杂交时可以提高杂化双链热稳定性, 与传统的DNA探针相比, 其检测成熟体miRNAs在有效性上至少提高了十倍.
本文研究了miR-143在胰腺癌中的表达, 并分析了miR-143与胰腺癌淋巴结转移、预后等临床特征参数间的相关性, 具有一定的意义.
编辑: 郭鹏 电编:闫晋利
| 1. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015. CA Cancer J Clin. 2015;65:5-29. [PubMed] [DOI] |
| 2. | Tuveson DA, Neoptolemos JP. Understanding metastasis in pancreatic cancer: a call for new clinical approaches. Cell. 2012;148:21-23. [PubMed] [DOI] |
| 3. | Cai Y, Yu X, Hu S, Yu J. A brief review on the mechanisms of miRNA regulation. Genomics Proteomics Bioinformatics. 2009;7:147-154. [PubMed] [DOI] |
| 4. | Takagi T, Iio A, Nakagawa Y, Naoe T, Tanigawa N, Akao Y. Decreased expression of microRNA-143 and -145 in human gastric cancers. Oncology. 2009;77:12-21. [PubMed] [DOI] |
| 5. | Chen X, Guo X, Zhang H, Xiang Y, Chen J, Yin Y, Cai X, Wang K, Wang G, Ba Y. Role of miR-143 targeting KRAS in colorectal tumorigenesis. Oncogene. 2009;28:1385-1392. [PubMed] [DOI] |
| 6. | Borralho PM, Simões AE, Gomes SE, Lima RT, Carvalho T, Ferreira DM, Vasconcelos MH, Castro RE, Rodrigues CM. miR-143 overexpression impairs growth of human colon carcinoma xenografts in mice with induction of apoptosis and inhibition of proliferation. PLoS One. 2011;6:e23787. [PubMed] [DOI] |
| 7. | Xu B, Niu X, Zhang X, Tao J, Wu D, Wang Z, Li P, Zhang W, Wu H, Feng N. miR-143 decreases prostate cancer cells proliferation and migration and enhances their sensitivity to docetaxel through suppression of KRAS. Mol Cell Biochem. 2011;350:207-213. [PubMed] [DOI] |
| 8. | Song T, Zhang X, Wang C, Wu Y, Dong J, Gao J, Cai W, Hong B. Expression of miR-143 reduces growth and migration of human bladder carcinoma cells by targeting cyclooxygenase-2. Asian Pac J Cancer Prev. 2011;12:929-933. [PubMed] |
| 9. | Deftereos G, Corrie SR, Feng Q, Morihara J, Stern J, Hawes SE, Kiviat NB. Expression of mir-21 and mir-143 in cervical specimens ranging from histologically normal through to invasive cervical cancer. PLoS One. 2011;6:e28423. [PubMed] [DOI] |
| 10. | Tavano F, di Mola FF, Piepoli A, Panza A, Copetti M, Burbaci FP, Latiano T, Pellegrini F, Maiello E, Andriulli A. Changes in miR-143 and miR-21 expression and clinicopathological correlations in pancreatic cancers. Pancreas. 2012;41:1280-1284. [PubMed] [DOI] |
| 11. | Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell. 2004;116:281-297. [PubMed] |
| 12. | Volinia S, Calin GA, Liu CG, Ambs S, Cimmino A, Petrocca F, Visone R, Iorio M, Roldo C, Ferracin M. A microRNA expression signature of human solid tumors defines cancer gene targets. Proc Natl Acad Sci USA. 2006;103:2257-2261. [PubMed] |
| 13. | 聂 伟伟, 唐 林, 韦 凤, 陈 龙邦, 张 辰宇, 朱 琳, 李 冬海, 管 晓翔. miR-144/451基因簇调控网络的生物信息学分析. 医学研究生学报. 2012;25; 229-233. |
| 14. | Kitade Y, Akao Y. MicroRNAs and their therapeutic potential for human diseases: microRNAs, miR-143 and -145, function as anti-oncomirs and the application of chemically modified miR-143 as an anti-cancer drug. J Pharmacol Sci. 2010;114:276-280. [PubMed] |
| 15. | Michael MZ, O' Connor SM, van Holst Pellekaan NG, Young GP, James RJ. Reduced accumulation of specific microRNAs in colorectal neoplasia. Mol Cancer Res. 2003;1:882-891. [PubMed] |
| 16. | Akao Y, Nakagawa Y, Naoe T. MicroRNAs 143 and 145 are possible common onco-microRNAs in human cancers. Oncol Rep. 2006;16:845-850. [PubMed] |
| 17. | Kulda V, Pesta M, Topolcan O, Liska V, Treska V, Sutnar A, Rupert K, Ludvikova M, Babuska V, Holubec L. Relevance of miR-21 and miR-143 expression in tissue samples of colorectal carcinoma and its liver metastases. Cancer Genet Cytogenet. 2010;200:154-160. [PubMed] [DOI] |
| 18. | Clapé C, Fritz V, Henriquet C, Apparailly F, Fernandez PL, Iborra F, Avancès C, Villalba M, Culine S, Fajas L. miR-143 interferes with ERK5 signaling, and abrogates prostate cancer progression in mice. PLoS One. 2009;4:e7542. [PubMed] [DOI] |
| 19. | Liu L, Yu X, Guo X, Tian Z, Su M, Long Y, Huang C, Zhou F, Liu M, Wu X. miR-143 is downregulated in cervical cancer and promotes apoptosis and inhibits tumor formation by targeting Bcl-2. Mol Med Rep. 2012;5:753-760. [PubMed] [DOI] |
| 20. | Ng EK, Tsang WP, Ng SS, Jin HC, Yu J, Li JJ, Röcken C, Ebert MP, Kwok TT, Sung JJ. MicroRNA-143 targets DNA methyltransferases 3A in colorectal cancer. Br J Cancer. 2009;101:699-706. [PubMed] [DOI] |
| 21. | Zhang Y, Wang Z, Chen M, Peng L, Wang X, Ma Q, Ma F, Jiang B. MicroRNA-143 targets MACC1 to inhibit cell invasion and migration in colorectal cancer. Mol Cancer. 2012;11:23. [PubMed] [DOI] |
| 22. | Fang R, Xiao T, Fang Z, Sun Y, Li F, Gao Y, Feng Y, Li L, Wang Y, Liu X. MicroRNA-143 (miR-143) regulates cancer glycolysis via targeting hexokinase 2 gene. J Biol Chem. 2012;287:23227-23235. [PubMed] [DOI] |
| 23. | Yang Y, Chaerkady R, Kandasamy K, Huang TC, Selvan LD, Dwivedi SB, Kent OA, Mendell JT, Pandey A. Identifying targets of miR-143 using a SILAC-based proteomic approach. Mol Biosyst. 2010;6:1873-1882. [PubMed] [DOI] |
| 24. | Pham H, Rodriguez CE, Donald GW, Hertzer KM, Jung XS, Chang HH, Moro A, Reber HA, Hines OJ, Eibl G. miR-143 decreases COX-2 mRNA stability and expression in pancreatic cancer cells. Biochem Biophys Res Commun. 2013;439:6-11. [PubMed] [DOI] |
| 25. | Kent OA, Chivukula RR, Mullendore M, Wentzel EA, Feldmann G, Lee KH, Liu S, Leach SD, Maitra A, Mendell JT. Repression of the miR-143/145 cluster by oncogenic Ras initiates a tumor-promoting feed-forward pathway. Genes Dev. 2010;24:2754-2759. [PubMed] [DOI] |
| 26. | Hu Y, Ou Y, Wu K, Chen Y, Sun W. miR-143 inhibits the metastasis of pancreatic cancer and an associated signaling pathway. Tumour Biol. 2012;33:1863-1870. [PubMed] [DOI] |
| 28. | Wienholds E, Kloosterman WP, Miska E, Alvarez-Saavedra E, Berezikov E, de Bruijn E, Horvitz HR, Kauppinen S, Plasterk RH. MicroRNA expression in zebrafish embryonic development. Science. 2005;309:310-311. [PubMed] |
| 29. | Sakahara H, Endo K, Nakajima K, Nakashima T, Koizumi M, Ohta H, Hidaka A, Kohno S, Nakano Y, Naito A. Serum CA 19-9 concentrations and computed tomography findings in patients with pancreatic carcinoma. Cancer. 1986;57:1324-1326. [PubMed] |
| 30. | Montgomery RC, Hoffman JP, Riley LB, Rogatko A, Ridge JA, Eisenberg BL. Prediction of recurrence and survival by post-resection CA 19-9 values in patients with adenocarcinoma of the pancreas. Ann Surg Oncol. 1997;4:551-556. [PubMed] |