修回日期: 2016-02-24
接受日期: 2016-02-29
在线出版日期: 2016-04-08
目的: 探讨胃癌HER2基因扩增与化疗药物敏感性标志物的联合检测及意义.
方法: 采用免疫组织化学、荧光原位杂交和实时定量PCR检测技术对120例胃癌HER2蛋白表达、HER2基因扩增与ERCC1、TUBB3、TYMS基因mRNA表达水平.
结果: HER2蛋白表达率40.8%(49/120), 其中HER2蛋白3+, 占10.8%(13/120). HER2蛋白2+, 占14.2%(17/120). HER2蛋白1+, 占15.8%(19/120). HER2基因扩增率38.8%(19/49). ERCC1、TUBB3、TYMS基因mRNA表达检测, 其中单基因中、低表达41例、双基因中、低表达45例, ERCC1、TUBB3、TYMS基因均中、低表达19例、均无中、低表达15例. HER2基因扩增49例和ERCC1、TUBB3、TYMS基因中、低表达19例的患者中有11例接受了化疗联合曲妥珠单抗治疗, 随访结果显示HER2基因状态与ERCC1、TUBB3、TYMS基因低表达联合治疗效果呈正相关, 其中本组5例HER2蛋白3+广泛型又是HER2基因簇状扩增、ERCC1、TUBB3、TYMS基因低表达的患者总生存期长达19.1 mo.
结论: 胃癌HER2检测有很大的异质性, 同时检测HER2蛋白表达、HER2基因扩增和化疗药物敏感性标志物联合检测, 能更好地为抗肿瘤药物治疗过程中受益提供重要的参考指标; 胃癌靶向与化疗药物的联合检测来选择个体化方案有推广价值.
核心提示: 由于胃癌有很大的异质性, 治疗前同时检测HER2蛋白表达、HER2基因扩增和化疗药物敏感性标志物联合检测, 能更好地为抗肿瘤药物治疗过程中受益提供重要的参考指标.
引文著录: 朱超亚, 王仰坤, 李芳, 王苏南, 李滢滢, 贠田, 潘治宇. 胃癌组织中HER2基因扩增与化疗药物敏感性标志物的联合检测及意义. 世界华人消化杂志 2016; 24(10): 1511-1519
Revised: February 24, 2016
Accepted: February 29, 2016
Published online: April 8, 2016
AIM: To investigate the significance of combined detection of HER2 gene amplification and markers of chemosensitivity in gastric cancer.
METHODS: Immunohistochemistry (IHC), fluorescence in situ hybridization (FISH) and fluorescence RT-PCR were used to detect HER2 protein expression in 120 cases of gastric cancer, HER2 gene amplification, and ERCC1, TUBB3, and TYMS mRNA expression, respectively.
RESULTS: The positive rate of HER2 expression was 40.8% (49/120), and the rates of strong positivity (+++), moderate positivity (++), and weak positivity (+) were 10.8% (13/120), 14.2% (17/120), and 15.8% (19/120), respectively. The rate of HER2 gene amplification was 38.8% (19/49). With regards to ERCC1, TUBB3, and TYMS mRNA expression, 41 cases showed moderate or low expression of only one gene, 45 cases showed moderate or low expression of two genes, 19 cases showed moderate or low expression of three genes, and 15 cases showed no moderate or low expression of the genes. Of 19 cases showing moderate or low expression of the three genes, 11 cases received chemotherapy combined with trastuzumab treatment. Follow-up results showed that HER2 gene status and ERCC1, TUBB3, and TYMS gene expression were positively related to treatment response. In 5 cases with strong HER2 expression, HER2 gene amplification, and low expression of ERCC1, TUBB3, and TYMS, overall survival was 19.1 mo.
CONCLUSION: HER2 testing in gastric cancer has great heterogeneity, and simultaneous detection of HER2 protein expression, HER2 gene amplification and markers of chemosensitivity provides an important reference index for antitumor drug therapy.
- Citation: Zhu CY, Wang YK, Li F, Wang SN, Li YY, Yun T, Pan ZY. Significance of combined detection of HER2 gene amplification and markers of chemosensitivity in gastric cancer. Shijie Huaren Xiaohua Zazhi 2016; 24(10): 1511-1519
- URL: https://www.wjgnet.com/1009-3079/full/v24/i10/1511.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i10.1511
"精准医学"火热, 提倡异病同治, 一个患者在不同阶段需要调整方案, 随着分子病理的发展, 使每个患者能精准分型、精准治疗[1,2]. 近年来, 针对信号转导、生长因子及其受体, 人们研发几种新型药物, 并且已取得了重要成果, 其表达的蛋白产物为人表皮生长因子受体2, 后者的高表达可活化细胞信号转导系统, 导致细胞转化、增殖[3,4]. 乳腺癌中HER2是一种广泛采用的治疗靶点[5-7], 越来越多的证据表明, HER2是胃癌的重要标志物, 高HER2表达的肿瘤患者最为受益[8-11]. 与乳腺癌相比, 胃癌表现出独特的免疫染色特性, HER2阳性病例中有较高的肿瘤异质性, 因此, 规范胃癌HER2是正确指导用药的保证. 另外, 化疗又是中晚期胃癌患者的主要治疗选择, 由于临床上化疗药物的选择存在盲目性, 导致患者在接受化疗后未能受益, 反而因诸多不良反应影响生活质量, 并延误治疗时机. 胃癌常见的化疗药物包括氟尿嘧啶类、铂类和紫杉类. 我们采用免疫组织化学法(immunohistochemistry, IHC)技术检测胃癌HER2蛋白表达、荧光原位杂交(fluoresce in situ hybridization, FISH)技术检测胃癌HER2基因状态, 实时定量PCR检测(real-time quantitative PCR, qRT-PCR)技术检测氟尿嘧啶类、铂类和紫杉类胃癌常用药物表达, 探讨FISH、IHC和qRT-PCR技术检测胃癌判断标准, 以便更好地为抗肿瘤药物治疗过程中受益提供量化的参考指标, 来指导个体化的选择.
收集洛阳市第150中心医院于2011-02/2013-09外科手术切除的胃及食管胃连接部根治标本120例, 组织学诊断标准按照文献胃肿瘤病理学[12]和2010年版世界卫生组织(World Health Organization, WHO)消化系肿瘤胃癌组织学分类[13]. 本组年龄25-74岁, 平均年龄62.4岁. 手术离体后标本均在30 min内固定, 经新鲜配置的40 g/L甲醛固定8-48 h, 固定液与组织体积比为10:1. 切取肿瘤组织4-6块(常规切取近端、远端切缘, 肿瘤及临近胃黏膜等处组织标本块不包括在内), 包括最深浸润点及最邻近浆膜层. 分别进行HE、IHC、FISH和qRT-PCR技术检测. 试剂: 美国美国食品和药品管理局(Food and Drug Administration, FDA)批准的HER2免疫组织化学染色试剂盒, HER2 Hercep TestTM Kit pharmDxTM Kit均购自Dako Cytomation公司. 试剂、探针Paraffin Pretreatment KitⅡ试剂盒, 其中主要含有预处理溶液和蛋白酶溶液; Path VysionTM HER2探针试剂盒; 人ERCC1、TUBB3、TYMS基因表达相对定量检测试剂盒(PCR-荧光探针法), ERCC1、TUBB3、TYMS PCR反应液、引物探针混合液、阳性质控品、阴性质控品, 以及内参PCR反应液、内参引物探针混合液、内参阳性质控品、内参阴性质控品. 不同批次之间同一组分不可以相互替换.
1.2.1 免疫组织化学染色: 染色阳性强度的结果判读: 每例4-6张切片中肿瘤细胞的细胞膜均无染色, 结果为0; 肿瘤细胞微弱或隐约可见膜染色者, 结果为1+; 肿瘤细胞的基底膜、侧面膜或完整性的膜有弱至中度染色者, 结果为2+; 肿瘤细胞的基底膜、侧面膜或完整性的膜有强阳性染色者, 结果为3+. 染色阳性面积的结果判读: 每例4-6张切片中肿瘤细胞的细胞膜均无着色为阴性, ≥80%为广泛型、79%-21%为部分型、≤20%为局灶型.
1.2.2 FISH技术检测: 试剂、探针及FISH操作步骤: 石蜡包埋胃癌组织切片的预处理程序、操作步骤按照文献及试剂盒说明进行[9]. FISH结果判断: 主要是根据IHC检测切片的HER2阳性区域, 进行FISH技术检测. 首先在HE染色切片上确认癌细胞阳性区域, 然后在×10物镜下, 于FISH切片上找到HE的同一视野, 在×40物镜下观察整张切片, 75%以上癌细胞核中都有杂交信号视为结果满意, 然后换成×100物镜, 计数至少30个边界完整、孤立无重叠的癌细胞. HER2基因状态评价标准: 随机计数30个癌细胞核中HER2基因拷贝数与17号染色体数量的比值, 17号染色体比值>2.2为阳性结果, 提示样本中HER2基因发生扩增, 比值<1.8为阴性结果, 提示该样本无HER2基因扩增. 如果HER2基因拷贝数在1.8-2.2之间时, 可选择其他肿瘤组织区域再进行30个肿瘤细胞计数.
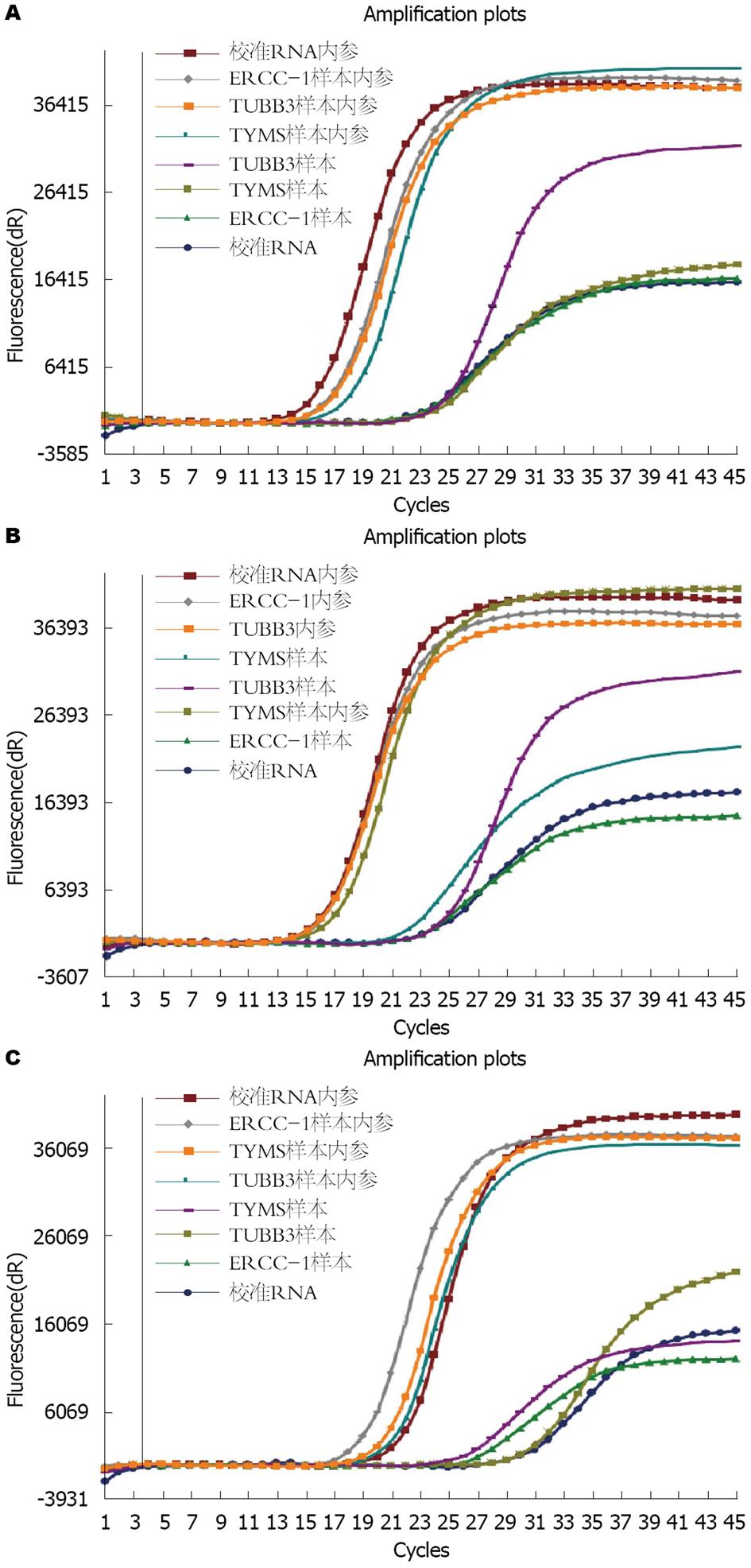
1.2.3 qRT-PCR技术: 石蜡切片样品应含有足够比例的肿瘤细胞, 样品无蛋白或DNA污染, 商品化的RNA提取试剂盒处理样本, 操作步骤按照试剂盒说明书进行. ERCC1、TUBB3、TYMS阳性质控品和内参阳性质控品、校准RNA质控品无需抽提, 使用前室温融化, 涡旋振荡10 s, 2000 r/min离心15 s. 确定反应数(待检样本数1加质控品数; 待检样本数2加质控品数). 将阴性质控品、已处理样本、校准RNA质控品和阳性质控品分别取6 μL加入到ERCC1 PCR反应管和内参PCR反应管中, 盖紧管盖, 2000 r/min离心15 s, 将管壁上的液体全部甩至管底, 避免产生气泡, 再次2000 r/min离心15 s, 然后立即进行PCR扩增反应. 高、中、低划分为, 低表达为<37.5%; 中表达为37.5%-62.5%之间; 高表达为>62.5%. ERCC1低表达和中表达选用DDP(C), TUBB3低表达和中表达选用Docetaxel(D), TYMS低表达和中表达选用5-氟胞嘧啶(F)组成敏感的化疗方案.
统计学处理 采用SPSS13.0统计软件分析, 应用t检验和χ2检验比较两组HER2基因状态; HER2基因扩增与ERCC1、TUBB3、TYMS基因mRNA表达水平. P<0.05为差异有统计学意义.
胃癌120例, 其中乳头状腺癌24例(19.0%)、腺管状腺31例(22.9%)、黏液腺癌19例(16.1%)、低黏附性腺癌11例(12.4%)、混合性腺癌35例(29.6%). 混合性腺癌包括乳头状腺癌、腺管状腺、黏液腺癌和低黏附性腺癌等不同组织学结构混合. 本组病例均为pT2-4期.
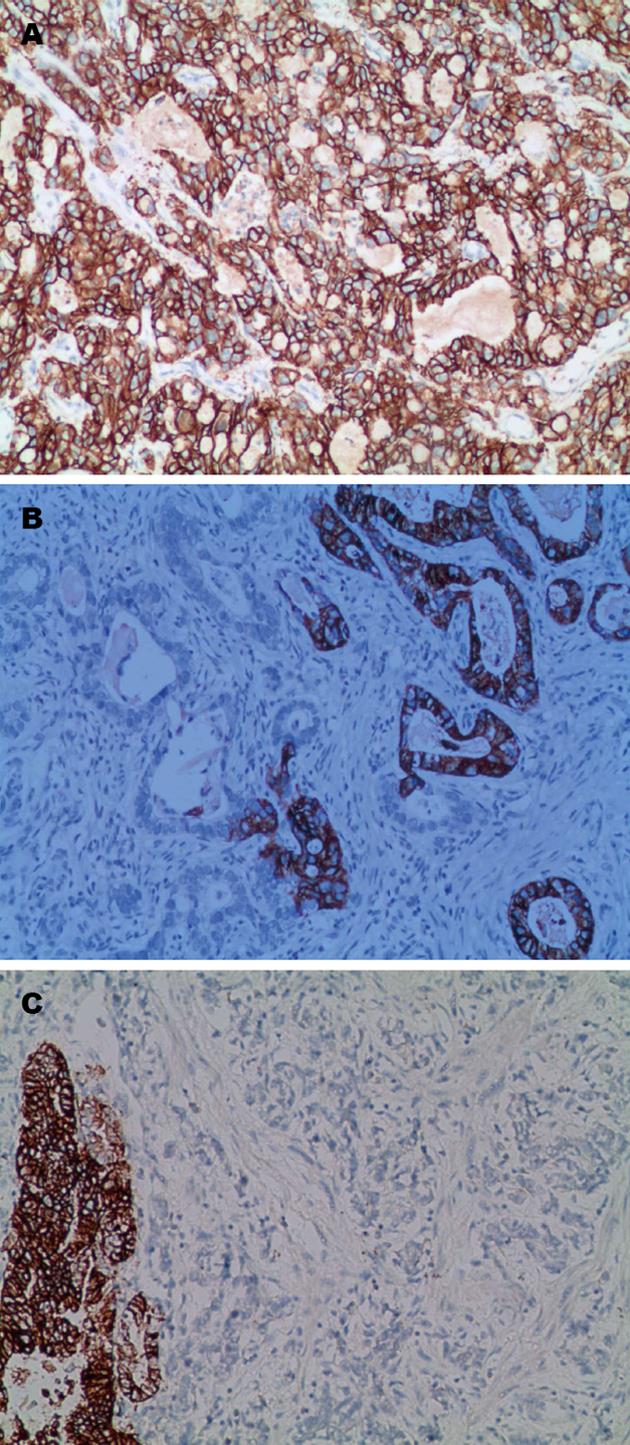
胃癌HER2蛋白表达率与组织学类型的关系如表1. HER2蛋白阳性表达定位在细胞膜, 表达率40.8%(49/120), 其中HER2阳性3+广泛型3例(图1A)、部分型7例(图1B)、局灶型3例(图1C), 占10.8%(13/120). HER2蛋白2+广泛型5例、部分型7例、局灶型5例, 占14.2%(17/120). HER2阳性1+广泛型7例、部分型8例、局灶型4例, 占15.8%(19/120). 胃癌HER2蛋白表达的显著特点是异质性, 每例4-6张切片中只有广泛型、部分型、局灶型和阴性的任何一种类型者, 称为单信号型, 占63.3%(31/49), 每例4-6张切片中同时有HER2阳性3+、HER2阳性2+、HER2阳性1+和阴性的2种或2种以上者称为多信号型, 占36.7%(18/49)(表2).
| 类型 | n | IHC | |||||
| 面积/强度 | - | 1+ | 2+ | 3+ | 阳性n(%) | ||
| 乳头状腺癌 | 24 | ≥80% | 1 | 1 | 2 | 4(16.7) | |
| 21%-79% | 1 | 2 | 2 | 5(20.8) | |||
| ≤20% | 0 | 1 | 1 | 2(8.3) | |||
| 阴性 | 13 | ||||||
| 管状腺癌 | 31 | ≥80% | 2 | 2 | 1 | 5(16.1) | |
| 21%-79% | 3 | 1 | 2 | 6(19.4) | |||
| ≤20% | 0 | 2 | 1 | 3(9.7) | |||
| 阴性 | 17 | ||||||
| 黏液腺癌 | 19 | ≥80% | 0 | 1 | 0 | 1(5.3) | |
| 21%-79% | 1 | 1 | 1 | 3(15.8) | |||
| ≤20% | 1 | 1 | 0 | 2(10.5) | |||
| 阴性 | 13 | ||||||
| 低黏附性癌 | 11 | ≥80% | 0 | 1 | 0 | 1(9.1) | |
| 21%-79% | 0 | 1 | 1 | 2(18.1) | |||
| ≤20% | 1 | 0 | 0 | 1(9.1) | |||
| 阴性 | 7 | ||||||
| 混合性腺癌 | 35 | ≥80% | 4 | 0 | 0 | 4(11.4) | |
| 21%-79% | 3 | 2 | 1 | 6(17.1) | |||
| ≤20% | 2 | 1 | 1 | 4(11.4) | |||
| 阴性 | 21 | ||||||
| 合计 | 120 | 71(59.2) | 19(15.8) | 17(14.2) | 13(10.8) | 49(40.8) | |
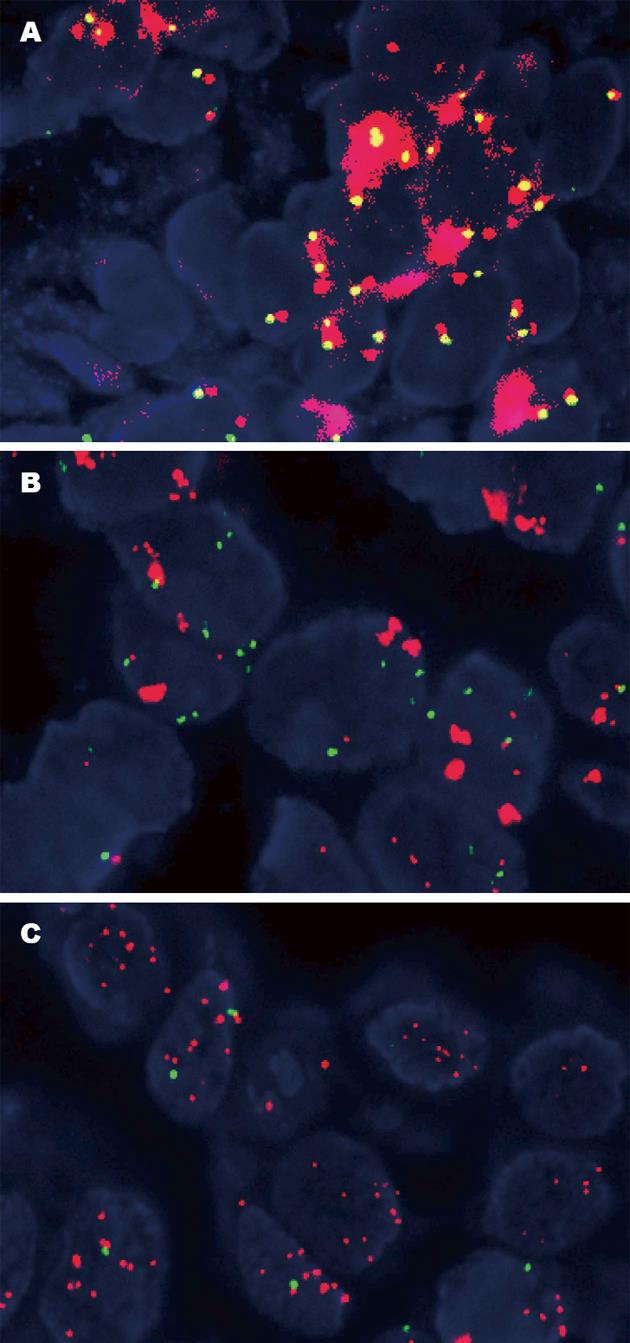
HER2基因扩增率38.8%(19/49)(表3). HER2蛋白3+者占92.3%(12/13)、HER2蛋白2+者占35.3%(6/17)和HER2蛋白1+者占5.3%(1/19). 19例HER2基因扩增中的形态类型: HER2基因簇状扩增(图2A)14.3%(7/19)、大颗粒状扩增(图2B)10.2%(5/19)、点状扩增(图2C)6.1%(3/19)和高多体8.2%(4/19).
| HER2强度(n) | HER2蛋白表达 | HER2基因扩增状态 | |||||
| 范围 | n | 簇状 | 大颗粒状 | 点状 | 高多体 | 扩增n(%) | |
| 3+(13) | 广泛型 | 3 | 2 | 1 | 1 | 1 | 12(92.3) |
| 部分型 | 7 | 2 | 1 | 1 | 1 | ||
| 局灶型 | 3 | 0 | 0 | 0 | 0 | ||
| 2+(17) | 广泛型 | 5 | 1 | 1 | 1 | 1 | 6(35.3) |
| 部分型 | 7 | 1 | 1 | 0 | 1 | ||
| 局灶型 | 5 | 0 | 0 | 0 | 0 | ||
| 1+(19) | 广泛型 | 7 | 0 | 1 | 0 | 0 | 1(5.3) |
| 部分型 | 8 | 1 | 0 | 0 | 0 | ||
| 局灶型 | 4 | 0 | 0 | 0 | 0 | ||
| 总计 | 49 | 7(14.3) | 5(10.2) | 3(6.1) | 4(8.2) | 19(38.8) | |
ERCC1、TUBB3、TYMS三种基因中单基因中、低表达41例(图3A); 双基因中、低表达45例(图3B); 三基因均为中、低表达19例(图3C); 三基因均无中、低表达15例(13.3%). HER2基因扩增与ERCC1、TUBB3、TYMS基因mRNA表达的关系(表4).
| 表达水平 | n | HER2基因状态 | |||
| 簇状 | 大颗粒状 | 点状 | 高多体 | ||
| 单基因中、低表达 | 41 | 2 | 2 | 1 | 1 |
| 双基因中、低表达 | 45 | 3 | 2 | 1 | 2 |
| 三基因均为中、低表达 | 19 | 1 | 0 | 1 | 1 |
| 三基因均无中、低表达 | 15 | 1 | 1 | 0 | 0 |
| 合计 | 120 | 7 | 5 | 3 | 4 |
HER2基因扩增联合ERCC1、TUBB3、TYMS基因mRNA表达水平方案称联合方案, 仅用化疗药的称单纯化疗(DCFf方案化疗). HER2基因扩增49例和ERCC1、TUBB3、TYMS基因中、低表达19例的患者中有11例接受了化疗联合曲妥珠单抗治疗(表5).
| 分组 | HER2基因状态49例 | 三基因均为中、低表达 | PFS和OS的平均值(mo) | |
| 中位PFS | 中位OS | |||
| 联合方案 | 11 | 11 | 9.1 | 16.7 |
| DCFf方案 | 38 | 8 | 5.6 | 12.1 |
近年来, 靶向HER2蛋白的单克隆抗体: 曲妥珠单抗(trastuzumab; 商品名赫赛汀, Herceptin)被证实能提高原发性和转移性HER2阳性乳腺癌患者的生存率[14,15]. 为准确挑选最适宜的患者接受治疗, 同时避免某些患者不必要的用药, 2007年美国临床肿瘤协会(American Society of Clinical Oncology, ASCO)/美国病理医师学院(College of American Pathologist, CAP)公布了在2007年版ASCO/CAP HER2检测指南[16]基础上的更新版[17], 对乳腺癌HER2检测的技术路线、结果判读标准、质量控制等多方面提出了新要求, 是具有循证医学意义的参考, 标志着HER2的检测向标准化迈进了一大步. 而在胃癌中, 相关研究起步稍晚. 新近一项包括中国在内的24个国家参与的全球多中心Ⅲ期临床试验(ToGA)揭示了曲妥珠单抗对HER2阳性晚期胃癌和胃食管交界癌患者的疗效[16,18,19], 随后FDA批准了该药联合化疗治疗HER2阳性转移性胃癌和胃食管交界癌患者[16,17]. 目前, 国内外一般采用IHC法检测HER2蛋白表达状态. 在胃癌中, 不同研究[20-22]报道的HER2蛋白过表达率不一致, 大部分集中在6.8%-34.0%. 胃癌HER2检测与乳腺癌不同, 其检测结果受到诸多因素的影响, 包括标本的术前处理、固定、检测的试剂及方法、实验室的质量控制、染色结果的判读等[23-26]. 本研究采用IHC和FISH技术联合检测120例胃癌, HER2蛋白表达率40.8%(49/120), 其中HER2蛋白3+, 占10.8%(13/120). HER2蛋白2+, 占14.2%(17/120). HER2蛋白1+, 占15.8%(19/120). HER2基因扩增率38.8%(19/49)(表3). HER2蛋白3+者占92.3%(12/13)、HER2蛋白2+者占35.3%(6/17)和HER2蛋白1+者占5.3%(1/19). 19例HER2基因扩增中的形态类型: HER2基因簇状扩增(图2A)14.3%(7/19)、大颗粒状扩增(图2B)10.2%(5/19)、点状扩增(图2C)6.1%(3/19)和高多体8.2%(4/19). 由此, 我们提出检测HER2蛋白结果划分为广泛型、部分型和局灶型和HER2基因扩增结果划分为簇状、大颗粒状、点状和高多体性, 能更好地为靶点的抗肿瘤药物治疗过程中受益提供量化的参考指标. 只有提供检测报告的完整性, 临床才有可能实施有效的个体化治疗.
目前, 胃癌的化疗多采用联合方案, 通常采用氟尿嘧啶类、铂类和紫杉类常用药. 三药联合的化疗方案属于较为强烈的化疗方案; 而单药或两药联合的化疗属于非强烈的方案. 三药联合的生存优势明显, 但不良反应较大[27,28]. 由于胃癌在所有的实体瘤中是预后较差, 异质性很强, 药物敏感性较差, 是对个体化要求较强的肿瘤, 在临床研究和临床实践中必须关注这些患者以及肿瘤特征合理的个体化的选择药物, 才有可能使患者真正获益, 并延长生存. 使得人们更加关注胃癌的高度异质性, 如何实现细胞毒药物和靶向药物在进展期胃癌中的个体化治疗成为大家讨论的热点[28,29]. 本研究采用IHC、FISH和qRT-PCR技术联合对胃癌靶向和化疗药物的检测, 对HER2基因扩增的49例和ERCC1、TUBB3、TYMS基因中、低表达的19例患者中的11例, 采用西妥昔单抗联合奥沙利铂, 亚叶酸钙、氟尿嘧啶方案; 并进行了27 mo随访. 随访结果显示HER2基因状态与ERCC1、TUBB3、TYMS基因低表达联合治疗效果呈正相关, 其中本组5例HER2蛋白3+广泛型又是HER2基因簇状扩增、ERCC1、TUBB3、TYMS基因低表达的患者总生存期长达19.1 mo. 采用了靶向药物的维持治疗, 无进展生存期9.1 mo; 客观缓解率显著改善; 疾病控制率. 胃癌HER2检测有很大的异质性, 同时检测HER2蛋白表达、HER2基因扩增和化疗药物敏感性标志物联合检测, 能更好地为抗肿瘤药物治疗过程中受益提供重要的参考指标; 胃癌靶向与化疗药物的联合检测来选择个体化方案有推广价值.
总之, 规范胃癌HER2检测与化疗药物敏感性标志物检测标准的判别是正确指导用药的保证. 胃癌组织中HER2检测有很大的异质性, HER2检测规范和细化便于用药效果的指导, HER2检测的范围和强度的广泛、部分和灶性的划分提示指导、评估靶向药物的受益情况. 在胃癌靶向治疗中还必须同时化疗药物敏感性标志物的检测, 通过检测化疗药物敏感性标志物来选择化疗方案, 进行胃癌个体化治疗将成为必然趋势.
近年来, 随着分子病理的发展, 使每个患者能精准分型、精准治疗. 因此, 规范胃癌HER2和化疗药物的检测是正确指导用药的保证. 通过检测化疗药物敏感性标志物来选择化疗方案, 进行胃癌个体化治疗将成为必然趋势.
孟繁杰, 教授, 主任医师, 上海中医药大学附属第七人民医院普外一科
由于临床上化疗药物的选择存在盲目性, 导致患者在接受化疗后未能受益, 反而因诸多不良反应影响生活质量, 并延误治疗时机. 免疫组织化学法和实时定量PCR检测技术检测胃癌判断标准, 以便更好地为抗肿瘤药物治疗过程中受益提供量化的参考指标.
胃癌HER2检测与乳腺癌不同, 其检测结果受到诸多因素的影响, HER2检测规范和细化便于用药效果的指导, HER2检测的范围和强度划分为广泛、部分和灶性, 能提示指导、评估靶向药物的受益情况.
HER2是胃癌的重要标志物, 高HER2表达的肿瘤患者最为受益, 在胃癌靶向治疗中还必须同时化疗药物敏感性标志物的检测, 通过检测化疗药物敏感性标志物来选择化疗方案, 进行胃癌个体化治疗将成为必然趋势.
胃癌在所有的实体瘤中是预后较差, 异质性很强, 药物敏感性较差, 是对个体化要求较强的肿瘤, 在临床研究和临床实践中必须关注这些患者以及肿瘤特征合理的个体化的选择药物, 才有可能使患者真正获益, 并延长生存.
本文设计新颖, 临床思路和分组设计合理, 统计处理较好, 有一定的临床意义.
编辑: 于明茜 电编:闫晋利
| 2. | Yk W, Cf G, T Y, Z C, Xw Z, Xx L, Nl M, Wz Z. Assessment of ERBB2 and EGFR gene amplification and protein expression in gastric carcinoma by immunohistochemistry and fluorescence in situ hybridization. Mol Cytogenet. 2011;4:14. [PubMed] [DOI] |
| 3. | García-García E, Gómez-Martín C, Angulo B, Conde E, Suárez-Gauthier A, Adrados M, Perna C, Rodríguez-Peralto JL, Hidalgo M, López-Ríos F. Hybridization for human epidermal growth factor receptor 2 testing in gastric carcinoma: a comparison of fluorescence in-situ hybridization with a novel fully automated dual-colour silver in-situ hybridization method. Histopathology. 2011;59:8-17. [PubMed] [DOI] |
| 4. | Wadhwa R, Song S, Lee JS, Yao Y, Wei Q, Ajani JA. Gastric cancer-molecular and clinical dimensions. Nat Rev Clin Oncol. 2013;10:643-655. [PubMed] [DOI] |
| 5. | Rieck LD, Pottala JV, Eliason SL, Koch MR, Egland PG, Egland KA. Status of HER-2 gene amplification in breast cancers from Native American women. Cancer Genet Cytogenet. 2008;187:54-56. [PubMed] [DOI] |
| 6. | English DP, Roque DM, Santin AD. HER2 expression beyond breast cancer: therapeutic implications for gynecologic malignancies. Mol Diagn Ther. 2013;17:85-99. [PubMed] [DOI] |
| 7. | Kim Y, Kim J, Lee HD, Jeong J, Lee W, Lee KA. Spectrum of EGFR gene copy number changes and KRAS gene mutation status in Korean triple negative breast cancer patients. PLoS One. 2013;8:e79014. [PubMed] [DOI] |
| 8. | Berezowska S, Novotny A, Bauer K, Feuchtinger A, Slotta-Huspenina J, Becker K, Langer R, Walch A. Association between HSP90 and Her2 in gastric and gastroesophageal carcinomas. PLoS One. 2013;8:e69098. [PubMed] [DOI] |
| 9. | Matsuoka T, Yashiro M. Recent advances in the HER2 targeted therapy of gastric cancer. World J Clin Cases. 2015;3:42-51. [PubMed] [DOI] |
| 10. | 王 仰坤, 高 春芳, 贠 田, 张 现伟, 赵 文召, 郑 国宝, 刘 广洛. HER2和EGFR基因在胃癌组织中的状态及其与临床病理的关系. 世界华人消化杂志. 2010;18:2642-2647. [DOI] |
| 11. | 王 仰坤, 高 春芳, 张 现伟, 贠 田, 李 富林, 赵 元珍, 赵 文召, 蒙 念龙. 利用FISH技术检测胃癌组织中HER2基因及其与p53蛋白表达的相关性. 临床与实验病理学杂志. 2011;27:126-129. |
| 12. | 哈 米霍恩, 虞 积耀. WHO肿瘤分类及诊断标准: 消化系统肿瘤病理学和遗传学. 北京: 人民卫生出版社 2002; 45-79. |
| 13. | 王 仰坤. 胃肿瘤病理学. 北京: 人民军医出版社 2012; 296-404. |
| 14. | Gordon MA, Gundacker HM, Benedetti J, Macdonald JS, Baranda JC, Levin WJ, Blanke CD, Elatre W, Weng P, Zhou JY. Assessment of HER2 gene amplification in adenocarcinomas of the stomach or gastroesophageal junction in the INT-0116/SWOG9008 clinical trial. Ann Oncol. 2013;24:1754-1761. [PubMed] [DOI] |
| 16. | Roa I, de Toro G, Schalper K, de Aretxabala X, Churi C, Javle M. Overexpression of the HER2/neu Gene: A New Therapeutic Possibility for Patients With Advanced Gallbladder Cancer. Gastrointest Cancer Res. 2014;7:42-48. [PubMed] |
| 17. | Wolff AC, Hammond ME, Hicks DG, Dowsett M, McShane LM, Allison KH, Allred DC, Bartlett JM, Bilous M, Fitzgibbons P. Recommendations for human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists clinical practice guideline update. Arch Pathol Lab Med. 2014;138:241-256. [PubMed] [DOI] |
| 20. | Dahle-Smith Å, Stevenson D, Massie D, Murray GI, Dutton SJ, Roberts C, Ferry D, Osborne A, Clark C, Petty RD. Epidermal Growth Factor (EGFR) copy number aberrations in esophageal and gastro-esophageal junctional carcinoma. Mol Cytogenet. 2015;8:78. [PubMed] [DOI] |
| 21. | Wang YK, Chen Z, Yun T, Li CY, Jiang B, Lv XX, Chu GH, Wang SN, Yan H, Shi LF. Human epidermal growth factor receptor 2 expression in mixed gastric carcinoma. World J Gastroenterol. 2015;21:4680-4687. [PubMed] |
| 22. | Somlo G, Chu P, Frankel P, Ye W, Groshen S, Doroshow JH, Danenberg K, Danenberg P. Molecular profiling including epidermal growth factor receptor and p21 expression in high-risk breast cancer patients as indicators of outcome. Ann Oncol. 2008;19:1853-1859. [PubMed] [DOI] |
| 23. | Wang SN, Li YY, Xu ZS, Zhao WZ, Yun T, Zhu WL, Wang YK. Study on the protein expression and amplification of HER2 gene in gastric cancer. Chinese-German J Clin Oncol. 2014;13:267-272. |
| 24. | Zhang F, Yang X, Li L, Sun L, Wang BO, Yu X. Epidermal growth factor receptor expression and gene copy number analysis in gastric carcinoma samples from Chinese patients. Oncol Lett. 2016;11:173-181. [PubMed] |
| 25. | Tang D, Liu CY, Shen D, Fan S, Su X, Ye P, Gavine PR, Yin X. Assessment and prognostic analysis of EGFR, HER2, and HER3 protein expression in surgically resected gastric adenocarcinomas. Onco Targets Ther. 2015;8:7-14. [PubMed] [DOI] |
| 26. | Stahl P, Seeschaaf C, Lebok P, Kutup A, Bockhorn M, Izbicki JR, Bokemeyer C, Simon R, Sauter G, Marx AH. Heterogeneity of amplification of HER2, EGFR, CCND1 and MYC in gastric cancer. BMC Gastroenterol. 2015;15:7. [PubMed] [DOI] |
| 27. | Luo Y, Li Z, Cui S, Shen C, Zhao J, Wu M, Li Y, Wang M, Chen R, Liu Z. Joint detection of ERCC1, TUBB3, and TYMS guidance selection of docetaxel, 5-fluorouracil and cisplatin (DDP) individual chemotherapy in advanced gastric cancer patients. Eur J Med Res. 2014;19:50. [PubMed] [DOI] |
| 28. | Li Y, Liu Z, Liu H, Wang LE, Tan D, Ajani JA, Wei QY. ERCC1 and ERCC2 variants predict survival in gastric cancer patients. PLoS One. 2013;8:e71994. [PubMed] [DOI] |
| 29. | Baek SK, Kim SY, Lee JJ, Kim YW, Yoon HJ, Cho KS. Increased ERCC expression correlates with improved outcome of patients treated with cisplatin as an adjuvant therapy for curatively resected gastric cancer. Cancer Res Treat. 2006;38:19-24. [PubMed] [DOI] |