修回日期: 2015-09-25
接受日期: 2015-10-13
在线出版日期: 2016-01-08
目的: 研究白介素12(interleukin 12, IL-12)基因治疗对介入栓塞后兔VX2肝癌模型的肿瘤微血管, 以及对免疫微环境的影响, 探讨IL-12抗肿瘤作用的机制.
方法: 成功建立VX2移植性肝癌模型的新西兰兔随机分为4组, 每组8只, 1组为对照组, 经动脉灌注生理盐水, 2组行肝动脉碘油化疗栓塞(超液态碘油+丝裂霉素), 3组经肝动脉灌注治疗基因(编码人IL-12的重组基因), 4组行肝动脉内碘油化疗栓塞+经肝动脉灌注治疗基因(超液态碘油+丝裂霉素+肝动脉内灌注编码人IL-12的重组基因). 于治疗后第14天处死所有实验兔, 免疫组织化学法检测肿瘤组织微血管密度值与CD3+、CD4+、CD8+效应性T细胞, 以及FoxP3+调节性T细胞.
结果: 化疗栓塞组肿瘤微血管密度、FoxP3+细胞明显高于对照组, CD3+、CD4+、CD8+ T细胞与对照组之间无明显差异(P>0.05). IL-12基因治疗后肿瘤微血管密度明显低于化疗栓塞组与对照组, 而CD3+、CD4+、CD8+ T细胞高于化疗栓塞组与对照组, 两个基因治疗组(3组与4组)之间无明显差异. IL-12基因治疗后, FoxP3+细胞变化不明显, 3组与1组之间差异、4组与2组之间差异无统计学意义.
结论: IL-12基因治疗可以抑制肿瘤血管生成, 并且诱导CD3+、CD4+、CD8+效应性T细胞浸润, 但存在于肿瘤中以及化疗栓塞后高表达的FoxP3+调节性T细胞可能会限制IL-12的抗肿瘤作用.
核心提示: 本研究使用免疫组织化学法检测微血管密度, CD3+、CD4+、CD8+效应性T细胞以及FoxP3+调节性T细胞, 探讨了白介素12(interleukin 12, IL-12)基因治疗对VX2肝癌微血管及免疫微环境的影响. 认为IL-12基因治疗可以抑制肿瘤血管生成作用.
引文著录: 夏向文, 李欣, 刘一鸣, 梁斌, 郑传胜, 冯敢生, 梁惠民. IL-12基因治疗对兔VX2肝癌的微血管及免疫微环境的影响. 世界华人消化杂志 2016; 24(1): 97-103
Revised: September 25, 2015
Accepted: October 13, 2015
Published online: January 8, 2016
AIM: To evaluate the effect of interleukin-12 (IL-12) gene therapy on microvessel density and microenvironment in a post-chemoembolization VX2 liver cancer model, and to investigate its anti-tumor mechanism.
METHODS: Rabbits with VX2 hepatic tumors were randomized into 4 groups, with eight rabbits in each group. Interventional procedure protocols were performed as follows: 0.9% saline solution (group 1, control), transcatheter arterial chemoembolization alone (group 2, lipiodol + mitomycin), intra-arterial IL-12 gene infusion (group 3, IL-12 gene therapy alone), and intra-arterial IL-12 gene infusion in combination with chemoembolization (group 4, IL-12 plus chemoembolization). Fourteen days after therapy, tumor tissues of the sacrificed animals were explanted for immunohistochemistry to evaluate microvessel density, effector T cells (CD3+, CD4+, and CD8+) and regulatory T cells (FoxP3+).
RESULTS: The microvessel density and FoxP3+ T cells in group 2 were significantly higher than those in group 1, but the differences in CD3+, CD4+, and CD8+ T cells between the two groups were not significant. The microvessel density in gene therapy groups (groups 3 and 4) were significantly lower, and CD3+, CD4+, and CD8+ T cells in these two groups were significantly higher than those in groups 1 and 2. The differences in CD3+, CD4+, and CD8+ T cells between the two gene therapy groups (groups 3 and 4) were not significant. The difference in FoxP3+ T cells was not significant between before and after IL-12 gene therapy. The differences in the level of FoxP3 were not significant between groups 3 and 1, as well as between groups 4 and 2.
CONCLUSION: IL-12 gene therapy can inhibit angiogenesis and induce effector T cell (CD3+, CD4+, and CD8+) infiltration in the VX2 liver cancer model, but the efficacy appears to be limited by the regulatory T cells (FoxP3+) existing in the tumors and overexpressed after chemoembolization.
- Citation: Xia XW, Li X, Liu YM, Liang B, Zheng CS, Feng GS, Liang HM. Effect of interleukin 12 gene therapy on microvessel density and microenvironment in a rabbit model of VX2 liver cancer. Shijie Huaren Xiaohua Zazhi 2016; 24(1): 97-103
- URL: https://www.wjgnet.com/1009-3079/full/v24/i1/97.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i1.97
白介素12(interleukin 12, IL-12)是由激活的炎性细胞产生的具有广泛生物学活性的免疫细胞因子, 也是研究较多且被认为具有广阔前景的抗肿瘤细胞因子之一. 在我们前期的研究中[1,2], 我们报道了动脉内IL-12基因治疗与化疗栓塞联合, 对VX2肝癌模型的抗肿瘤作用, 结果显示两者联合应用具有促进肿瘤细胞凋亡并降低肿瘤生长速率的作用, 但是仅有少数显示肿瘤缩小, 而大部分肿瘤只是生长速度减慢. 在本研究中, 我们对前期的肿瘤标本进一步研究, 采用免疫组织化学法分析肿瘤微血管及免疫微环境的变化, 试图进一步研究IL-12抗肿瘤作用的机制以及可能影响其疗效的原因, 以期为进一步提高肝癌的辅助治疗效果提供新思路.
实验动物为新西兰大白兔, 华中科技大学同济医学院动物实验中心提供[批准文号: SCXK(鄂)2007-0006]. 小鼠抗CD31单克隆抗体(Dako公司, Glostrup, Denmark), CD3、CD4、CD8、叉头状转录因子(forkhead transcription factor, FoxP3)小鼠单克隆抗体(eBioscience公司). EnVisionTM二步法非生物素检测系统为Dako(Denmark)公司产品. Olympus IX71倒置显微镜. 编码IL-12双亚基的质粒载体pEGFP-C1-hIL_12由本实验室构建并扩增. 转染载体采用的是一种新颖的多聚阳离子型基因载体, 该转染载体由一种有生物活性的多糖经胺化还原法阳离子化而成. 质粒构建及转染载体的制备细节可见诸我们之前的报道[1,2].
1.2.1 动物模型分组及介入治疗: 动物模型建立、分组及介入治疗详请见我们之前的描述[1], 简述如下: 开腹肿瘤法建立兔VX2肝癌模型, 计算机断层扫描(computed tomography, CT)扫描证实造模成功的荷瘤兔随机分成四组, 每组八只, 开腹穿刺肝动脉后行介入治疗, 1组经肝动脉灌注生理盐水, 2组行肝动脉化疗栓塞(transcatheter arterial chemoembolization, TACE)(注入超液态碘油+丝裂霉素混悬液至血流完全停滞, 含丝裂霉素1 mg/mL, 下同), 3组经肝动脉基因灌注治疗(灌注阳离子多糖载基因复合物, 含pEGFP-C1_IL-12质粒100 µg), 4组行肝动脉内化疗栓塞+基因治疗(夹心法, 先注入超液态碘油+丝裂霉素混悬液, 至血液明显减慢后注入阳离子多糖载基因复合物, 含pEGFP-C1_IL-12质粒100 µg, 再注入超液态碘油+丝裂霉素混悬液至血流完全停滞).
1.2.2 免疫组织化学分析: 治疗后第14天处死所有实验动物, 留取肿瘤区及瘤周组织标本, 4%甲醛固定, 石蜡包埋并切片, 切片厚度为4 µm.
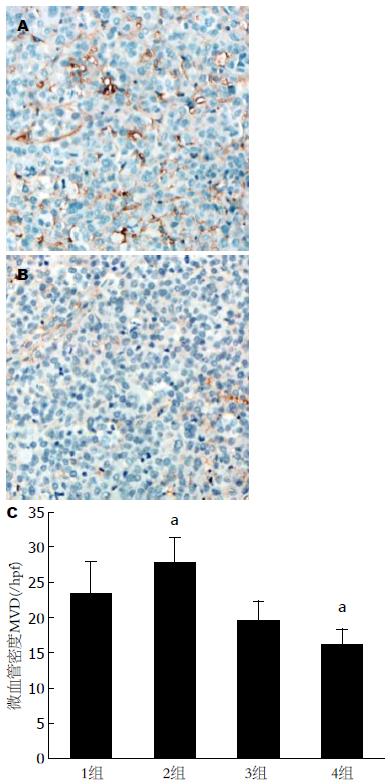
微血管密度(microvessel density, MVD)采用小鼠抗CD31单克隆抗体(Dako, Glostrup, Denmark)检测, 抗体稀释度为1:100, 内皮细胞胞浆和胞膜的棕黄色颗粒状染色为CD31阳性表达表现. 计数方法参照Gasparini等[3]报道的方法进行, 先在低倍镜(×40)下观察每例切片中3个血管密度最高区域即所谓血管热点区, 再在高倍视野(×200)下计数三个视野的阳性血管数, 取其平均值作为MVD值.
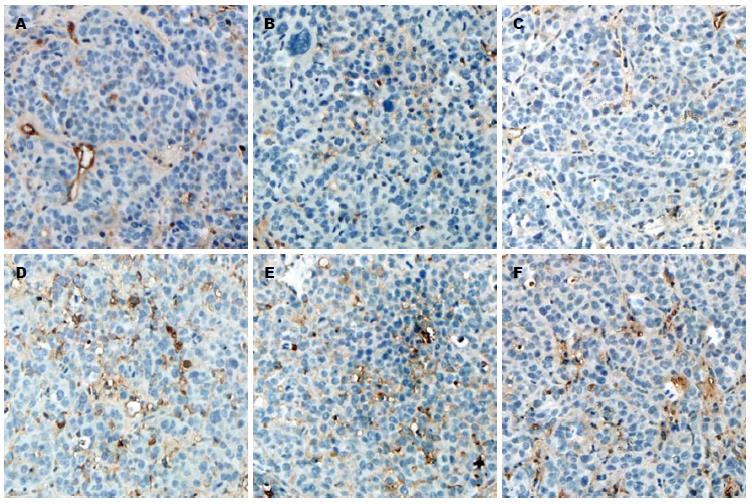
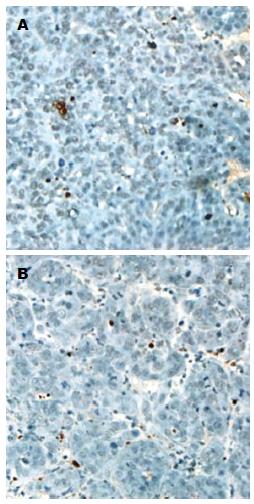
CD3、CD4、CD8、FoxP3免疫组织化学检测按照说明书进行, 采用小鼠单克隆抗体(eBioscience公司), FoxP3抗体稀释度为1:300, CD3抗体稀释度为1:300, CD4、CD8抗体稀释度为1:100. 判断标准: CD3+、CD4+及CD8+ T细胞以细胞膜、细胞质出现棕黄色染色为阳性细胞, Foxp3以细胞核出现棕黄色着色判断为阳性细胞, 随机选择10个高倍视野(×200)计数阳性细胞, 计算平均每个视野阳性细胞数, 结果以"阳性细胞个数/hpf"表示.
统计学处理 计量资料以mean±SD表示, 组间比较采用方差分析(LSD法), 统计学分析使用SPSS13.0软件, P<0.05差异具有统计学意义.
微血管主要见于肿瘤坏死区周边, 单纯碘油化疗栓塞组, 残余肿瘤的血管较丰富, MVD值达28.0/hpf±3.48/hpf, 较对照组(23.5/hpf±4.44/hpf)升高(P<0.05). 而基因治疗组(单纯基因治疗组和基因治疗联合化疗栓塞组), MVD值均显著下降, 分别为19.7/hpf±2.60/hpf和16.3/hpf±2.26/hpf, 两个基因治疗组之间无明显差异(P>0.05)(图1).
淋巴细胞浸润如表1所示, IL-12基因治疗后CD3+、CD4+、CD8+ T淋巴细胞浸润明显增加, 两个基因治疗组之间差异不显著(图2).
作为一种姑息性治疗手段, TACE广泛应用于不能手术切除的中晚期肝癌[4]. 近年来大量证据[5,6]表明, TACE治疗可以造成肿瘤坏死及萎缩, 但因其治疗的不彻底性, 残存的肿瘤细胞在以缺氧为特征的肿瘤微环境中会上调低氧诱导因子-1(hypoxia inducible factor-1, HIF-1)的表达, 进而诱导下游细胞因子的表达, 从而形成对放化疗的抵抗, 具有更强的侵袭性、转移性, 以及遗传不稳定性. 这些细胞表型发生转变的残存肿瘤, 在缺氧环境中继续生存并生长, 成为肿瘤复发和转移的根源. 因此, TACE单独治疗难以根治肝癌, 有必要联合其他手段来治疗.
IL-12是研究较多且被认为具有广阔前景的抗肿瘤细胞因子, 研究[7]表明, IL-12一方面可以促进Th1型免疫反应, 并且能够保进具有调节细胞死亡的的效应子, 如CD4+、CD8+ T细胞及NK细胞与巨噬细胞等向肿瘤的渗透[8,9]; 另一方面, IL-12可以活化NK细胞、NKT细胞等, 这些活化的细胞分泌IFN-γ, 通过调节其下游细胞因子IP-10, 来下调血管内皮生长因子(vascular endothelial growth factor, VEGF)及转化生长因子-β(transforming growth factor-β, TGF-β), 进而抑制肿瘤血管生成[10,11]. 在我们的前期工作中[1], 我们研究了动脉内IL-12基因治疗联合TACE对VX2肝癌的抗肿瘤作用, 结果显示, 相较于TACE或动脉内IL-12基因灌注单独治疗, 两者联合应用可以明显促进肿瘤细胞凋亡, 并且降低肿瘤生长速率. 然而, 在我们的研究中, 仅有2例显示肿瘤缩小, 而大部分肿瘤只是生长速度减慢. 在本研究中, 我们采用免疫组织化学法进一步分析IL-12基因治疗后的肿瘤微血管密度, CD3+、CD4+、CD8+效应性T细胞, 以及以Foxp3+细胞为代表的调节性T细胞等, 以探索IL-12基因治疗的机制, 及可能影响其治疗效果的因素, 以期为进一步提高肝癌的辅助治疗效果提供新思路.
血管生成在肿瘤生长及远处转移中发挥极其重要的作用, MVD是反应血管生成的指标, 他与包括肝癌在内的众多肿瘤的预后之间有着明显的相关性[12]. 本研究中, 与对照组和化疗栓塞组相比, 两个基因治疗组(单独基因治疗组及联合治疗组)MVD值明显下降, 而两个基因治疗组之间无明显差异, 这提示IL-12基因治疗具有抗肿瘤血管生成的作用.
效应性T细胞介导的细胞免疫在抗肿瘤免疫效应中发挥非常重要的作用[13], CD8+ T细胞水平与肿瘤的预后呈正相关[14], 高水平CD3+、CD8+细胞往往预示高生存率[15]. 在本研究中, 我们检测了不同治疗组CD3+、CD4+及CD8+ T淋巴细胞浸润情况, 结果显示IL-12基因治疗后于肿瘤组织中CD3+、CD4+及CD8+ T淋巴细胞明显高于对照组及化疗栓塞组, 而两个基因治疗组(单纯基因治疗及联合治疗组)之间差异无统计学意义, 这提示IL-12基因治疗可以促进效应性T淋巴细胞浸润, 这与Chan等[7]的研究结果一致.
调节性T细胞(regulatory T cells, Treg Cells)是一种具有免疫调节功能的成熟T细胞亚群[16,17], 以组成性表达CD25、PD-1、CTLA-4、FoxP3等标志分子为特征的Treg细胞在肿瘤的外周围免疫耐受中发挥重要的作用[18-21], 其中最重要也是目前研究较多的为FoxP3, 他是控制Treg细胞发育及其功能效应的关键因子[22]. Huang等[23]的研究表明, 对于较大的肿瘤往往伴有调节性T细胞浸润, 而这些细胞的存在可能会降低免疫治疗的效果. 我们采用免疫组织化学法分析了VX2肝癌组织中的FoxP3阳性细胞, 以评价Treg细胞介导的免疫抑制机制是否会影响IL-12的疗效. 我们观察到对照组(1组)可以检测出Foxp3+细胞, 化疗栓塞后VX2肝癌Foxp3+细胞计数明显增高, 基因治疗前后Foxp3+细胞变化不明显, 这些结果提示, VX2肝癌中存在有Foxp3+调节性T细胞, 而化疗栓塞后Foxp3+细胞增多, IL-12基因治疗并不能清除这些调节性T细胞.
综合我们的研究结果, 可以得出如下结论: 在VX2肝癌动物模型中, IL-12主要通过诱导细胞凋亡、诱导淋巴细胞浸润及抑制肿瘤血管生成来发挥抗肿瘤作用, 然而, 存在于肿瘤环境中的调节性T细胞, 以及化疗栓塞本身诱导的调节性T细胞等, 可能会限制IL-12的免疫杀伤作用, 这可以部分解释IL-12基因治疗在VX2肝癌模型中抗肿瘤作用不够强大的原因. 我们推测, 如果联合一种可以清除这些调节性T细胞的治疗手段, 将有可能产生更为强大的抗肿瘤作用.
然而需要指出的是, VX2肝癌模型因其血供特点决定他适合用于进行动脉内介入治疗, 但他是一种移植性肿瘤, 与人原发性肝癌这种自发性肿瘤相比, 生物学行为不尽相同, 因此由该动物模型得出的结论尚不能简单用于人肝癌的辅助治疗, 有必要使用更为合适的动物模型来探索联合治疗方案.
化疗栓塞后残存的肿瘤细胞在以缺氧为特征的肿瘤微环境中发生细胞转变, 具有更强的侵袭性、转移性, 以及遗传不稳定性, 成为肿瘤复发和转移的根源, 肝动脉化疗栓塞(transcatheter arterial chemoembolization, TACE)联合基因治疗有望产生更强大的抗肿瘤作用.
孙星, 副教授, 副主任医师, 上海交通大学附属第一人民医院普外科
IL-12在多种实体肿瘤中表现出强大的抗肿瘤作用, 但近年来研究表明, 较大的肿瘤中存在着以表达CD25、PD-1、CTLA-4、FoxP3等标志分子为特征的调节性T细胞, 而反复免疫治疗能促进这些抑制性细胞表达, 这些抑制性细胞的存在可能会影响免疫治疗的疗效. 肝癌化疗栓塞后是否会促进这些细胞的表达, 目前尚未见相关文献报道.
IL-12基因治疗可以抑制化疗栓塞后肿瘤血管生成, 并且诱导CD3+、CD4+、CD8+效应性T细胞向肿瘤浸润, 但存在于肿瘤中以及化疗栓塞后高表达的FoxP3+调节性T细胞可能会阻碍其抗肿瘤作用.
对于化疗栓塞后肝癌, IL-12基因治疗联合一种可以清除FoxP3+等调节性T细胞的治疗手段, 将有可能产生更为强大的抗肿瘤作用.
免疫微环境: 以免疫效应细胞和分子以及免疫抑制性细胞和分子为特征的肿瘤微环境, 对于肿瘤的发生、发展和临床转归具有重要作用, 对于肿瘤的预后诊断具有重要意义.
本文通过研究IL-12基因治疗对介入栓塞后兔VX2肝癌模型的肿瘤微环境影响, 证明IL-12基因治疗可以抑制肿瘤血管生成, 并且诱导CD3+、CD4+、CD8+效应性T细胞浸润. 本研究内容较新颖, 在前期基础上进一步深入, 具有较好的科研性和理论价值.
编辑: 郭鹏 电编: 都珍珍
| 1. | Xia X, Li X, Feng G, Zheng C, Liang H, Zhou G. Intra-arterial interleukin-12 gene delivery combined with chemoembolization: anti-tumor effect in a rabbit hepatocellular carcinoma (HCC) model. Acta Radiol. 2013;54:684-689. [PubMed] [DOI] |
| 2. | 夏 向文, 李 欣, 冯 敢生, 郑 传胜, 梁 惠民, 柳 曦, 熊 斌. 介入途径下中药白芨提取物作为基因递送载体的可行性. 世界华人消化杂志. 2009;17:1832-1835. [DOI] |
| 3. | Gasparini G, Harris AL. Clinical importance of the determination of tumor angiogenesis in breast carcinoma: much more than a new prognostic tool. J Clin Oncol. 1995;13:765-782. [PubMed] |
| 4. | Xu L, Peng ZW, Chen MS, Shi M, Zhang YJ, Guo RP, Lin XJ, Lau WY. Prognostic nomogram for patients with unresectable hepatocellular carcinoma after transcatheter arterial chemoembolization. J Hepatol. 2015;63:122-130. [PubMed] [DOI] |
| 5. | Liang B, Zheng C, Feng G, Wu H, Wang Y, Zhao H, Li X, Qian J, Liang H. Experimental evaluation of inhibitory effect of 10-hydroxycamptothecin on hypoxia-inducible factor-1α expression and angiogenesis in liver tumors after transcatheter arterial embolization. J Vasc Interv Radiol. 2010;21:1565-1572. [PubMed] [DOI] |
| 7. | Chan SF, Wang HT, Huang KW, Torng PL, Lee HI, Hwang LH. Anti-angiogenic therapy renders large tumors vulnerable to immunotherapy via reducing immunosuppression in the tumor microenvironment. Cancer Lett. 2012;320:23-30. [PubMed] [DOI] |
| 8. | Yin X, Yan X, Yang Q, Cao H, Liang H. Antitumor mechanism of recombinant murine interleukin-12 vaccine. Cancer Biother Radiopharm. 2010;25:263-268. [PubMed] [DOI] |
| 9. | Kalams SA, Parker SD, Elizaga M, Metch B, Edupuganti S, Hural J, De Rosa S, Carter DK, Rybczyk K, Frank I. Safety and comparative immunogenicity of an HIV-1 DNA vaccine in combination with plasmid interleukin 12 and impact of intramuscular electroporation for delivery. J Infect Dis. 2013;208:818-829. [PubMed] [DOI] |
| 10. | Oshikawa K, Rakhmilevich AL, Shi F, Sondel PM, Yang N, Mahvi DM. Interleukin 12 gene transfer into skin distant from the tumor site elicits antimetastatic effects equivalent to local gene transfer. Hum Gene Ther. 2001;12:149-160. [PubMed] [DOI] |
| 11. | Nanni P, Nicoletti G, De Giovanni C, Landuzzi L, Di Carlo E, Cavallo F, Pupa SM, Rossi I, Colombo MP, Ricci C. Combined allogeneic tumor cell vaccination and systemic interleukin 12 prevents mammary carcinogenesis in HER-2/neu transgenic mice. J Exp Med. 2001;194:1195-1205. [PubMed] [DOI] |
| 12. | Liao XF, Yi JL, Li XR, Deng W, Yang ZF, Tian G. Angiogenesis in rabbit hepatic tumor after transcatheter arterial embolization. World J Gastroenterol. 2004;10:1885-1889. [PubMed] [DOI] |
| 13. | 叶 韵斌, 彭 峰, 李 洁羽, 林 丽平, 郑 雄伟, 周 东, 力 超, 黎 巧连, 蔡 晓雯. 肝细胞肝癌组织浸润性淋巴细胞及其因子的表达. 细胞与分子免疫学杂志. 2011;27:1056-1060. |
| 14. | Flecken T, Schmidt N, Hild S, Gostick E, Drognitz O, Zeiser R, Schemmer P, Bruns H, Eiermann T, Price DA. Immunodominance and functional alterations of tumor-associated antigen-specific CD8+ T-cell responses in hepatocellular carcinoma. Hepatology. 2014;59:1415-1426. [PubMed] [DOI] |
| 15. | Gooden MJ, de Bock GH, Leffers N, Daemen T, Nijman HW. The prognostic influence of tumour-infiltrating lymphocytes in cancer: a systematic review with meta-analysis. Br J Cancer. 2011;105:93-103. [PubMed] [DOI] |
| 17. | Li J, Qiu SJ, She WM, Wang FP, Gao H, Li L, Tu CT, Wang JY, Shen XZ, Jiang W. Significance of the balance between regulatory T (Treg) and T helper 17 (Th17) cells during hepatitis B virus related liver fibrosis. PLoS One. 2012;7:e39307. [PubMed] [DOI] |
| 18. | Jie HB, Gildener-Leapman N, Li J, Srivastava RM, Gibson SP, Whiteside TL, Ferris RL. Intratumoral regulatory T cells upregulate immunosuppressive molecules in head and neck cancer patients. Br J Cancer. 2013;109:2629-2635. [PubMed] [DOI] |
| 19. | Wang B, Li B, Dai Z, Ren S, Bai M, Wang Z, Li Z, Lin S, Wang Z, Huang N. Low-dose splenic radiation inhibits liver tumor development of rats through functional changes in CD4+CD25+Treg cells. Int J Biochem Cell Biol. 2014;55:98-108. [PubMed] [DOI] |
| 20. | Kryczek I, Liu R, Wang G, Wu K, Shu X, Szeliga W, Vatan L, Finlayson E, Huang E, Simeone D. FOXP3 defines regulatory T cells in human tumor and autoimmune disease. Cancer Res. 2009;69:3995-4000. [PubMed] [DOI] |
| 21. | Kalathil S, Lugade AA, Miller A, Iyer R, Thanavala Y. Higher frequencies of GARP(+)CTLA-4(+)Foxp3(+) T regulatory cells and myeloid-derived suppressor cells in hepatocellular carcinoma patients are associated with impaired T-cell functionality. Cancer Res. 2013;73:2435-2444. [PubMed] [DOI] |
| 23. | Huang KW, Wu HL, Lin HL, Liang PC, Chen PJ, Chen SH, Lee HI, Su PY, Wu WH, Lee PH. Combining antiangiogenic therapy with immunotherapy exerts better therapeutical effects on large tumors in a woodchuck hepatoma model. Proc Natl Acad Sci U S A. 2010;107:14769-14774. [PubMed] [DOI] |