修回日期: 2015-11-26
接受日期: 2015-12-07
在线出版日期: 2016-01-08
目的: 观察甘露糖受体(mannose receptor, MR)在肝细胞癌组织/肝癌细胞系中的表达, 探讨其与肝细胞癌发生、发展及恶性程度的关系.
方法: 应用免疫组织化学检测50例肝细胞癌组织及癌旁组织、10例正常肝组织中MR的表达, 免疫荧光法、Western blot法检测肝癌细胞系、肝细胞系中MR的表达.
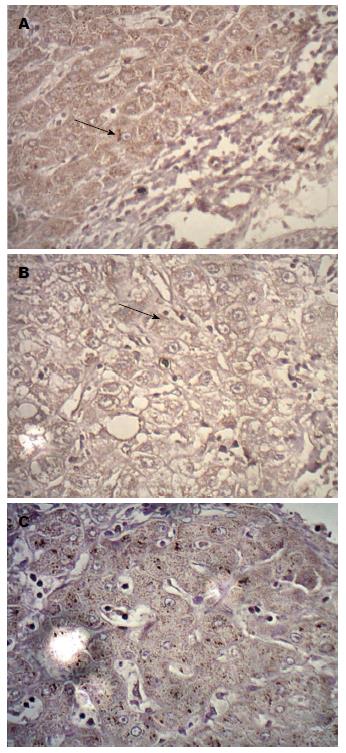
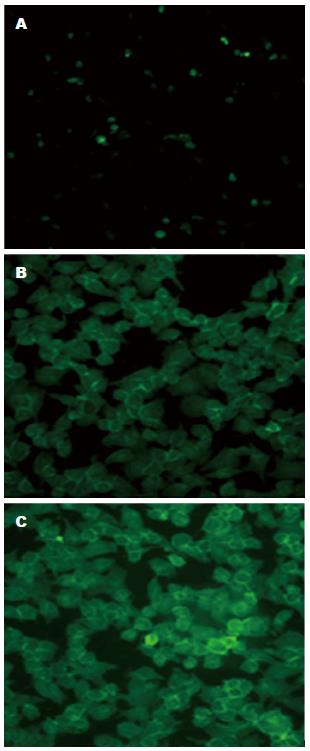
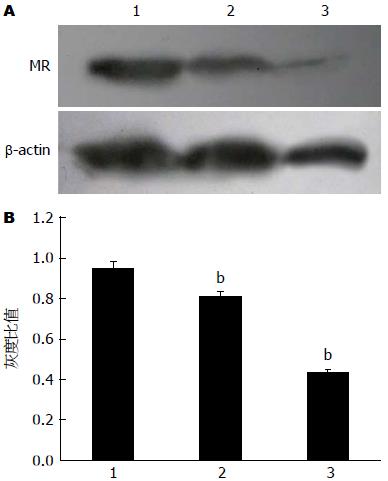
结果: 免疫组织化学染色: 肝细胞癌组织中MR的表达水平明显高于癌旁组织及正常肝组织(86% vs 76%, 30%, P<0.05). 免疫荧光: MR在肝癌细胞系BEL-7402、HepG2和人肝细胞系HL-7702中均有表达. 在肝癌细胞系BEL-7402、HepG2上有很强的MR表达, 在肝细胞系HL-7702上MR的表达分布明显较少. Western blot法: MR在肝癌细胞系HepG2、BEL-7402和人肝细胞系HL-7702上均有表达, 肝癌细胞BEL-7402中MR的表达水平明显高于肝癌细胞HepG2(P<0.01)、肝细胞HL-7702(P<0.01).
结论: MR在肝细胞癌组织/肝癌细胞系中高表达提示可能与肝细胞癌的发生、发展及恶性程度密切相关.
核心提示: 本文使用免疫组织化学法、免疫荧光法及Western blot法检测肝细胞癌组织/肝癌细胞系中甘露糖受体(mannose receptor, MR)的表达, 结果显示, MR在恶性程度高的组织和细胞系中表达强度高. 提示MR的表达与肝细胞癌的发生、发展有密切关系, 并且肝细胞癌的恶性程度可能与MR的表达呈正相关.
引文著录: 郭林娜, 高恒宇, 何苗, 刘丹. 甘露糖受体在肝细胞癌中的表达及意义. 世界华人消化杂志 2016; 24(1): 37-43
Revised: November 26, 2015
Accepted: December 7, 2015
Published online: January 8, 2016
AIM: To detect the expression of mannose receptor (MR) in hepatocellular carcinoma tissues and hepatocellular carcinoma cell lines, and to analyze the relationship between MR expression and the occurrence, development and malignancy of hepatocellular carcinoma.
METHODS: Immunohistochemical method was used to detect the expression of MR in 50 hepatocellular carcinoma tissues, matched tumor adjacent tissues and 10 normal liver tissues. Immunofluorescence and Western blot were used to assay the expression of MR in hepatocellular carcinoma cell lines and a normal liver cell line.
RESULTS: By immunohistochemistry, it was found that MR expression was significantly higher in hepatocellular carcinoma tissues than in tumor adjacent tissues (86% vs 76%, P < 0.05) and normal liver tissues (86% vs 30%, P < 0.01). Immunofluorescence showed that MR was highly expressed in hepatocellular carcinoma cell lines BEL-7402 and HepG2, but lowly expressed in the human liver cell line HL-7702. Western blot analysis indicated that MR expression was significantly higher in BEL-7402 cells than in HepG2 cells (P < 0.01) and HL-7702 cells (P < 0.01).
CONCLUSION: MR is highly expressed in hepatocellular carcinoma tissues and hepatocellular carcinoma cell lines, and the expression of MR is significantly associated with the occurrence, development and malignancy of hepatocellular carcinoma.
- Citation: Guo LN, Gao HY, He M, Liu D. Significance of expression of mannose receptor in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2016; 24(1): 37-43
- URL: https://www.wjgnet.com/1009-3079/full/v24/i1/37.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i1.37
肝细胞癌(hepatocellular carcinoma, HCC)是一种恶性程度极高的消化系恶性肿瘤, 是全世界癌症死亡的第3大原因[1]. 在世界上发病率不断上升, 有60%的患者就诊时已是中晚期, 手术治愈率极差, 5年生存率仅为0%-10%[2,3]. 因此, 寻找组织特异性强的诊断指标、治疗靶点成为目前肝癌研究的热点之一. 甘露糖受体(mannose receptor, MR)作为一种模式识别受体主要表达于巨噬细胞及树突细胞[4,5]等免疫细胞表面, 也称CD206, 也可以用作巨噬细胞的分型[6]. 学者们在阴道上皮细胞[7]、星形胶质细胞[8]等细胞上也发现了MR的表达, 目前已证明MR在胰腺癌细胞[9]、结肠癌[10]等多种肿瘤细胞中都有表达, 本研究主要检测MR在HCC组织/肝癌细胞系中的表达, 初步探讨其与肝癌的发生、发展、恶性程度的关系, 为诊断及治疗提供新的靶点.
选取2003-01/2014-01在大庆油田总院和齐齐哈尔医学院病理中心手术切除并病理证明为HCC的存档蜡块标本53例, 其中男性36例, 女性17例, 平均年龄51.41岁±7.37岁, 从中选取50例蜡块切取癌组织、癌旁组织. 同时取病理检查确认为正常的肝组织10例为对照组. CD206人抗兔单克隆抗体购自Proteintech公司; 内参蛋白、二抗、浓缩型DAB试剂盒购自北京中杉金桥生物技术有限公司.
1.2.1 SP法免疫组织化学染色: 由病理科技师切片, 取4 µm厚的组织切片, 铺平, 常规脱蜡至水, 组织切片脱水之前于60 ℃的烤片机上烘烤过夜. 第2天自烤片机中取出组织切片, 梯度乙醇脱水, 取出组织切片放入PBS缓冲液中, 洗3次, 每次5 min. 0.3%H2O2 37 ℃恒温箱中孵育30 min, 以阻断内源性过氧化物酶. PBS冲洗5 min×3次, 0.01%柠檬酸盐缓冲液抗原修复, 高压2 min, 自然冷却至室温. PBS冲洗5 min×3次, 滴加一抗, 4 ℃过夜. PBS冲洗5 min×3次, 滴加二抗, 室温孵育30 min. PBS冲洗5 min×3次, DAB显色, 苏木素复染, 中性树胶封片, 光镜观察. PBS代替一抗作为阴性对照.
1.2.2 细胞培养: 取冻存在-80 ℃的肝癌细胞系复苏培养, HepG2和BEL-7402在含10%胎牛血清的DMEM培养基中培养, 人肝细胞系HL-7702用含20%胎牛血清的1640培养基培养, 且含100 U/mL的青霉素和100 µg/mL的链霉素, 在37 ℃ 50 mL/L CO2饱和湿度的培养箱中培养, 2 d换液1次, 3 d左右传代1次, 并取对数生长期的细胞做以下实验.
1.2.3 荧光免疫检测: 分别取对数生长期的BEL-7402、HepG2和HL-7702 3种细胞制备成细胞悬液, 调整细胞浓度为5×106/mL种植于载玻片上, 在37 ℃ 50 mL/L CO2饱和湿度的培养箱中培养48 h. 4%多聚甲醛固定, 用含5%胎牛血清的PBS做细胞封闭, 滴加一抗室温下作用2 h, PBS冲洗5 min×3次, 滴加异硫氰酸荧光素结合的二抗, PBS冲洗5 min×3次, 95%甘油封片, 荧光免疫显微镜下进行观察, 拍照.
1.2.4 细胞裂解: 取对数生长期的肝癌细胞系HepG2、BEL-7402和人肝细胞系HL-7702, PBS洗涤细胞2次, 0.25%的胰酶消化细胞, 收集至1.5 mL的EP管内, 向EP管内加入100 µL细胞裂解液(裂解液与蛋白酶抑制剂的混合物)冰上裂解30 min, 4 ℃ 14000 g离心10 min, 取上清分别装入1.5 mL的EP管内并做好体积、分组情况等标记.
1.2.5 蛋白定量: 将0.5 mg/mL蛋白标准品稀释品按0、1、2、4、8、16 µL加入96孔板上, 样品蛋白肝癌细胞系HepG2、BEL-7402和人肝细胞系HL-7702按每孔2 µL加入96孔板内, 每组设3个复孔, 各孔用0.9%生理盐水补足至20 µL, 每孔加入BCA 200 µL, 混匀后, 室温孵育2 h, 置于自动酶标仪中检测570 nm的吸光度(A)值, 利用A值与浓度之间的关系, 绘制标准曲线, 计算出样品的蛋白浓度, 加1×上样缓冲液, 然后用细胞裂解液调整样品蛋白浓度为1.8 µg/µL, 100 ℃加热5 min, 冷却后混匀, -20 ℃保存.
1.2.6 Western blot检测: 按抗体分子量要求配置8%的分离胶和5%的浓缩胶, 每孔18 µL蛋白样品上样, 电泳电压为110 V, 时间为2 h, 转膜电压设置为70 V, 时间为90 min, 5%脱脂奶粉封闭1 h, 丽春红染色3 min, TBS冲膜5 min×3次, 加一抗(1:500)4 ℃过夜, TBST洗膜5 min×3次, 滴加二抗(1:2000)室温孵育2 h, 进行ECL发光, 显影, 定影, 图像灰度分析用Photoshop软件.
1.2.7 结果判断: 具体方法[11,12]为在显微镜下观察切片, 随机选取5个不同的视野, 阳性结果呈棕黄色颗粒, 分别记录每个视野的阳性细胞数量, 计算其平均值: (1)阳性细胞数<10%或无阳性细胞表达为0分; (2)阳性细胞数<25%或多数阳性细胞显色较弱为1分; 强阳性细胞数占25%-75%为2分; (3)强阳性细胞数>75%为3分. 并对细胞着色情况评分, 细胞不着色为1分, 着色浅棕色为2分, 着色深棕色为3分, 将切片着色得分与阳性细胞数得分相乘得数定为阳性系数, 0分为阴性(-), 1-4分为弱阳性(+), 4-9分为强阳性(++).
统计学处理 采用SPSS17.0进行统计学分析, 对两组间均数比较采用t检验、计数资料用SNK-q检验. P<0.05为差异显著有统计学意义.
免疫组织化学检测结果显示, 43例HCC组织、38例癌旁组织及3例肝组织中检测到MR的表达, 表现为位于细胞胞质内或胞内的棕黄色颗粒(图1). 3例正常肝组织中, 见少量的MR阳性表达. MR在3种组织中的阳性表达率分别为86%、76%、30%(表1), 3组之间进行分析有统计学意义(P<0.05).
免疫荧光染色法检测结果显示: 甘露糖受体染色阳性的结果为黄绿色, 根据图2可以看到甘露糖受体在肝癌细胞系BEL-7402、HepG2和人肝细胞系HL-7702中均有表达. 但在肝癌细胞系BEL-7402、HepG2上可见有非常典型的很强的甘露糖受体分布表达, 而在肝细胞系HL-7702上甘露糖受体的表达分布明显较低.
通过Western blot检测甘露糖受体在肝癌细胞系HepG2、BEL-7402和人肝细胞系HL-7702上均有表达, 在各个细胞系的相对表达量由高向低为肝癌细胞系BEL-7402、HepG2及人肝细胞系HL-7702; 甘露糖受体在HepG2、BEL-7402两个肝癌细胞系上的表达均较正常肝细胞系HL-7702上的表达高, 而甘露糖受体在HepG2、BEL-7402两个肝癌细胞系上的表达情况进行比较, 得出MR在肝癌细胞系BEL-7402中的相对表达量高于在肝癌细胞系HepG2上的表达(图3).
HCC是一种多基因多途径致病、病情隐匿、恶性程度极高、发展速度快、生存率低、发现晚的疾病, 发现为多中晚期[13]. 从肝癌的治疗角度来看, 手术切除率不到20%[14], 或经肝动脉栓塞化疗, 局部消融和放疗等, 但总体疗效差[15]. 而且以化疗药物为主的治疗, 其白细胞下降、恶心呕吐等全身反应特别明显, 治疗效果亦不佳, 所以寻找肝癌诊断和治疗的新靶点已经成为了肝癌诊治研究的热点之一, 本研究对MR在HCC中的表达情况进行分析, 为肝癌靶向药物的研究提供依据, 进而增加药物的组织特异性, 减少药物的全身反应.
MR为Ⅰ型跨膜蛋白受体, 是一大小为175 kDa的跨膜糖蛋白, MR是20世纪70年代作为MR家族成员之一第一个被发现, 其被称为糖识别受体可通过胞外区识别和结合特定的糖类分子, 在不同的多糖分子中以甘露糖、岩藻糖与甘露糖受体结合能力最强, 其次为葡萄糖、N-乙酰葡萄胺, 半乳糖则不能与之结合[5,16]. MR作为糖识别受体被广泛应用, 利用多糖与甘露糖受体结合及巨噬细胞表达甘露糖受体这一特性. 田维毅等[17]建立了筛选中药复方的巨噬细胞甘露糖受体模型, 用于筛选四物汤等6个复方多糖中的MR结合成分, 确定了四君子汤、六味地黄汤和玉屏风散等3种复方多糖可能通过与MR结合发挥药理活性. 帅小雪等[18]证明灵芝多糖可以通过甘露糖受体影响巨噬细胞的免疫调节作用. 江泽波等[19]亦证明猪苓多糖通过MR对巨噬细胞的免疫作用起到双向调节作用. 本实验证实肝癌细胞上也有MR的表达, 所以, 我们可以推测, 多糖类药亦可以通过与MR结合, 对肝癌细胞起到相应的作用. 另外, 关于MR更多的是免疫方面的研究, 研究[20-23]证明MR在病原体感染、识别、吞噬及清除等过程中发挥着十分的重要作用. 根据此方面研究结果, 我们也可以认为MR在肝癌组织上表达, 通过免疫调节方面起到抗肿瘤的作用. 汪炳瑞等[9]利用铜绿假单胞菌的多糖菌毛可以特异性识别甘露糖受体的特性, 对铜绿假单胞菌对胰腺癌细胞的抑制效应及分子机制进行研究, 证明该药可通过MR这一靶点促进胰腺癌细胞SW1990、PANC-1凋亡. 有研究证明MR与纤维化疾病也存在相关性, López-Guisa等[24]指出MR2存在能减轻肾纤维化的程度, 肝纤维化过程中MR的表达呈逐渐上升的趋势[25,26], Gai等[27]也发现在HCC上有MRC2表达, 在肝癌的靶向治疗的研究中也多次把甘露糖受体作为研究对象提出[26]. Movahedi等[28]发现在缺氧时, 肿瘤区前血管TAM的MR高表达, 选择MR靶向沉默的TAM既可以抑制肿瘤的生长. Keler等[29]研究利用MR靶向疫苗治疗肿瘤. 还有研究[30,31]证明MR与肿瘤的淋巴管转移相关. 有文献报道[9,32], PA-MSHA通过识别MR, 抑制肿瘤细胞上受体EGFR的活化, 继而抑制肿瘤细胞增殖并诱导其凋亡. 因此, 如果可以证实HCC上有丰富的甘露糖受体表达, 并随着肝癌的恶性程度提高表达量也进一步提高, 那么我们就可以把MR作为HCC的治疗靶点提出, 基于此目的本研究主要检查MR在肝癌组织及细胞中的表达, 证明MR表达与肝癌的发生、发展及恶性程度的关系, 为肝癌诊断和治疗提供新的靶点. 本研究利用免疫组织化学方法观察了甘露糖受体在HCC中的表达情况, 其在肝癌组织中的表达水平高于其在癌旁组织中的表达, 癌旁组织内的表达水平高于正常肝组织, 三者统计学分析有明显差异, 证明其可能与HCC的发生、发展及恶性程度有关. 另外, MR在肝癌中高表达使其成为肝癌治疗靶点筛选的潜在指标. Western blot检测、免疫荧光染色法检测肝癌细胞系HepG2、BEL-7402上MR的表达情况明显高于人肝细胞系HL-7702, 且在恶性程度较高. 肝癌细胞系BEL-7402内的表达水平高于肝癌细胞系HepG2的表达, 为筛选甘露糖受体敏感型药提供了实验室支持. 根据此项研究结果我们可以推测: 甘露糖受体的表达与HCC的发生、发展有密切关系, 并且HCC的恶性程度可能与甘露糖受体的表达呈正相关的.
总之, MR在肝癌组织内部有较高的表达, 而在癌旁组织表达较低, 正常肝组织中表达最低, 因此, 推测其可能与肝癌的发生、发展有关, 可以发展成为HCC治疗和诊断的新靶点. 下一步我们将进行分子生物学及基因干扰等方面的实验, 进一步证实MR与肝癌发生发展的关系. 为肝癌的诊断筛选出新的标志物、为肝癌的治疗提供新靶点, 为临床诊断治疗奠定理论基础.
肝癌是我国常见的恶性肿瘤, 全世界每年新增肝癌约为26万例, 而42.5%的肝癌分布在中国. 寻找肝细胞癌的治疗和诊断的靶点就成为研究的热点, 而甘露糖受体(mannose receptor, MR)作为识别受体可以作为治疗的靶点.
张毅, 教授, 主任医师, 郑州大学第一附属医院生物细胞治疗中心; 曲春枫, 教授, 中国医学科学院肿瘤医院肿瘤研究所分子肿瘤学国家重点实验室
MR作为一种模式识别受体, 已经证明在多种组织中有表达, 但在肝细胞癌中的表达情况报道很少, 本课题主要检测MR在肝细胞癌中表达与肝细胞癌的发生、发展及恶性程度的关系.
目前已经证明MR与胰腺癌、膀胱癌等密切相关, 而在肝癌中的表达研究较少.
MR作为多糖识别受体在肝癌上丰富的表达, 可成为治疗和诊断的靶点.
通过多种方法检测MR在肝细胞癌中的表达, 可以作为肝细胞癌病理诊断的依据.
本文内容祥实, 文字精炼, 研究课题新颖, 提出了一种鉴别肝癌细胞的新方法, 为肝癌的诊断及临床治疗提供了新的靶点, 具有潜在的临床应用前景.
编辑: 郭鹏 电编: 都珍珍
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Dalton-Fitzgerald E, Tiro J, Kandunoori P, Halm EA, Yopp A, Singal AG. Practice patterns and attitudes of primary care providers and barriers to surveillance of hepatocellular carcinoma in patients with cirrhosis. Clin Gastroenterol Hepatol. 2015;13:791-798.e1. [PubMed] [DOI] |
| 3. | Yang JD, Nakamura I, Roberts LR. The tumor microenvironment in hepatocellular carcinoma: current status and therapeutic targets. Semin Cancer Biol. 2011;21:35-43. [PubMed] [DOI] |
| 4. | Gorovits B, Krinos-Fiorotti C. Proposed mechanism of off-target toxicity for antibody-drug conjugates driven by mannose receptor uptake. Cancer Immunol Immunother. 2013;62:217-223. [PubMed] [DOI] |
| 5. | Gazi U, Martinez-Pomares L. Influence of the mannose receptor in host immune responses. Immunobiology. 2009;214:554-561. [PubMed] [DOI] |
| 6. | Liu G, Yang H. Modulation of macrophage activation and programming in immunity. J Cell Physiol. 2013;228:502-512. [PubMed] [DOI] |
| 10. | Höchst B, Schildberg FA, Böttcher J, Metzger C, Huss S, Türler A, Overhaus M, Knoblich A, Schneider B, Pantelis D. Liver sinusoidal endothelial cells contribute to CD8 T cell tolerance toward circulating carcinoembryonic antigen in mice. Hepatology. 2012;56:1924-1933. [PubMed] [DOI] |
| 14. | Llovet JM, Bruix J. Molecular targeted therapies in hepatocellular carcinoma. Hepatology. 2008;48:1312-1327. [PubMed] [DOI] |
| 15. | Lin S, Hoffmann K, Schemmer P. Treatment of hepatocellular carcinoma: a systematic review. Liver Cancer. 2012;1:144-158. [PubMed] [DOI] |
| 20. | Ramirez-Garcia A, Arteta B, Abad-Diaz-de-Cerio A, Pellon A, Antoran A, Marquez J, Rementeria A, Hernando FL. Candida albicans increases tumor cell adhesion to endothelial cells in vitro: intraspecific differences and importance of the mannose receptor. PLoS One. 2013;8:e53584. [PubMed] [DOI] |
| 21. | Liu Z, Ma Y, Moyer MP, Zhang P, Shi C, Qin H. Involvement of the mannose receptor and p38 mitogen-activated protein kinase signaling pathway of the microdomain of the integral membrane protein after enteropathogenic Escherichia coli infection. Infect Immun. 2012;80:1343-1350. [PubMed] |
| 22. | Upham JP, Pickett D, Irimura T, Anders EM, Reading PC. Macrophage receptors for influenza A virus: role of the macrophage galactose-type lectin and mannose receptor in viral entry. J Virol. 2010;84:3730-3737. [PubMed] [DOI] |
| 23. | McDonald B, Jenne CN, Zhuo L, Kimata K, Kubes P. Kupffer cells and activation of endothelial TLR4 coordinate neutrophil adhesion within liver sinusoids during endotoxemia. Am J Physiol Gastrointest Liver Physiol. 2013;305:G797-G806. [PubMed] [DOI] |
| 24. | López-Guisa JM, Cai X, Collins SJ, Yamaguchi I, Okamura DM, Bugge TH, Isacke CM, Emson CL, Turner SM, Shankland SJ. Mannose receptor 2 attenuates renal fibrosis. J Am Soc Nephrol. 2012;23:236-251. [PubMed] [DOI] |
| 25. | Andersen ES, Rødgaard-Hansen S, Moessner B, Christensen PB, Møller HJ, Weis N. Macrophage-related serum biomarkers soluble CD163 (sCD163) and soluble mannose receptor (sMR) to differentiate mild liver fibrosis from cirrhosis in patients with chronic hepatitis C: a pilot study. Eur J Clin Microbiol Infect Dis. 2014;33:117-122. [PubMed] [DOI] |
| 27. | Gai X, Tu K, Lu Z, Zheng X. MRC2 expression correlates with TGFβ1 and survival in hepatocellular carcinoma. Int J Mol Sci. 2014;15:15011-15025. [PubMed] [DOI] |
| 28. | Movahedi K, Schoonooghe S, Laoui D, Houbracken I, Waelput W, Breckpot K, Bouwens L, Lahoutte T, De Baetselier P, Raes G. Nanobody-based targeting of the macrophage mannose receptor for effective in vivo imaging of tumor-associated macrophages. Cancer Res. 2012;72:4165-4177. [PubMed] [DOI] |
| 29. | Keler T, Ramakrishna V, Fanger MW. Mannose receptor-targeted vaccines. Expert Opin Biol Ther. 2004;4:1953-1962. [PubMed] |
| 30. | Irjala H, Alanen K, Grénman R, Heikkilä P, Joensuu H, Jalkanen S. Mannose receptor (MR) and common lymphatic endothelial and vascular endothelial receptor (CLEVER)-1 direct the binding of cancer cells to the lymph vessel endothelium. Cancer Res. 2003;63:4671-4676. [PubMed] |
| 32. | Von Hoff DD, Ramanathan RK, Borad MJ, Laheru DA, Smith LS, Wood TE, Korn RL, Desai N, Trieu V, Iglesias JL. Gemcitabine plus nab-paclitaxel is an active regimen in patients with advanced pancreatic cancer: a phase I/II trial. J Clin Oncol. 2011;29:4548-4554. [PubMed] [DOI] |