修回日期: 2015-11-25
接受日期: 2015-11-30
在线出版日期: 2016-01-08
目的: 探讨姜黄素通过信号传导与转录激活因子3(signal transducer and activator of transcription 3, STAT3)通路对小鼠溃疡性结肠炎(ulcerative colitis, UC)模型的作用, 以及姜黄素对环氧合酶-2(cyclooxygenase-2, COX-2)、过氧化物酶体增殖物激活受体-γ(peroxisome proliferator-activated receptor-γ, PPAR-γ)的影响.
方法: 将♀BALB/c小鼠60只, 随机分为6组, 每组10只. A组: 正常对照组; B组: 模型组; C组: 地塞米松组[1.5 mg/(kg•d)]; L组: 姜黄素低剂量组[25 mg/(kg•d)]; M组: 姜黄素中剂量组[50 mg/(kg•d)]; H组: 姜黄素高剂量组[100 mg/(kg•d)]. 小鼠UC模型采用葡聚糖硫酸钠诱导, 观察小鼠疾病活动指数(disease activity index, DAI)评分, HE染色观察结肠组织学改变以及免疫组织化学测PPAR-γ、STAT3, ELISA测COX-2的表达, Western blot测p-STAT3的表达, 逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR)测STAT3 mRNA的表达.
结果: (1) B组小鼠症状、组织学都符合UC标准, DAI评分和组织学评分均高于A组, C组、L组、M组、H组DAI评分和组织学评分较B组都有不同程度的下降; (2)免疫组织化学显示: B组小鼠结肠PPAR-γ低于A组(23.15±2.33 vs 42.07±3.82, P<0.01); B组小鼠结肠STAT3比A组、C组、L组、M组、H组高(66.36±6.08 vs 28.25±2.84, 29.84±3.32, 45.26±5.42, 29.02±3.28, 21.22±3.30, P<0.01); (3)ELISA显示与B组相比, C组、L组、M组、H组COX-2含量较B组低(P<0.01); (4)Western blot检测显示B组p-STAT3蛋白水平相比A组明显上升, C组、L组、M组、H组水平较B组降低(P<0.05); (5)RT-PCR显示结肠组织STAT3 mRNA的表达: B组STAT3 mRNA表达水平相比A组明显上升, C、L、M、H组水平较B组降低(P<0.05).
结论: (1)STAT3、PPAR-γ可能参与了溃疡性结肠炎的发病; (2)姜黄素治疗小鼠UC模型的机制可能通过提高PPAR-γ的含量, 抑制STAT3信号通路, 减少COX-2的释放, 减轻中性粒细胞的浸润, 从而减轻小鼠结肠黏膜的损伤而达到治疗UC的作用.
核心提示: 姜黄素可能通过阻断信号转导与转录激活因子3转导通路, 抑制炎症因子环氧合酶-2的释放, 提高过氧化物酶体增殖物激活受体-γ的含量, 从而达到减轻炎症而治疗溃疡性结肠炎的目的.
引文著录: 郭琳, 李珏宏, 李昌平, 石蕾, 钟晓琳. STAT3、PPAR-γ在小鼠溃疡性结肠炎的作用及姜黄素的影响. 世界华人消化杂志 2016; 24(1): 28-36
Revised: November 25, 2015
Accepted: November 30, 2015
Published online: January 8, 2016
AIM: To investigate the role of signal transducer and activator of transcription 3 (STAT3) and peroxisome proliferator-activated receptor-γ (PPAR-γ) in the pathogenesis of ulcerative colitis (UC) in mice, and the effect of curcumin on STAT3 pathway, cyclooxygenase-2 (COX-2), and peroxisome proliferator-activated receptor γ (PPAR-γ) in UC.
METHODS: Sixty female BALB/c mice were randomly and equally divided into six groups: A (normal group), B (model group), C [dexamethasone intervention group, 1.5 mg/(kg•d)], L [low dose curcumin group, 25 mg/(kg•d)], M [medium dose curcumin group, 50 mg/(kg•d)], and H (high dose curcumin group, 100 mg/(kg•d)]. UC was induced in mice with dextran sodium sulfate. Disease activity index (DAI) scores were calculated in UC mice. HE staining was performed for observing colonic histological changes. PPAR-γ and STAT3 expression was detected by immunohistochemistry. The expression of COX-2 was detected by ELISA, the expression of p-STAT3 was detected by Western blot, and the expression of STAT3 mRNA was detected by RT-PCR.
RESULTS: Mice in group B showed symptoms and histological changes consistent with UC standards. DAI and histological scores in group B were higher than those in group A, but compared with group B, DAI and histological scores in groups C, L, M and H showed varying degrees of decrease. Immunohistochemical results showed that the expression of PPAR-γ in mouse colon in group B was lower than that in group A (23.15 ± 2.33 vs 42.07 ± 3.82, P < 0.01). The expression of STAT3 in mouse colon in group B was significantly higher than that in groups A, C, L, M and H (66.36 ± 6.08 vs 28.25 ± 2.84, 29.84 ± 3.32, 45.26 ± 5.42, 29.02 ± 3.28, 21.22 ± 3.30, P < 0.01). The expression of COX-2 in mouse colon in groups C, L, M and H was lower than that in group B (P < 0.01). The expression of p-STAT3 in mouse colon in group B was significantly higher than that in group A, but lower than that in groups C, L, M and H (P < 0.05). The expression of STAT3 mRNA in mouse colon in group B was significantly higher than that in group A, but lower than that in groups C, L, M and H (P < 0.05).
CONCLUSION: STAT3 and PPAR-γ may participate in the pathogenesis of UC. The mechanism of curcumin for treating UC may be through increasing the expression of PPAR-γ, inhibiting STAT3 signaling pathway, reducing the release of COX-2, decreasing neutrophil infiltration and thus attenuating colonic mucosa damage.
- Citation: Guo L, Li JH, Li CP, Shi L, Zhong XL. Role of STAT3 and PPAR-γ in pathogenesis of UC: Implications for therapeutic effect of curcumin. Shijie Huaren Xiaohua Zazhi 2016; 24(1): 28-36
- URL: https://www.wjgnet.com/1009-3079/full/v24/i1/28.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i1.28
溃疡性结肠炎(ulcerative colitis, UC)是一种病因尚不十分清楚的直肠和结肠慢性非特异性炎症性疾病, 属于炎症性肠病(inflammatory bowel disease, IBD)之一[1]. 在过去二十年中流行病学显示UC和克罗恩病在亚洲国家患病率增加[2], 多种因素与溃疡性结肠炎有密切关系, 如改变的生活方式、改良的健康方式、改良的卫生和工业化等[3].
UC主要药物治疗有氨基水杨酸制剂, 但此类药物不良反应多, 且临床疗效不甚令人满意, 而5-ASA新型制剂不良反应明显减少, 缺点是价格昂贵, 因此需要研发既能更好地对UC起良好疗效, 同时不良反应少且经济实惠的新药. 姜黄素是从姜科植物姜黄中提取的一种色素, 研究[4]证明他具有抗氧化、抗炎、抗凝、降脂、抗动脉粥样硬化、抗衰老消除自由基及抑制肿瘤生长等作用. 本研究拟通过对正常小鼠、葡聚糖硫酸钠(dextran sulfate sodium, DSS)模型小鼠各组治疗前后的生物行为、病理学、免疫组织化学、分子生物学研究, 测定过氧化物酶体增殖物激活受体-γ(peroxisome proliferator-activated receptor-γ, PPAR-γ)蛋白、环氧合酶-2(cyclooxygenase-2, COX-2)蛋白、信号传导与转录激活因子3(signal transducer and activator of transcription 3, STAT3) mRNA、p-STAT3蛋白的表达, 观察PPAR-γ、COX-2、STAT3在UC发病中的作用以及姜黄素对UC的干预作用, 探讨姜黄素治疗UC的可能机制, 为开发治疗UC的中药打下理论基础.
60只♀BALB/C小鼠, 鼠龄: 7-10 wk, 体质量: 15-25 g(重庆腾鑫生物技术有限公司), 普通级, 饲养: 泸州医学院公共卫生系动物房. 饲料及垫料: 泸州医学院城北动物房. 葡聚糖硫酸钠粉剂(Sigma公司), 姜黄素粉剂(纯度>98%), 地塞米松磷酸钠注射液, COX-2 ELISA检测试剂盒, PPAR-γ兔抗鼠多克隆抗体, STAT3兔抗鼠多克隆抗体, 磷酸化STAT3兔鼠单克隆抗体, 联苯胺检测试剂盒.
1.2.1 造模: ♀BALB/c小鼠60只, 适应性喂养1 wk, 按随机数字表分为A、B、C、L、M、H六组, 每组10只. A组: 正常对照组, 每日自由进饮用水及饲料, 每日腹腔注射1 mL生理盐水, 共7 d; B组: 模型组, 每日自由饮用5%DSS溶液替代饮用水, 自由进食饲料, 每日腹腔注射1 mL的25 mL/L乙醇溶液, 共7 d; C组: 地塞米松治疗组, 每日饮用5%DSS溶液替代饮用水, 自由进食饲料, 每日腹腔注射1次地塞米松针剂[剂量为1.5 mg/(kg•d), 溶于1 mL生理盐水], 共7 d; L组: 姜黄素低剂量组, 饮用5%DSS溶液替代饮用水, 自由进食饲料, 每日腹腔注射姜黄素悬液1次[姜黄素按每日25 mg/(kg•d)[5]的剂量溶于1 mL 25 mL/L乙醇溶液], 共 7 d; M组: 姜黄素中剂量组, 饮用5%DSS溶液替代饮用水, 自由进食饲料, 每日腹腔注射姜黄素悬液1次[姜黄素按每日50 mg/(kg•d)[5,6]的剂量溶于1 mL 25 mL/L乙醇溶液], 共7 d; H组: 姜黄素高剂量组, 饮用5%DSS溶液替代饮用水, 自由进食饲料, 每日腹腔注射姜黄素悬液1次[姜黄素100 mg/(kg•d)[5]的剂量溶于1 mL 25 mL/L乙醇溶液], 共7 d.
1.2.2 结肠组织疾病活动指数、组织学评分标准: 根据疾病活动指数(disease activity index, DAI)评分[7]和组织评分[8]标准对小鼠进行DAI及组织学评分. DAI评分: 体质量无下降, 大便性状正常, 便血隐血, 0分; 体质量下降1%-5%, 大便性状正常, 便血阴性, 1分; 体质量下降6%-10%, 大便性状半稀便, 隐血阳性, 2分; 体质量下降11%-15%, 大便性状半稀便, 隐血阳性, 3分; 体质量下降>15%, 大便性状稀便, 肉眼血便, 4分(正常大便: 成形大便; 松散大便: 不黏附于肛门的糊状、半成形大便; 稀便: 可黏附于肛门的大便).
组织学评分: 光镜下可见结肠无损伤, 0分; 结肠隐窝腺体丢失l/3, 1分; 隐窝腺体丢失2/3, 2分; 隐窝腺体全部丢失, 黏膜上皮存在, 伴有轻度炎性细胞浸润, 3分; 黏膜上皮糜烂, 破坏, 伴有明显炎性细胞浸润, 4分.
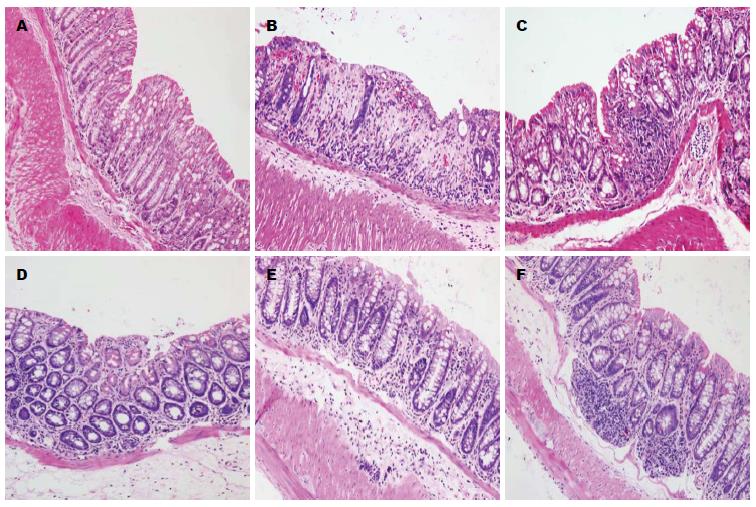
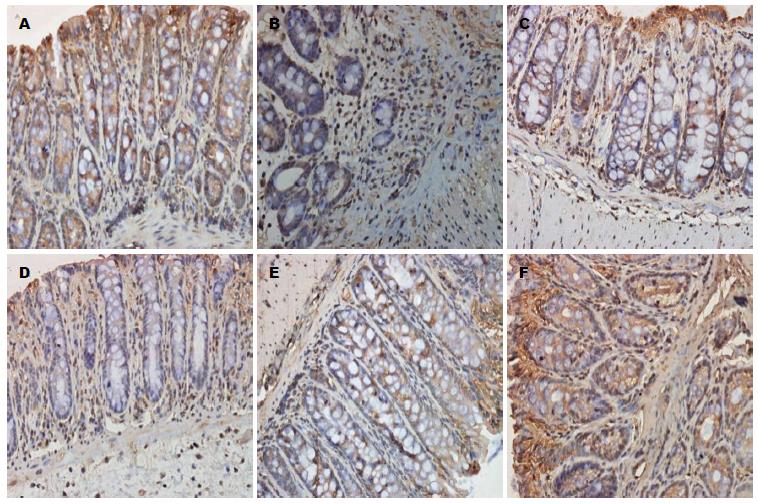
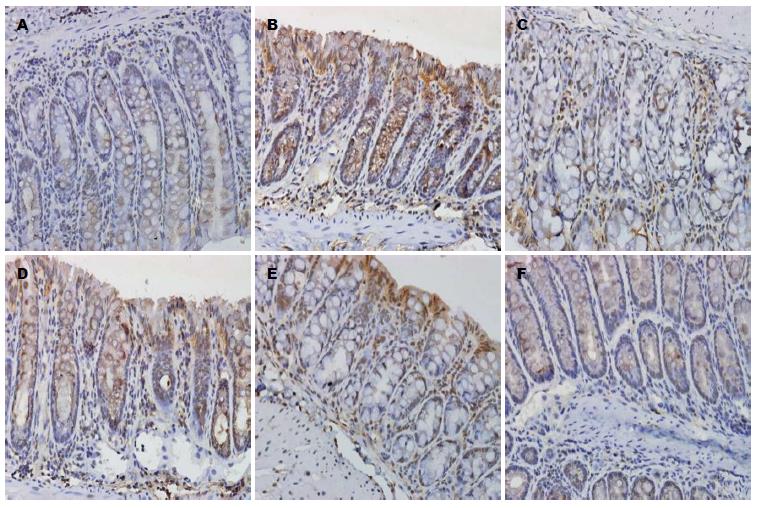
1.2.3 免疫组织化学法测PPAR-γ和STAT3的表达: 使用En Vision免疫组织化学法检测结肠组织中检测结肠组织PPAR-γ和STAT3的表达, 按照说明书操作进行. 常规石蜡切片并脱蜡, 抗原修复, 3%H2O2中浸泡消除过氧化物酶, 加入相应的一抗、二抗, DAB显色, 苏木素复染, 脱水、透明、封片. 免疫组织化学法检测结肠组织中PPAR-γ、STAT3的表达, 按照说明书操作进行, 在高倍镜(×400)下取5个视野, 呈棕黄色颗粒为阳性, 采用显微镜照相机将玻片置于同样的环境下, 拍摄后的照片保存为TIFF格式, 用Image pro-plus6.0图像分析软件, 使用积分光密度(integrated option density, IOD)对所拍照片阳性部位进行分析, 并收集数据.
1.2.4 ELISA法测结肠组织COX-2的表达情况: 在液氮中取出结肠组织约1 cm, 生理盐水洗净后称质量, 加入适量的PBS液, 用匀浆器将标本匀浆, 离心(3000 r/min)后取上清液. 参照说明书配制COX-2稀释标准品, 在空白孔、标准品孔、待测样品孔分别加样, 各孔加终止液50 μL, 加入终止液后反应10 min内, 用酶标仪在450 nm波长处测吸光值(OD值). 以不同浓度的标准品认定为X轴, 相应的OD值认定为Y轴作出相应的曲线, 并计算得出直线回归方程, 再将每个样品的OD值通过方程式得到COX-2相应的量, 再根据相应的稀释倍数扩大后得到目标值.
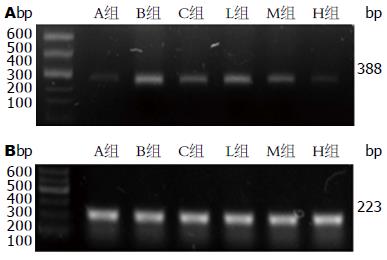
1.2.5 RT-PCR技术检测结肠组织内STAT3 mRNA的表达情况: 取100 mg结肠组织于无酶匀浆器中, 加入TRIzol试剂从而提取总RNA, 以β-actin作为内参, 以半定量RT-PCR对转录产物进行扩增. 扩增产物通过琼脂糖凝胶电泳方法检测、Quantity One图像分析系统分析, 以目的与内参基因的比值作为STAT3表达的相对含量. 引物序列; STAT3基因引物(目的片段388 bp)上游: AACCTCCAGGACGACTTTG; 下游: CGCCCTTGTAGGACACTTT.
1.2.6 Western blot测磷酸化的STAT3: 将组织裂解取上清液, 按碧云天蛋白定量试剂盒使用说明制作标准曲线, 根据标准曲线测定蛋白浓度, 进行SDS-PAGE电泳, 按照海绵, 转膜滤纸, 凝胶, PVDF膜, 转膜滤纸, 海绵的顺序放入转膜槽内, 恒电流(400mA)转膜1 h, 孵育一抗、二抗, 用滤纸吸干PVDF膜表面液体, 将膜蛋白面向上, 滴加200 μL发光液, 1 min后进行化学发光, 放入化学发光仪成像, 做好实验记录. 结果分析使用Quantity One软件分析各条带的灰度值.
统计学处理 所用数据采用SPSS19.0统计软件进行处理, 结果用mean±SD表示. 对各组数据进行方差齐性检验, 如果方差齐性检验的P>0.10, 说明方差相等, 各组间比较使用LSD-t检验, 如果方差不齐则使用DunnettT法进行各组数据比较, P<0.05为差异有统计学意义.
B组DAI评分及组织学评分最高(表1), 而L组、M组、H组随着姜黄素浓度的升高评分降低(图1).
B组小鼠结肠PPAR-γ低, 而STAT3高, 而L组、M组、H组PPAR-γ逐渐增多, STAT3逐渐减少(表2, 图2, 3).
与A组相比, B组、C组、L组、M组、H组COX-2含量比A组含量高, 差异有统计学意义(P<0.01). 与B组相比, C组、L组、M组、H组COX-2含量较B组低, 差异有统计学意义(表2).
RT-PCR方法检测结肠组织STAT3 mRNA表达, B组STAT3 mRNA表达水平相比A组明显上升, C组、L组、M组、H组水平较B组降低, 差异有统计学意义(P<0.05). C组比L组STAT3 mRNA的表达低、比H组STAT3 mRNA的表达高, 差异有统计学意义(P<0.05). C组与M组差异无统计学意义(P>0.5). M组比H组STAT3 mRNA的表达高, 差异有统计学意义(P<0.05)(图4).
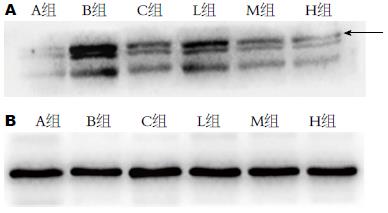
Western blot显示B组p-STAT3蛋白水平相比A组明显上升, C组、L组、M组、H组水平较B组降低, 差异有统计学意义(P<0.05). C组比L组p-STAT3蛋白低、比H组p-STAT3蛋白高, 差异有统计学意义(P<0.05). C组与M组差异无统计学意义(P>0.5). M组比H组p-STAT3蛋白表达高, 差异有统计学意义(P<0.05)(图5).
化学药诱导UC模型常用的有: 葡聚糖硫酸钠[9]、三硝基苯磺酸[10]、恶唑酮[11]、乙酸[12]、非类固醇抗炎药[13]、角叉莱胶[14]、肽多糖[15]等, 而DSS结肠炎模型在IBD研究中由于他的迅速、简单性、再现性和可控性非常受欢迎. 急性、慢性和急慢性结肠炎模型能通过DSS浓度的变化和给药频率来完成[16].
PPAR是一组具有复杂功能的核受体超家族成员, 有PPARα、PPARβ/δ、PPAR-γ 3种亚型, 分别由不同的基因编码, 存在于鼠类和人的脂肪组织、炎性细胞和肠上皮细胞中, 参与脂肪代谢、调节血糖、细胞分化等功能, 还参与炎症反应[17]. 目前清楚地了解到PPAR-γ与免疫调节和炎症反应相关. PPAR-γ表达在人类和啮齿类的结肠巨噬细胞和T细胞、B细胞检测到[18]. PPAR-γ已经被证实成为炎症的主要的调节剂, 达到部分对抗转录因子AP-1, STAT和核因子-κB(nuclear factor-κB, NF-κB)的活性的作用[19]. PPAR-γ对UC有保护作用, 与结肠炎的严重程度呈负相关.
COX-2是启动子含NF-κB结合位点的一种诱生型酶, 在正常情况下不表达, 而在有炎症时高度表达, 在UC的发病中起重要作用, COX-2作为促炎症介质和促细胞分裂刺激早的反应表达, 在慢性结肠炎增加的前列腺素产物依赖于COX-2的活性, COX-2是催化花生四烯酸生成前列腺素E2(prostaglandin E2, PGE2)的关键酶, PGE2具有扩血管、增加肠黏膜通透性和刺激肠上皮细胞分泌的作用, 可能与UC腹痛、腹泻的发生有关. 在Sánchez-Hidalgo等[20]的研究中, 已经观察到在慢性结肠炎中增加的前列腺素产物依赖于COX-2的活性, 大肠炎评分和肠内COX-2表达指数呈较强的正相关. 在慢性结肠炎中过多的iNOS、NO产物可能对黏膜层的完整性有害, 在不同的组织中能够使细胞衰退的活性氮的产生, 促成肠内损伤的进展, iNOS与COX-2协同促进炎症反应.
STAT是一个重要的细胞内信号转导分子, STAT蛋白质是一个含有STAT1/2/3/4/5a/5b/6的蛋白质家族, 在没有特殊受体刺激时STAT在细胞质中保持无活性形式, 与多个炎症因子的表达相关, 他在UC的发病机制中有重要作用[21]. 在不同的刺激如细胞因子、生长因子、激素类等, STAT蛋白质通过磷酸化、二聚、核转位后能诱导转录, 迅速通过酪氨酸磷酸化而被激活. STAT3是一个重要的细胞内信号转导分子, 扮演一个中心作用, 因为他控制了肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、白介素(interleukin, IL)-1β等的产生[22]. 在UC的作用机制中, STAT的家族成员之一STAT3在UC发病机制中的重要作用已经在实验研究和临床研究中得到证实, STAT3蛋白、STAT3 mRNA的表达水平与疾病的活动度成正比[23]. 本研究显示与正常组及C组相比, 模型组大鼠结肠组织DAI评分和组织学评分明显增高; 免疫组织化学法显示模型组大鼠PPAR-γ在结肠的表达较正常组及C组明显降低; 免疫组织化学法、RT-PCR法、Western blot法均显示模型组大鼠STAT较正常组及C组明显增高; ELISA法显示模型组大鼠结肠组织COX-2的表达较正常组明显增高情况, 提示STAT3、PPAR-γ参与了UC的发病.
姜黄素已被证明具有抗炎、降血糖、抗氧化、伤口愈合和抗菌活性. 大量的研究已经证实, 在动物大肠炎模型和UC患者中姜黄素能减弱炎症. Aggarwal等[4]证实姜黄素不但抑制STAT3磷酸化和STAT3基因DNA的结合性, 而且降低白细胞的聚集, 下调TNF-α、IL-1β的产生, 限制炎症反应, 从而改善DSS诱导大肠炎的严重性. 姜黄素通过剂量依赖明显地抑制NO、PGE2、促炎细胞因子的释放, 同样, 姜黄素能也减弱NO酶、COX-2 mRNA的表达和蛋白水平[24]. 姜黄素对结肠炎模型的治疗作用机制可能牵涉PPAR-γ和配体的激活. 陈欧等[25]、何双艳等[26]研究显示, 通过姜黄素干预小鼠UC, 证实姜黄素对UC有治疗作用.
本实验通过5%DSS溶液建立小鼠UC模型, 姜黄素低、中、高剂量治疗组比模型组小鼠的DAI评分、组织学评分低(P<0.05), 说明姜黄素对UC模型有一定的治疗作用. 免疫组织化学测各组小鼠结肠PPAR-γ、STAT3含量: L、M、H组比B组PPAR-γ含量均高, 差异有统计学意义(P<0.01), L、M、H组比B组STAT3含量均低, 差异有统计学意义(P<0.01), 说明姜黄素能提高溃疡性PPAR-γ含量, 而降低STAT3含量. ELISA法测COX-2量: L、M、H组较B组COX-2量降低, 差异有统计学意义(P<0.01). 与C组相比, L、M组COX-2含量比C组低, 差异有统计学意义(P<0.01), H组评分与C组差异统计学无意义(P>0.05). 于L组相比, M、H组含量低, 差异有统计学意义(P<0.01). M组与H组相比, 差异有统计学意义(P<0.01), 证实姜黄素能降低COX-2, 且根据浓度的不同下调幅度不一. p-STAT3蛋白及STAT3 mRNA含量: C组p-STAT3蛋白、STAT3 mRNA比L组低、比H组高, 差异有统计学意义(P<0.05). C组与M组差异无统计学意义(P>0.5). M组比H组p-STAT3蛋白、STAT3 mRNA表达高, 差异有统计学意义(P<0.05). 提示姜黄素可能通过阻断STAT3信号转导通路, 抑制炎症因子COX-2的释放, 提高PPAR-γ的含量, 从而达到减轻炎症而治疗UC的目的.
大量的研究证明姜黄素具有治疗人类一系列疾病的作用, 包括神经系统病变[27]、心脏血管系统疾病[28]、呼吸道疾病代谢疾病[29]、自身免疫性疾病、肿瘤等疾病, 以及具有预防慢性炎症疾病的作用[30]. 因此, 姜黄素有待很好地应用于临床.
溃疡性结肠炎(ulcerative colitis, UC)是一种直肠和结肠黏膜及黏膜下层慢性复发性炎症疾病, 目前药物的临床疗效不甚令人满意, 而姜黄素治疗UC的研究近年来有所进步, 其作用机制更甚明确, 有很好的利用价值.
吴杰, 主任医师, 武汉市中心医院消化科
姜黄素对UC的分子作用机制是研究的热点之一, 同时为姜黄素将来作为临床治疗UC的有效药物提供了充分的理论依据.
姜黄素还能通过抑制核因子-κB、丝裂原活化蛋白激酶、Toll样受体4等通路从而达到抑制炎症反应的作用.
姜黄素对实验性大肠炎中信号转导与转录激活因子3(signal transduction and activator of transcription, STAT3)通路起作用, 证实了姜黄素确实可通过STAT3通路对葡聚糖硫酸钠诱导的UC有重要的治疗效果, 且与姜黄素的浓度有一定的关系.
STAT: 是一个重要的细胞内信号转导分子, 其存在7个家族成员, 在没有特殊受体刺激时STAT在细胞质中保持无活性形式, 在不同的刺激下STAT蛋白质迅速通过酪氨酸磷酸化而被激活. 其成员之一STAT3在UC发病机制中的重要作用已经在得到证实.
本文探讨姜黄素通过STAT3通路对小鼠UC模型的作用, 以及姜黄素对环氧合酶-2、过氧化物酶体增殖物激活受体-γ(peroxisome proliferator-activated receptor γ, PPAR-γ)的影响. 研究结果提示姜黄素治疗小鼠UC模型的机制可能通过提高PPAR-γ的含量, 抑制STAT3信号通路, 减少环氧合酶-2的释放, 减轻中性粒细胞的浸润, 从而减轻小鼠结肠黏膜的损伤而达到治疗UC的作用. 选题有一定的创新性, 给广大临床研究者提供了一定的信息, 对后期药物开发奠定了理论基础.
编辑: 于明茜 电编: 都珍珍
| 1. | Podolsky DK. Inflammatory bowel disease. N Engl J Med. 2002;347:417-429. [PubMed] [DOI] |
| 2. | Dhar A. Environmental factors associated with Crohn's disease in India-there's more to it than meets the eye. Indian J Gastroenterol. 2011;30:255-256. [PubMed] [DOI] |
| 3. | Ordás I, Eckmann L, Talamini M, Baumgart DC, Sandborn WJ. Ulcerative colitis. Lancet. 2012;380:1606-1619. [PubMed] [DOI] |
| 4. | Aggarwal BB, Sung B. Pharmacological basis for the role of curcumin in chronic diseases: an age-old spice with modern targets. Trends Pharmacol Sci. 2009;30:85-94. [PubMed] [DOI] |
| 5. | Venkataranganna MV, Rafiq M, Gopumadhavan S, Peer G, Babu UV, Mitra SK. NCB-02 (standardized Curcumin preparation) protects dinitrochlorobenzene- induced colitis through down-regulation of NFkappa-B and iNOS. World J Gastroenterol. 2007;13:1103-1107. [PubMed] [DOI] |
| 6. | Liu L, Liu YL, Liu GX, Chen X, Yang K, Yang YX, Xie Q, Gan HK, Huang XL, Gan HT. Curcumin ameliorates dextran sulfate sodium-induced experimental colitis by blocking STAT3 signaling pathway. Int Immunopharmacol. 2013;17:314-320. [PubMed] [DOI] |
| 7. | Cooper HS, Murthy SN, Shah RS, Sedergran DJ. Clinicopathologic study of dextran sulfate sodium experimental murine colitis. Lab Invest. 1993;69:238-249. [PubMed] |
| 8. | Kato S, Hokari R, Matsuzaki K, Iwai A, Kawaguchi A, Nagao S, Miyahara T, Itoh K, Ishii H, Miura S. Amelioration of murine experimental colitis by inhibition of mucosal addressin cell adhesion molecule-1. J Pharmacol Exp Ther. 2000;295:183-189. [PubMed] [DOI] |
| 9. | Cheah KY, Bastian SE, Acott TM, Abimosleh SM, Lymn KA, Howarth GS. Grape seed extract reduces the severity of selected disease markers in the proximal colon of dextran sulphate sodium-induced colitis in rats. Dig Dis Sci. 2013;58:970-977. [PubMed] [DOI] |
| 10. | de Almeida AB, Sánchez-Hidalgo M, Martín AR, Luiz-Ferreira A, Trigo JR, Vilegas W, dos Santos LC, Souza-Brito AR, de la Lastra CA. Anti-inflammatory intestinal activity of Arctium lappa L. (Asteraceae) in TNBS colitis model. J Ethnopharmacol. 2013;146:300-310. [PubMed] [DOI] |
| 11. | Lee J, Yamamoto T, Kuramoto H, Kadowaki M. TRPV1 expressing extrinsic primary sensory neurons play a protective role in mouse oxazolone-induced colitis. Auton Neurosci. 2012;166:72-76. [PubMed] [DOI] |
| 12. | Yu Q, Zhu S, Zhou R, Yi F, Bing Y, Huang S, Wang Z, Wang C, Xia B. Effects of sinomenine on the expression of microRNA-155 in 2,4,6-trinitrobenzenesulfonic acid-induced colitis in mice. PLoS One. 2013;8:e73757. [PubMed] [DOI] |
| 13. | Narushima S, Spitz DR, Oberley LW, Toyokuni S, Miyata T, Gunnett CA, Buettner GR, Zhang J, Ismail H, Lynch RG. Evidence for oxidative stress in NSAID-induced colitis in IL10-/- mice. Free Radic Biol Med. 2003;34:1153-1166. [PubMed] [DOI] |
| 14. | Pricolo VE, Madhere SM, Finkelstein SD, Reichner JS. Effects of lambda-carrageenan induced experimental enterocolitis on splenocyte function and nitric oxide production. J Surg Res. 1996;66:6-11. [PubMed] [DOI] |
| 15. | Reingold L, Rahal K, Schmiedlin-Ren P, Rittershaus AC, Bender D, Owens SR, Adler J, Zimmermann EM. Development of a peptidoglycan-polysaccharide murine model of Crohn's disease: effect of genetic background. Inflamm Bowel Dis. 2013;19:1238-1244. [PubMed] [DOI] |
| 16. | Chassaing B, Aitken JD, Malleshappa M, Vijay-Kumar M. Dextran sulfate sodium (DSS)-induced colitis in mice. Curr Protoc Immunol. 2014;104:Unit 15.25. [PubMed] [DOI] |
| 17. | Semple RK, Chatterjee VK, O'Rahilly S. PPAR gamma and human metabolic disease. J Clin Invest. 2006;116:581-589. [PubMed] [DOI] |
| 18. | Adachi M, Kurotani R, Morimura K, Shah Y, Sanford M, Madison BB, Gumucio DL, Marin HE, Peters JM, Young HA. Peroxisome proliferator activated receptor gamma in colonic epithelial cells protects against experimental inflammatory bowel disease. Gut. 2006;55:1104-1113. [PubMed] [DOI] |
| 19. | Kundu P, Ling TW, Korecka A, Li Y, D'Arienzo R, Bunte RM, Berger T, Arulampalam V, Chambon P, Mak TW. Absence of intestinal PPARγ aggravates acute infectious colitis in mice through a lipocalin-2-dependent pathway. PLoS Pathog. 2014;10:e1003887. [PubMed] [DOI] |
| 20. | Sánchez-Hidalgo M, Martín AR, Villegas I, Alarcón De La Lastra C. Rosiglitazone, an agonist of peroxisome proliferator-activated receptor gamma, reduces chronic colonic inflammation in rats. Biochem Pharmacol. 2005;69:1733-1744. [PubMed] [DOI] |
| 21. | Mudter J, Weigmann B, Bartsch B, Kiesslich R, Strand D, Galle PR, Lehr HA, Schmidt J, Neurath MF. Activation pattern of signal transducers and activators of transcription (STAT) factors in inflammatory bowel diseases. Am J Gastroenterol. 2005;100:64-72. [PubMed] [DOI] |
| 22. | Fu XY. STAT3 in immune responses and inflammatory bowel diseases. Cell Res. 2006;16:214-219. [PubMed] [DOI] |
| 24. | Jin CY, Lee JD, Park C, Choi YH, Kim GY. Curcumin attenuates the release of pro-inflammatory cytokines in lipopolysaccharide-stimulated BV2 microglia. Acta Pharmacol Sin. 2007;28:1645-1651. [PubMed] [DOI] |
| 27. | Noorafshan A, Asadi-Golshan R, Abdollahifar MA, Karbalay-Doust S. Protective role of curcumin against sulfite-induced structural changes in rats' medial prefrontal cortex. Nutr Neurosci. 2015;18:248-255. [PubMed] [DOI] |
| 28. | Ali MS, Mudagal MP, Goli D. Cardioprotective effect of tetrahydrocurcumin and rutin on lipid peroxides and antioxidants in experimentally induced myocardial infarction in rats. Pharmazie. 2009;64:132-136. [PubMed] |
| 29. | Obata K, Kojima T, Masaki T, Okabayashi T, Yokota S, Hirakawa S, Nomura K, Takasawa A, Murata M, Tanaka S. Curcumin prevents replication of respiratory syncytial virus and the epithelial responses to it in human nasal epithelial cells. PLoS One. 2013;8:e70225. [PubMed] [DOI] |
| 30. | Aggarwal BB, Harikumar KB. Potential therapeutic effects of curcumin, the anti-inflammatory agent, against neurodegenerative, cardiovascular, pulmonary, metabolic, autoimmune and neoplastic diseases. Int J Biochem Cell Biol. 2009;41:40-59. [PubMed] [DOI] |