修回日期: 2015-10-29
接受日期: 2015-11-09
在线出版日期: 2016-01-08
炎症性肠病(inflammatory bowel disease, IBD)是一种系统性疾病, 不仅累及肠道, 亦可出现多种肠外表现(extraintestinal manifestations, EIMs). EIMs涉及多个系统. 本文总结IBD的肠外表现及其治疗, 提高对IBD的认识, 并更全面指导临床诊疗.
核心提示: 本文较全面地介绍了炎症性肠病的肠外临床表现及治疗进展, 内容较丰富, 观点新颖, 并提供较为典型的肠外表现图片.
引文著录: 陈劲华, 李初俊, 郅敏. 炎症性肠病的肠外表现及治疗进展. 世界华人消化杂志 2016; 24(1): 1-9
Revised: October 29, 2015
Accepted: November 9, 2015
Published online: January 8, 2016
Inflammatory bowel disease (IBD) is a systemic disease, and it not only affects the gastrointestinal tract, but also may show a variety of extraintestinal manifestations (EIMs). EIMs can involve multiple systems. This paper reviews the EIMs of IBD for a more comprehensive understanding of IBD to guide its clinical diagnosis and treatment.
- Citation: Chen JH, Li CJ, Zhi M. Extraintestinal manifestations of inflammatory bowel disease. Shijie Huaren Xiaohua Zazhi 2016; 24(1): 1-9
- URL: https://www.wjgnet.com/1009-3079/full/v24/i1/1.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v24.i1.1
炎症性肠病(inflammatory bowel disease, IBD)是一种慢性的肠道非特异性炎症性疾病, 是一种可累及全身各系统的肠道疾病, 包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD). 其临床表现多种多样, 且肠外表现(extraintestinal manifestations, EIMs)常见, 几乎涉及每一个器官、系统.
目前IBD的EIMs有两种较常见的分类方法. 按发生机制分类, IBD的EIMs可分为三类[1-3]. 第一类与IBD的肠道炎症活动相关, 常发生于肠道炎症严重时, 可能其发病机制与肠道一致, 部分可随肠道炎症控制而缓解, 包括关节炎、结节性红斑、坏疽性脓皮病、增殖性口腔炎、虹膜炎、葡萄膜炎等. 第二类与IBD肠道活动相互独立, 与肠道炎症活动与否无明确关系, 多为自身免疫性疾病, 包括原发性硬化性胆管炎(primary sclerotic cholangitis, PSC)、强直性脊柱炎、斑秃、自身免疫性甲状腺炎等[1]. 第三类为因肠道炎症使代谢或解剖异常所致的, 包括骨质疏松、贫血、生长发育迟缓、脂肪肝、胆石症、尿石症等. 按发生的系统、器官分类, 可分为骨关节系统、皮肤黏膜、眼睛、肝胆、泌尿系统、呼吸系统、心血管系统、神经系统、内分泌系统等.
IBD的EIMs机制目前尚不明确. 目前比较认同的包括遗传易感性、抗原交叉反应及肠黏膜T淋巴细胞归巢等. 遗传易感性观点: van Sommeren等[4]认为存在一类风险基因, 携带这类基因的IBD患者更易于发生肠外表现, 甚至于同时出现多种肠外表现; 肠外表现有家族遗传倾向性. 抗原交叉反应观点: 很多IBD的患者同时发生多个肠外表现[2]; Chapman等[5]发现, 一个并发PSC的UC患者, 其血清和结肠黏膜中包含的抗结肠黏膜自身抗体, 同时对胆道上皮产生反应; 即肠道的免疫活动, 不仅对肠道相关抗原产生应答, 而且对共享抗原的肠外器官发动免疫攻击; Taurog等[3]认为存在一种位于结肠上皮的特殊蛋白与眼、关节、皮肤及胆道存在交叉反应; Geng等[6]发现, 一种结肠上皮蛋白(colon epithelial protein, CEP)和人类原肌球蛋白5(human tropomyosin isoform 5, hTM5)同时表达在胆道、皮肤、眼睛和关节, 而CEP和hTM5一直怀疑为自身免疫性攻击的主要目标. 肠黏膜T淋巴细胞归巢观点: Butcher等[7]发现, 肠外器官表达肠道特异性的内皮细胞黏附分子-地址素, 地址素可招募记忆性或效应性T淋巴细胞迁移到靶器官, 引起免疫反应, 导致靶器官的损伤. 但是Su等[8]发现, 机体在不接触抗原的情况下也存在记忆性T细胞. 所以, IBD的肠外表现机制仍有待进一步探索研究.
IBD最常见的肠外表现是关节症状, 影响的关节包括外周大小关节及轴向关节[9].
3.1.1 外周关节炎: 外周型关节炎较中轴型关节炎常见, 可分为两类[10]: 第一类受累关节较少, 多<5个关节, 通常影响不对称的大关节, 如踝关节、膝关节、髋关节、腕关节、肘关节和肩关节等, 与IBD活动程度平行, 呈急性、自限性病程; 一般治疗肠道炎症可缓解症状. 第二类受累关节较多, 多>5个关节, 通常涉及对称的小关节, 与IBD活动程度相互独立, 可能增加葡萄膜炎的风险, 而结肠切除术后仍可持续. 常规治疗包括短期应用非甾体类抗炎药(non-steroid anti-inflammtory drugs, NSAIDs)和环氧合酶2(cyclooxygenase 2, COX-2)拮抗剂, 使用时应注意其胃肠道不良反应和IBD激活的风险[11,12], 病变关节内的类固醇治疗及柳氮磺胺吡啶均被证明是有效的[13].
3.1.2 中轴型关节炎: 中轴性关节炎与IBD活动相互独立, 包括强直性脊柱炎和骶髂关节炎. 强直性脊柱, 一般与肠道活动相独立, 男性多于女性, 多于年轻时发病; 经常表现为睡眠或休息后的晨僵或疼痛加剧; 查体可见腰椎前凸消失, 脊柱弯曲受限; 其诊断的金标准是核磁共振成像(magnetic resonance imaging, MRI), 表现为"关节僵硬及竹节样脊柱". 骶髂关节炎表现为骨盆疼痛, 活动加重, 但有部分无症状的患者也可发现骶髂关节的硬化. 中轴型关节炎治疗包括物理治疗及药物治疗, 缓解病情的药物包括COX-2抑制剂、甲氨蝶呤、柳氮磺胺吡啶及生物制剂等[14,15].
3.1.3 骨质疏松: IBD患者发生骨质疏松的风险比普通人群明显增加, 骨折发生率也比普通人群略高, 且随着年龄的增长而增长[16,17]. 有研究[18]表明, 新诊断IBD的女性及>30岁的男性, 建议行骨质相关的检查包括椎体的X片及甲状旁腺素检查等. 骨质疏松的病因可能包括激素治疗的不良反应, 机体维生素D缺乏, 性腺机能减退及系统性炎症反应等. 其治疗包括磷酸盐、钙剂、维生素D、雌激素及其类似物、甲状旁腺激素、日照等.
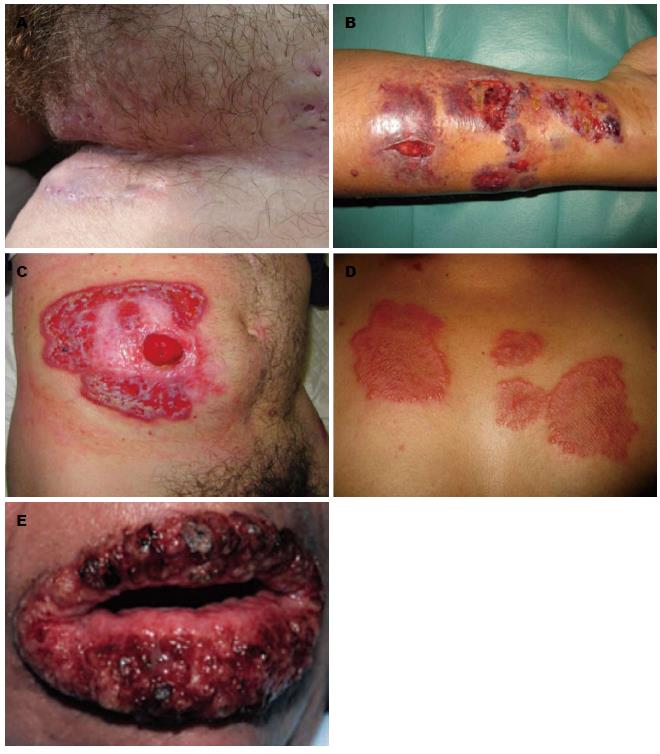
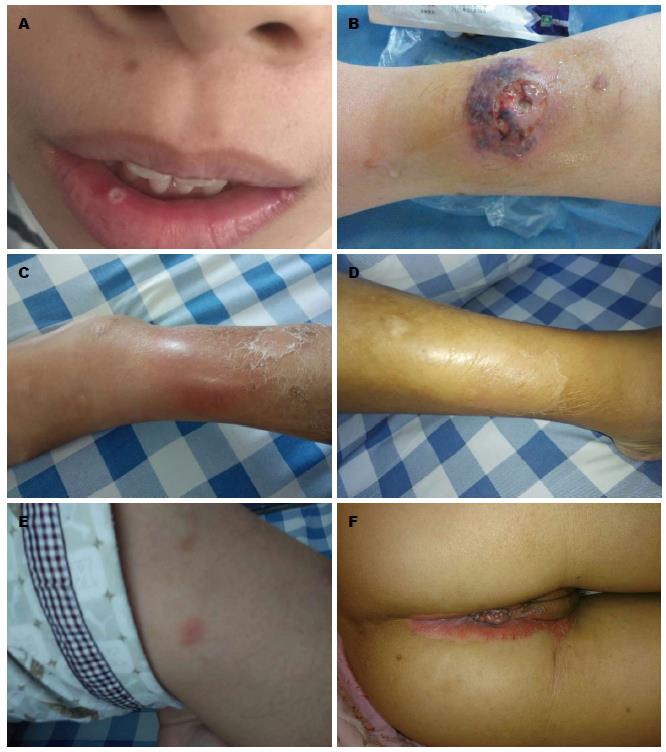
IBD相关的皮肤黏膜病变是在排除其他特定的皮肤黏膜病, 并基于临床情况和皮肤黏膜特征诊断的. 可分为三类[19,20]: (1)肉芽肿性表现, 其皮肤病变组织学特性与肠道疾病相同, 如皮肤转移性IBD、肛瘘等; (2)反应性表现, 如结节性红斑、坏疽性脓皮病、Sweet综合征、增殖性脓皮炎、皮肤结节性多动脉炎等; (3)营养和吸收不良(锌、铁及维生素缺乏)继发的表现. 注意鉴别药物继发的皮肤表现(图1, 2).
3.2.1 结节性红斑: 结节性红斑是IBD最为常见的皮肤表现, 与IBD的活动性密切相关, 常与眼睛、关节、全结肠病变及坏疽性脓皮病同时发生[1,21,22]. 临床表现为皮下痛性结节, 典型的皮疹可持续3-6 wk, 不发生溃疡和瘢痕, UC的发病高于CD, 女性多见, 多数为自限性, 可随着肠道炎症的缓解而好转. 严重的情况下可能需要系统性皮质类固醇、免疫抑制剂或肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)单抗治疗[23].
3.2.2 坏疽性脓皮病: 坏疽性脓皮病常见于UC, 好发于下肢伸侧面, 通常始于一个红斑的脓疱或结节迅速扩散到相邻皮肤, 发展成中心无菌性化脓性坏死的溃疡, 边缘隆起, 有紫红色晕. 多出现于肠道炎症活动期, 结肠受累者更多见, 但结肠切除术后的缓解并不明显[22,24-26]. 坏疽性脓皮病的治疗包括伤口护理、药物治疗、继发感染的抗生素治疗及治疗潜在的IBD. 轻度局限性病变可予局部治疗, 包括皮质类固醇、他克莫司等. 最常用的系统性药物包括皮质类固醇和环孢霉素单药治疗或组合治疗. 二线治疗药物包括氨苯砜、硫唑嘌呤、环磷酰胺、甲氨蝶呤、静脉注射免疫球蛋白、骁悉、血浆置换等. 高压氧可作为支持性疗法. 依那西普、英夫利昔单抗和阿达木单抗可用于难治性病例[25,27,28].
3.2.3 口腔病变: 口腔病变包括阿弗他溃疡、唇炎、增殖性口腔炎、口角炎、口面部肉芽肿病、肉芽肿性腮腺、牙龈病变、梅罗综合征、口腔癌前病变等[29]. 以阿弗他溃疡为主, 其特点是口腔反复发生的多发性溃疡, 多为圆形或椭圆形小而浅的溃疡, 通常在IBD活动期出现, 与疾病的活动性相关, 随着IBD症状的缓解而缓解. 唇炎表现与营养缺乏导致的唇炎相似, 表现为唇部有垂直的皲裂伴脱皮, 皲裂愈合后出现充血, 累及口角易造成出血, 稍大的皲裂可有渗出液和血液, 结有黄色痂皮或血痂, 严重可继发感染. 增殖性脓性口腔炎是一种罕见的口腔病损, 可以发生在任何年龄阶段, 其特点是增厚的黏膜及红斑上有许多小的脓包形成, 脓包破裂后形成广泛的溃疡面和糜烂以及"蜗牛轨迹样"外观, 最常见的病损部位是唇侧附着龈、软硬腭、前庭沟及扁桃体区域, 口底黏膜和舌部通常不受累. "蜗牛轨迹样"外观脓性口炎被认为是IBD的高特异性标志, 尤其与UC的相关性最高. 口腔抗菌漱口水及局部皮质类固醇、局部利多卡因可用于治疗. 有研究报道, IBD患者口腔癌及口腔癌前病变的风险较正常人增加[30], IBD人群是口腔癌及口腔癌前病变的高危人群, 建议对即将开始用免疫抑制剂的IBD患者进行口腔检查.
3.2.4 Sweet综合征: Sweet综合征又称急性发热性嗜中性皮病, 是由于中性粒细胞增多, 广泛浸润真皮浅、中层引起的皮肤疼痛性隆起性红斑. 多见于女性、结肠受累及肛周病变患者. Sweet综合征通常对口服糖皮质激素反应较好, 耐药或高度复发病例也可考虑应用免疫抑制剂[25].
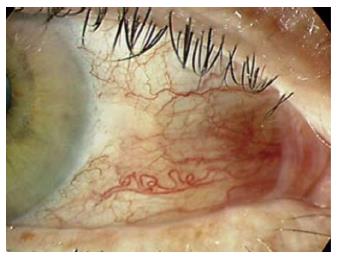
眼部表现需区分药物导致的眼部表现和与免疫相关的眼部表现. 药物导致的眼部表现包括白内障、青光眼, 主要为长期使用皮质类固醇药物所致. 与免疫相关的眼部表现包括表层巩膜炎、葡萄膜炎、角膜疾病, 多伴随与IBD免疫活动相关的肠外表现, 如关节表现. 葡萄膜炎表现为疼痛、畏光、红眼, 有些出现视力模糊及飞蚊症. 可分为前葡萄膜炎(炎症主要在前房)、中葡萄膜炎(炎症主要在玻璃体)、后葡萄膜炎(炎症主要在视网膜及脉络膜)及全葡萄膜炎. 最常见的为前葡萄膜炎, 女性多见. IBD的眼部病变一般仅需IBD的基础治疗, 症状严重者可应用激素, 包括局部、眼周及系统用药; 但如有明显的类固醇不良反应时, 可考虑系统性免疫抑制剂及生物制剂的应用; 当出现白内障等情况时, 手术治疗会是一个较好的选择[31,32](图3).
肝胆病变一般不与肠道活动相关. 按其发生机制, 可分为四类: (1)与IBD有共同发病机制, 包括PSC、胆管周围炎、免疫球蛋白G4(immunoglobulin G4, IgG4)相关性胆管炎等; (2)与IBD的病理生理改变平行, 包括胆石症、门静脉血栓、肝脓肿等; (3)与IBD的治疗不良反应相关, 包括药物性肝损害、药物诱导的胰腺炎、肝硬化、乙型肝炎病毒激活、肝脾T细胞淋巴瘤等; (4)可能与IBD相关, 包括脂肪肝、肝淀粉样变性、肉芽肿性肝炎等.
3.4.1 PSC: PSC是IBD最常见且最特异的肝胆合并症. 广泛结肠受累的UC患者更易合并PSC, 但结肠切除术后仍可出现PSC. PSC典型特征为肝内外胆管炎症及进展性纤维化, 最终可致肝硬化肝衰竭, 可由内镜下逆行胰胆管造影、磁共振胰胆管成像检查诊断. 有研究[33]报道, PSC是IBD患者发生结直肠癌的危险因素, 但是有报道肝移植后, 并不能减少结直肠癌的发生. 目前并无有效的药物可阻止PSC病程进展, 熊去氧胆酸对改善肝功能有益, 但对疾病的预后无影响, 甚至Eaton等[34]发现, 熊去氧胆酸可能增加UC患者结直肠肿瘤发生的风险. PSC最终需要进行肝移植.
3.4.2 脂肪肝: IBD患者的非酒精性脂肪肝发病率较一般人群高. IBD患者发生脂肪肝可能与肠道炎症及肠道切除所致营养吸收不良相关. Wieser等[35]发现, 肥胖及胰岛素抵抗为IBD患者非酒精性脂肪肝的独立高危因素. 皮质类固醇及TNF-α单抗对治疗IBD合并脂肪肝有效.
3.4.3 胆石症: CD患者胆石症患病率较一般人群高, 而UC患者胆石症发生率与一般人群无明显差异[36]. 年龄、疾病特异性的因素如诊断时累及部位、肠道切除手术史、手术次数、切除部位是CD患者发生胆石症的危险因素. IBD患者发生胆石症的机制可能为回肠末端的胆汁酸盐重吸收障碍, 胆汁中胆固醇过饱和使回肠微环境改变, 而无法阻止细菌过度生长; 而且可使小肠运输时间缩短等. 另外, Brink等[37]发现, 有回肠病变的CD患者的胆汁中结合胆红素、非结合胆红素均升高, 胆红素的肝肠循环增加.
IBD能增加急慢性胰腺炎的风险, 但胰腺炎是否为IBD的EIMs仍不清楚[38,39]. 因为有很多治疗IBD的药物, 如水杨酸盐类药物、硫唑嘌呤等, 有潜在诱发急性胰腺炎的风险[40]. 急性胰腺炎可能还与胆石症、CD相关的十二指肠乳头损伤、CD相关的胰腺肉芽肿性炎症、PSC等有关.
IBD患者伴神经系统症状间有报道, 包括周围神经病变、视神经病变、神经性耳聋、多发性硬化症等[41,42], 但神经系统病变是否为IBD肠外表现, 目前并不明确. 有研究报道, CD患者的脱髓鞘病变较普通人群高; 而且约半数以上CD患者的神经系统体格检查出现异常[43]. 神经系统病变可能的病因有叶酸、维生素B12吸收不良; 有些药物也能导致神经病变, 甲硝唑、美沙拉嗪、英夫利昔单抗等药物可导致周围神经病变.
IBD合并肺部异常有多种表现, 包括间质性肺炎、细支气管炎、闭塞性细支气管炎机化性肺炎、炎性气管狭窄、支气管扩张、浆膜炎、肺血管炎、肺结节病、韦格纳肉芽肿病等[44]. 支气管扩张是被报道的最常见的IBD相关肺部损伤[45]. 肺部异常一般不与肠道炎症活动相关, 结肠切除不能治疗IBD的肺部表现[46]. 肺部异常其可能的病因[44]: 肺与胃肠道胚胎起源相似, 均起源于前肠, 可能有相似的抗原性; 另外肺及胃肠道均含有黏膜下淋巴组织, 而黏膜下淋巴组织在宿主黏膜防御中起重要作用; 同时氧化应激也可能是肺部损伤的病因. 但是一部分肺部损伤可能是药物诱导引起的, 如机会感染如肺结核等. 另外, 部分治疗IBD药物可导致肺部损伤, 如抗肿瘤坏死因子及美沙拉嗪可导致肺部损伤[47]. IBD相关的肺部损伤的治疗一般与具体的病变形式相关, 但大多数对皮质类固醇有效, 包括系统性用药及局部雾化, 在感染及化脓时, 需加强抗生素的应用[44].
IBD的合并心脏表现较为罕见, 但后果严重, 多数在活动期出现. 包括心肌炎、心包炎、缺血性心脏病等. IBD合并心脏表现是否为IBD的肠外表现, 鉴别较困难. Rungoe等[48]认为IBD所致的慢性炎症和免疫失调可能与心血管疾病的发展相关, IBD可能增加冠状动脉性疾病的风险. 但Ruisi等[49]认为慢性炎症在缺乏传统危险因素的情况下并不会增加心血管事件的风险. 部分IBD的治疗药物如美沙拉嗪、5-ASA有心脏毒性. 而对于缺血性心肌炎, 使用5-ASA、皮质类固醇、巯嘌呤类及TNF-α单抗可减少缺血性心肌炎的风险[50].
IBD合并泌尿系统表现包括肾小球肾炎、间质性肾炎、泌尿系结石、肾脏淀粉样变性、尿路瘘管形成等[51]. IBD伴随的腹泻和吸收不良, 可导致尿量及电解质损失, 可能是泌尿系结石形成的诱发因素; 另外高蛋白摄入可能与泌尿系结石形成相关; 回结肠病变是CD患者泌尿系结石的危险因素[52]. IBD相关肾病主要影响肾小球及小管间质, IgA肾病最多见, 其次为间质性肾炎; 虽然大多数间质性肾炎与对氨基水杨酸暴露相关, 但是不能排除与IBD疾病无关[53]. IBD相关性肾炎多数与肠道活动相关, 对IBD的治疗反应好.
IBD合并血栓性疾病的风险较正常人群明显增加, 而血栓栓塞在发展中国家的IBD患者的发病率低于发达国家. IBD患者的血栓栓塞主要发生在静脉系统, 较少发生于动脉系统, 以深静脉血栓形成和肺栓塞为血栓栓塞症最常见的类型, 其他部位如大脑、肾、肝、肠系膜静脉也可发生. 血液高凝状态被认为是血栓栓塞的发病机制, 而住院、长期卧床及围手术期是IBD患者发生血栓的危险因素[54]. 血栓栓塞是可以预防的. 重症的住院患者给予预防性抗凝治疗、避免及治疗脱水及营养不良可减少血栓栓塞的风险. 临床医生应加强患者健康教育, 让患者了解血栓栓塞的危险性及症状, 同时, 应定期评估IBD患者心血管疾病的风险(包括高血压、糖尿病、高脂血症、肥胖症、高同型半胱氨酸血症及家族史)及对高危患者予预防性治疗. 在轻度至中度血栓栓塞事件中常予抗凝治疗, 而严重的大量血栓形成可考虑予溶栓治疗. 抗凝及溶栓治疗时应评估胃肠道和全身出血的风险[55].
3.11 内分泌及代谢系统
IBD与多种内分泌及代谢紊乱相关, 包括生长发育迟缓、青春期延迟、性腺机能减退、脂质异常及胰岛素抵抗、代谢性骨病等. IBD患儿生长发育迟缓和青春期延迟不仅仅是皮质类固醇治疗的结果, 更主要的是慢性的炎症及营养不良导致. 对于患儿生长发育迟缓, 最重要的治疗是达到并且维持疾病缓解, 最大限度减少机体炎症负荷. 有研究报道, 生长激素不敏感导致免疫紊乱也是生长发育迟缓的一个重要机制. 胰岛素样生长因子-1(insulin-like growth factor-1, IGF-1)可促进长骨软骨细胞生长. 特别是对炎症控制不理想的患儿, 生长激素及IGF-1可能是有效的治疗[56]. 但是Pituch-Zdanowska等[57]发现, 并不是所有IBD患儿均为营养不良, 超重及肥胖的患儿在新诊断的患儿中也不少见, 其中UC患儿超重及肥胖的发病率高于CD患儿.
IBD是一种系统性疾病, 其临床表现不仅为肠道表现, 还涉及到全身多个系统. 对肠外表现的全面认识有重要意义. IBD的肠外表现较多, 有些严重影响患者的生活质量. 因此加强对肠外表现的认识, 有助于对IBD的早期诊断及治疗, 更好的改善患者生活质量及预后.
炎症性肠病(inflammatory bowel disease, IBD)是一种病因尚不十分清楚的慢性非特异性肠道炎症性疾病, 并有多种多样的肠外表现. IBD是北美和欧洲的常见病, 近年来亚洲国家如日本IBD的发病率逐步增高, 而中国因IBD就诊人数亦逐步增加.
季国忠, 教授, 南京医科大学第二附属医院消化科
IBD常因肠外表现而误诊, 加强对肠外表现的认识, 有助于对IBD的早期诊断及治疗以及更好的改善患者生活质量及预后.
本文分系统介绍了IBD的肠外表现, 并对相应的治疗作一简述. 此外, 本文提供几种较为典型常见的肠外表现图片, 形象具体.
IBD是一种系统性疾病, 其临床表现不仅为肠道表现, 还涉及到全身多个系统. 对肠外表现的全面认识有重要意义. IBD的肠外表现较多, 有些严重影响患者的生活质量. 因此加强对肠外表现的认识, 有助于对IBD的早期诊断及治疗, 更好的改善患者生活质量及预后.
IBD: 是一种慢性的肠道非特异性炎症性疾病, 是一种可累及全身各系统的肠道疾病, IBD的肠外表现是指IBD相关的胃肠道外的临床表现.
本文全面地介绍了炎症性肠病的肠外临床表现及治疗进展, 内容丰富, 观点新颖, 提供的图片较为典型.
编辑: 于明茜 电编: 都珍珍
| 1. | Veloso FT, Carvalho J, Magro F. Immune-related systemic manifestations of inflammatory bowel disease. A prospective study of 792 patients. J Clin Gastroenterol. 1996;23:29-34. [PubMed] |
| 2. | Das KM. Relationship of extraintestinal involvements in inflammatory bowel disease: new insights into autoimmune pathogenesis. Dig Dis Sci. 1999;44:1-13. [PubMed] |
| 3. | Taurog JD, Richardson JA, Croft JT, Simmons WA, Zhou M, Fernández-Sueiro JL, Balish E, Hammer RE. The germfree state prevents development of gut and joint inflammatory disease in HLA-B27 transgenic rats. J Exp Med. 1994;180:2359-2364. [PubMed] [DOI] |
| 4. | van Sommeren S, Janse M, Karjalainen J, Fehrmann R, Franke L, Fu J, Weersma RK. Extraintestinal manifestations and complications in inflammatory bowel disease: from shared genetics to shared biological pathways. Inflamm Bowel Dis. 2014;20:987-994. [PubMed] [DOI] |
| 5. | Chapman RW, Cottone M, Selby WS, Shepherd HA, Sherlock S, Jewell DP. Serum autoantibodies, ulcerative colitis and primary sclerosing cholangitis. Gut. 1986;27:86-91. [PubMed] [DOI] |
| 6. | Geng X, Biancone L, Dai HH, Lin JJ, Yoshizaki N, Dasgupta A, Pallone F, Das KM. Tropomyosin isoforms in intestinal mucosa: production of autoantibodies to tropomyosin isoforms in ulcerative colitis. Gastroenterology. 1998;114:912-922. [PubMed] [DOI] |
| 7. | Butcher EC, Picker LJ. Lymphocyte homing and homeostasis. Science. 1996;272:60-66. [PubMed] [DOI] |
| 8. | Su LF, Kidd BA, Han A, Kotzin JJ, Davis MM. Virus-specific CD4(+) memory-phenotype T cells are abundant in unexposed adults. Immunity. 2013;38:373-383. [PubMed] |
| 9. | Vavricka SR, Brun L, Ballabeni P, Pittet V, Prinz Vavricka BM, Zeitz J, Rogler G, Schoepfer AM. Frequency and risk factors for extraintestinal manifestations in the Swiss inflammatory bowel disease cohort. Am J Gastroenterol. 2011;106:110-119. [PubMed] [DOI] |
| 10. | Orchard TR, Wordsworth BP, Jewell DP. Peripheral arthropathies in inflammatory bowel disease: their articular distribution and natural history. Gut. 1998;42:387-391. [PubMed] |
| 11. | Felder JB, Korelitz BI, Rajapakse R, Schwarz S, Horatagis AP, Gleim G. Effects of nonsteroidal antiinflammatory drugs on inflammatory bowel disease: a case-control study. Am J Gastroenterol. 2000;95:1949-1954. [PubMed] [DOI] |
| 12. | Mahadevan U, Loftus EV, Tremaine WJ, Sandborn WJ. Safety of selective cyclooxygenase-2 inhibitors in inflammatory bowel disease. Am J Gastroenterol. 2002;97:910-914. [PubMed] [DOI] |
| 13. | Clegg DO, Reda DJ, Abdellatif M. Comparison of sulfasalazine and placebo for the treatment of axial and peripheral articular manifestations of the seronegative spondylarthropathies: a Department of Veterans Affairs cooperative study. Arthritis Rheum. 1999;42:2325-2329. [PubMed] [DOI] |
| 14. | Generini S, Giacomelli R, Fedi R, Fulminis A, Pignone A, Frieri G, Del Rosso A, Viscido A, Galletti B, Fazzi M. Infliximab in spondyloarthropathy associated with Crohn's disease: an open study on the efficacy of inducing and maintaining remission of musculoskeletal and gut manifestations. Ann Rheum Dis. 2004;63:1664-1669. [PubMed] |
| 15. | Van den Bosch F, Kruithof E, De Vos M, De Keyser F, Mielants H. Crohn's disease associated with spondyloarthropathy: effect of TNF-alpha blockade with infliximab on articular symptoms. Lancet. 2000;356:1821-1822. [PubMed] [DOI] |
| 16. | Card T, West J, Hubbard R, Logan RF. Hip fractures in patients with inflammatory bowel disease and their relationship to corticosteroid use: a population based cohort study. Gut. 2004;53:251-255. [PubMed] [DOI] |
| 17. | Tsai MS, Lin CL, Tu YK, Lee PH, Kao CH. Risks and predictors of osteoporosis in patients with inflammatory bowel diseases in an Asian population: a nationwide population-based cohort study. Int J Clin Pract. 2015;69:235-241. [PubMed] [DOI] |
| 18. | Adriani A, Pantaleoni S, Luchino M, Ribaldone DG, Reggiani S, Sapone N, Sguazzini C, Isaia G, Pellicano R, Astegiano M. Osteopenia and osteoporosis in patients with new diagnosis of inflammatory bowel disease. Panminerva Med. 2014;56:145-149. [PubMed] |
| 19. | Tavarela Veloso F. Review article: skin complications associated with inflammatory bowel disease. Aliment Pharmacol Ther. 2004;20 Suppl 4:50-53. [PubMed] |
| 20. | Pellicer Z, Santiago JM, Rodriguez A, Alonso V, Antón R, Bosca MM. Management of cutaneous disorders related to inflammatory bowel disease. Ann Gastroenterol. 2012;25:21-26. [PubMed] |
| 21. | Orchard TR, Chua CN, Ahmad T, Cheng H, Welsh KI, Jewell DP. Uveitis and erythema nodosum in inflammatory bowel disease: clinical features and the role of HLA genes. Gastroenterology. 2002;123:714-718. [PubMed] [DOI] |
| 22. | Farhi D, Cosnes J, Zizi N, Chosidow O, Seksik P, Beaugerie L, Aractingi S, Khosrotehrani K. Significance of erythema nodosum and pyoderma gangrenosum in inflammatory bowel diseases: a cohort study of 2402 patients. Medicine (Baltimore). 2008;87:281-293. [PubMed] [DOI] |
| 23. | Quin A, Kane S, Ulitsky O. A case of fistulizing Crohn's disease and erythema nodosum managed with adalimumab. Nat Clin Pract Gastroenterol Hepatol. 2008;5:278-281. [PubMed] [DOI] |
| 24. | Sheldon DG, Sawchuk LL, Kozarek RA, Thirlby RC. Twenty cases of peristomal pyoderma gangrenosum: diagnostic implications and management. Arch Surg. 2000;135:564-568; discussion 564-568. [PubMed] [DOI] |
| 25. | Marzano AV, Ishak RS, Saibeni S, Crosti C, Meroni PL, Cugno M. Autoinflammatory skin disorders in inflammatory bowel diseases, pyoderma gangrenosum and Sweet's syndrome: a comprehensive review and disease classification criteria. Clin Rev Allergy Immunol. 2013;45:202-210. [PubMed] [DOI] |
| 26. | Weizman AV, Huang B, Targan S, Dubinsky M, Fleshner P, Kaur M, Ippoliti A, Panikkath D, Vasiliauskas E, Shih D. Pyoderma Gangrenosum among Patients with Inflammatory Bowel Disease: A Descriptive Cohort Study. J Cutan Med Surg. 2015;19:125-131. [PubMed] [DOI] |
| 27. | Friedman S, Marion JF, Scherl E, Rubin PH, Present DH. Intravenous cyclosporine in refractory pyoderma gangrenosum complicating inflammatory bowel disease. Inflamm Bowel Dis. 2001;7:1-7. [PubMed] [DOI] |
| 28. | Argüelles-Arias F, Castro-Laria L, Lobatón T, Aguas-Peris M, Rojas-Feria M, Barreiro-de Acosta M, Soto-Escribano P, Calvo-Moya M, Ginard-Vicens D, Chaparro-Sánchez M. Characteristics and treatment of pyoderma gangrenosum in inflammatory bowel disease. Dig Dis Sci. 2013;58:2949-2954. [PubMed] [DOI] |
| 29. | Lourenço SV, Hussein TP, Bologna SB, Sipahi AM, Nico MM. Oral manifestations of inflammatory bowel disease: a review based on the observation of six cases. J Eur Acad Dermatol Venereol. 2010;24:204-207. [PubMed] |
| 30. | Katsanos KH, Roda G, Brygo A, Delaporte E, Colombel JF. Oral Cancer and Oral Precancerous Lesions in Inflammatory Bowel Diseases: A Systematic Review. J Crohns Colitis. 2015;9:1043-1052. [PubMed] [DOI] |
| 31. | Calvo P, Pablo L. Managing IBD outside the gut: ocular manifestations. Dig Dis. 2013;31:229-232. [PubMed] [DOI] |
| 32. | Manganelli C, Turco S, Balestrazzi E. Ophthalmological aspects of IBD. Eur Rev Med Pharmacol Sci. 2009;13 Suppl 1:11-13. [PubMed] |
| 33. | Wang R, Leong RW. Primary sclerosing cholangitis as an independent risk factor for colorectal cancer in the context of inflammatory bowel disease: a review of the literature. World J Gastroenterol. 2014;20:8783-8789. [PubMed] |
| 34. | Eaton JE, Silveira MG, Pardi DS, Sinakos E, Kowdley KV, Luketic VA, Harrison ME, McCashland T, Befeler AS, Harnois D. High-dose ursodeoxycholic acid is associated with the development of colorectal neoplasia in patients with ulcerative colitis and primary sclerosing cholangitis. Am J Gastroenterol. 2011;106:1638-1645. [PubMed] [DOI] |
| 35. | Wieser V, Gerner R, Moschen AR, Tilg H. Liver complications in inflammatory bowel diseases. Dig Dis. 2013;31:233-238. [PubMed] [DOI] |
| 36. | Gizard E, Ford AC, Bronowicki JP, Peyrin-Biroulet L. Systematic review: The epidemiology of the hepatobiliary manifestations in patients with inflammatory bowel disease. Aliment Pharmacol Ther. 2014;40:3-15. [PubMed] [DOI] |
| 37. | Brink MA, Slors JF, Keulemans YC, Mok KS, De Waart DR, Carey MC, Groen AK, Tytgat GN. Enterohepatic cycling of bilirubin: a putative mechanism for pigment gallstone formation in ileal Crohn's disease. Gastroenterology. 1999;116:1420-1427. [PubMed] [DOI] |
| 38. | Herrlinger KR, Stange EF. The pancreas and inflammatory bowel diseases. Int J Pancreatol. 2000;27:171-179. [PubMed] [DOI] |
| 39. | Chen YT, Su JS, Tseng CW, Chen CC, Lin CL, Kao CH. Inflammatory bowel disease on the risk of acute pancreatitis: A population-based cohort study. J Gastroenterol Hepatol. 2015; Sep 28. [Epub ahead of print]. [PubMed] [DOI] |
| 40. | Teich N, Mohl W, Bokemeyer B, Bündgens B, Büning J, Miehlke S, Hüppe D, Maaser C, Klugmann T, Kruis W. Azathioprine-induced acute pancreatitis in patients with inflammatory bowel diseases-a prospective study on incidence and severity. J Crohns Colitis. 2015; Oct 13. [Epub ahead of print]. [PubMed] |
| 41. | Katsanos A, Asproudis I, Katsanos KH, Dastiridou AI, Aspiotis M, Tsianos EV. Orbital and optic nerve complications of inflammatory bowel disease. J Crohns Colitis. 2013;7:683-693. [PubMed] [DOI] |
| 42. | Gondim FA, Brannagan TH, Sander HW, Chin RL, Latov N. Peripheral neuropathy in patients with inflammatory bowel disease. Brain. 2005;128:867-879. [PubMed] [DOI] |
| 43. | Stovicek J, Liskova P, Lisy J, Hlava S, Keil R. Crohn's disease: is there a place for neurological screening? Scand J Gastroenterol. 2014;49:173-176. [PubMed] [DOI] |
| 44. | Ji XQ, Wang LX, Lu DG. Pulmonary manifestations of inflammatory bowel disease. World J Gastroenterol. 2014;20:13501-13511. [PubMed] [DOI] |
| 45. | Black H, Mendoza M, Murin S. Thoracic manifestations of inflammatory bowel disease. Chest. 2007;131:524-532. [PubMed] |
| 46. | Songür N, Songür Y, Tüzün M, Doğan I, Tüzün D, Ensari A, Hekimoglu B. Pulmonary function tests and high-resolution CT in the detection of pulmonary involvement in inflammatory bowel disease. J Clin Gastroenterol. 2003;37:292-298. [PubMed] |
| 47. | Lee HS, Jo KW, Shim TS, Song JW, Lee HJ, Hwang SW, Park SH, Yang DH, Kim KJ, Ye BD. Six Cases of Lung Injury Following Anti-tumour Necrosis Factor Therapy for Inflammatory Bowel Disease. J Crohns Colitis. 2015;9:1053-1057. [PubMed] |
| 48. | Rungoe C, Nyboe Andersen N, Jess T. Inflammatory bowel disease and risk of coronary heart disease. Trends Cardiovasc Med. 2015;25:699-704. [PubMed] [DOI] |
| 49. | Ruisi P, Makaryus JN, Ruisi M, Makaryus AN. Inflammatory bowel disease as a risk factor for premature coronary artery disease. J Clin Med Res. 2015;7:257-261. [PubMed] [DOI] |
| 50. | Rungoe C, Basit S, Ranthe MF, Wohlfahrt J, Langholz E, Jess T. Risk of ischaemic heart disease in patients with inflammatory bowel disease: a nationwide Danish cohort study. Gut. 2013;62:689-694. [PubMed] [DOI] |
| 51. | Corica D, Romano C. Renal Involvement in Inflammatory Bowel Diseases. J Crohns Colitis. 2015; Jul 29. [Epub ahead of print]. [PubMed] [DOI] |
| 52. | Cury DB, Moss AC, Schor N. Nephrolithiasis in patients with inflammatory bowel disease in the community. Int J Nephrol Renovasc Dis. 2013;6:139-142. [PubMed] [DOI] |
| 53. | Ambruzs JM, Walker PD, Larsen CP. The histopathologic spectrum of kidney biopsies in patients with inflammatory bowel disease. Clin J Am Soc Nephrol. 2014;9:265-270. [PubMed] [DOI] |
| 54. | Issa H, Al-Momen S, Bseiso B, Al-Janobi GA, Aljama MA, Almousa FA, Al-Jarodi ME, Al-Salem AH. Thromboembolism in inflammatory bowel diseases: a report from Saudi Arabia. Clin Exp Gastroenterol. 2011;4:1-7. [PubMed] [DOI] |
| 55. | Zezos P, Kouklakis G, Saibil F. Inflammatory bowel disease and thromboembolism. World J Gastroenterol. 2014;20:13863-13878. [PubMed] [DOI] |
| 56. | Sanderson IR. Growth problems in children with IBD. Nat Rev Gastroenterol Hepatol. 2014;11:601-610. [PubMed] [DOI] |
| 57. | Pituch-Zdanowska A, Banaszkiewicz A, Dziekiewicz M, Łazowska-Przeorek I, Gawrońska A, Kowalska-Duplaga K, Iwańczak B, Klincewicz B, Grzybowska-Chlebowczyk U, Walkowiak J. Overweight and obesity in children with newly diagnosed inflammatory bowel disease. Adv Med Sci. 2015; Aug 8. 61: 28-31 [Epub ahead of print]. [PubMed] [DOI] |