修回日期: 2015-01-23
接受日期: 2015-01-30
在线出版日期: 2015-03-28
目的: 探讨顺铂(顺式二氨二氯铂)(cis-dichlorodiamineplatinum, DDP)对人结肠癌Caco-2细胞凋亡及相关蛋白Bcl-2、Caspase9、Caspase3表达的影响.
方法: 体外培养结肠癌Caco-2细胞; 检测不同浓度DDP干预下MTT染色的A值, 判定其对人结肠癌细胞恶性增殖的影响; 不同浓度DDP对人结肠癌细胞凋亡的影响使用流式细胞仪进行检测, Western blot检测不同浓度DDP对人结肠癌细胞内Bcl-2蛋白的表达; 应用分光光度法检测不同浓度DDP对人结肠癌细胞内Caspase9、Caspase3蛋白活性的影响.
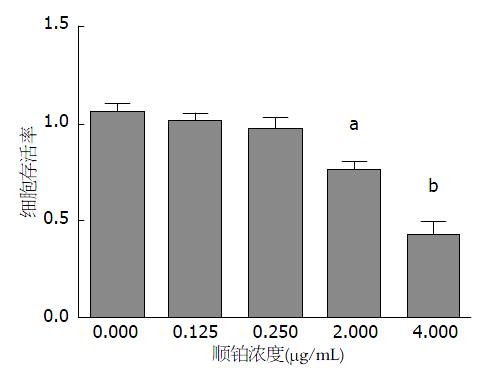
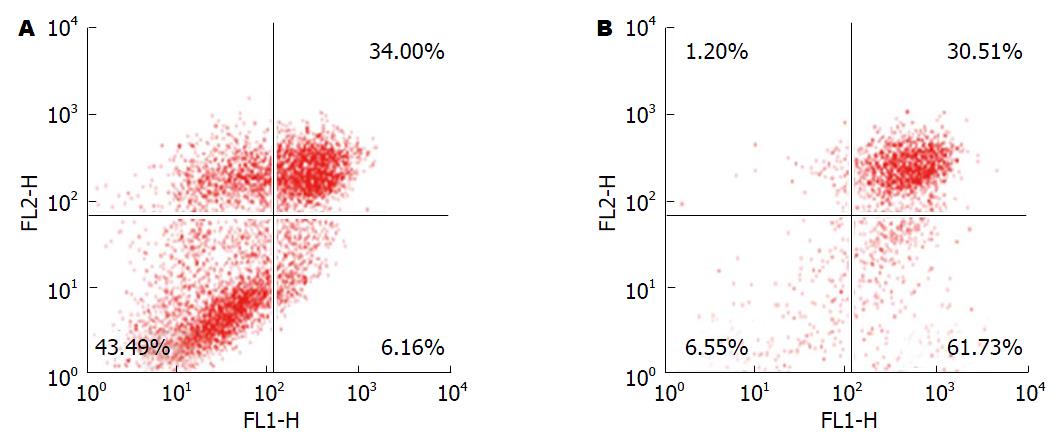
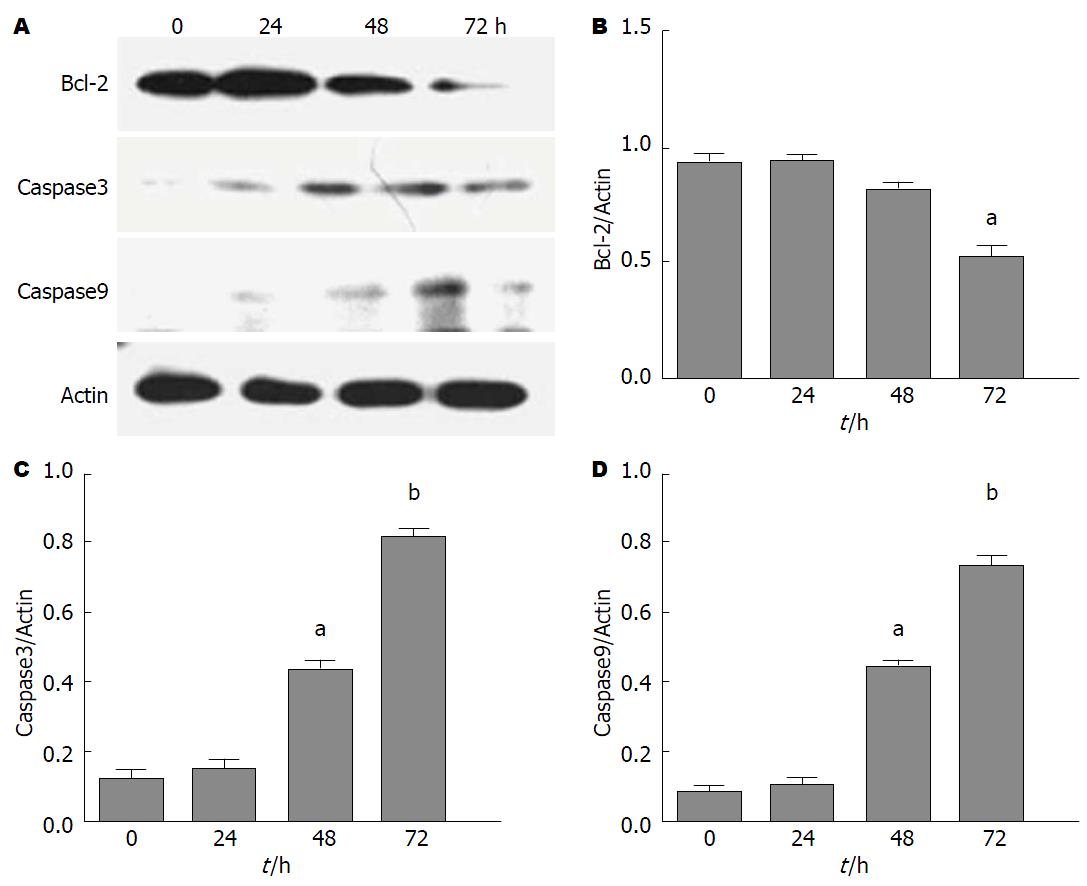
结果: (1)癌细胞增殖结果显示, 在一定的作用时间范围内, Caco-2细胞存活率与DDP浓度呈负相关, 具有剂量依赖性, 其中4.000、2.000 µg/mL干预的各组细胞抑制率最显著, 差异均有统计学意义(P<0.05). 而低剂量组0.250、0.125 µg/mL及对照DMSO干预组细胞存活率比较差异均无统计学意义(P>0.05), 其细胞存活率明显高于其他各浓度组, 差异有统计学意义(P<0.01); (2)流式细胞仪检测结果显示: DDP能诱导Caco-2细胞的凋亡, 其诱导凋亡的效果呈时间和剂量性依赖; (3)Western blot检测结果显示: Bcl-2蛋白在结肠癌Caco-2细胞中低表达, DDP干预Caco-2细胞72 h后, 与对照组比较, Bcl-2蛋白表达明显下降(P<0.05). Caspase9、Caspase3在Caco-2细胞中低表达, DDP干预Caco-2细胞48、72 h后, 与对照组比较, Caspase9、Caspase3表达明显升高(P<0.01).
结论: 顺铂可以抑制Caco-2细胞增殖、诱导Caco-2细胞凋亡, 其机制可能与活化Caco-2细胞中Caspase9、Caspase3蛋白以及抑制Bcl-2蛋白表达有关.
核心提示: 顺铂可以抑制Caco-2细胞增殖、诱导Caco-2细胞凋亡, 其机制可能与活化Caco-2细胞中Caspase9、Caspase3蛋白以及抑制Bcl-2蛋白表达有关.
引文著录: 李世清, 陈福敏, 罗君, 陈龙, 齐曼. 顺铂对结肠癌细胞株Caco-2增殖凋亡和Bcl-2、Caspase3、Caspase9蛋白表达的影响. 世界华人消化杂志 2015; 23(9): 1460-1464
Revised: January 23, 2015
Accepted: January 30, 2015
Published online: March 28, 2015
AIM: To investigate whether cisplatin induces the apoptosis of colon cancer Caco-2 cells and inhibits the expression of Bcl-2, Caspase9 and Caspase3.
METHODS: Caco-2 cells were treated with cisplatin. Cell proliferation was measured by MTT assay and fluorescence microscopy. The protein expression of Bcl-2 was determined by Western blot, and the protein expression of Caspase9 and Caspase3 was determined by spectrophotometry.
RESULTS: Cisplatin inhibited the proliferation of Caco-2 cells in a concentration-dependent manner, and the survival rates of cells treated with 4 and 2 µg/mL cisplatin showed a statistical difference (P < 0.01), although there was no significant difference between cells treated with l.0 and 0.5 µg/mL cisplatin (P > 0.05). Cisplatin induced the apoptosis of Caco-2 cells in a time- and dose-dependent manner. Bcl-2 protein was highly expressed in Caco-2 cells. Cisplatin intervention for 72 h significantly reduced the expression of Bcl-2 protein in Caco-2 cells compared with control cells (P < 0.05).The protein expression of Caspase9 and Caspase3 was significantly up-regulated at 48 and 72 h after treatment with cisplatin when compared with control cells (P < 0.01).
CONCLUSION: Cisplatin inhibits the proliferation and induces apoptosis of Caco-2 cells via mechanisms that may be related to activation of Caspase9 and Caspase3 and inhibition of Bcl-2 protein expression.
- Citation: Li SQ, Chen FM, Luo J, Chen L, Qi M. Effect of cisplatin on cell proliferation and apoptosis and expression of Bcl-2, Caspase3 and Caspase9 proteins in human colon carcinoma cell line Caco-2. Shijie Huaren Xiaohua Zazhi 2015; 23(9): 1460-1464
- URL: https://www.wjgnet.com/1009-3079/full/v23/i9/1460.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i9.1460
结肠癌是一种常见的消化系恶性肿瘤, 严重威胁着人们的健康. 结肠癌可以通过手术予以切除治疗, 但治疗后多半会出现复发和转移, 因此寻求到有效的抗癌药物成为结肠癌治疗的关键问题之一[1]. 在临床上的各种实体瘤的治疗中, 铂类药物使用最广泛且具有最佳的治疗效果[2,3]. 但是, 单独使用铂类药物具有明显的不良反应, 主要是因为铂类容易与核蛋白或者DNA交联, 形成DNA-蛋白质交联产物, 进而活化分裂原活化蛋白激酶、p53、p73和Bcl-2等众多细胞凋亡相关的通路, 引发细胞凋亡的发生或抑制细胞周期发生[4]. 为了研究顺铂对于人结肠癌细胞生长增殖的抑制作用, 我们做了该研究, 现汇报如下.
细胞株Caco2采购自美国菌种保藏中心(ATCC), 胎牛血清采购自Gibco公司, 青霉素、链霉素采购自杭州民生药业有限公司.
1.2.1 细胞培养: 细胞培养在DMEM完全培养基中, 添加10%的胎牛血清(fatal bovine serum, FBS), 青霉素(100 U/mL)和链霉素(100 µg/mL). 于37 ℃、50 mL/L CO2培养箱中通气培养.
1.2.2 MTT测定DDP对Caco-2细胞增殖的影响: 按照试剂盒要求配置MTT溶液, 浓度为5 mg/mL. 每孔加入培养基终体积1/10 MTT溶液, 37 ℃细胞培养箱内孵育4 h. 终止培养, 小心吸去孔内培养液. 加入100 µL MTT显色液, 摇床低速震荡10 min. 在570 nm处测定吸光度(A)值. 细胞存活率 = (实验组A值-调零组A值)/(对照组A值-调零组A值).
1.2.3 流水细胞仪检测DDP对Caco-2细胞凋亡的影响: 取对数生长的Caco-2细胞1×106置于培养皿中培养24 h, 贴壁后, 分别加入终浓度为(0.000, 0.125, 0.250, 2.000, 4.000 µg/mL)的DPP; 培养48 h后, 胰酶消化后, 离心后弃上清, 加缓冲液200 µL, 分出100 µL作为参照. 细胞凋亡的检测: 取出细胞, 倒去培养液, 胰酶适度消化细胞, 用培养液吹打, 1500 r/min, 离心6 min, 去上清. PBS洗1次后, 重悬于1×Binding Buffer中, 转移至流式管中. 加入FITC-Annexin V和PI, 轻柔弹起混匀, 室温(25 ℃)避光孵育15 min. 加400 µL 1×Binding Buffer至每管中, 混匀. 1 h内上机分析.
1.2.4 Western blot检测DDP对Caco-2细胞Bcl-2、Caspase3、Caspase9蛋白表达的影响: Western blot实验方法介绍如文献[5]所示: 通过破裂细胞, 获取细胞裂解液进行SDS-PAGE凝胶电泳, 并与抗Bcl-2、Caspase3、Caspase9 (Millipore)孵育过夜, 然后洗涤, 再与二抗孵育1 h, 最后用检测蛋白含量.
统计学处理 采用SPSS17.0软件包进行统计学处理, 实验数据以mean±SD表示, 组间数据通过方差分析和相关性分析进行分析, 以P<0.05表示数据是否具有统计学意义.
利用MTT法测定不同浓度的DDP(0.000, 0.125, 0.250, 2.000, 4.000 µg/mL)作用结肠癌细胞Caco-2, 从图1可以看出, 顺铂对结肠癌细胞Caco-2生存率的抑制作用在相同作用时间, DPP对Caco-2细胞抑制作用具有剂量依赖性, 其中作用浓度为4.000、2.000 µg/mL具有最明显的抑制作用, 且差异具有统计学意义(P<0.05). 低剂量组及DMSO干预组细胞存活率比较差异均无统计学意义(P>0.05).
为了进一步确认DDP诱导结肠癌细胞Caco-2凋亡的效果, 我们采用相差和荧光显微镜下观察, 流式细胞检测结果显示: DDP能诱导Caco-2细胞的凋亡, 其诱导凋亡的效果. 细胞凋亡流式检测结果说明, DPP处理过的细胞与对照细胞相比, 早期凋亡细胞显著增多, 而晚期凋亡细胞几乎没有变化(图2).
Western blot检测结果显示: Bcl-2蛋白在结肠癌Caco-2细胞中低表达, DDP干预Caco-2细胞72 h后, 与对照组比较, Bcl-2蛋白表达明显下降(P<0.05). Caspase9、Caspase3在Caco-2细胞中低表达, DDP干预Caco-2细胞48、72 h后, 与对照组比较, Caspase9、Caspase3表达明显升高(P<0.01)(图3).
Bcl-2蛋白质家族成员包括促凋亡蛋白(pro-apoptotic proteins), 如Bax, Bim, Bok, Bad等, 抗凋亡蛋白(anti-apoptotic proteins), 如Bcl-2, Bcl-xl, Bfl-1等[6]. 抗凋亡蛋白通常以膜蛋白的形式存在, 而促凋亡蛋白则广泛分布于细胞质. 当外界有刺激细胞凋亡相关的应激发生时, 促凋亡相关的蛋白成员发生构象上的变化, 并从胞质中游离到细胞器膜上, 与膜上的抗凋亡蛋白, 如Bcl-2家族相结合, 进而抑制抗凋亡相关蛋白的生物活性, 导致细胞凋亡的发生[7], Bcl-2是线粒体凋亡途径的重要因子, Bcl-2蛋白通过以与线粒体膜上抗凋亡相关的蛋白结合, 继而对细胞色素C释放进行抑制, 促使细胞抗凋亡的发生[8,9].
Caspases是富含半胱氨酸的天冬氨酸特异性蛋白酶, 同时具有特异酶切天冬氨酸位点, 是一类与细胞凋亡相关的蛋白酶家族. Caspases家族是一类在氨基酸序列、结构及酶的特性上具有相似性的蛋白总称, 一般情况下, 以无活性的酶原形式存在于胞质中, 根据其具体构象可以分为3部分, 即一大一小两个亚基及一个N端前域. Caspase是促使细胞凋亡的最终途径, 在介导细胞凋亡的过程中发挥极其关键的作用, 是多条凋亡通路的汇聚点, 是执行凋亡的最终途径, 此外, Caspase的另外一种行使功能的机制是通过相互激活完成自我活化, 一旦启动凋亡过程, 即表现出级联放大效应[10]. Caspase9位于级联反应上游, 是最重要的凋亡始动子之一, 在其他蛋白参与下发生自我激化并激活下游的Caspase因子, 如Caspase3, 然后引起级联放大效应, 从而导致细胞的凋亡. Caspase3是重要的凋亡效应子, 是凋亡的关键蛋白酶[11], Caspase3一旦被激活, 即发生下游的级联反应,使凋亡不可避免. 在正常生理条件下, Caspase3在胞质中以无活性的酶原形存在, 一旦细胞发生凋亡, Caspase3在可以再胞质中被多种蛋白水解酶作用并发生裂解[12-14]. Caspase3活化后对细胞裂解依赖于3种作用方式[15]: (1)凋亡抑制物的酶解失活; (2)细胞架蛋白的酶解失活; (3)DNA修复相关蛋白的酶解失活. 有研究表明, Bcl-2蛋白不仅可以与线粒体膜结合, 抑制细胞色素C释放, 从而阻止Caspase的活化发挥其抗凋亡的作用, 还可拮抗Caspases级联放大效应; Caspase活化后则可灭活Bcl-2, Bcl-2灭活后可促使细胞的功能和形态发生变化, 诱导凋亡.
本实验初步探讨不同浓度顺铂对激素非依赖性结肠癌Caco-2细胞系的体外抑制作用和观察Caco-2细胞中Bcl-2、Caspase9、Caspase3蛋白表达, 并分析细胞系的体外抑制作用和蛋白表达之间的关系, 为进一步研究提供实验依据.
结肠癌是一种常见的消化系恶性肿瘤, 严重威胁着人们的健康. 结肠癌可以通过手术予以切除治疗, 但治疗后多半会出现复发和转移, 因此寻求到有效的抗癌药物成为结肠癌治疗的关键问题之一.
白雪, 副主任医师, 中国人民解放军北京军区总医院普通外科
铂类药物是目前最有效的抗癌药物之一, 广泛应用于各种实体瘤的治疗. 铂类药物的细胞毒作用主要是铂类与核蛋白连接, 形成铂类药物与DNA链间或链内交联以及DNA-蛋白质交联损伤, DNA损伤信号可以通过促分裂原活化蛋白激酶、p53、p73 和Bcl-2等多种信号转导通路, 介导凋亡信号的激活, 最终引起细胞凋亡或细胞周期抑制.
本实验初步探讨不同浓度顺铂对激素非依赖性结肠癌Caco-2细胞系的体外抑制作用和观察Caco-2细胞中Bcl-2、Caspases9、Caspase3蛋白表达, 并分析细胞系的体外抑制作用和蛋白表达之间的关系, 尚属首次.
本研究有一定的新颖性.
编辑: 郭鹏 电编:都珍珍
| 1. | Alavizadeh SH, Badiee A, Golmohammadzadeh S, Jaafari MR. The influence of phospholipid on the physicochemical properties and anti-tumor efficacy of liposomes encapsulating cisplatin in mice bearing C26 colon carcinoma. Int J Pharm. 2014;473:326-333. [PubMed] [DOI] |
| 2. | Amin M, Badiee A, Jaafari MR. Improvement of pharmacokinetic and antitumor activity of PEGylated liposomal doxorubicin by targeting with N-methylated cyclic RGD peptide in mice bearing C-26 colon carcinomas. Int J Pharm. 2013;458:324-333. [PubMed] [DOI] |
| 3. | Chen J, Cheng D, Li J, Wang Y, Guo JX, Chen ZP, Cai BC, Yang T. Influence of lipid composition on the phase transition temperature of liposomes composed of both DPPC and HSPC. Drug Dev Ind Pharm. 2013;39:197-204. [PubMed] [DOI] |
| 4. | DeMarzo AM, Nelson WG, Isaacs WB, Epstein JI. Pathological and molecular aspects of prostate cancer. Lancet. 2003;361:955-964. [PubMed] [DOI] |
| 5. | Chen J, Yan GJ, Hu RR, Gu QW, Chen ML, Gu W, Chen ZP, Cai BC. Improved pharmacokinetics and reduced toxicity of brucine after encapsulation into stealth liposomes: role of phosphatidylcholine. Int J Nanomedicine. 2012;7:3567-3577. [PubMed] |
| 6. | Majumder PK, Yeh JJ, George DJ, Febbo PG, Kum J, Xue Q, Bikoff R, Ma H, Kantoff PW, Golub TR. Prostate intraepithelial neoplasia induced by prostate restricted Akt activation: the MPAKT model. Proc Natl Acad Sci USA. 2003;100:7841-7846. [PubMed] |
| 7. | Gao H, Ouyang X, Banach-Petrosky WA, Gerald WL, Shen MM, Abate-Shen C. Combinatorial activities of Akt and B-Raf/Erk signaling in a mouse model of androgen-independent prostate cancer. Proc Natl Acad Sci USA. 2006;103:14477-14482. [PubMed] |
| 8. | Ellwood-Yen K, Graeber TG, Wongvipat J, Iruela-Arispe ML, Zhang J, Matusik R, Thomas GV, Sawyers CL. Myc-driven murine prostate cancer shares molecular features with human prostate tumors. Cancer Cell. 2003;4:223-238. [PubMed] |
| 9. | Abate-Shen C, Banach-Petrosky WA, Sun X, Economides KD, Desai N, Gregg JP, Borowsky AD, Cardiff RD, Shen MM. Nkx3.1; Pten mutant mice develop invasive prostate adenocarcinoma and lymph node metastases. Cancer Res. 2003;63:3886-3890. [PubMed] |
| 10. | Pradelli LA, Villa E, Zunino B, Marchetti S, Ricci JE. Glucose metabolism is inhibited by caspases upon the induction of apoptosis. Cell Death Dis. 2014;5:e1406. [PubMed] |
| 11. | Shang Y, Myers M, Brown M. Formation of the androgen receptor transcription complex. Mol Cell. 2002;9:601-610. [PubMed] [DOI] |
| 12. | Shi XB, Xue L, Yang J, Ma AH, Zhao J, Xu M, Tepper CG, Evans CP, Kung HJ, deVere White RW. An androgen-regulated miRNA suppresses Bak1 expression and induces androgen-independent growth of prostate cancer cells. Proc Natl Acad Sci USA. 2007;104:19983-19988. [PubMed] [DOI] |
| 13. | So A, Gleave M, Hurtado-Col A, Nelson C. Mechanisms of the development of androgen independence in prostate cancer. World J Urol. 2005;23:1-9. [PubMed] [DOI] |
| 14. | Danial NN. BCL-2 family proteins: critical checkpoints of apoptotic cell death. Clin Cancer Res. 2007;13:7254-7263. [PubMed] [DOI] |
| 15. | Murphy KM, Streips UN, Lock RB. Bcl-2 inhibits a Fas-induced conformational change in the Bax N terminus and Bax mitochondrial translocation. J Biol Chem. 2000;275:17225-17228. [PubMed] [DOI] |