修回日期: 2015-01-24
接受日期: 2015-01-29
在线出版日期: 2015-03-28
目的: 探究原花青素(proanthocyanidin, PC)抗氧化功能对大鼠肢体缺血再灌注(limb ischemia-reperfusion, LI/R)损伤后肠道的保护作用及可能的机制.
方法: 健康成年Sprague-Dawley♂大鼠21只, 随机分为假手术组(n = 7), 缺血再灌注组(n = 7), PC组(n = 7); PC组给予PC 100 mg/(kg•d)预处理, 其余两组灌胃等量色拉油, 连续给药7 d. 采用止血带捆绑大鼠左后肢复制缺血3 h后再灌注18 h大鼠LI/R模型, 随后打开腹腔, 分离腹主动脉取血离心, 测定血清超氧化物歧化酶(superoxide dismutase, SOD)活力值和丙二醛(malondialdehyde, MDA)含量, 取回肠组织进行苏木精-伊红(HE)染色, 同时制备肠组织匀浆测定分泌型免疫球蛋白A(secretory immunoglobulin A, sIgA)的含量.
结果: 与假手术组比较, LI/R后, 血清SOD活力降低(P<0.01), MDA含量增多(P<0.01), 大鼠肠黏膜损伤加重(P<0.01), 且肠组织中sIgA含量明显减少(P<0.01); 与LI/R组相比, PC预处理后, 大鼠血清SOD活力提高(P<0.05), MDA的含量明显减少(P<0.01), 肠黏膜损伤减轻(P<0.01), 肠组织中sIgA含量上升(P<0.05).
结论: PC可通过提高血清SOD活力, 减少MDA含量, 增加肠组织中sIgA含量来减轻肠黏膜损伤, 进而减轻LI/R后大鼠肠道损伤.
核心提示: 原花青素(proanthocyanidin)可以提高血清超氧化物歧化酶(superoxide dismutase)活性、降低血清丙二醛(malondialdehyde)和肠组织分泌型免疫球蛋白A(secretory immunoglobulin A)含量来减轻肢体缺血再灌注(limb ischemia-reperfusion, LI/R)对肠黏膜功能的损伤, 是今后LI/R损伤应借鉴的, 减少LI/R损伤后的氧化应激反应是今后临床治疗的又一途径.
引文著录: 宋强, 罗兰, 杨拯, 卓睿, 李禹呈, 陈勇, 唐丽娟, 黄倩, 计震华, 杨德晶. 原花青素抗氧化应激效应对大鼠肢体缺血再灌注后肠黏膜的保护作用. 世界华人消化杂志 2015; 23(9): 1454-1459
Revised: January 24, 2015
Accepted: January 29, 2015
Published online: March 28, 2015
AIM: To investigate the protective effect of proanthocyanidin (PC) on the intestinal mucosa of rats with limb ischemia-reperfusion (LI/R) and to explore the possible mechanism.
METHODS: Twenty-one male adult Sprague-Dawley rats were randomly divided into three groups (n = 7): sham operation group, LI/R group and PC group. The PC group received 100 mg/(kg•d) PC via oral gavage for 7 d before LI/R. The sham operation and LI/R groups were given the same dose of salad oil each day for 7 d. A tourniquet was used to tie the rat left hind limb to induce LI/R injury in rats (ischemia 3 h and reperfusion 18 h). Following reperfusion, the abdominal cavity was opened and blood samples were taken from the abdominal aorta to determine serum superoxide dismutase (SOD) and malondialdehyde (MDA) levels. Segments of the ileum were quickly resected and equally separated into two parts to conduct hematoxylin & eosin (H&E) staining and determine tissue secretory immunoglobulin A (sIgA) levels, respectively.
RESULTS: Compared with the sham operation group, serum SOD activity was significantly decreased (P < 0.01), MDA levels were significantly increased (P < 0.01), mucosal injury was significantly aggravated in light microscopic evaluations (P < 0.01) and tissue sIgA (P < 0.01) was significantly reduced after LI/R. Compared with the LI/R group, pretreatment with PC significantly enhanced serum SOD activity (P < 0.05), decreased MDA levels (P < 0.01), mitigated intestinal mucosal injury (P < 0.01) and increased the tissue sIgA contents (P < 0.05).
CONCLUSION: PC protects the intestinal mucosa by elevating serum SOD activity, reducing MDA levels and increasing tissue sIgA contents in rats after LI/R injury.
- Citation: Song Q, Luo L, Yang Z, Zhuo R, Li YC, Chen Y, Tang LJ, Huang Q, Ji ZH, Yang DJ. Anti-oxidative stress effect of proanthocyanidin on intestinal mucosa of rats with limb ischemia-reperfusion injury. Shijie Huaren Xiaohua Zazhi 2015; 23(9): 1454-1459
- URL: https://www.wjgnet.com/1009-3079/full/v23/i9/1454.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i9.1454
缺血再灌注损伤(ischemia-reperfusion injury, I/RI)是指发生缺血后的组织器官在恢复血供后反而对机体损伤加重的现象[1,2], 研究[3,4]表明, 肢体缺血再灌注(limb ischemia-reperfusion, LI/R)不仅会引起缺血肢体的损伤, 也会引起远隔重要器官的损伤, 在内脏组织中, 肠组织是对缺血性损伤最为敏感的器官[5], 而临床上出现的肢体创伤、血管栓塞、腹主动脉瘤手术、断肢移植、挤压综合征、四肢手术和使用止血带等病症常引发LI/R损伤, 继而引发肠缺血再灌注损伤, 并释放大量氧自由基和炎性因子, 导致血液微循环障碍、钙超载、细胞凋亡等病理生理学改变[6-9], 因此如何有效预防和减轻这种损伤是基础与临床上较为热点的问题之一.
原花青素(proanthocyanidin, PC)是一类多酚类化合物的总称, 属于生物类黄酮[10], 广泛分布于植物界, 也存在某些饮料(茶叶、啤酒)、蔬菜、水果和粮食中, 与人类生活和健康密切相关. 研究[11]发现, PC具有强大的抗氧化和抗炎作用. 何沙沙等[12]和Stefanovic等[13]学者发现PC能明显减轻心肌和肾等组织和器官的I/RI程度.
本研究采用止血带结扎大鼠左后肢复制LI/R模型, 通过测定血清中超氧化物歧化酶(superoxide dismutase, SOD)活性、丙二醛(malondialdehyde, MDA)含量和肠组织分泌型免疫球蛋白A(secretory immunoglobulin A, sIgA)的含量并进行肠黏膜损伤程度评分, 探究PC对LI/R后肠道损伤保护作用, 旨在为减轻LI/R后引发肠道功能损害提供实验依据.
PC(四川省普菲德生物科技有限公司, 批号: 20120426, 纯度UV≥95%); 水合氯醛(成都市科龙化工试剂厂, 批号: 20100920); SOD试剂盒(南京建成生物试剂研究所, 批号: 20130709); MDA试剂盒(南京建成生物工程研究所, 批号: 20130709); TGL-16G台式离心机(上海安亭科学仪器厂); 721E型可见分光光度计(上海光谱仪器有限公司).
1.2.1 动物分组: 体质量为200 g±20 g的SD成年♂大鼠21只, 由四川省医学科学院•四川省人民医院实验动物研究所提供, 许可证号: SCXK(川)2013-15. 随机分为3组: 假手术组、缺血再灌注组、PC组, 每组7只.
1.2.2 动物日常护理和预处理措施: 实验大鼠置于清洁的鼠笼中单独喂养, 给予充足饲料, 自由饮水. 每天观察记录大鼠精神状况, 若大鼠出现异常表现则及时记录. PC治疗组大鼠灌胃100 mg/(kg•d)的PC[14], 假手术组和LI/R组大鼠每天灌胃等量色拉油, 连续灌胃7 d后制备LI/R动物模型.
1.2.3 复制LI/R动物模型: 大鼠在造模前12 h开始禁食, 自由饮水, 最后1次灌胃后2 h进行手术. 称质量后腹腔注射10%水合氯醛麻醉, Yassin法[15], 用止血带统一拉力复制缺血模型, 放置到温暖环境中, 3 h后剪断止血带恢复血供18 h, 假手术组进行同样操作后立即剪断止血带.
1.2.4 血清SOD活力和MDA含量测定: 大鼠腹主动脉取全血3500 r/min, 离心10 min, 分离血清置于-20 ℃保存备用. 按照试剂盒说明书测定SOD活力和MDA含量.
1.2.5 组织HE染色: 大鼠麻醉成功后, 打开腹腔, 取回盲瓣以上的肠段2 cm, 用4%多聚甲醛固定, 脱水, 包埋, 切片, 并进行苏木精-伊红(HE)染色, 采用Chiu's肠黏膜损伤评分法评价肠黏膜的损伤程度.
1.2.6 组织匀浆sIgA含量测定: 随后再取2 cm肠段去除肠内容物, 剪除肠系膜, 滤纸吸干, 称质量, 放入50 mL的小烧杯中, 量取体积为肠组织质量的9倍生理盐水, 先取总量的2/3加入烧杯中, 用眼科剪剪碎肠组织(在冰水浴中进行), 将剪碎的肠组织倒入玻璃匀浆器中, 再用剩余1/3的生理盐水冲洗残留在烧杯中的碎组织块, 一起倒入匀浆管中进行匀浆, 匀浆管下端插入盛有冰水混合物的器皿中, 充分研碎, 使组织匀浆化, 将制备好的10%匀浆液, 3500 r/min离心15 min, 取上清液, 存于-80 ℃冰箱. 采用ELISA法检测肠组织匀浆sIgA含量, 按试剂盒说明操作, 用酶标仪在450 nm波长下测定光密度值, 根据标准曲线计算样品中sIgA含量.
统计学处理 实验数据均使用SPSS17.0统计软件包分析处理, 结果用mean±SD表示, 各组均数比较采用单因素方差分析(One-way ANOVA), 选择Levene方法进行方差齐性检验, 符合方差齐性要求采Student-Newman-Keuls法(S-N-K)对数据进行组间比较, 结果均以mean±SD表示, 检验水准取α = 0.05, 当P<0.05为差异具有统计学意义.
各组大鼠灌胃药品后均无异常反应, 精神状态较好, 食量正常, 毛色未出现明显异常, 灌胃后的前2 d部分大鼠出现稀便而后自然恢复. 造模完成待大鼠苏醒后, 均呈现精神虚弱状态, 缺血再灌注组与PC组大鼠左后肢运动明显减少.
与假手术组比较, 缺血再灌注组血清SOD活力明显下降(P<0.01), MDA含量显著增加(P<0.01); 与缺血再灌注组比较, PC组的大鼠血清SOD活力升高(P<0.05), MDA含量显著减少(P<0.01), 且趋于假手术组(表1).
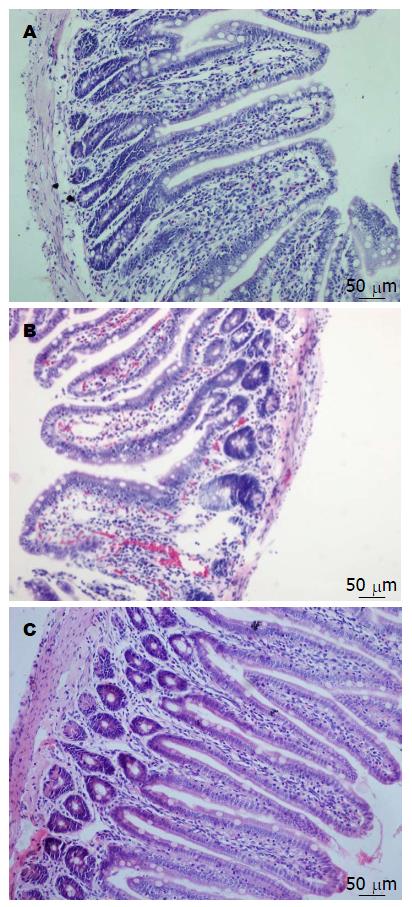
HE染色发现假手术组表现为正常绒毛; 缺血再灌注组小肠绒毛变钝、排列紊乱, 间质水肿明显并伴有炎细胞浸润; PC预处理后小肠黏膜损伤程度减轻, 炎性反应、水肿情况及血管反应优于缺血再灌注组大鼠(图1). 经Chiu's肠黏膜损伤评分, 缺血再灌注组大鼠肠黏膜的损伤程度强于假手术组(P<0.01), 而经PC预处理后明显低于缺血再灌注组(P<0.01)(表2).
与假手术组比较, 缺血再灌注组肠组织sIgA含量明显增加(P<0.01); 与缺血再灌注组比较, PC组肠组织sIgA含量减少(P<0.05)(表2).
PC属于生物类黄酮, 具有强大的抗氧化、抗炎作用. 动物机体自身不能合成, 只能从食物中摄取. PC具有多种生物学效应, 其中抗氧化作用受到了广泛关注. 研究[16]表明, 从葡萄籽中提取的PC具有极强的抗氧化、清除氧自由基作用和抗炎活性, PC在体内其抗氧化、清除自由基能力是维生素E的50倍、维生素C的20倍[17]. 近年对PC的研究已成为热点, 学者还发现PC能保护心脏, 保护血管、保护眼睛、抗炎、抗癌和抗氧化等功效[18].
LI/R损伤在肢体创伤和断肢移植手术中常见, 且术后易引发肠I/R损伤, 是致死率较高的重要因素[19]. 研究[20]表明, I/R不仅可以引起消化系局部的组织损害而且可以导致肠内细菌和毒素移位到体循环, 引起网状内皮系统发生系列反应, 进而导致大量相关介质及细胞因子的释放, 甚至引起多脏器功能衰竭综合征(multiple organdies dysfunction syndrome, MODS), 严重危及患者生命健康. 研究[21]发现, I/R后产生大量氧自由基引起细胞膜脂质过氧化是肠I/R损伤的重要途径, 受损的细胞膜导致整个细胞结构和功能异常, 使得肠道运动功能衰减. 在LI/R所引发的肠缺血再灌注脂质过氧化损伤中, 由于大量炎症介质释放以及氧自由基(ROS)等有害物质产生, 使得肠黏膜受到损伤. SOD是一种能有效清除自由基的内源性酶, 能对抗脂质过氧化损伤, 其活力越高表示机体清除自由基的能力越强. MDA是脂质过氧化反应的终产物之一, 机体缺血缺氧时产生自由基的多少与MDA含量呈正相关, 通过检测体内MDA水平的变化可间接反映体内脂质过氧化损伤的程度[22], 因此清除氧自由基, 减少脂质过氧化反应可能是减轻LI/R后肠道损伤的重要机制之一.
sIgA是胃肠道和黏膜表面主要免疫球蛋白, 对消化系黏膜防御起着重要作用, 可抑制肠道内的细菌黏附, 还可中和肠道内的毒素、酶和病毒, 并结合抗原形成免疫复合物由吞噬细胞清除[23], 他是防御病菌在肠道黏膜黏附和定植的第一道防线[24,25]. 而在创伤后, 黏膜sIgA水平下降, 有利于细菌、毒素侵入体内, 因此sIgA减少会削弱肠道的免疫功能, 可引起肠道菌群失调, 发生以脂肪痢疾为特征的消化吸收障碍, 甚至引起肠道细菌的易位而发生肠源性全身感染[26]. 本研究显示LI/R后肠组织sIgA含量降低, 表明LI/R后, 肠道免疫功能下降, 而PC预处理的大鼠肠组织sIgA含量较缺血再灌注组上升(P<0.05), 表明PC能通过改善LI/R后肠道免疫功能, 进而减轻肠黏膜损伤.
PC已经证实有抗炎、抗氧化、防癌、美白等多种药用理化特性[11,27]. 本研究显示, 经PC预处理后, 大鼠肠黏膜的损伤情况较缺血在灌注组明显改善(P<0.01)(表2); 而血清中SOD活性增加, MDA含量减少, 减轻了氧自由基对肠组织损伤; 肠组织sIgA含量上升, 表明小肠屏障功能得到改善(P<0.05). 此结果提示PC能有效清除LI/R后产生的氧自由基, 增强肠道的免疫屏障功能, 进而减轻肠黏膜损伤. 因此PC的开发利用具有广阔的前景, 但对其相关具体作用机制还有待更进一步深入研究.
目前对肢体缺血再灌注(limb ischemia-reperfusion, LI/R)损伤的关注越来越高. 研究表明, LI/R损伤可引起肠道I/R损伤, 而随后的氧化应激反应进一步加重肠道损伤, 表现为肠黏膜屏障功能的障碍. 因此, 减轻LI/R后氧自由基的产生, 保护肠黏膜屏障是减轻肠黏膜损伤的主要途径.
麻勇, 副研究员, 哈尔滨医科大学附属第一医院肝脏外科
对于LI/R损伤后肠道功能障碍的机制研究尚少. 事实上, 减少LI/R后氧自由基的产生是减轻组织损伤的主要途径之一. 已有文献提示, LI/R后出现氧化应激反应增强, 肠黏膜屏障功能障碍现象, 这为减轻LI/R损伤后肠黏膜损伤提供思路.
有学者已经明确原花青素(proanthocyanidin, PC)具有强大的抗氧化功能, 提示降低氧自由基的含量可以保护肠道功能, 之后也有研究发现LI/R对心脏肝等脏器功能有损伤作用, 但鲜有LI/R后肠黏膜损伤以及相关治疗方法的报道.
本研究通过实验性研究PC对LI/R损伤后血清超氧化物歧化酶(superoxide dismutase, SOD)活性、丙二醛(malondialdehyde, MDA)含量、肠组织分泌型免疫球蛋白A(secretory immunoglobulin A, sIgA)含量以及对肠黏膜的损伤程度的影响, 并阐明其可能通过抗氧化应激反应途径实现, 更直接科学的反映了LI/R对肠黏膜功能的损伤, 是既往未曾报道过的.
本研究方法中关于血清SOD活性、MDA含量、肠组织sIgA含量和肠黏膜损伤的变化程度, 是今后LI/R损伤应借鉴的, 减少LI/R损伤后的氧化应激反应是今后临床治疗的又一方向.
氧化应激: 是指机体在遭受各种有害刺激时, 体内高活性分子如活性氧自由基(reactive oxygen species)和活性氮自由基(reactive nitrogen species)产生过多, 氧化程度超出氧化物的清除, 氧化系统和抗氧化系统失衡, 从而导致组织损伤.
PC抗氧化应激效应是近年来该天然化合物研究的热点, 已在心脏、肝脏等重要脏器中得到研究验证, 而在LI/R损伤方面的研究鲜见报道. 本研究探讨PC抗氧化应激效应对大鼠LI/R后肠黏膜保护效应, 实验设计合理, 书写认真, 数据较为详实, 具有较好的创新性及学术价值.
编辑: 韦元涛 电编:都珍珍
| 2. | Mallick IH, Yang W, Winslet MC, Seifalian AM. Ischemia-reperfusion injury of the intestine and protective strategies against injury. Dig Dis Sci. 2004;49:1359-1377. [PubMed] [DOI] |
| 3. | Liu T, Fang Y, Liu S, Yu X, Zhang H, Liang M, Ding X. Limb ischemic preconditioning protects against contrast-induced acute kidney injury in rats via phosphorylation of GSK-3β. Free Radic Biol Med. 2015;81:170-182. [PubMed] [DOI] |
| 4. | 陈 雯, 刘 宁, 齐 迎春, 张 颖, 邓 昭阳, 杨 靖, 谢 晓华. 大鼠肢体缺血再灌注致心肌损伤中过氧化物酶及肿瘤坏死因子-α的动态变化及意义. 南方医科大学学报. 2013;33:761-764. |
| 5. | Shimojima N, Nakaki T, Morikawa Y, Hoshino K, Ozaki H, Hori M, Kitajima M. Interstitial cells of Cajal in dysmotility in intestinal ischemia and reperfusion injury in rats. J Surg Res. 2006;135:255-261. [PubMed] [DOI] |
| 7. | Kassahun WT, Schulz T, Richter O, Hauss J. Unchanged high mortality rates from acute occlusive intestinal ischemia: six year review. Langenbecks Arch Surg. 2008;393:163-171. [PubMed] [DOI] |
| 11. | Xu Z, Du P, Meiser P, Jacob C. Proanthocyanidins: oligomeric structures with unique biochemical properties and great therapeutic promise. Nat Prod Commun. 2012;7:381-388. [PubMed] |
| 13. | Stefanovic V, Savic V, Vlahovic P, Cvetkovic T, Najman S, Mitic-Zlatkovic M. Reversal of experimental myoglobinuric acute renal failure with bioflavonoids from seeds of grape. Ren Fail. 2000;22:255-266. [PubMed] [DOI] |
| 14. | Ulusoy S, Ozkan G, Ersoz S, Orem A, Alkanat M, Yucesan FB, Kaynar K, Al S. The effect of grape seed proanthocyanidin extract in preventing amikacin-induced nephropathy. Ren Fail. 2012;34:227-234. [PubMed] [DOI] |
| 15. | Yassin MM, Barros D'Sa AA, Parks TG, McCaigue MD, Leggett P, Halliday MI, Rowlands BJ. Lower limb ischaemia-reperfusion injury alters gastrointestinal structure and function. Br J Surg. 1997;84:1425-1429. [PubMed] [DOI] |
| 20. | Deitch EA, Xu D, Kaise VL. Role of the gut in the development of injury- and shock induced SIRS and MODS: the gut-lymph hypothesis, a review. Front Biosci. 2006;11:520-528. [PubMed] [DOI] |
| 21. | Xia ZY, Liu XY, Zhan LY, He YH, Luo T, Xia Z. Ginsenosides compound (shen-fu) attenuates gastrointestinal injury and inhibits inflammatory response after cardiopulmonary bypass in patients with congenital heart disease. J Thorac Cardiovasc Surg. 2005;130:258-264. [PubMed] [DOI] |
| 22. | Savas S, Savas C, Altuntas I, Adiloglu A. The correlation between nitric oxide and vascular endothelial growth factor in spinal cord injury. Spinal Cord. 2008;46:113-117. [PubMed] [DOI] |
| 24. | Macpherson AJ, Hunziker L, McCoy K, Lamarre A. IgA responses in the intestinal mucosa against pathogenic and non-pathogenic microorganisms. Microbes Infect. 2001;3:1021-1035. [PubMed] [DOI] |
| 25. | Saini MS, Liberati DM, Diebel LN. Sequential changes in mucosal immunity after hemorrhagic shock. Am Surg. 2001;67:797-801. [PubMed] |
| 26. | Kozlowski PA, Williams SB, Lynch RM, Flanigan TP, Patterson RR, Cu-Uvin S, Neutra MR. Differential induction of mucosal and systemic antibody responses in women after nasal, rectal, or vaginal immunization: influence of the menstrual cycle. J Immunol. 2002;169:566-574. [PubMed] [DOI] |
| 27. | de la Iglesia R, Milagro FI, Campión J, Boqué N, Martínez JA. Healthy properties of proanthocyanidins. Biofactors. 2010;36:159-168. [PubMed] [DOI] |