修回日期: 2015-01-23
接受日期: 2015-01-29
在线出版日期: 2015-03-28
目的: 比较高迁移率族蛋白B1(high mobility group protein B1, HMGB1)与其他炎症因子在急性肝衰竭(acute liver failure, ALF)大鼠肝组织和血清中出现时间及持续时间, 探讨其来源及作用.
方法: 采用腹腔内注射D-氨基半乳糖(D-galactosamine, D-Gal)和脂多糖(lipopolysaccharide, LPS)制备大鼠ALF模型, 以腹腔内注射生理盐水作为对照组. 于注射后3、6、12、24、48、72 h检测血清中肝功能的变化, 观察肝组织病理, 实时荧光定量PCR检测肝组织中HMGB1、白介素1β(interleukin 1β, IL-1β)、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α) mRNA变化, ELISA法检测血清中HMGB1、IL-1β、IL-6、TNF-α水平变化, 免疫组织化学检测肝组织中HMGB1表达变化. 使用重组高迁移率族蛋白B1(recombinant high mobility group protein 1, rHMGB1)单独尾静脉注射或联合D-Gal、LPS腹腔内注射, 观察大鼠的一般情况并计算生存率.
结果: 采用D-Gal和LPS成功建立大鼠ALF模型. ALF大鼠肝组织中HMGB1 mRNA表达和血清中HMGB1水平高峰均较IL-1β、IL-6、TNF-α出现晚, 但其高峰持续时间更长. D-Gal和LPS注射后的3 h, 免疫组织化学可见肝细胞中HMGB1由细胞核转移到细胞质中; 注射后24-48 h, 肝脏正常组织结构消失, HMGB1蛋白自坏死的肝细胞被动释放. 添加外源性rHMGB1使大鼠死亡时间提前, ALF大鼠在相同时间点死亡率升高.
结论: 大鼠ALF过程中HMGB1由坏死的肝细胞被动释放, 其出现时间较其他炎症因子为晚. HMGB1与其他炎症因子相互作用, 可能进一步促进ALF中的炎症反应.
核心提示: 大鼠急性肝衰竭(acute liver failure, ALF)过程中高迁移率族蛋白B1(high mobility group box 1 protein, HMGB1)由坏死的肝细胞被动释放, 其出现时间较其他炎症因子为晚. HMGB1与其他炎症因子相互作用, 可能进一步促进ALF中的炎症反应. HMGB1有希望作为治疗肝衰竭的有效靶点, 为阻止器官损伤的发展起到保护作用, 为临床治疗提供更充裕的时间.
引文著录: 张宇, 王刚, 祝文彩, 陈钟. 急性肝衰竭大鼠高迁移率族蛋白B1的变化和意义. 世界华人消化杂志 2015; 23(9): 1402-1410
Revised: January 23, 2015
Accepted: January 29, 2015
Published online: March 28, 2015
AIM: To observe the changes in the expression of high mobility group protein B1 (HMGB1) and other inflammatory cytokines in acute liver failure (ALF) in rats.
METHODS: D-galactosamine (D-Gal) and lipopolysaccharide (LPS) were used to establish a model of ALF by intraperitoneal injection. Rats were treated with normal saline alone in a control group. Serum and liver tissues were collected at different time points (3, 6, 12, 48, 72 and 96 h). Serum biochemical indicators were detected, and HMGB1 expression in liver tissue was observed by immunohistochemical analysis. HE staining was performed to evaluate the severity of liver damage. The changes of HMGB1, interleukin 1β (IL-1β), IL-6, and tumor necrosis factor-α (TNF-α) mRNA expression were determined by real-time fluorescent quantitative PCR, and the levels of HMGB1, IL-1β, IL-6 and TNF-α were measured using ELISA kits. rHMGB1 was injected via the tail vein alone or combined with D-Gal and LPS by intraperitoneal injection, and the changes of symptoms and signs and survival rates of rats were observed.
RESULTS: ALF was successfully induced in rats using D-Gal and LPS. In ALF rats, the peak of HMGB1 gene expression and serum levels of HMGB1 were later but lasted longer than IL-1β, IL-6 and TNF-α. Cytoplasmic translocation of HMGB1 was observed as early as 3 h after D-Gal and LPS administration. In 24-48 h, normal liver tissue structures disappeared, and HMGB1 was overflowed from necrotic liver cells and showed diffused yellow staining, full of the entire field of vision. Administration of exogenous rHMGB1 reduced the time to death and increased mortality rates .
CONCLUSION: HMGB1 may be passively leaked by necrosis hepatic cells, which appeared later compared with other inflammatory cytokines. The interaction of HMGB1 and other inflammatory cytokines can promote the inflammation progression in ALF.
- Citation: Zhang Y, Wang G, Zhu WC, Chen Z. Changes in expression of high mobility group protein B1 in acute liver failure in rats. Shijie Huaren Xiaohua Zazhi 2015; 23(9): 1402-1410
- URL: https://www.wjgnet.com/1009-3079/full/v23/i9/1402.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i9.1402
急性肝衰竭(acute liver failure, ALF)指突发肝细胞大量坏死和严重的肝功能损害, 是继发性全身炎症反应综合征, 自然死亡率高达60%-90%以上[1-3]. 高迁移率族蛋白B1(high mobility group protein B1, HMGB1)被认为是无菌性炎症和感染性炎症反应中的重要介质. HMGB1联同其他细胞因子, 可以通过诱导刺激各种炎性因子的释放[如白介素1β(interleukin 1β, IL-1β)、γ 干扰素(interferon γ , IFN-γ )、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)]而放大炎症反应[4]. 但HMGB1在ALF中的作用和相关机制尚不清楚. 本实验通过采用D-氨基半乳糖(D-galactosamine, D-Gal)和脂多糖(lipopolysaccharide, LPS)腹腔内注射建立大鼠ALF模型, 观察HMGB1在大鼠ALF肝组织中的表达和血清中水平的变化, 探讨其来源及作用.
D-Gal(南京德宝生化器材有限公司); LPS(美国Sigma公司); SYBR Green Ⅰ试剂盒(瑞士罗氏); 兔抗大鼠HMGB1单克隆抗体(美国CST公司); 大鼠IL-1β、IL-6和TNF-α ELISA试剂盒购自美国RayBiotech公司; 大鼠HMGB1试剂盒购自德国IBL国际公司; 重组人HMGB1蛋白购自美国R&D公司, 其他试剂均为国产分析纯.
1.2.1 ALF大鼠模型的建立及分组: SD大鼠(体质量180-220 g, n = 48, 雌雄各半)由南通大学实验动物中心提供. 所有实验动物在实验之前, 先在实验室中饲养1 wk, 以适应实验环境, 期间可以自由取食和饮水. 其中实验组(n = 42), 行腹腔注射D-Gal 700 mg/kg和LPS 100 µg/kg, 分别于注射后3、6、12、24、48、72、96 h分别随机取6只大鼠水合氯醛麻醉, 用肝素化的毛细玻璃管由眼眶后静脉丛取血0.5 mL, 并离心分离血清, 保存于-20 ℃. 取血后将大鼠颈椎脱臼处死, 开腹取出肝脏, 取1 cm×1 cm大小肝组织立即4%多聚甲醛固定, 用于病理及免疫组织化学检测. 对照组(n = 6), 腹腔内注射等量生理盐水.
1.2.2 肝组织病理检查及肝功能检测: 4%多聚甲醛固定的肝组织, 石蜡包埋, 5 µm切片, HE染色, 光镜下观察组织形态学变化. 留存血清使用TBA-40FR艾科自动分析仪检测血清天门冬氨酸转氨酶(aspartate transaminase, AST)、谷丙氨酸转氨酶(alanine aminotransferase, ALT)、血清总胆红素(total serum bilirubin, TBIL)及血清直接胆红素(direct serum bilirubin, DBIL)的水平.
1.2.3 肝组织中HMGB1表达的检测: 采用免疫组织化学染色按照试剂盒说明步骤操作, 并设阴性对照. 其中每张切片分别加HMGB1一抗(1:500稀释)4 ℃过夜. 工作浓度的HRP标记IgG二抗50 µL, 37 ℃孵育1.5 h.
1.2.4 肝组织中HMGB1、IL-1β、IL-6、TNF-α mRNA的表达: 采用实时定量PCR分析, HMGB1引物: 5'-CTGGCTTATCCATTGGTGATGT-3', 3'-CCTTTAGCTCTGTAGGCAGCAA-5'; IL-1β引物: 5'-CTTCAAATCTCACAGCAGCATC-3', 3'-GCTGTCTAATGGGAACATCACA-5'; IL-6引物: 5'-TCCGTTTCTACCTGGAGTTTGT-3', 3'-GTTGGATGGTCTTGGTCCTTAG-5'; TNF-α引物: 5'-CATGGATCTCAAAGACAACCAA-3', 3'-CTCCTGGTATGAAATGGCAAAT-5'; 内参GAPDH引物: 5'-CAACTCCCTCAAGATTGTCAGCAA-3', 3'-GGCATGGACTGTGGTCATGA-5'. 总RNA的提取按说明书进行; RNA的逆转录为cDNA的过程按说明书进行. 设置标准参照, 特异基因的核酸含量对比GAPDH的含量计算. 在ABI 7500(美国应用生物系统公司)定量PCR仪上用SYBR Green Ⅰ试剂盒进行核酸定量分析, 在定量PCR过程中, 取2 µL cDNA作为模板, 终体积为20 µL, 按以下程序进行: 95 ℃ 30 s预变性后进入40个循环反应: 95 ℃ 5 s→60 ℃ 30 s→72 ℃ 12 s获取荧光信号温度为84 ℃, 以排除二聚体的干扰, 而后进行溶解曲线分析确定扩增产物的特异性和灵敏度.
1.2.5 血清中HMGB1, IL-1β, IL-6和TNF-α浓度的测定: 参照ELISA试剂盒说明书进行.
1.2.6 观察ALF大鼠的存活率: 48只SD大鼠(雌雄各半), 随机分为阴性对照组(CO组, n = 12); rHMGB1注射组(HM组, n = 12); D-Gal和LPS注射组(DL组, n = 12); rHMGB1、D-Gal和LPS注射组(HDL组, n = 12). DL组大鼠接受900 mg/kg D-Gal和100 µg/kg LPS腹腔内注射. HM组, rHMGB1溶解在适量生理盐水中, 每只大鼠采用rHMGB1 750 ng经尾静脉注射. HDL组腹腔内注射900 mg/kg D-Gal和100 µg/kg LPS的同时经尾静脉注射rHMGB1 750 ng. CO组大鼠作为阴性对照腹腔注射同等量的生理盐水. 注射后大鼠均自由获取食物和水, 所有实验大鼠, 在模型建立后观察均超过7 d, 观察指标: 肝衰竭大鼠一般表现的变化并统计大鼠死亡时间;
统计学处理 采用SPSS19.0软件分析所有数据, 数据采用mean±SD表示. 每个实验均至少重复3次. 进行方差齐性检验与方差分析. 以P<0.05为差异有统计学意义.
建模前后ALF大鼠血清AST、ALT、TBIL和DBIL浓度变化如表1, 各指标在建模前处于正常范围. 在注射D-Gal和LPS建立肝衰竭模型后, 血清ALT和AST浓度逐渐升高, 并在24 h达到峰值, 与建模前相比差异有统计学意义(P<0.05); TBIL和DBIL的浓度进行性升高, 建模后48 h达到峰值, 与建模前相比差异有统计学意义(P<0.05). ALF大鼠的ALT和AST浓度较建模前提高了约700倍.
| 指标 | 建模前 | 12 h | 24 h | 48 h | 72 h | 96 h |
| AST(U/L) | 105.0±3.8 | 870.7±344.5a | 6429.0±1067.0a | 1661.0±392.3a | 341.5±99.38 | 107.5±12.49 |
| ALT(U/L) | 24.3±1.0 | 306.0±145.3 | 1650.0±299.58a | 266.8±219.8a | 131.3±39.2 | 31.25±5.4 |
| TBIL(µmol/L) | 7.0±2.6 | 25.5±15.4 | 78.1±28.7a | 143.4±16.3a | 81.5±56.6a | 10.93±2.7 |
| DBIL(µmol/L) | 4.1±0.5 | 16.2±11.5 | 49.9±17.5a | 79.9±11.38 | 14.4±6.7 | 6.4±1.5 |
D-Gal和LPS腹腔注射24 h后, 出现肝组织亚大块坏死, 肝细胞大面积溶解, 肝板解离、肝细胞排列紊乱, 肝窦明显扩张充血. 大量炎症细胞浸润, 吞噬细胞碎片, 色素沉着. 注射后48-72 h, 邻近中央静脉之间出现桥接样坏死, 狄氏腔轻度扩张, 肝细胞的气球样变性最为显著. 然而在对照组中细胞结构完整, 核清晰可见, 排列有序.
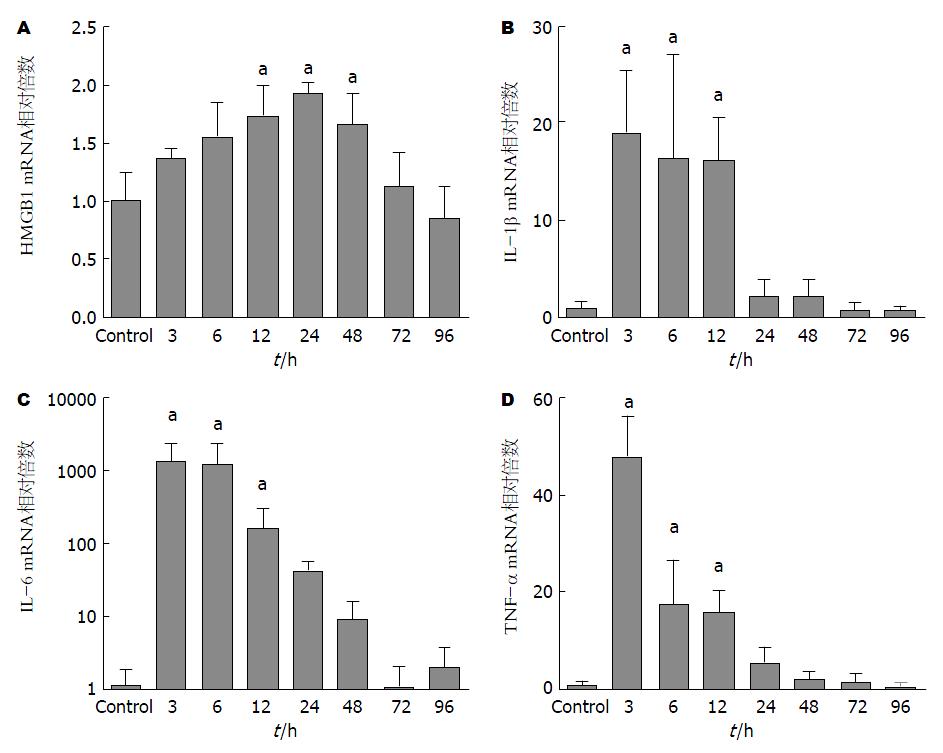
不同时间点ALF模型大鼠的肝组织中mRNA表达如图1所示. HMGB1 mRNA表达, 在建立ALF模型后逐渐升高并在24 h达到峰值. 在12-48 h与对照组相比差异有统计学意义(P<0.05), 在72-96 h与对照组持平. IL-1β、IL-6、TNF-α的mRNA表达在建模后3 h即达到峰值, 3-12 h之内mRNA的表达水平与阴性对照组相比差异有统计学意义, 而后随时间延长逐渐下降与对照组持平.
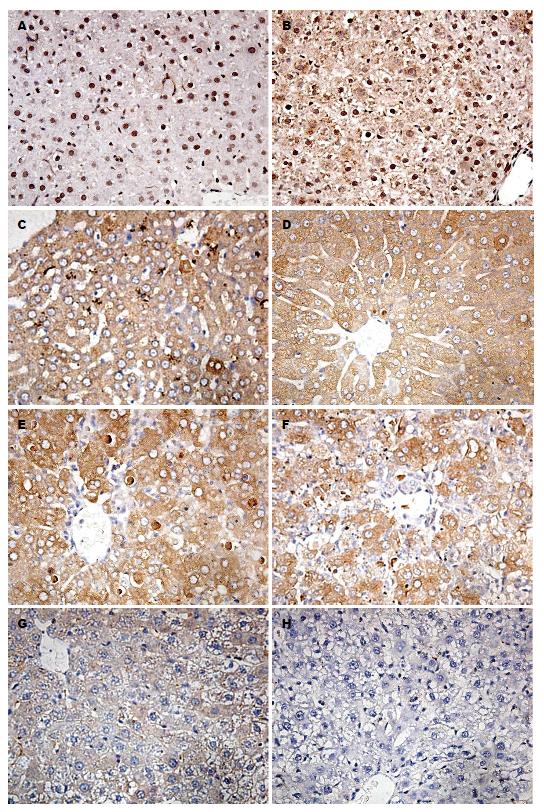
不同时间点肝脏标本的免疫组织化学结果如图2所示. 在正常大鼠的肝脏中, 胞核内可见到明显棕黄色颗粒, 但细胞浆中未能见到明显棕色颗粒. HMGB1主要存在于细胞核内, 而在胞浆中很少表达. D-Gal和LPS注射后的3 h, 有近一半的肝细胞浆中开始出现明显的棕黄色颗粒, 颗粒颜色深, 粗大. 而细胞核中棕色变浅, 表明早在建模后3 h内HMGB1自细胞核迁移至细胞浆中. 此后, 棕色颗粒主要分布在细胞浆中. 在24 h, 肝细胞体积缩小, 细胞质出现浓缩的凋亡小体, 凋亡细胞显示的棕色染色比其他细胞更深, 提示凋亡小体内可能高表达HMGB1. 24-48 h, 肝细胞破坏严重, 肝脏正常结构消失, HMGB1蛋白自坏死的细胞内溢出, 布满整个视野, 形成大片黄染区. 细胞间质中也可以看到粗大的棕黄色颗粒. 72-96 h主要是细胞水肿, 棕色染色主要存在于部分细胞结构尚完整的细胞浆中, 水肿的肝细胞中几乎不能观察到HMGB1的棕色染色.
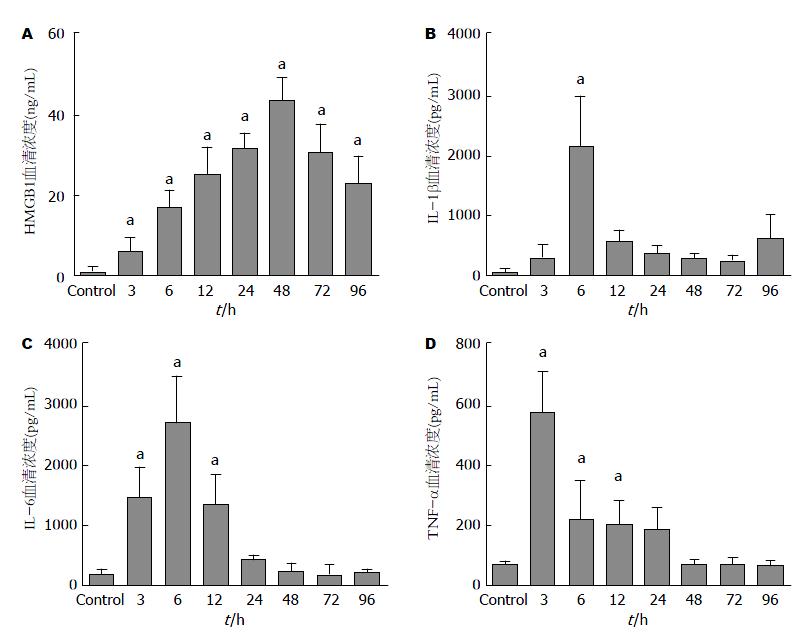
如图3所示. HMGB1在血清中的初始浓度为1.293 ng/mL±0.774 ng/mL, 诱导ALF后逐渐增加, 在48 h达到峰值43.88 ng/mL±5.759 ng/mL. 自建立ALF模型后的大鼠血清中HMGB1蛋白的水平与对照组大鼠血清水平相比差异均有统计学意义(P<0.05). 血清IL-1β、IL-6的平均水平在建立模型6 h内达到峰值(2173.0 pg/mL±481.9 pg/mL, 1676.0 pg/mL±274.2 pg/mL), TNF-α的平均浓度峰在3 h达到峰值(578.9 pg/mL±64.8 pg/mL), 与对照组相比差异存在统计学意义(P<0.05). 随后血清IL-1β、IL-6、TNF-α的水平缓慢下降. 24-96 h的血清水平与对照组差异无统计学意义.
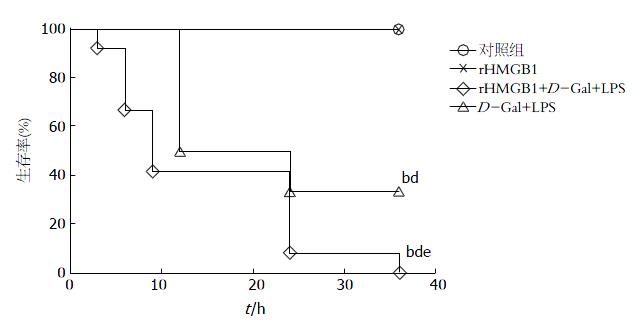
ALF大鼠的生存曲线如图4所示. 在CO和HM组所有大鼠均全部成活(12/12). 在DL组在12 h开始有近一半的大鼠死亡, 在24 h时间点有约33.3%(4/12)存活. 在HDL组, 动物早在3 h内开始死亡, 在12 h内生存率为41.67%(5/12), 36 h时所有大鼠均死于肝功能衰竭. 所有存活的大鼠喂养2 wk以避免晚期不良反应. CO组和HM组与DL组和HDL组之间的生存率差异存在统计学意义(P<0.05). DL组与HDL组的生存率之间差异存在统计学意义(P<0.05).
ALF病理生理学特征为全身性炎症反应. 在ALF中, 肝细胞大量坏死, 失去其解读功能, 而肠道产生的内毒素可通过Toll样受体诱导核因子-κB(nuclear factor-κB, NF-κB)活化, 促进炎性细胞浸润和炎症细胞因子的释放, 引起风暴式的炎性反应, 促进ALF的病情进展致死[5-9]. HMGB1是细胞核内普遍存在并高度保守的DNA结合蛋白, 在细胞核内具有稳定核酸结构、调节转录和基因表达等多种功能[10]. Wang等[6]研究发现HMGB1在细胞外是一种引导炎症和组织损伤的重要细胞因子. HMGB1与许多炎症性疾病有关[11-13], 在感染和损伤模型中, 形成炎症前抑制HMGB1活性, 可以对动物起到治疗作用[14-17]. 但迄今为止HMGB1在ALF中的变化、来源、作用机制和作用时间仍不清楚.
文献报告采用D-Gal和LPS建立大鼠ALF模型, 其可重复性好, 肝外毒性不明显, 剂量一定范围内可控, 肝损害的表现又与临床肝衰竭相近[18,19]. 本实验中ALF大鼠在24-48 h细胞坏死数量最多. 此时大鼠表现为皮肤、巩膜黄疸, 竖毛, 对外界刺激淡漠和厌食的明显病态. 24-48 h正是ALF模型大鼠死亡的高峰. 在72-96 h期间内, 主要病理的特征是肝组织水肿和肝细胞再生, 而此时也是ALF大鼠肝功能开始逐渐恢复的阶段. 本实验中建模后24 h大鼠的血清ALT, AST浓度较正常组增加700余倍. 肝细胞短期内出现大量坏死的典型病理变化, 肝功能损害变化, 大鼠皮肤巩膜黄染, 凝血时间延长, 对外界反应淡漠等症状及体征证明在本实验中成功诱导建立了ALF模型.
本实验中ALF模型大鼠肝组织中HMGB1 mRNA表达和血清中HMGB1的水平均显著升高. Oshima等[20]发现ALF患者血清中HMGB1浓度升高. 由刀豆素引起的动物急性肝损伤中, 除血液和肝脏组织中炎性因子如TNF-α增多外, 肝组织HMGB1 mRNA表达水平也比对照组显著增加, 提示HMGB1可能参与上述肝损伤过程[21].
本研究中, 免疫组织化学显示ALF肝组织中HMGB1从细胞核迁移到细胞质, 早在3 h便能观察到HMGB1移位. 这一结果与HBV感染引起肝衰竭的患者肝组织免疫组织化学的结果相同[22]. 在注射D-Gal和LPS后24-48 h, 肝脏正常组织结构消失, HMGB1蛋白自坏死的肝细胞内溢出, 形成大片黄染区, 布满整个视野. 大鼠ALF肝组织中HMGB1蛋白48 h迁移率约达90%. 重新定位和细胞质中HMGB1的积累是细胞外释放的必要步骤[23]. 细胞质中的HMGB1移位可能是导致肝脏炎性病变的发病基础. 已有研究[24,25]表明通过抑制HMGB1胞浆移位和释放, 减轻肝脏炎症反应, 也反证了HMGB1移位在ALF中的重要性. 在本实验中, ALF大鼠血清中HMGB1的浓度自3 h起较阴性对照组明显增高, 而肝组织中HMGB1 mRNA的表达差异起始于12 h, 提示ALF大鼠血清中的HMGB1可能部分来源于坏死的肝细胞被动释放.
在体内实验中, 900 mg/kg D-Gal和100 µg/kg LPS诱导的ALF大鼠死亡主要集中在12-24 h区间, 48 h后ALF模型动物肝功能渐渐恢复, 没有新动物死亡. 而HDL组, 大鼠在建模后2 h便出现对外界反应淡漠, 竖毛等ALF表现, 死亡开始的时间比DL组更早, 在相同时间点死亡率更高. HDL组的ALF模型大鼠存活率最低, 由此可见rHMGB1可能加快ALF的进展和加重病情, 甚至介导致死性损伤. 单独尾静脉注射rHMGB1组中36 h内无大鼠死亡, 这可能和实验中rHMGB1的剂量不能诱导实验动物致死性肝损伤, 而在ALF大鼠模型中使用外源性rHMGB1可以促进原有的炎症反应过程.
实时荧光定量PCR显示在肝组织中经典的早期炎症因子(如IL-1β、IL-6和TNF-α)的mRNA表达3 h内迅速增加, 达到高峰后, 在12 h内下降至初始水平. 而HMGB1 mRNA的表达逐渐增加并在24 h达到高峰. 大鼠ALF肝组织中HMGB1 mRNA的表达较IL-1β等经典早期炎症因子晚(12 h vs 3 h), 但HMGB1的高表达持续时间较IL-1β等持续时间更长(36 h vs 8 h). 血清ELISA也证明了在ALF模型的血清中HMGB1的浓度高峰出现较IL-1β出现晚(3 h vs 48 h), 并且持续时间更长. 文献报告LPS诱导的肝损伤主要通过刺激Kupffer细胞释放L-1β、IL-6、TNF-α等炎症因子. TNF-α诱导肝细胞损害在D-Gal/LPS所致大鼠ALF模型的早期发挥作用. IL-1β、IL-6、TNF-α等作为早期炎症因子可以与HMGB1相互诱生, 从而放大炎症反应. HMGB1释放到细胞外时是一种有效的晚期炎症递质, 有较强的致炎活性, 与多种细胞因子、血管黏附因子和促炎因子互相作用参与炎症反应[26]. HMGB1可以促使蛋白激酶激活, 刺激单核细胞产生IL-1β、IL-6、TNF-α[6]. 血清中IL-1β等"早期炎症因子"在ALF模型建立后迅速升高并在3 h达到高峰, 12 h内即恢复至正常水平, 而HMGB1出现时间较晚, 但持续时间更长, 提示后期的肝损伤和下游因子HMGB1有关. 因此HMGB1可能在大鼠ALF中作为晚期炎症因子而发挥作用. 而在败血症中, HMGB1由巨噬细胞主动分泌, 并且在疾病过程的晚期血清HMGB1升高[6]. 与此相反, 缺血再灌注损伤[27,28]、烧伤[29]、创伤[30]患者血浆中的HMGB1自损伤开始便升高, 并且在24 h内达到峰值, 可能是因为HMGB1是由急性受损的组织被动释放.
急性肝衰竭(acute liver failure, ALF)是突然发生大量肝细胞坏死或严重的肝功能损害. ALF的病理变化是继发性全身炎症反应综合征. 如何在ALF中控制炎症反应, 可能成为改善患者症状, 缓解病情的新方法.
姚鹏, 主任医师, 首都医科大学附属北京朝阳医院西区肝病科
高迁移率族蛋白B1(high mobility group box 1 protein, HMGB1)是细胞核内高度保守的蛋白, 具有维持核稳定的功能. 当HMGB1迁移到细胞外, 可以诱导机体固有免疫启动炎症反应, 表现出炎症因子的作用. HMGB1与许多炎症性疾病有关.
HMGB1不仅在脓毒性休克和内毒素血症中起关键的调节作用, 而且与肝、肺、肠、关节损伤及肿瘤的发生和发展有关. 很多实验证实: 关节炎、动脉粥样硬化、系统性红斑狼疮性脑炎、克隆恩病以及癌症中, 血清中HMGB1的含量有所增加.
HMGB1与许多炎症相关疾病有关, 但迄今为止HMGB1在ALF中的变化、来源、作用机制和作用时间仍不清楚.
HMGB1作为验证肝脏损伤的有效指标, 比经典的炎症因子出现晚、持续时间长, 抗HMGB1治疗具有更宽的干预窗口. HMGB1有望作为治疗肝衰竭的有效靶点, 为阻止器官损伤的发展起到保护作用, 为临床治疗提供更充裕的时间.
全身炎症反应综合征: 是因感染或非感染病因作用于机体而引起的机体失控的自我持续放大和自我破坏的全身性炎症反应. 当机体受到损伤或毒性物质打击时, 可促发初期炎症反应, 同时产生内源性免疫炎性因子形成"瀑布效应".
HMGB1被认为是无菌性炎症和感染性炎症反应中的重要介质. 可以联同其他炎性细胞因子, 通过诱导刺激各种炎性因子的释放并放大炎症反应. 与许多炎性疾病有关. 本文研究HMGB1在ALF的意义, 有一定的新颖性.
编辑: 韦元涛 电编:都珍珍
| 1. | Rolando N, Wade J, Davalos M, Wendon J, Philpott-Howard J, Williams R. The systemic inflammatory response syndrome in acute liver failure. Hepatology. 2000;32:734-739. [PubMed] [DOI] |
| 4. | Sha Y, Zmijewski J, Xu Z, Abraham E. HMGB1 develops enhanced proinflammatory activity by binding to cytokines. J Immunol. 2008;180:2531-2537. [PubMed] [DOI] |
| 5. | Merenmies J, Pihlaskari R, Laitinen J, Wartiovaara J, Rauvala H. 30-kDa heparin-binding protein of brain (amphoterin) involved in neurite outgrowth. Amino acid sequence and localization in the filopodia of the advancing plasma membrane. J Biol Chem. 1991;266:16722-16729. [PubMed] |
| 6. | Wang H, Bloom O, Zhang M, Vishnubhakat JM, Ombrellino M, Che J, Frazier A, Yang H, Ivanova S, Borovikova L. HMG-1 as a late mediator of endotoxin lethality in mice. Science. 1999;285:248-251. [PubMed] [DOI] |
| 7. | Bustin M. Revised nomenclature for high mobility group (HMG) chromosomal proteins. Trends Biochem Sci. 2001;26:152-153. [PubMed] |
| 8. | Barsness KA, Arcaroli J, Harken AH, Abraham E, Banerjee A, Reznikov L, McIntyre RC. Hemorrhage-induced acute lung injury is TLR-4 dependent. Am J Physiol Regul Integr Comp Physiol. 2004;287:R592-R599. [PubMed] [DOI] |
| 9. | Silva E, Arcaroli J, He Q, Svetkauskaite D, Coldren C, Nick JA, Poch K, Park JS, Banerjee A, Abraham E. HMGB1 and LPS induce distinct patterns of gene expression and activation in neutrophils from patients with sepsis-induced acute lung injury. Intensive Care Med. 2007;33:1829-1839. [PubMed] [DOI] |
| 10. | Scaffidi P, Misteli T, Bianchi ME. Release of chromatin protein HMGB1 by necrotic cells triggers inflammation. Nature. 2002;418:191-195. [PubMed] [DOI] |
| 11. | Chen R, Hou W, Zhang Q, Kang R, Fan XG, Tang D. Emerging role of high-mobility group box 1 (HMGB1) in liver diseases. Mol Med. 2013;19:357-366. [PubMed] [DOI] |
| 12. | Magna M, Pisetsky DS. The role of HMGB1 in the pathogenesis of inflammatory and autoimmune diseases. Mol Med. 2014;20:138-146. [PubMed] [DOI] |
| 13. | Tsung A, Tohme S, Billiar TR. High-mobility group box-1 in sterile inflammation. J Intern Med. 2014;276:425-443. [PubMed] [DOI] |
| 14. | Tang Y, Lv B, Wang H, Xiao X, Zuo X. PACAP inhibit the release and cytokine activity of HMGB1 and improve the survival during lethal endotoxemia. Int Immunopharmacol. 2008;8:1646-1651. [PubMed] [DOI] |
| 15. | 杨 智勇, 凌 燕, 陶 京, 周 峰, 熊 炯, 吴 河水, 王 春友. 延迟的丙酮酸乙酯治疗对重症急性胰腺炎大鼠胰外脏器损伤的影响及其机制. 世界华人消化杂志. 2007;15:2638-2642. [DOI] |
| 17. | 葛 文松, 吴 建新, 陈 颖伟, 范 建高, 胡 颖. 丙酮酸乙酯对实验性结肠炎大鼠结肠组织HMGB1表达及细胞因子的影响. 世界华人消化杂志. 2012;20:558-562. [DOI] |
| 19. | Yang HZ, Chen L, Tong JJ, Zhang HY, Pang F, Xu ZH, Xin SJ, Hu JH. [Orthogonal design based optimization of a mouse model of acute liver failure induced by D-galactosamine and lipopolysaccharide]. Zhonghua Ganzangbing Zazhi Za Zhi. 2013;21:464-466. [PubMed] [DOI] |
| 20. | Oshima G, Shinoda M, Tanabe M, Ebinuma H, Nishiyama R, Takano K, Yamada S, Miyasho T, Masugi Y, Matsuda S. Increased plasma levels of high mobility group box 1 in patients with acute liver failure. Eur Surg Res. 2012;48:154-162. [PubMed] [DOI] |
| 21. | Zhou RR, Liu HB, Peng JP, Huang Y, Li N, Xiao MF, Wang H, Fan XG. High mobility group box chromosomal protein 1 in acute-on-chronic liver failure patients and mice with ConA-induced acute liver injury. Exp Mol Pathol. 2012;93:213-219. [PubMed] [DOI] |
| 22. | Zhou RR, Zhao SS, Zou MX, Zhang P, Zhang BX, Dai XH, Li N, Liu HB, Wang H, Fan XG. HMGB1 cytoplasmic translocation in patients with acute liver failure. BMC Gastroenterol. 2011;11:21. [PubMed] [DOI] |
| 23. | Zhang F, He Y, Duan Z. Changes of high mobility group box 1 in serum of pig acute hepatic failure model and significance. J Huazhong Univ Sci Technolog Med Sci. 2008;28:52-55. [PubMed] [DOI] |
| 25. | Xu W, Lu Y, Yao J, Li Z, Chen Z, Wang G, Jing H, Zhang X, Li M, Peng J. Novel role of resveratrol: suppression of high-mobility group protein box 1 nucleocytoplasmic translocation by the upregulation of sirtuin 1 in sepsis-induced liver injury. Shock. 2014;42:440-447. [PubMed] [DOI] |
| 26. | Naglova H, Bucova M. HMGB1 and its physiological and pathological roles. Bratisl Lek Listy. 2012;113:163-171. [PubMed] |
| 27. | Tsung A, Sahai R, Tanaka H, Nakao A, Fink MP, Lotze MT, Yang H, Li J, Tracey KJ, Geller DA. The nuclear factor HMGB1 mediates hepatic injury after murine liver ischemia-reperfusion. J Exp Med. 2005;201:1135-1143. [PubMed] [DOI] |
| 28. | Liu A, Dirsch O, Fang H, Dong W, Jin H, Huang H, Sun J, Dahmen U. HMGB1 translocation and expression is caused by warm ischemia reperfusion injury, but not by partial hepatectomy in rats. Exp Mol Pathol. 2011;91:502-508. [PubMed] [DOI] |