修回日期: 2015-01-29
接受日期: 2015-02-06
在线出版日期: 2015-03-28
目的: 探讨N-乙酰-5-羟色胺(N-acetylserotonin, NAS)对肝缺血再灌注(ischemia-reperfusion, I/R)损伤后细胞凋亡的作用.
方法: ♂成年未经产SD大鼠, 随机分为假手术(Sham)组、I/R组和I/R+NAS组. 采用夹闭至肝中叶和左叶肝蒂的分支的方法制作肝I/R模型, 冰冻切片, HE染色检测肝细胞形态; RT-PCR和免疫组织化学染色观察激活型Caspase3、Bcl-2和Bax的表达; TUNEL法检测细胞凋亡并计算肝细胞凋亡指数(apoptosis index, AI).
结果: (1)HE染色显示, I/R组肝细胞出现明显的水样变性和局灶性坏死, NAS可减轻I/R损伤所引起的肝组织结构的破坏; (2)与Sham组相比, I/R损伤后AI、激活型Caspase3、Bcl-2和Bax的表达升高, Bcl-2/Bax降低(P<0.01), NAS干预可使AI降低(P<0.01), Caspase3和Bax的表达降低, Bcl-2的表达及Bcl-2/Bax显著升高(P<0.01).
结论: NAS可通过提高Bcl-2、降低Bax的表达, 抑制Caspase3的激活, 减轻肝I/R损伤所致的肝细胞凋亡.
核心提示: 本研究发现, N-乙酰-5-羟色胺(N-acetylserotonin, NAS)可抑制缺血再灌注(ischemia-reperfusion)损伤诱导的肝细胞凋亡, 且NAS的这一作用与调节Bcl-2/Bax比值、抑制Caspase3的活化有关.
引文著录: 姜政辰, 梁翠宏, 王海亮, 陈悦, 郑洁, 于树娜, 蒋吉英. N-乙酰-5-羟色胺对大鼠肝缺血再灌注损伤后细胞凋亡的影响. 世界华人消化杂志 2015; 23(9): 1387-1394
Revised: January 29, 2015
Accepted: February 6, 2015
Published online: March 28, 2015
AIM: To investigate the effect of N-acetylserotonin (NAS) on hepatocyte apoptosis after liver ischemia-reperfusion (I/R) injury in rats.
METHODS: Adult male SD rats weighting 200-250 g were used. The afferent vessels of the left and median lobes were occluded by a microvascular bulldog clamp and then reperfused after 60 min with or without NAS. The morphologic changes and hepatocyte apoptosis were evaluated by hematoxylin-eosin (HE) staining and TUNEL (terminal deoxynucleotidyl transferase dUTP nick end labeling) staining, respectively. The expression of Bcl-2, Bax and activated Caspase3 was evaluated by immunohistochemistry.
RESULTS: The hepatocytes exhibited marked ballooning hydropic degeneration and focal necrosis in the I/R group. NAS pretreatment rescued the morphological damage. Compared with the sham operation group, the expression of cleaved Caspase3, Bcl-2 and Bax in the liver tissue was increased, and the ratio of Bcl-2/Bax was decreased in the I/R group (P < 0.01). The apoptosis index (AI) and expression of cleaved Caspase3 and Bax were decreased in the NAS intervention group compared with the I/R group (P < 0.01), and the expression of Bcl-2 and Bcl-2/Bax ratio were increased (P < 0.01).
CONCLUSION: NAS could attenuate hepatocyte apoptosis after liver I/R injury via mechanisms possibly associated with induction of Bcl-2 protein expression and inhibition of Bax protein expression in hepatocytes.
- Citation: Jiang ZC, Liang CH, Wang HL, Chen Y, Zheng J, Yu SN, Jiang JY. Effect of N-acetylserotonin on hepatocyte apoptosis after liver ischemia-reperfusion injury in rats. Shijie Huaren Xiaohua Zazhi 2015; 23(9): 1387-1394
- URL: https://www.wjgnet.com/1009-3079/full/v23/i9/1387.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i9.1387
肝缺血再灌注(ischemia-reperfusion, I/R)损伤是指各种原因导致肝血流中断和不足使肝缺血一段时间, 在重新恢复血液灌注后肝脏功能不仅得不到恢复, 反而进一步加重的现象, 是术后肝功能异常、原发性移植肝无功能、多器官功能衰竭的重要原因, 也是影响手术成功率、患者近期存活率和远期存活率的重要因素[1]. 因此, 探讨肝I/R损伤的发病机制、寻找预防和治疗肝I/R损伤新方案已成为目前的研究热点. N-乙酰-5-羟色胺(N-acetylserotonin, NAS)是一种强自由基清除剂和抗氧化剂. 已有研究[2-6]显示, NAS可减轻苦味酸-铁、H2O2诱导的多种细胞的氧化损伤, 但其对大鼠肝I/R损伤是否具有保护作用尚未见报道. 本研究采用肝I/R损伤的动物模型, 观察NAS对肝I/R损伤后肝细胞凋亡的影响, 并通过检查凋亡相关蛋白Bcl-2和Bax蛋白的表达, 探讨其可能的作用机制, 为肝I/R损伤的防治提供新的靶点, 也为NAS的应用开拓新领域.
♂成年未经产SD大鼠18只, 购自山东鲁抗制药有限公司, 体质量200-250 g. NAS购自Sigma公司, 激活型Caspase3抗体购自Cell Signaling, Bcl-2和Bax抗体购自Santa Cruz公司, TUNEL染色、链霉素抗生物素蛋白-过氧化酶连接(SP)和DAB显色试剂盒均购自博士德公司, TRIzol试剂购自上海生物工程有限公司, RevertAid™ M-MuLV逆转录酶购自Fermentas公司, Taq DNA聚合酶购自BBI公司.
1.2.1 动物分组及肝I/R损伤动物模型的制备: ♂成年未经产SD大鼠18只, 随机分成Sham组、I/R组和I/R+NAS组, 每组6只. I/R损伤组大鼠术前晚禁食, 自由饮水. 用1%戊巴比妥钠40 mg/kg腹腔注射麻醉, 上腹部正中切口, 无创血管夹至肝左、中叶肝蒂的分支, 制备肝脏I/R损伤模型[7,8]. 夹闭后肝的颜色由红色变为暗紫红色, 表明模型制作成功. 60 min后去除血管夹复流形成再灌注, 6 h处死大鼠, 切取肝组织, 分两部分: 一部分用冰生理盐水洗去血迹后, 快速置入冻存管, 于液氮罐冻存, 用于RT-PCR检测; 另一部分肝组织经4 g/L多聚甲醛固定过夜, 30%蔗糖沉糖过夜, 冰冻切片(厚10 µm), 用于HE染色、免疫荧光组织化学及TUNEL染色. NAS组在造模前30 min腹腔注射10 mg/kg NAS, 然后处理同I/R损伤组. Sham组仅行麻醉开腹分离肝蒂, 但不阻断肝血流.
1.2.2 病理组织学检查: 常规HE染色, 光镜下观察肝的组织学变化.
1.2.3 免疫组织化学染色: 采用SP法行Caspase3(1:200)、Bcl-2(1:200)、Bax(1:200)免疫组织化学染色, 以PBS代替一抗做阴性对照, 光学显微镜下观察、摄片.
1.2.4 TUNEL染色: 按照试剂盒的说明步骤, 不同实验组的切片分别经4%多聚甲醛后固定、3%H2O2封闭、DIG-dUDP孵育、1:100的抗地高辛抗体孵育、DAB呈色、梯度乙醇脱水、二甲苯透明、中性树胶封片. 以PBS代替一抗做阴性对照, 光学显微镜下观察、摄片. 每组观察3张切片, 每张切片选择细胞丰富的区域观察10个400倍视野, 计数凋亡的肝细胞数及肝细胞总数, 根据以下公式计算凋亡指数(apoptosis index, AI), AI = (凋亡细胞数/总细胞数)×100%.
1.2.5 RT-PCR检测: 按RNA提取试剂盒说明提取总RNA, 用UV-1206紫外分光光度计测定其260 nm和280 nm紫外线吸光度值, 计算其含量, 10 g/L琼脂糖凝胶电泳检测RNA的完整性. 保存于-80 ℃冰箱备用. 根据Bcl-2、Bax和GAPDH的mRNA序列, 利用Primer5引物设计软件, 设引物序列, 由上海生物工程有限公司合成. Bcl-2上游引物: 5'-CGGGAGAACAGGGTATGA-3', 下游引物: 5'-CAGGCTGGAAGGAGAAGAT-3', 目标片段长149 bp; Bax上游引物: 5'-GGCGATGAACTGGACAAC-3', 下游引物: 5'-TCCCGAAGTAGGAAAGGAG-3', 目标片段长301 bp. GAPDH上游引物: 5'-CTCATGACCACAGTCCATGC-3', 下游引物: 5'-TTCAGCTCTGGGATGACCTT-3', 目标片段长451 bp. 按Revertard™ H Minus First Strand cDNA Synthesis Kit的说明合成cDNA的第一链. 再分别进行Bcl-2和Bax的PCR扩增, Bcl-2和Bax分别与内参照GAPDH在同一个体系内进行扩增反应. 20 g/L琼脂糖凝胶(含溴乙锭0.5 µg/mL)电泳, GDS8000琼脂成像分析系统和Grab-IT2.9软件分析电泳带, 计算目的基因与内参照(β-actin)扩增带灰度值之比, 即得目的基因mRNA的相对表达量.
统计学处理 所有数据以mean±SD表示, 采用SPSS17.0统计软件对结果进行分析, 先进行方差齐性检验, 两样本间均数比较采用t检验或秩和检验, 检验水准α = 0.05. P<0.05为差异有统计学意义.
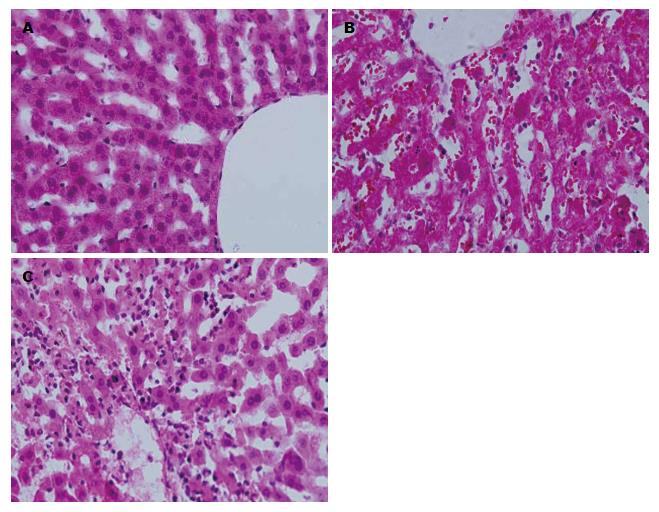
I/R组肝小叶结构紊乱, 肝细胞明显肿胀, 呈水样变性, 有局灶性坏死; 伴有嗜酸小体和炎细胞浸润, 以汇管区和坏死灶周围为重; 中央静脉及肝窦淤血扩张. NAS组肝组织损伤明显减轻, 肝小叶结构基本正常, 近中央静脉部分肝细胞浊肿变性, 无肝细胞坏死(图1).
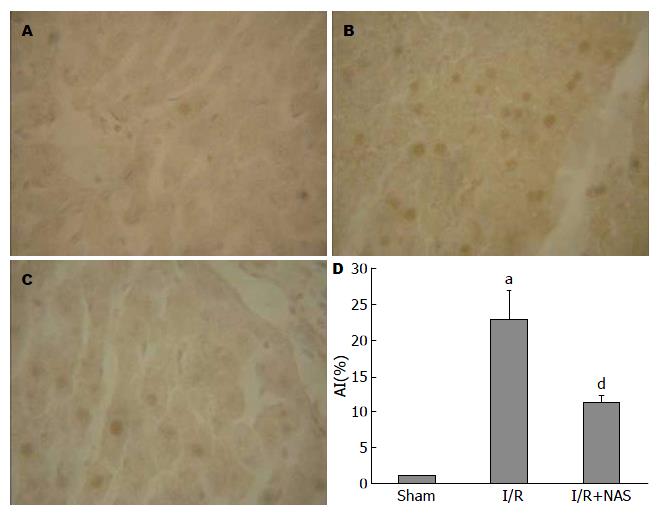
TUNEL染色阳性细胞的表现为细胞核呈棕黄色, 阳性细胞体积较小, 形态不规则. Sham组偶见TUNEL阳性细胞, AI为1.08%±0.06%; I/R组在汇管区周围可见大量呈TUNEL阳性的肝细胞, AI为22.81%±4.15%; NAS组阳性细胞的数量较IR组减少, AI为11.37%±1.03%(图2).
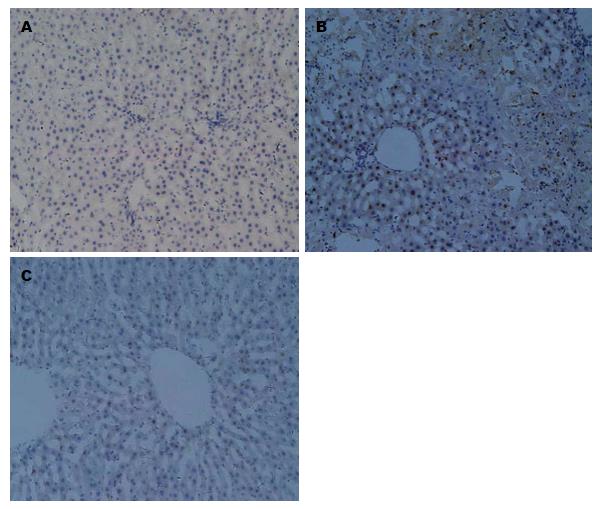
免疫组织化学染色结果显示, 激活型Caspase3免疫阳性产物位于肝细胞浆和胞核. Sham组偶见Caspase3阳性的肝细胞; I/R组肝小叶的汇管区可见大量的阳性肝细胞; NAS干预后Caspase3阳性细胞的数量减少(图3).
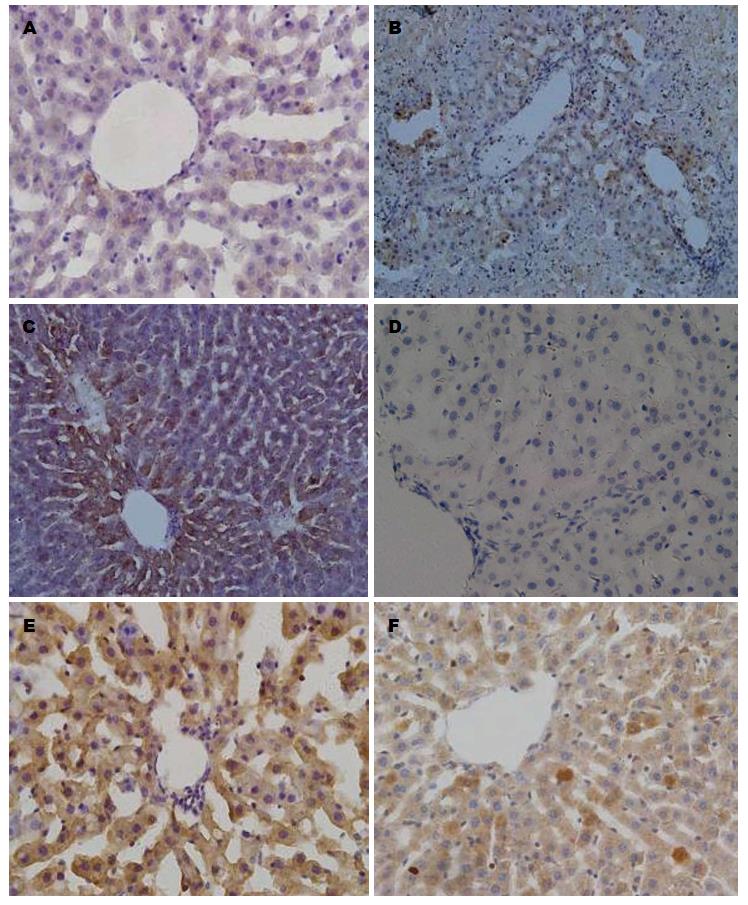
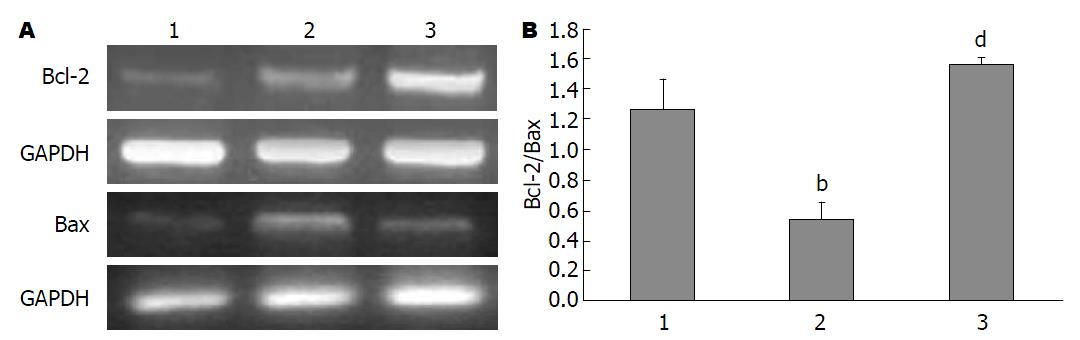
免疫组织化学染色显示, Bcl-2和Bax免疫反应阳性细胞主要位于肝细胞核和细胞浆. Sham组可见少量Bcl-2和Bax阳性细胞, 阳性细胞的数量在I/R组增多, NAS干预后, Bcl-2阳性细胞数较I/R组升高、Bax降低(图4). RT-PCR检测显示, Bcl-2和Bax mRNA水平的变化与免疫组织化学检测的结果相似, 并且I/R组的Bcl-2/Bax的比值高于对照组(P<0.01), 而低于I/R+NAS组(P<0.01)(图5).
I/R损伤是肝移植、部分肝切除及休克的复苏等过程中常见的病理过程, 其损伤的程度影响术后肝功能的恢复和肝脏的存活, 与疾病预后直接相关. 肝I/R损伤的机制复杂, 目前尚未完全清楚. 近年来的研究[9-14]表明, 细胞凋亡参与了心、肝、肺、肾、脑、胃及肠等多个脏器的I/R损伤的病理过程, 干预细胞凋亡可减轻这些脏器的I/R损伤. 因此, 探讨影响细胞凋亡的因素, 对于寻找缓解肝I/R损伤的措施具有重要意义.
有研究[14]表明, 线粒体参与了肝I/R损伤的细胞凋亡. 在I/R损伤中, 线粒体呼吸链通过"渗透机制"产生氧自由基, 氧自由基又可损伤线粒体膜, 使MPT孔开放, 线粒体通透性增加、线粒体钙超载、细胞色素C(cytochrome c, Cytc)等线粒体促凋亡因子释放. 因此, 线粒体既是ROS产生的主要场所, 又是ROS作用的主要靶点. 如果能找到有效的自由基清除剂, 将有效减少I/R损伤.
NAS属于吲哚类激素, 在松果体内合成后, 在羟吲哚氧甲基转移酶的作用下生产褪黑素[15]. 随着研究的深入, 人们发现NAS不仅是褪黑素的前体, 还具有调节生物节律、睡眠、血压及免疫, 改善认知、镇痛及抗氧化、抗衰老等生物学功能[16,17]. 因此, NAS被美国食品药品监督管理局(Food and Drug Administration, FDA)批准用于临床, 其疗效和安全性已被多家实验室证实[18,19]. 近年来, NAS的抗氧化作用已成为医学研究的热点.
Barsacchi等[20]以维生素E的消耗量作为衡量氧化损伤的标准, 发现褪黑素对H2O2诱导的红细胞氧化损伤不仅无保护作用, 还可加重维生素E的消耗, 而NAS则具有剂量依赖性的抗氧化作用, 并发现这一作用可能与NAS的供氢能力有关. Sadowska-Woda等[21]也证实了NAS对beta-cyfluthrin诱导红细胞氧化损伤的保护作用, 而Mel则无此作用. Aguiar等[22]以脑室内注射6-羟基多巴胺制备纹状体氧化损伤的大鼠模型, 发现NAS可改善动物的运动功能, 提高神经功能评分, Bachurin等[23]认为NAS的这一作用与抑制线粒体膜通透性的增高有关. 同时, 也有研究证实了NAS对肝细胞、神经细胞、肺泡上皮细胞、红细胞、淋巴细胞、视网膜上皮细胞及睾丸上皮细胞等多种细胞氧化损伤的保护作用[3,24-29]. Stuss等[30]证实了NAS对脂多糖诱导脑、肾、肝等多种组织匀浆氧化损伤的保护作用也较Mel强. 上述研究说明NAS的抗氧化作用是非Mel依赖性的, NAS及其衍生物可用于治疗氧化损伤引起的细胞死亡.
根据NAS对铁、铜、H2O2诱导的脂质过氧化反应的保护作用比褪黑素强以及褪黑素对多个内脏器官I/R损伤具有保护作用, 本实验室前期的研究也证实了NAS可抑制H2O2诱导后HepG2细胞中Caspase3的活化、线粒体膜势能的下降和Cytc等促凋亡因子的释放等结果[6], 可以推测NAS可减轻大鼠肝I/R损伤后的细胞凋亡. 为验证这一作用, 本课题采用夹闭肝蒂60 min、再灌注6 h制备肝I/R损伤模型, HE染色和TUNEL染色观察肝细胞的形态和凋亡的变化, 结果发现NAS可减轻I/R损伤所引起的肝组织的结构的破坏、降低肝细胞的AI, 提示NAS可减轻I/R损伤后的肝细胞凋亡.
细胞凋亡是一个由一系列基因控制的细胞主动死亡过程, 在众多的凋亡调节基因中, 原癌基因Bcl-2蛋白家族的作用倍受关注. Bcl-2蛋白家族是线粒体途径细胞凋亡的主要调控因子, 可通过改变线粒体的通透性, 调节Cytc等线粒体促凋亡因子释放. Bcl-2蛋白家族包括抑制和促进凋亡的两类功能相反的蛋白质, 其中Bcl-2是最主要的凋亡抑制基因、Bax是最主要的凋亡促进基因, 二者的比例是决定细胞是否发生凋亡的重要因素[31]. 本研究结果显示, 与I/R组相比, NAS干预组AI降低(P<0.01), 激活型Caspase3和Bax的表达降低, Bcl-2的表达升高, Bcl-2/Bax比值升高(P<0.01). 提示NAS可抑制肝I/R损伤后肝细胞凋亡的发生, 且NAS的保肝作用与调节Bcl-2/Bax比值有关.
肝缺血再灌注(ischemia/reperfusion, I/R)损伤是术后肝功能异常及多器官功能衰竭的重要原因, 也是影响手术成功率和患者存活率的重要因素. 因此, 探讨肝I/R损伤的发病机制、寻找预防和治疗肝I/R损伤新方案已成为目前的研究热点.
孙星, 副教授, 副主任医师, 上海交通大学附属第一人民医院普外科
氧自由基在肝I/R损伤的发生、发展中起重要作用, 寻找有效的自由基清除剂对其防治具有重要意义. N-乙酰-5-羟色胺(N-acetylserotonin, NAS)是一种强自由基清除剂, 但其对大鼠肝I/R损伤是否具有保护作用尚未见报道.
近年来的研究发现, NAS不仅是褪黑素的前体, 其对铁、铜、H2O2等诱导的肝细胞和神经细胞等多种细胞的脂质过氧化反应的保护作用比褪黑素强, 而且褪黑素对多个内脏器官I/R损伤具有保护作用.
本文观察了NAS对肝I/R损伤后肝细胞的凋亡及Bcl-2、Bax和Caspase3等凋亡相关蛋白表达的影响, 探讨了NAS对肝I/R损伤的保护作用及其机制, 为NAS在肝脏疾病中的应用提供了实验依据.
本研究发现NAS可通过提高Bcl-2、降低Bax的表达, 减轻肝I/R损伤所致的肝细胞凋亡. 为肝I/R损伤的防治提供新的靶点, 也为NAS的应用开拓新领域.
I/R损伤: 是指组织器官在缺血时, 其功能不仅不能得到恢复, 反而出现功能障碍和结构损伤的现象.
本文内容较新颖, 设计合理, 思路清晰, 统计方法运用正确, 结论明确, 其研究为肝I/R损伤的防治提供新的靶点.
编辑: 郭鹏 电编:都珍珍
| 1. | Hasegawa K, Takayama T, Orii R, Sano K, Sugawara Y, Imamura H, Kubota K, Makuuchi M. Effect of hypoventilation on bleeding during hepatic resection: a randomized controlled trial. Arch Surg. 2002;137:311-315. [PubMed] [DOI] |
| 2. | Gavazza MB, Català A. Protective effect of N-acetyl-serotonin on the nonenzymatic lipid peroxidation in rat testicular microsomes and mitochondria. J Pineal Res. 2004;37:153-160. [PubMed] [DOI] |
| 3. | Gavazza M, Catalá A. Relative efficacies of alpha-tocopherol, N-acetyl-serotonin, and melatonin in reducing non-enzymatic lipid peroxidation of rat testicular microsomes and mitochondria. Mol Cell Biochem. 2009;321:37-43. [PubMed] [DOI] |
| 4. | Leaden PJ, Catalá A. Melatonin and N-acetyl serotonin inhibit selectively enzymatic and non-enzymatic lipid peroxidation of rat liver microsomes. Prostaglandins Leukot Essent Fatty Acids. 2007;77:29-35. [PubMed] [DOI] |
| 5. | García JJ, Reiter RJ, Karbownik M, Calvo JR, Ortiz GG, Tan DX, Martínez-Ballarín E, Acuña-Castroviejo D. N-acetylserotonin suppresses hepatic microsomal membrane rigidity associated with lipid peroxidation. Eur J Pharmacol. 2001;428:169-175. [PubMed] [DOI] |
| 6. | Jiang J, Yu S, Jiang Z, Liang C, Yu W, Li J, Du X, Wang H, Gao X, Wang X. N-acetyl-serotonin protects HepG2 cells from oxidative stress injury induced by hydrogen peroxide. Oxid Med Cell Longev. 2014;2014:310504. [PubMed] [DOI] |
| 7. | Zhang Q, Fu H, Zhang H, Xu F, Zou Z, Liu M, Wang Q, Miao M, Shi X. Hydrogen sulfide preconditioning protects rat liver against ischemia/reperfusion injury by activating Akt-GSK-3β signaling and inhibiting mitochondrial permeability transition. PLoS One. 2013;8:e74422. [PubMed] [DOI] |
| 8. | Dogan S, Ozlem Elpek G, Kirimlioglu Konuk E, Demir N, Aslan M. Measurement of intracellular biomolecular oxidation in liver ischemia-reperfusion injury via immuno-spin trapping. Free Radic Biol Med. 2012;53:406-414. [PubMed] [DOI] |
| 9. | Guan LY, Fu PY, Li PD, Li ZN, Liu HY, Xin MG, Li W. Mechanisms of hepatic ischemia-reperfusion injury and protective effects of nitric oxide. World J Gastrointest Surg. 2014;6:122-128. [PubMed] [DOI] |
| 10. | Jaeschke H, Woolbright BL. Current strategies to minimize hepatic ischemia-reperfusion injury by targeting reactive oxygen species. Transplant Rev (Orlando). 2012;26:103-114. [PubMed] [DOI] |
| 11. | Javadov S, Hunter JC, Barreto-Torres G, Parodi-Rullan R. Targeting the mitochondrial permeability transition: cardiac ischemia-reperfusion versus carcinogenesis. Cell Physiol Biochem. 2011;27:179-190. [PubMed] [DOI] |
| 15. | Simonneaux V, Ribelayga C. Generation of the melatonin endocrine message in mammals: a review of the complex regulation of melatonin synthesis by norepinephrine, peptides, and other pineal transmitters. Pharmacol Rev. 2003;55:325-395. [PubMed] [DOI] |
| 16. | Oxenkrug G. Antioxidant effects of N-acetylserotonin: possible mechanisms and clinical implications. Ann N Y Acad Sci. 2005;1053:334-347. [PubMed] [DOI] |
| 17. | Oxenkrug GF, Bachurin SO, Prakhie IV, Zefirov NS. Quinone reductase 2 and antidepressant effect of melatonin derivatives. Ann N Y Acad Sci. 2010;1199:121-124. [PubMed] [DOI] |
| 18. | Moosmann B, Behl C. The antioxidant neuroprotective effects of estrogens and phenolic compounds are independent from their estrogenic properties. Proc Natl Acad Sci USA. 1999;96:8867-8872. [PubMed] [DOI] |
| 19. | Wang X, Panyda R, Yao J, Ma H, Li J. Targeting caspases in neonatal hypoxia-ischemic brain injury and traumatic brain injury. Neurodegeneration: Theory, Disorders and Treatments A S McNeill, Eds NOVA Science Publishers, Inc New York 2010; 125-134. |
| 20. | Barsacchi R, Kusmic C, Damiani E, Carloni P, Greci L, Donato L. Vitamin E consumption induced by oxidative stress in red blood cells is enhanced by melatonin and reduced by N-acetylserotonin. Free Radic Biol Med. 1998;24:1187-1192. [PubMed] [DOI] |
| 21. | Sadowska-Woda I, Wójcik N, Karowicz-Bilińska A, Bieszczad-Bedrejczuk E. Effect of selected antioxidants in beta-cyfluthrin-induced oxidative stress in human erythrocytes in vitro. Toxicol In Vitro. 2010;24:879-884. [PubMed] [DOI] |
| 22. | Aguiar LM, Macedo DS, de Freitas RM, de Albuquerque Oliveira A, Vasconcelos SM, de Sousa FC, de Barros Viana GS. Protective effects of N-acetylserotonin against 6-hydroxydopamine-induced neurotoxicity. Life Sci. 2005;76:2193-2202. [PubMed] [DOI] |
| 23. | Bachurin SO, Shevtsova EP, Kireeva EG, Oxenkrug GF, Sablin SO. Mitochondria as a target for neurotoxins and neuroprotective agents. Ann N Y Acad Sci. 2003;993:334-344; discussion 345-349. [PubMed] |
| 24. | Zhou H, Wang J, Jiang J, Stavrovskaya IG, Li M, Li W, Wu Q, Zhang X, Luo C, Zhou S. N-acetyl-serotonin offers neuroprotection through inhibiting mitochondrial death pathways and autophagic activation in experimental models of ischemic injury. J Neurosci. 2014;34:2967-2978. [PubMed] [DOI] |
| 25. | Tosini G, Ye K, Iuvone PM. N-acetylserotonin: neuroprotection, neurogenesis, and the sleepy brain. Neuroscientist. 2012;18:645-653. [PubMed] [DOI] |
| 26. | Shen J, Ghai K, Sompol P, Liu X, Cao X, Iuvone PM, Ye K. N-acetyl serotonin derivatives as potent neuroprotectants for retinas. Proc Natl Acad Sci USA. 2012;109:3540-3545. [PubMed] [DOI] |
| 27. | Tang GY, Ip AK, Siu AW. Pinoline and N-acetylserotonin reduce glutamate-induced lipid peroxidation in retinal homogenates. Neurosci Lett. 2007;412:191-194. [PubMed] [DOI] |
| 28. | Yang S, Jan YH, Gray JP, Mishin V, Heck DE, Laskin DL, Laskin JD. Sepiapterin reductase mediates chemical redox cycling in lung epithelial cells. J Biol Chem. 2013;288:19221-19237. [PubMed] [DOI] |
| 29. | Wölfler A, Abuja PM, Schauenstein K, Liebmann PM. N-acetylserotonin is a better extra- and intracellular antioxidant than melatonin. FEBS Lett. 1999;449:206-210. [PubMed] [DOI] |
| 30. | Stuss M, Wiktorska JA, Sewerynek E. N-acetylserotonin reduces lipopolysaccharide-induced lipid peroxidation in vitro more effectively than melatonin. Neuro Endocrinol Lett. 2010;31:489-496. [PubMed] |
| 31. | Thomadaki H, Scorilas A. BCL2 family of apoptosis-related genes: functions and clinical implications in cancer. Crit Rev Clin Lab Sci. 2006;43:1-67. [PubMed] [DOI] |