修回日期: 2015-01-26
接受日期: 2015-01-29
在线出版日期: 2015-03-18
目的: 通过对溃疡性结肠炎(ulcerative colitis, UC)患者外周血单个核细胞进行内质网应激(endoplasmic reticulum stress, ERS)刺激, 比较X-盒结合蛋白1(X-box binding protein 1, XBP1)剪切形式(XBP1 splicing, XBP1s)及炎性细胞因子表达水平变化, 探讨UC患者对ERS反应的变化.
方法: 通过实时聚合酶链反应(real time-polymerase chain reaction, RT-RCR)检测XBP1s, 实时定量聚合酶链反应(quantitative-polymerase chain reaction, Q-PCR)检测白介素-2(interleukin-2, IL-2)、γ-干扰素(interferon-γ, IFN-γ)、IL-17α表达变化. 比较UC之间差异并进行相关分析.
结果: (1)用植物凝集素(phytohemagglutinin, PHA)及毒胡萝卜素(thapsigargin, TG)单独及联合刺激正常人及UC患者外周血单个核细胞后XBP1均发生剪切, 联合刺激时剪切形势较明显; (2)分别PHA与TG、联合刺激正常人及UC患者外周血单个核细胞, 发现联合刺激组IL-2、IFN-γ、IL-17α表达水平增高.
结论: 在ERS状态下, 正常人群及UC患者的T淋巴细胞均可通过XBP1s所介导的信号通路对ERS发生响应, 激活炎性细胞因子表达, 加重炎性发生, 与正常人相比, UC患者外周血单个核细胞对ERS作用更为敏感.
核心提示: 人T淋巴细胞能通过X-盒结合蛋白1(X-box binding protein 1, XBP1)的剪切反应对内质网应激(endoplasmic reticulum stress, ERS)产生影响, 促进γ干扰素(interferon-γ)、白介素(interleukin, IL)-17α、IL-2等细胞因子的分泌, 并且溃疡性结肠炎(ulcerative colitis)患者的外周血单个核细胞对ERS作用更为敏感, 且患者的T淋巴细胞可以通过肌醇需求酶l(inositol-requiring enzyme 1)/XBP1通路对ERS做出响应, 激活体内获得性免疫促进细胞因子的表达, 在炎症的发生、发展过程中起重要作用.
引文著录: 李楠, 王雪明, 姜丽君, 张萌, 李娜, 魏真真, 郑楠, 赵亚娇. 内质网应激对溃疡性结肠炎患者炎性因子表达的影响. 世界华人消化杂志 2015; 23(8): 1359-1368
Revised: January 26, 2015
Accepted: January 29, 2015
Published online: March 18, 2015
AIM: To demonstrate the regulatory effect of endoplasmic reticulum stress (ERS) on T lymphocyte function and the pathogenesis of ulcerative colitis (UC) by stimulating peripheral blood mononuclear cells of UC patients with thapsigargin (TG) and measuring the splicing of X-box binding protein 1 (XBP1) and changes of cytokine expression.
METHODS: Primary T lymphocytes were seeded in 12-well plates and stimulated with TG for 12 h. The cells were collected and lysed for mRNA analysis of cytokine expression and XBP1 splicing. All subjects were from Department of Gastroenterology of Chinese PLA 309th Hospital from May 2002 to March 2013, and UC was diagnosed according to the diagnostic standard for UC which was formulated in 2007 in Jinan. Peripheral blood mononuclear cells were isolated, seeded in 12-well plates and stimulated with phytohemagglutinin (PHA), TG, or PHA + TG, respectively. The expression of interleukin-2 (IL-2), interferon-γ (IFN-γ), and IL-7α was analyzed by quantitative polymerase chain reaction (Q-PCR), and the splicing of XBP1 was detected by real-time polymerase chain reaction (RT-PCR).
RESULTS: XBP splicing was detected when peripheral blood mononuclear cells were stimulated with PHA and TG, alone or in combination, both in UC patients and healthy adults, and XBP splicing was more significant in cells from UC patients treated with PHA plus TG. Increased levels of IL-2, IFN-γ, and IL-17α could be observed both in UC patients and healthy adults when peripheral blood mononuclear cells were stimulated with PHA plus TG, and the increase was more significant in the UC group.
CONCLUSION: Compared to health subjects, UC patients are more sensitive to ERS in terms of increased XBP 1 splicing and up-regulation of inflammatory cytokines such as IL-2, IFN-γ and IL-17α.
- Citation: Li N, Wang XM, Jiang LJ, Zhang M, Li N, Wei ZZ, Zheng N, Zhao YJ. Influence of endoplasmic reticulum stress on T cell function and expression of inflammatory cytokines in ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2015; 23(8): 1359-1368
- URL: https://www.wjgnet.com/1009-3079/full/v23/i8/1359.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i8.1359
内质网作为重要细胞器, 能够调控蛋白质合成、折叠及促进胆固醇、类固醇等多种脂质合成. 在多种生理或病理的状态下, 如未折叠蛋白的增加、错误折叠蛋白的生成、钙离子的调节紊乱以及细胞内氧化还原状态改变都能引起内质网应激(endoplasmic reticulum stress, ERS)[1]发生, ERS通过蛋白未折叠反应(unfolded protein response, UPR)来修复应激引起的细胞损伤, 恢复细胞正常功能.
肌醇需求酶l(inositol-requiring enzyme 1, IRE1)/X-盒结合蛋白1(X-box binding protein 1, XBP1)是ERS过程中重要的信号通路之一, 他可以通过减少蛋白合成、促进蛋白降解、增加伴侣分子生成, 减缓ERS发生, 使细胞功能恢复正常, 最终使受损细胞得以修复. 在ERS条件下, IRE1/XBP1通路可以激活c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)[2,3]相关的信号通路, 促进细胞因子及生物趋化因子的释放, 通过激活天然免疫系统对机体起到调控作用. 各国学者们从Toll样受体(Toll-like receptor, TLR)[4]、细胞因子的改变及机体免疫系统等角度研究, 阐述炎症性肠病(inflammatory bowel disease, IBD)、溃疡性结肠炎(ulcerative colitis, UC)的发病机制, IRE1/XBP1信号通路能通过维持肠道黏膜屏障完整维持肠道潘氏细胞数目、促进肠道内细胞因子分泌等方面保护肠道黏膜, 减少肠道炎症的发生[5-7]. 但目前ERS对T淋巴细胞的影响及UC患者对ERS的相应变化尚无文献报道. 那么, XBP1是否通过调节获得性免疫来影响UC的发生就成为我们关注的问题.
正常对照组18例, 年龄为25-55岁(平均40岁), 男13例, 女5例, 选自2012-05/2013-03在总参谋部医院消化科体检均排除UC诊断标准的健康志愿者. 所有研究对象均排除高血压、冠心病、脑血管意外等心脑血管疾病, 糖尿病、甲状腺功能衰退等内分泌代谢疾病, 肝、肾、胰腺疾病, 缺氧相关性疾病, 炎症、肿瘤、应激反应等. UC组21例, 年龄为23-54岁(平均39岁), 男16例, 女5例, 选自2012-05/2013-03在总参谋部总医院消化科、西苑医院级朝阳医院西院治疗的UC患者, 按照2007年在济南制定的: "我国对UC诊断治疗规范达成共识意见"均诊断为中重度UC, 患者资料如表1. 低温高速离心机(德国Eppendorf公司); 干式恒温仪(杭州奥盛生物技术公司); DNA扩散仪(美国PE公司); 实时定量PCR仪(德国Eppendorf公司); 聚丙烯酸胺凝胶电泳及电转仪(美国Boi-Rad公司); 倒置荧光显微镜(日本Nikon公司); CO2培养箱(美国Thenno公司); 台式高速离心机(德国Eppendorf公司); 台式低温高速离心机(德国Eppendorf公司); 漩涡震荡器(北京同正生物技术有限公司); 超低温水箱(中国海尔电器公司); 化学发光仪(美国DLR公司); 温度模块控制仪(德国Eppendorf公司); 纯水器(美国Millipore公司); 紫外分光光度计(美国Pharmacia公司); 琼脂糖凝胶电泳槽(北京六一设备厂). 氯仿、异丙醇、无水乙醇(北京化工厂); Concanavalin A(ConA)(美国Sigma公司); Phytohemagglutinin(PHA)(美国Sigma公司); Thapsingargin(TG)(美国Sigma公司); RPMI 1640培养基(北京钮因华信公司); FBS(美国Gibco公司); RNAiso Plus(日本Takara公司); RAN反转录试剂盒(日本Takara公司); Real-time试剂盒(日本Takara公司); SYBR(康为试剂公司); 琼脂糖(GENE公司); Goodview(赛百盛基因技术公司); 淋巴细胞分层液(美国Sigma公司).
| 编号 | 性别 | 年龄(岁) | 肠镜诊断 | 病理表现 |
| 1 | 男 | 25 | 重度, 急性期 | 急慢性炎 |
| 2 | 男 | 52 | 重度, 急性期 | 急慢性炎 |
| 3 | 女 | 48 | 中重度, 急性期 | 急慢性炎 |
| 4 | 男 | 43 | 中重度, 缓解期 | 慢性炎 |
| 5 | 女 | 57 | 中度, 急性期 | 慢性炎 |
| 6 | 男 | 50 | 中度, 急性期 | 慢性炎 |
| 7 | 男 | 42 | 中度, 缓解期 | 慢性炎 |
| 8 | 男 | 23 | 中度, 急性期 | 急慢性炎 |
| 9 | 男 | 41 | 中重度, 急性期 | 急慢性炎 |
| 10 | 男 | 23 | 中度, 急性期 | 急性炎 |
| 11 | 男 | 45 | 中重度, 急性期 | 急慢性炎 |
| 12 | 男 | 35 | 重度, 缓解期 | 急慢性炎 |
| 13 | 男 | 47 | 重度, 急性期 | 急慢性炎 |
| 14 | 男 | 33 | 中重度, 缓解期 | 慢性炎 |
| 15 | 女 | 56 | 中度, 缓解期 | 慢性炎 |
| 16 | 男 | 51 | 中度, 急性期 | 慢性炎 |
| 17 | 男 | 40 | 中度, 缓解期 | 急性炎 |
| 18 | 男 | 22 | 中度, 急性期 | 急慢性炎 |
| 19 | 男 | 39 | 中重度, 缓解期 | 慢性炎 |
| 20 | 男 | 27 | 中度, 急性期 | 急性炎 |
| 21 | 男 | 43 | 中重度, 缓解期 | 急性炎 |
1.2.1 细胞分离及原代培养: 人外周血单个核细胞的分离培养: 采取人外周肝素钠抗凝静脉血4-6 mL, 用RPMI 1640培养基稀释2倍, 取15 mL离心管, 分别加入与外周血等量的淋巴细胞分离液, 将已稀释好的外周血缓慢加入离心管中, 使其悬浮于人淋巴细胞分离液上, 2000 r/min离心20 min, 缓慢吸取人淋巴细胞分离液之上的细胞层, 即为单个核细胞, 加入RPMI 1640完全培养液的离心管中(注意尽量将细胞吸净, 避免将其下层液体吸入), 1500 r/min离心5 min, 弃上清, 清洗细胞2次, 弃上清, 细胞计数, 调整细胞密度为5×108个/L, 于37 ℃、50 mL/L CO2的CO2培养箱中培养.
1.2.2 人外周血单个核细胞的分组和处理: (1)将所提取的正常人和UC患者外周血单个核细胞悬液分别铺于12孔板中, 每孔加1 mL细胞悬液, 细胞密度调整为5×108个/L; (2)实验分两大组, 分别正常人外周血单个核细胞及UC患者外周血单个核细胞; 每大组各自分4小组, 分别为空白对照组、PHA刺激组、TG刺激组及PHA+TG刺激组, 每组3个复孔, 实验重复3次; (3)配制PHA和TG工作液, 用RPMI 1640培培养液稀释PHA及TG, 将1 mg/mL的PHA稀释成250 μg/mL; 将1 mmol/L的TG稀释成100 nmol/L; (4)空白组不加任何药物; PHA刺激组加入20 μL的PHA稀释液(刺激终浓度为5 μg/mL); TG刺激组加入30 μL的TG稀释液(刺激终浓度300 nmol/L); PHA+TG刺激组同时加入20 μL的PHA稀释液和30 μL的TG稀释液, 37 ℃、50 mL/L CO2培养箱中培养12 h后收集细胞, 提取RNA待用.
1.2.3 实时荧光定量PCR(real-time fluorescence quantification PCR, qRT-PCR): 总RNA提取: (1)细胞处理后吸取细胞悬液, 1000 r/min、5 min离心, 小心去除上清, 每瓶加入0.4 mL TRIzol, 用吸管吹打置于1.5 mL EP管中, 室温静置5 min; (2)加入0.1 mL氯仿, 剧烈振荡EP管15 s, 室温静置5 min, 12000 g, 4 ℃, 离心15 min, 取上层水相置于一新的EP管; (3)加入0.3 mL异丙醇, 轻微震荡15 s, 室温静置5 min, 12000 g, 4 ℃离心10 min, 留沉淀; (4)加入0.5 mL 750 mL/L乙醇, 涡旋混匀, 12000 g, 4 ℃, 离心5 min, 留沉淀; (5)超净台中室温晾5-10 min至半干, 加入适量灭菌DEPC水, 57 ℃, 水溶10 min, 使RNA充分溶解; (6)取2 μL溶解好的RNA, 用灭菌DEPC水2:9稀释, 用分光光度计测定RNA浓度及纯度, 比值在1.7-2.0之间, 将所提取的RNA保存在-70 ℃以备反转录用.
逆转录PCR(reverse transcription PCR, RT-PCR): (1)RT反应体系共10 μL, 5×primerScript Bμffer 2 μL, Random6 (100 μmol)0.5 μL, PrimerScript RT Enzyme Mix 0.5 μL, Oligo dT Primer(50 μmol)0.5 μL, 总RNA 2 μg, 灭菌DEPC水加至终体积为10 μL; (2)RT反应条件: RT反应体系于37 ℃反应15 min, 85 ℃ 5 s终止逆转录, 4 ℃保存.
QRT-PCR: (1)按下列组份配制PCR反应液(在冰上进行, 避光): SYBR Premix Ex TaqTM(2×)12.5 μL, PCR Forward Primer 1 μL, PCR Reverse Primer 1 μL, DNA模板2.0 μL, dH2O(灭菌蒸馏水)9.5 μL, 总体系25 μL; (2)添加PCR扩增用模板; (3)使用qRT-PCR扩增仪, 采用两步法进行PCR扩增, 标准程序如下: Stage l: 预变性, Reps: l 95 ℃ 30 s; Stage 2: PCR反应, Reps: 45 95 ℃ 5 s, 60 ℃ 30 s, 45/20 circle; (4)实验结果分析: 反应结束后确认qRT-PCR的扩增曲线和融解曲线, 进行PCR定量时制作标准曲线等. 引物序列(表2).
| 引物名称(Human) | 序列 | |
| IL-2 | Fowerd | 5'-AAGTTTTACATGCCCAAGAAGG-3' |
| Reverse | 5'-AAGTGAAAGTTTTTGCTTTGAGCTA-3' | |
| IFN-γ | Fowerd | 5'-AGGGAAGCGAAAAAGGAGTCA-3' |
| Reverse | 5'-GGACAACCATTACTGGGATGCT-3' | |
| IL-17α | Fowerd | 5'-GAGCCCCAAAAGCAAGAGGAA-3' |
| Reverse | 5'-TGCGGGCATACGGTTTCATC-3' | |
| IL-4 | Fowerd | 5'-GCCAAGACCCCTTCGAGAAAT-3' |
| Reverse | 5'-CCGTCCCTGTTATCTGCCTCC-3' | |
| GAPDH | Fowerd | 5'-TGTGGGCATCAATGGATTTGG-3' |
| Reverse | 5'-ACACCATGTTATTCCGGGTCAAT-3' | |
1.2.4 半定量RT-PCR: 总RNA提取: (1)细胞处理后每瓶加入0.4 mL TRIzol, 用吸管吹打置于1.5 mL EP管中, 室温静置5 min; (2)加入0.1 mL氯仿, 剧烈震荡EP管15 s, 室温静置5 min, 12000 g, 4 ℃, 离心15 min, 取上层水相置于一新的ER管; (3)加入0.3 mL异丙醇, 轻微振荡15 s, 室温静置10 min, 12000 g, 4 ℃, 离心10 min, 留沉淀; (4)加入0.5 mL 75%乙醇, 涡旋混匀, 12000 g, 4 ℃, 离心5 min, 留沉淀; (5)超净台中室温晾5-10 min至半干, 加入适量灭菌DEPC水, 57 ℃, 水溶10 min, 使RNA充分溶解; (6)将2 μL溶解好的RNA, 溶于98 μL的DEPC水中, 用分光光度计测定RNA浓度及纯度, 比值在1.7-2.0之间, 将RNA保存于-70 ℃冰箱, 以备反转录用.
逆转录(RT): (1)RT反应体系共10 μL, 5×PrimerScript Buffer 2 μL, Random 6 (100 μmol) 0.5 μL, PrimerScript RT Enzyme Mix 0.5 μL, Olligo dT Primer(50 μmol)0.5 μL, 总RNA 2 μg, 灭菌DEPC水加至终体积为10 μL; (2)RT反应条件: RT反应体系于37 ℃反应15 min, 85 ℃ 5 s终止逆转录, 4℃保存.
普通PCR: (1)按下列组份配制PCR反应液(在冰上进行, 避光): Tag Mixture(2×) 15 μL, PCR Forward Primer 2 μL, PCR Reverse Primer 2 μL, cDNA模板4 μL, dH2O(灭菌蒸馏水)11 μL, Total 35 μL; (2)添加0.2 mL的EP管中进行扩增; (3)使用PCR扩增仪, 采用两步法进行PCR扩增, 标准程序如下: Stage 1: 预变性→Reps: 1 95 ℃ 30 s→63 ℃ 30 s→72 ℃ 30 s→Stage 2: 终延伸→Reps: 1→72 ℃ 30 min→45/20 circles; (4)配置3%的琼脂糖胶50 mL加5 μL的Goodview, 待胶固定备用; (5)将PCR后的产物加入琼脂糖凝胶槽中行电泳观察不同组间XBP1剪切情况, 引物序列(表3).
| 引物名称 | 序列 | |
| Human XBP1 | Fowerd | 5'-AAACAGAGTAGCAGCTCAGACTGC-3' |
| Reverse | 5'-TCCTTCTGGGTAGACCTCTGGGAG-3' | |
| Mouse XBP1 | Fowerd | 5'-AAACAGAGTAGCAGCGCAGACTGC-3' |
| Reverse | 5'-TCCTTCTGGGTAGACCTCTGGGAG-3' | |
统计学处理 实验数据以mean±SD表示, 用统计软件Graphpad Prism 5.0进行作图. 用t-test进行显著性分析, P<0.05为差异有统计学意义.
对人T淋巴细胞刺激激活, 诱导内质网效应产生的角度证实T淋巴细胞可以通过XBP1对ERS产生效应, 即在ERS状态下, 可以通过XBP1应激适应性免疫系统, 使其对ERS产生应答, 促进炎症因子表达.
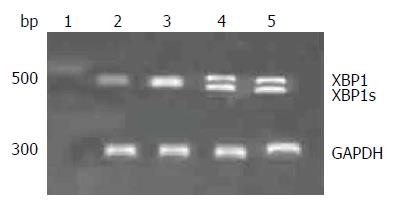
UC患者外周血单个核细胞提取、刺激、实验分组、分别为空白对照(Ctrl)组、PHA刺激组(刺激组浓度为5 μg/mL)、TG刺激组12 h后收集细胞, 检测XBP1的剪切情况, 结果如图1所示, 经溃疡性肠炎患者外周血单个核细胞PHA和TG联合刺激组XBP1s的表达量明显增高.
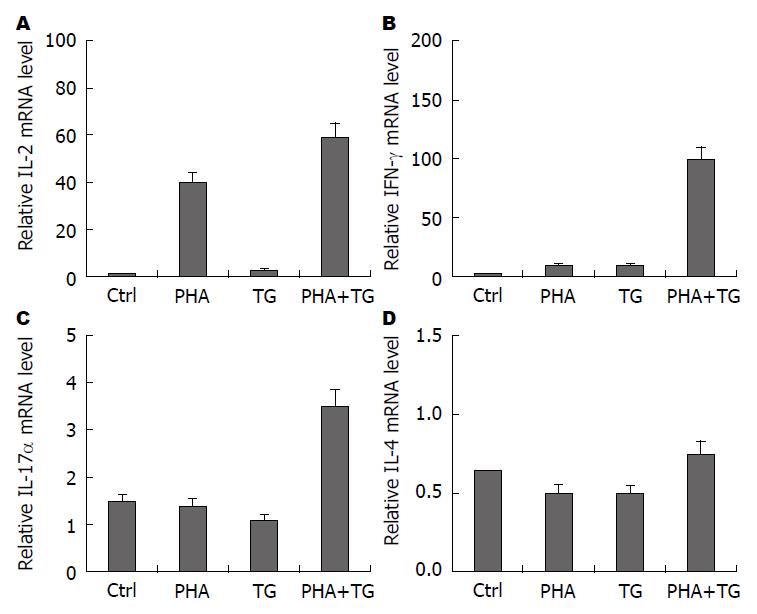
用PHA、TG刺激活化UC换者外周血单个核细胞分别为空白对照(Ctrl)组、PHA刺激组(刺激浓度为5 μg/mL)、TG刺激组(刺激终浓度300 nmol/L)及PHA+TG刺激组, 刺激12 h后收集细胞, 检查白介素-2(interleukin-2, IL-2)、γ-干扰素(interferon-γ, IFN-γ)、IL-17α、IL-4等细胞因子的表达情况, 如图2所示, 经PHA及TG联合刺激后IL-2、IFN-γ、IL-17α的表达量明显增高.
为了研究健康对照组与UC患者外周血单个核细胞在ERS状态下XBP1剪切形式的变化情况及炎性细胞因子的表达间的差异, 我们进一步抽取正常人群的外周血进行.
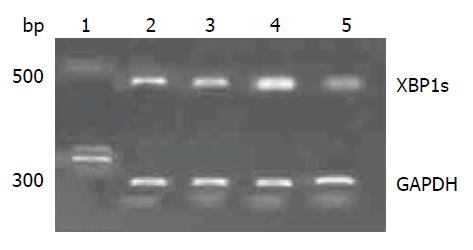
首先, 我们抽取正常人群的外周血, 提取单个核细胞, 并用PHA、TG单独联合刺激, 实验分四组, 分别为空白对照(Ctrl)组、PHA刺激组(刺激浓度为5 μg/mL)、TG刺激组(刺激终浓度300 nmol/L)及PHA+TG刺激组, 刺激12 h后收集细胞, 检测XBP1的剪切情况, 结果如图3所示, 经PHA和TG联合刺激XBP1s见明显变化.
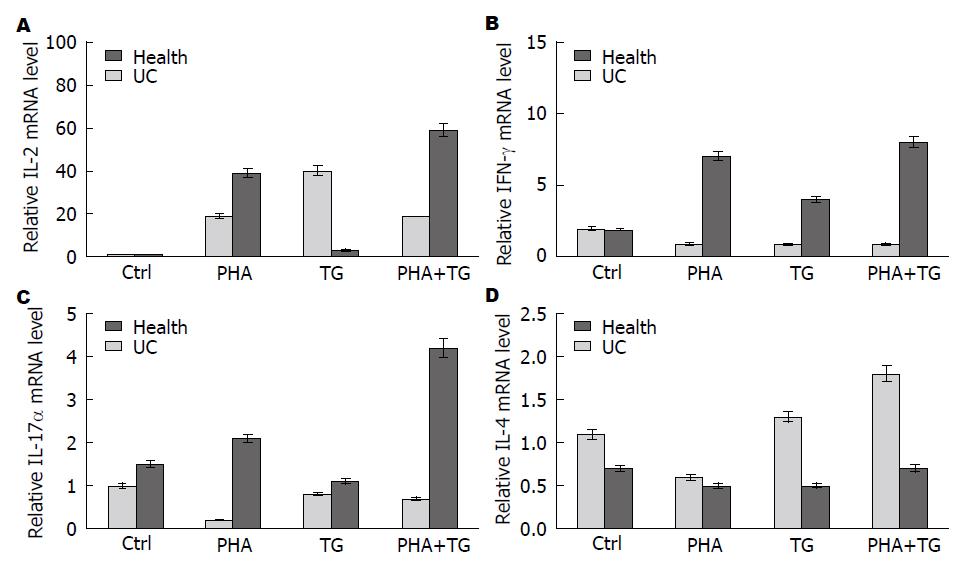
为了研究在ERS状态下, 经刺激后的健康对照组与UC患者的外周血单个核细胞炎性细胞因子的表达差异, 我们进行以下实验. 实验分两大组, 分别正常人外周血单个核细胞及UC患者外周血单个核细胞; 每大组各自分4小组, 分别为空白对照(Ctrl)组、PHA刺激组(刺激终浓度为5 μg/mL)、TG刺激组(刺激终浓度300 nmol/L)及PHA+TG刺激组, 刺激12 h后收集细胞, 检测IL-2、IFN-γ、IL-17α等细胞因子的表达情况. 如图4所示, 经PHA及TG联合溃疡性结肠炎患者中IL-2、IFN-γ、IL-17α的表达量较正常人明显增高.
经上述实验证实, 用PHA刺激正常人及UC患者外围血单个核细胞使其中的T淋巴细胞激活, 给予TG刺激, 使其处于ERS状态下, 经PHA和TG联合刺激UC患者外周血单个核细胞后, XBP1的剪切形式较空白对照组、PHA及TG单独刺激组明显增强, 但正常人群XBP1s未见明显差异, 同时检测发现用PHA与TG联合刺激后正常人和UC患者涠洲血单个核细胞后, 正常健康人群IL-2、IFN-γ、IL-17α表达无明显变化, 但溃疡性结肠炎患者细胞因子的表达量较正常人增高, 均有统计学意义. 说明在同样的ERS刺激下. UC患者的T淋巴细胞对ERS更加敏感, 同时UC患者可表达更多的促炎因子, 加剧炎症反应的发生.
IBD(包括UC及克罗恩病)是发生与肠道的一种慢性非特异性疾病, 目前病因未明, 多数学者将其归因为自身免疫性疾病. 由于其病因未明导致该病的诊断率低、治疗效果差、预后不佳, 成为临床诊治的难题. 内质网作为机体的细胞器, 在蛋白的合成成熟运输及维持钙的稳态方面起着重要的作用, 进而影响蛋白的折叠、质量控制及转运调节. 体内、外任何条件改变是内质网功能受到影响, 导致蛋白质的加工受阻, 大量折叠蛋白蓄积于内质网中, 使得内质网功能障碍. 为了缓解内质网的压力, 与ERS通路中3个重要信号分子蛋白激酶R样内质网激酶(PRKR-like endoplasmic reticulum kinase, PERK)、转录激活因子-6(activating transcription factor 6, ATF6)、IRE1结合的分子伴侣结合免疫球蛋白(binding immunoglobulin protein, BiP)与上述3个分子解离, BiP直接作用于折叠蛋白, 促进会折叠蛋白发生折叠, 协助蛋白合成并将加工完成的蛋白质输入内质网, 发挥蛋白的正常生理功能, 同时解除了内质网的压力, 是内质网的功能恢复正常. 如果内质网众位折叠蛋白继续大量产生, 压力持续负荷增大, 使得PERK、ATF6、IRE1 3条通路被激活, 他们通过减少蛋白的合成、促进蛋白降解、增加伴侣分子的生成而减缓ERS的发生, 使细胞功能恢复正常, 但若内质网中的压力负荷仍未解除, 最终将导致细胞的凋亡. 在ERS发生的过程中, 机体的免疫系统、与炎症及压力相关的通道及氧化应激通路的功能均会受到影响, 从而引起机体产生一些慢性代谢性疾病及自身免疫性疾病, 如2型糖尿病、脂肪肝、神经性病变、各种肿瘤及IBD[8]等. 这为我们探索UC的发病机制提供新思路.
目前已经有实验证明, 在ERS状态下, IRE1/XBP1通路可以通过TLR激活机体的天然免疫系统[4]. 在巨噬细胞中, XBP1的活化一方面可以通过TLR促进外周血单个核细胞NADPH氧化酶-2(mononuclear cells NADPH oxidase-2, NOX2)的诱导实现[9]; 另一方面可以通过激活ROR系统[10]而引起XBP1的活化, 最终激活k基因结合核因子(nuclear factor-κB, NF-κB)、JNK等信号通路[2,11,12], 并促进IL-6、肿瘤坏死因子(tumor necrosis factor, TNF)等细胞因子的分泌, 并在免疫反应发生的早期作用[9]. 我们通过实验发现, 在ERS状态下, 人T淋巴细胞激活后XBP1s的表达明显增高, 并促进IL-2、IFN-γ、IL-17α的表达, 加重炎症发生. 进一步实验发现, 与未被激活T淋巴细胞相比, 激活的T淋巴细胞用TG刺激后检测XBP1s表达明显增强. XBP1s是XBP1的活性形式, 当IRE1/XBP1信号通路被激活后XBP1s将明显增强. 与单独激活的T淋巴细胞相比, 激活剂与TG协同刺激T淋巴细胞后IL-2、IFN-γ、IL-17α细胞因子的mRNA水平表达量明显增加. 以上结果说明集体活化T淋巴细胞功能通过XBP1对ERS产生影响, 即在ERS状态下, XBP1不仅能够激活天然免疫反应[13], 同时可以激活机体获得性免疫并释放细胞因子. 获得性免疫作为免疫系统中最为重要的部分之一, 在机体产生免疫应答过程中起关键作用, 参与影响多种自身免疫性疾病的发生、发展及影响其预后. 以往研究发现IBD的发病与自身免疫关系最为密切, 已证实TLR家族通过15天然免疫及CD4+CD25+调节T细胞[14]通过适应性免疫分别在IBD发病过程中起着重要的调节作用, 发现一些细胞因子如TNFα、IL-17α、IL-23、转化生长因子(transforming growth factor, TGF)-β在IBD的发病过程中起重要作用, 但是仍无法阐明IBD的解释清楚. 本实验对内质网三条通道中的关键分子进行检测, 发现在严重性患者肠道上皮黏膜中IRE1/XBP1及ATF6的表达量较正常对照明显增加而PERK表达量降低[15], 这就表明IBD患者肠道中有ERS的发生, 但其具体机体尚不清楚.
我们的实验室针对ERS可激活UC患者获得性免疫系统, 而对UC的发生发展起作用而展开. 我们通过采取UC患者外周血, 分离其单个核细胞并用PHA刺激使T淋巴细胞激活, 同时给予TG刺激检测XBP1剪切情况, 发现在ERS状态下UC患者被激活的T淋巴细胞中发现XBP1发生明显剪切, 且剪切形式较未刺激及PHA、TG单独刺激时明显增强. 我们同时对处理后各组细胞的细胞因子进行检测, 发现经诱导激活剂PHA与TG共同刺激到UC患者外周血单个核细胞IL-2、IFN-γ及IL-17α的mRNA水平的表达量明显增加. 我们还将健康人群的外周血单个核细胞提取后给予PHA、TG分别及联合刺激, 发现经过PHA和TG联合刺激后IL-2、IFN-γ、IL-17α表达量及XBP1剪切形式有所增加; 但与UC患者相比其各组细胞因子的表达量明显减低, 且XBP1剪切形式表达减弱. 由此, 我们认为UC患者的外周血单个会细胞对ERS作用更为敏感. 在ERS状态下, 激活的UC患者感到外周血单个核细胞中XBP1s表达更明显, 并可以激活体内获得性免疫促进IL-2、IFN-γ、IL-17α等细胞因子表达, 加重UC的发生.
通过我们的实验还发现用TG刺激激活T淋巴细胞及UC患者外周血单个核细胞IL-2、IFN-γ、IL-17α的表达均有明显增加, 但IL-14的表达量无明显变化. 机体T细胞中存在T辅助细胞(helper T cells, Th), 他分为Th1与Th2两型, 而IL-2及IFN-γ是由Th1型细胞表达的, IL-4由Th2细胞表达, 正常情况下Th1与Th2之间存在动态平衡. 通过我们的实验可以看出, IL-2、IFN-γ、IL-17α的表达增加, IL-4未见明显变化, 说明在ERS状态下淋巴细胞向Th1方向发生漂移, 而Th1细胞主要介导细胞免疫反应[16], 参与诱发器官特异性自身免疫病的发生. 进一步说明机体处于ERS状态下更易发生自身免疫病. 这可能是UC发生的一个重要机制. 通过我们实验发现在ERS条件下, UC患者淋巴细胞中IL-2、IFN-γ、IL-17α表达均增加, IL-4表达量无明显变化. 说明UC患者淋巴细胞向Th1方向发生了漂移, 而在正常健康人中无此现象, 这也与文献报道的活动期UC患者淋巴细胞向Th1漂移相一致[17].
IL-17α是由Th17细胞亚群分泌释放的一种细胞因子, 是一种促进炎症发生的细胞因子, 常在自身免疫性疾病及感染性疾病中发挥作用[18]. 有文献报道UC发生过程中IL-17α表达量明显增加[19]. 我们用TG刺激正常人及UC患者活化的外周血单个细胞, 发现与正常人相比, UC患者淋巴细胞经刺激后IL-17α表达量增加. 且经PHA与TG联合刺激的UC患者的淋巴细胞IL-17α的表达量较PHA单独刺激时明显增加. 我们用TG刺激激活的人T淋巴细胞时IL-17α的表达量均明显增加, 说明在ERS可以使激活的T淋巴细胞表达IL-17α, 加重炎症发生. 我们用TG刺激激活的UC患者淋巴细胞IL-17α, 表达水平明显高于PHA、TG单独刺激, 说明UC患者对ERS更加敏感.
在ERS状态下, 活化的人T淋巴细胞能够通过XBP1对ERS产生影响并促进炎性细胞因子的表达且淋巴细胞向Th1方向漂移. 因此, 本文认为ERS状态下获得性免疫能够被激活, 促进炎症因子表达, 加重自身免疫疾病发生. UC被认为是自身免疫性疾病, 通过对该病患者外周血淋巴细胞的研究发现, 与正常健康人群相比, UC患者外周血淋巴细胞对ERS作用更为敏感, 且其淋巴细胞能够通过XBP1对ERS做出响应, 激活体内获得性免疫促进IL-2、IL-17α、IFN-γ等细胞因子的表达. 这可能是UC的发病机制之一, 如果阻断该条途径可能成为治疗溃疡性结肠炎的方法之一, 尚需进一步实验证实.
总之, 本研究发现人T淋巴细胞能通过XBP1的剪切反应对ERS产生影响, 促进IFN-γ、IL-17α、IL-2等细胞因子的分泌, 并且发现UC患者的外周血单个核细胞对ERS作用更为敏感, 且患者的T淋巴细胞可以通过IRE1/XBP1通路对ERS做出响应, 激活体内获得性免疫促进细胞因子的表达, 在炎症的发生、发展过程中起重要作用.
溃疡性结肠炎(ulcerative colitis, UC)目前病因未明, 多数学者将其归因为自身免疫性疾病. 内质网作为机体的细胞器, 在蛋白的合成成熟运输及维持钙的稳态方面起着重要的作用, 进而影响蛋白的折叠、质量控制及转运调节. 体内、外任何条件改变是内质网功能受到影响, 导致蛋白质的加工受阻, 大量折叠蛋白蓄积于内质网中, 使得内质网功能障碍. 从而导致机体的免疫系统、与炎症及压力相关的通道及氧化应激通路的功能均受到影响, 引起机体产生一些慢性代谢性疾病及自身免疫性疾病, 如2型糖尿病、脂肪肝、神经性病变、各种肿瘤及炎症性肠病(inflammatory bowel disease, IBD)等. 这为我们探索UC的发病机制提供新思路.
刘杰民, 副主任医师, 贵州省人民医院消化内镜科
文献显示肌醇需求酶1(inositol-requiring enzyme 1, IRE1)/X-盒结合蛋白1(X-box binding protein 1, XBP1)信号通路能通过维持肠道黏膜屏障完整维持肠道潘氏细胞数目、促进肠道内细胞因子分泌等方面保护肠道黏膜, 减少肠道炎症的发生. 但目前内质网应激(endoplasmic reticulum stress, ERS)对T淋巴细胞的影响及UC患者对ERS的相应变化尚无文献报道. 那么, XBP1是否通过调节获得性免疫来影响UC的发生就成为我们关注的问题.
国内外文献从Toll样受体、细胞因子的改变及机体免疫系统等角度研究, 阐述UC的发病机制. 提示IRE1/XBP1信号通路能通过维持肠道黏膜屏障完整维持肠道潘氏细胞数目、促进肠道内细胞因子分泌等方面保护肠道黏膜, 减少肠道炎症的发生. 但目前ERS对T淋巴细胞的影响及UC患者对ERS的相应变化尚无文献报道.
目前ERS对T淋巴细胞的影响及UC患者对ERS的相应变化尚无文献报道. 那么, XBP1是否通过调节获得性免疫来影响UC的发生就成为我们关注的问题. 经过我们研究发现在ERS状态下, 正常人群及UC患者的T淋巴细胞均可通过XBP1s所介导的信号通路对ERS发生响应, 激活炎性细胞因子表达, 加重炎性发生, 与正常人相比, UC患者外周血单个核细胞对ERS作用更为敏感.
ERS状态下获得性免疫能够被激活, 促进炎症因子表达, 加重自身免疫疾病发生. UC被认为是自身免疫性疾病, 通过对该病患者外周血淋巴细胞的研究发现, 与正常健康人群相比, UC患者外周血淋巴细胞对ERS作用更为敏感, 且其淋巴细胞能够通过XBP1对ERS做出响应, 激活体内获得性免疫促进白介素(interleukin, IL)-2、IL-17α、γ干扰素(interferon-γ, IFN-γ)等细胞因子的表达. 这可能是UC的发病机制之一, 如果阻断该条途径可能成为治疗UC的方法之一.
内质网应激(ERS): 内质网内环境的稳定是实现内质网功能的基本条件, 因此内质网具有极强的内稳态体系. 但仍然有很多因素可导致内质网功能的内稳态失衡, 形成ERS. 例如缺血再灌注损伤、氧化应激、同型半胱氨酸等化学物质处理、细胞内蛋白质合成过快以至于超过蛋白折叠能力、内质网钙代谢紊乱、卵磷脂合成障碍等多种物理、化学或遗传因素等均可引发ERS.
本研究通过探讨ERS对UC患者炎性因子表达的影响, 结果提示人T淋巴细胞能通过XBP1的剪切反应对ERS产生影响, 促进IFN-γ、IL-17α、IL-2等细胞因子的分泌, 并且发现UC患者的外周血单个核细胞对ERS作用更为敏感, 且患者的T淋巴细胞可以通过IRE1/XBP1通路对ERS做出响应, 激活体内获得性免疫促进细胞因子的表达, 在炎症的发生、发展过程中起重要作用, 对指导临床工作具有一定意义.
编辑: 韦元涛 电编: 闫晋利
| 2. | Urano F, Wang X, Bertolotti A, Zhang Y, Chung P, Harding HP, Ron D. Coupling of stress in the ER to activation of JNK protein kinases by transmembrane protein kinase IRE1. Science. 2000;287:664-666. [PubMed] [DOI] |
| 3. | Nishitoh H, Matsuzawa A, Tobiume K, Saegusa K, Takeda K, Inoue K, Hori S, Kakizuka A, Ichijo H. ASK1 is essential for endoplasmic reticulum stress-induced neuronal cell death triggered by expanded polyglutamine repeats. Genes Dev. 2002;16:1345-1355. [PubMed] [DOI] |
| 4. | Zhang K, Kaufman RJ. From endoplasmic-reticulum stress to the inflammatory response. Nature. 2008;454:455-462. [PubMed] [DOI] |
| 5. | Kaser A, Lee AH, Franke A, Glickman JN, Zeissig S, Tilg H, Nieuwenhuis EE, Higgins DE, Schreiber S, Glimcher LH. XBP1 links ER stress to intestinal inflammation and confers genetic risk for human inflammatory bowel disease. Cell. 2008;134:743-756. [PubMed] [DOI] |
| 6. | Keshav S, Lawson L, Chung LP, Stein M, Perry VH, Gordon S. Tumor necrosis factor mRNA localized to Paneth cells of normal murine intestinal epithelium by in situ hybridization. J Exp Med. 1990;171:327-332. [PubMed] |
| 7. | Cadwell K, Liu JY, Brown SL, Miyoshi H, Loh J, Lennerz JK, Kishi C, Kc W, Carrero JA, Hunt S. A key role for autophagy and the autophagy gene Atg16l1 in mouse and human intestinal Paneth cells. Nature. 2008;456:259-263. [PubMed] [DOI] |
| 8. | Hotamisligil GS. Endoplasmic reticulum stress and the inflammatory basis of metabolic disease. Cell. 2010;140:900-917. [PubMed] [DOI] |
| 9. | Martinon F, Chen X, Lee AH, Glimcher LH. TLR activation of the transcription factor XBP1 regulates innate immune responses in macrophages. Nat Immunol. 2010;11:411-418. [PubMed] [DOI] |
| 10. | Malhotra JD, Kaufman RJ. Endoplasmic reticulum stress and oxidative stress: a vicious cycle or a double-edged sword? Antioxid Redox Signal. 2007;9:2277-2293. [PubMed] [DOI] |
| 11. | Kawai T, Akira S. TLR signaling. Semin Immunol. 2007;19:24-32. [PubMed] [DOI] |
| 12. | Hu P, Han Z, Couvillon AD, Kaufman RJ, Exton JH. Autocrine tumor necrosis factor alpha links endoplasmic reticulum stress to the membrane death receptor pathway through IRE1alpha-mediated NF-kappaB activation and down-regulation of TRAF2 expression. Mol Cell Biol. 2006;26:3071-3084. [PubMed] [DOI] |
| 13. | Siddique I, Khan I. Mechanism of regulation of Na-H exchanger in inflammatory bowel disease: role of TLR-4 signaling mechanism. Dig Dis Sci. 2011;56:1656-1662. [PubMed] [DOI] |
| 14. | Kanai T, Kawamura T, Dohi T, Makita S, Nemoto Y, Totsuka T, Watanabe M. TH1/TH2-mediated colitis induced by adoptive transfer of CD4+CD45RBhigh T lymphocytes into nude mice. Inflamm Bowel Dis. 2006;12:89-99. [PubMed] [DOI] |
| 15. | Tréton X, Pédruzzi E, Cazals-Hatem D, Grodet A, Panis Y, Groyer A, Moreau R, Bouhnik Y, Daniel F, Ogier-Denis E. Altered endoplasmic reticulum stress affects translation in inactive colon tissue from patients with ulcerative colitis. Gastroenterology. 2011;141:1024-1035. [PubMed] [DOI] |