修回日期: 2015-01-07
接受日期: 2015-01-12
在线出版日期: 2015-03-18
目的: 近年来, 出现了很多有关微小RNA(micro RNAs, miRNAs)对肝细胞癌(hepatocellular carcinoma, HCC)诊断价值的研究, 结果显示不同的miRNAs对HCC的诊断价值有所不同, 现将各文献的研究结果作一荟萃分析, 用以评价miRNAs对HCC的诊断价值.
方法: 系统性地检索"Cochrane图书馆"、"PubMed文献数据库"、"MEDLINE数据库"、"EMBASE数据库"、"维普中文科技期刊数据库"、"万方数据知识服务平台"、"中国生物医学文献数据库"、"中国科学期刊数据库"、"中国学术期刊全文数据库"截止2014-10以前的文献, 对相关文献进行"纳入"和"排除", 提取符合要求文献的诊断数据, 评价其诊断效能.
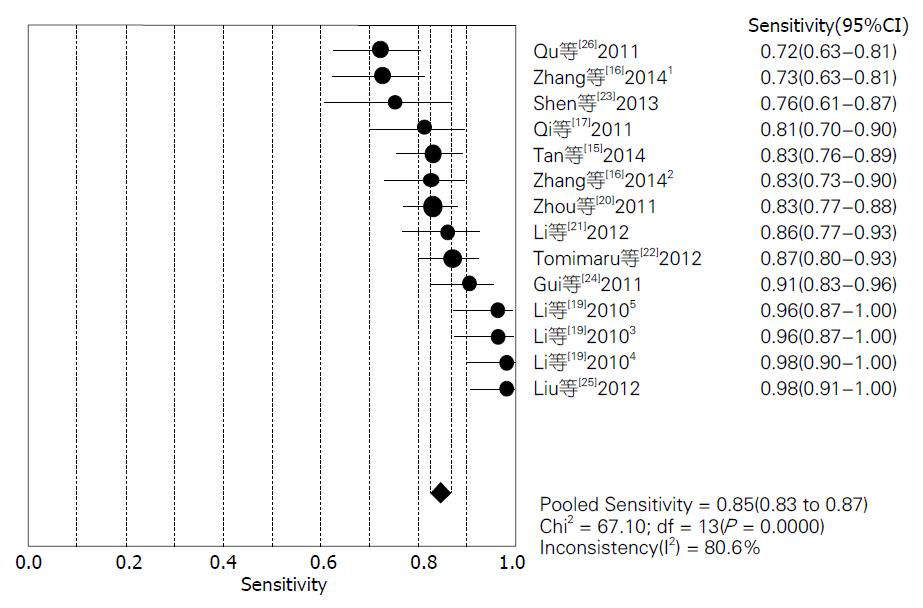
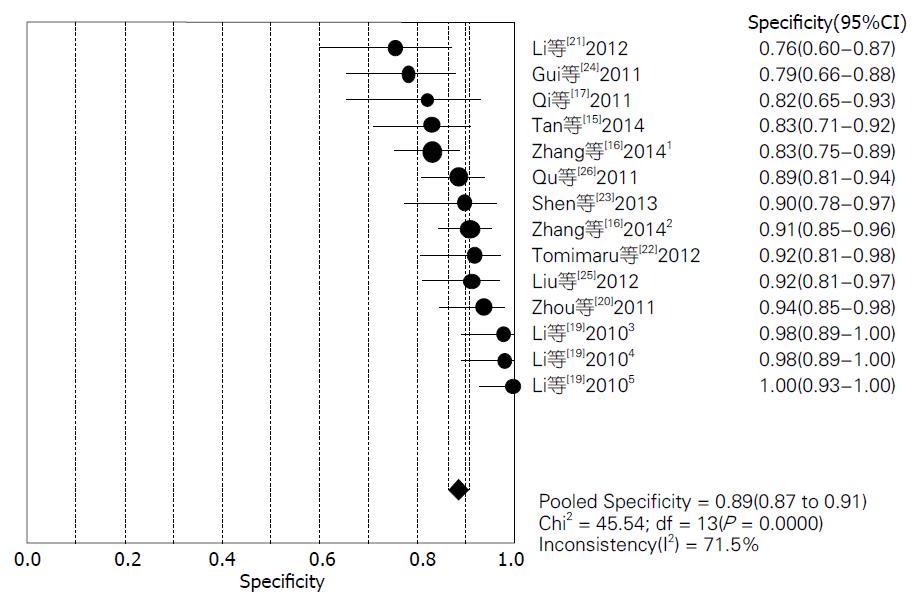
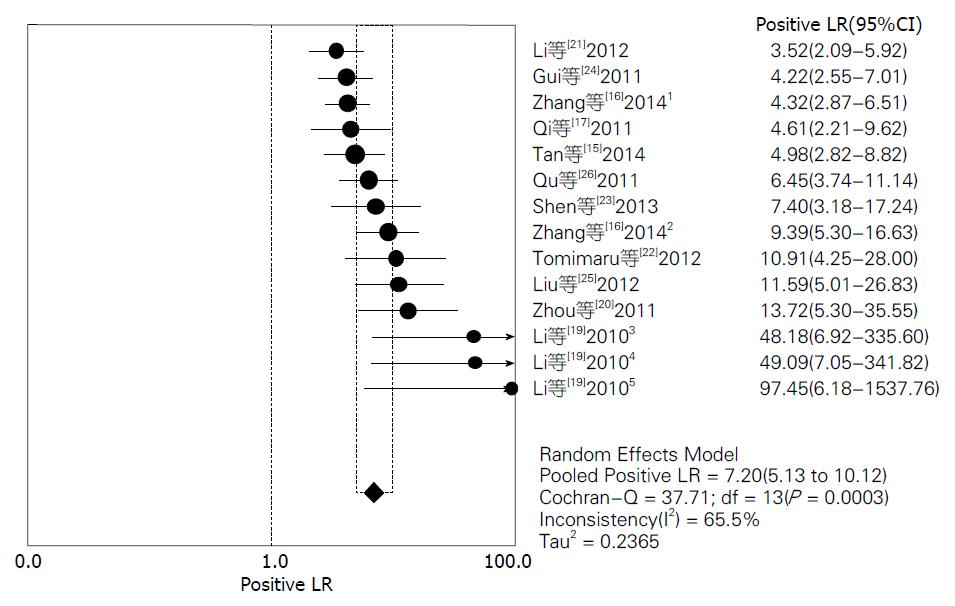
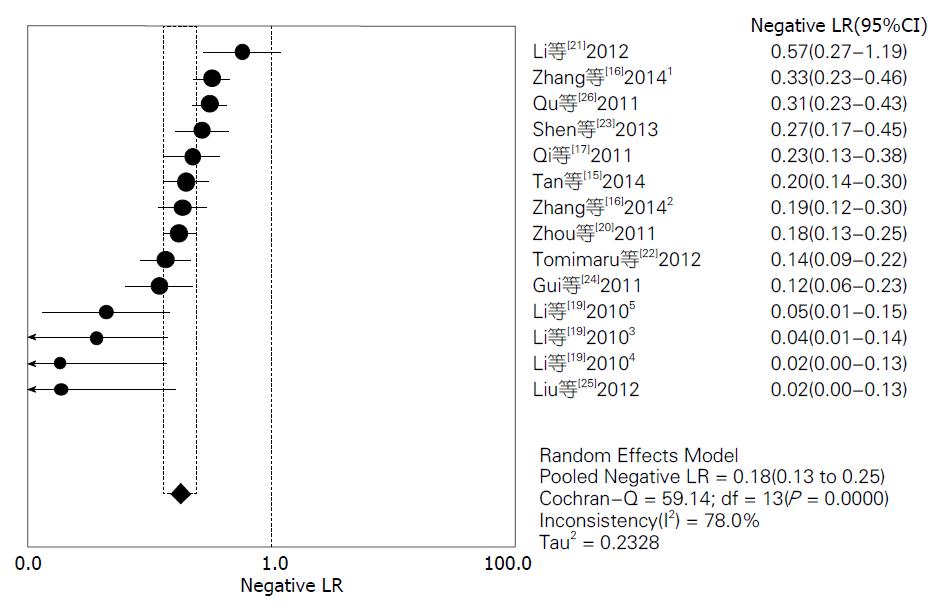
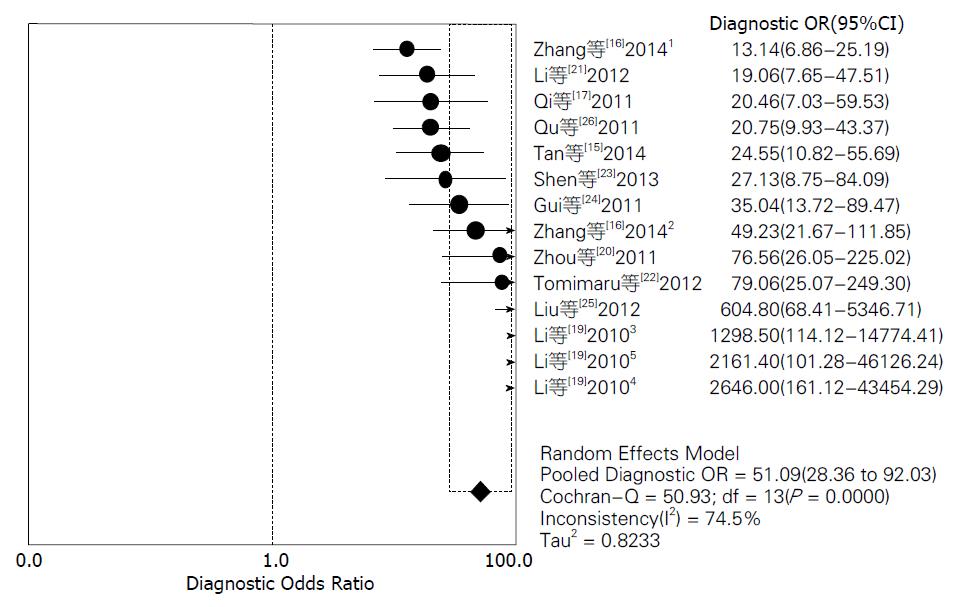
结果: 共检索出676条文献, 排除后总共有11篇文献符合分析要求, 进行荟萃和异质性分析后, 其灵敏度范围为72%-98%, 合并灵敏度为85%; 特异度范围为76%-100%, 合并特异度为89%; 阳性似然比范围为3.52-97.45, 合并阳性似然比为7.20; 阴性似然比范围为0.02-0.57, 合并阴性似然比为0.18; 诊断优势比范围为13.14-2646.00, 合并诊断优势比为51.09.
结论: miRNAs对HCC有较高的诊断价值.
核心提示: 本研究通过对文献的纳入和排除, 挑选出11篇与微小RNA(microRNAs)诊断肝细胞癌(hepatocellular carcinoma)诊断价值相关的文献, 先对文献质量进行评估, 再提取数据进行统计学分析, 得出其有较高诊断价值的重要结论, 不仅是一次文献的聚集、再现, 更是数据的充分展示, 可为科研和临床工作者提供较大的参考价值.
引文著录: 胡琼英, 张爽, 张朝明. 有关肝细胞癌微小RNA诊断价值的系统评价. 世界华人消化杂志 2015; 23(8): 1314-1322
Revised: January 7, 2015
Accepted: January 12, 2015
Published online: March 18, 2015
AIM: To perform a literature review and meta-analysis of the diagnostic accuracy of microRNAs (miRNAs) for HCC.
METHODS: We systematically searched the Cochrane Central Register of Controlled Trials, PubMed, MEDLINE, EMBASE, the Chinese Biomedical Literature Database, the China Academic Journals Full-text Database, and the Chinese Scientific Journals Database for potential studies till October 2014. Studies were included and excluded according to inclusion and exclusion criteria. Meta-analysis was then performed to evaluate the overall diagnostic performance of miRNAs.
RESULTS: A total of 676 studies were retrieved, of which 11 were finally included in this meta-analysis. The range of the diagnostic sensitivity of miRNAs for HCC was 72%-98%, pooled sensitivity was 85%; specificity was 76%-100%, pooled specificity was 89%; positive likelihood ratio was 3.52-97.45, pooled positive likelihood ratio was 7.20; negative likelihood ratio was 0.02-0.57, pooled negative likelihood ratio was 0.18; and diagnostic odds ratio was 13.14-2646.00, pooled diagnostic odds ratio was 51.09.
CONCLUSION: MiRNAs have a relatively high accuracy in identifying HCC.
- Citation: Hu QY, Zhang S, Zhang CM. MicroRNAs as diagnostic biomarkers for hepatocellular carcinoma: A meta-analysis. Shijie Huaren Xiaohua Zazhi 2015; 23(8): 1314-1322
- URL: https://www.wjgnet.com/1009-3079/full/v23/i8/1314.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i8.1314
微小RNA(microRNA, miRNA)是一类长度约为22个核苷酸的非编码RNA分子, 可以调控真核细胞的基因表达、增殖、分化、凋亡等一系列生物学行为[1]. 通过对miRNA的功能研究, 了解其与疾病发生、发展和预后之间的关系是miRNA研究的热点. 研究[2]表明, 约有50%的miRNA基因位于肿瘤相关的基因位点区域, 并且不同的肿瘤类型表达不同的miRNA谱. miRNA与肿瘤关系的探讨涉及到肿瘤研究的各个领域, 包括肿瘤的发生(癌基因和抑癌基因的调控)、肿瘤的诊断和治疗等, 这些肿瘤包括肝肝细胞癌(hepatocellular carcinoma, HCC)[3,4]、肺癌[5,6]、卵巢癌[7,8]、白血病[9,10]等. HCC是全世界最常见的死亡率较高、预后较差的恶性肿瘤之一, 转移和复发率较高与HCC发现晚错失了手术及放化疗的最佳时期密切相关, 因此, 早期发现、早期治疗成为HCC诊治策略的主要方向[11]. HCC的常规诊断包括肝活体组织穿刺检查、影像学检查及血肿瘤标志物检查. 肝活体组织穿刺检查是HCC诊断的"金标准", 但因其取材部位、花费和较大创伤性限制, 难以普及应用; B超、计算机断层扫描(computed tomography, CT)及磁共振成像(magnetic resonance imaging, MRI)等影像学检查手段对HCC的诊断有十分重要的价值, 但对<1 cm的癌灶及组织的癌前病变缺乏较高的灵敏度; 甲胎蛋白(alpha fetoprotein, AFP)是HCC实验室诊断的常用指标, 但据报道其灵敏度和特异度仅41%-65%和80%-94%, 难以早期诊断[12,13]. 由此可见, 寻找一种早期诊断HCC的方法或标志物, 是HCC诊断研究领域的重点. 近年来, 越来越多的文献研究了不同的miRNAs诊断HCC的诊断价值, Yang等[14]汇总了miRNA与HCC诊治之间的关系, 指出miRNA是一类创伤性小、灵敏度高的早期诊断HCC的生物标志物. Tan等[15]筛选出8种miRNAs联合诊断HCC, 受试者工作曲线(receiver operating characteristic curve, ROC)下面积(area under the curve, AUC)为88%; Zhang等[16]发现miR-143和miR-215是HCC早期诊断的循环标志物, 诊断灵敏度和特异度分别为: 73%和83%(miR-143), 80%和91%(miR-215). Qi等[17]应用RT-PCR筛选出血清miR-122在诊断界值为0.475时, 诊断HCC的灵敏度和特异度分别为81.6%和83.3%.
基于miRNA在HCC诊断研究中的优秀表现, 我们将这些文献做一汇总分析, 以期评判miRNA诊断HCC的价值, 为HCC的分子机制、诊断及分子靶向治疗提供新的证据.
检索数据库和策略: 检索"Cochrane图书馆"(2005/2014-10的系统评价)、"PubMed文献数据库"、"MEDLINE数据库"(1946/2014-10)、"EMBASE数据库"、"维普中文科技期刊数据库"、"万方数据知识服务平台"、"中国生物医学文献数据库"(1978/2014-10)、"中国科学期刊数据库"(1989/2014-10)、"中国学术期刊全文数据库"(1979/2014-10)相关的文献(无语言限制), 遵循的检索策略为英文: 'microRNA' and ('hepatocellular carcinoma' OR 'HCC' OR 'liver cancer' OR 'liver'); 中文: #1检测技术指标(主题词OR自由词); #2目标疾病(主题词OR自由词); #3诊断准确性指标(主题词OR自由词); #4#1 AND #2 AND #3; 中文主要检索词: 微小RNA、microRNA、miRNA、肝细胞癌、HCC、肝癌、肝等. 所有的文献管理应用文献管理软件(Thomson Reuters EndNote X5).
1.2.1 纳入和排除标准: 纳入标准: 所有待纳入的文献必须有诊断价值的数据(灵敏度、特异度等), 并能构建2×2表格(直接数据或间接计算); 金标准明确.
排除标准: 数据不足; 动物实验; 语言非中英文; 病例未经"金标准"确诊.
1.2.2 质量评价: 运用QUADAS质量评价表评价文献质量, 如有异议, 由所有评价者共同讨论或咨询原文献作者决定. 表内容的评价方式是"是"、"否"和"不清楚"[18].
1.2.3 数据提取和分析: 提取纳入文献的原始数据, 基本的资料信息包括: 第一作者名字, 出版年限, 研究对象, 方法设计, 标本例数、miRNA类型和检测方法等; 对纳入文献进行异质性评价.
统计学处理 提取2×2表格(诊断性试验的四格表)所需数据来源于验证标本例数、灵敏度和特异度; 进行基本数据提取后, 将数据整合, 应用诊断性试验系统评价专用软件Meta-Disc1.4软件进行数据分析和处理, 得到诊断比值比(diagnostic odds ratio, DOR), 计算及各诊断指标的综合效应, 绘制汇总受试者工作特征曲线(summary receiver operating characteristic, SROC), 用Q值描述SROC曲线接近图形左上角的程度, 作为诊断试验效能综合测量的评价指标, Q值越大, 诊断试验准确性越好, 并计算AUC.
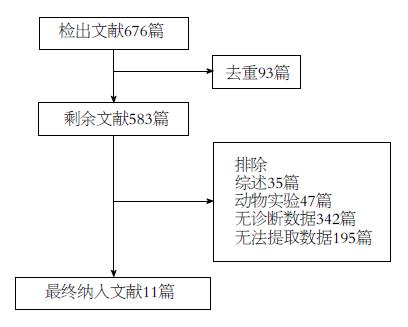
共检索文献676篇, 去重93篇, 按纳入和排除标准, 排除572篇, 最终纳入11篇文献(图1). 对11篇待评价的文献进行基本信息、文献质量分析和基本数据提取(构建2×2表格)(表1, 2).
| 纳入研究 | Li等[19]2010 | Gui等[24]2011 | Qi等[17]2011 | Qu等[26]2011 | Zhou等[20]2011 | Li等[21]2012 | Liu等[25]2012 | Tomimaru等[22]2012 | Shen等[23]2013 | Tan等[15]2014 | Zhang等[16]2014 |
| miRNAs类型 | microRNA组合1 | miR-885-5p | miR-122 | miR-16 | microRNA组合2 | miR-18a | miR-15b和 miR-130b | miR-21 | miR-483-5p | microRNA组合3 | miR-143和 miR-215 |
| 相关疾病 | HBV相关性HCC | HCC | HCC(HBV阳性) | HCC | HBV相关性HCC | HBV相关性HCC | HCC | HCC | HCC | HCC | HCC |
| 样本种类 | 血清 | 血清 | 血清 | 血清 | 血浆 | 血清 | 血清 | 血浆 | 血浆 | 血清 | 血清 |
| 检测方法 | qRT-PCR | qRT-PCR | qRT-PCR | qRT-PCR | qRT-PCR | qRT-PCR | qRT-PCR | qRT-PCR | qRT-PCR | qRT-PCR | qRT-PCR |
| 年龄(岁) | 53.43±9.10b | 54.2(平均) | 24-55 | 55(平均) | 53±12b | 54(25-82) | <60和≥60 | 63±10b | 61.1±11.7 | 52.01±10.21 | 54.21±6.95 |
| a条目1 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 |
| a条目2 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 |
| a条目3 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 |
| a条目4 | 不清楚 | 是 | 不清楚 | 不清楚 | 不清楚 | 不清楚 | 是 | 是 | 是 | 是 | 是 |
| a条目5 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 |
| a条目6 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 |
| a条目7 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 |
| a条目8 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 |
| a条目9 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 |
| a条目10 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 |
| a条目11 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 |
| a条目12 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 | 是 |
| a条目13 | 否 | 否 | 否 | 否 | 否 | 否 | 否 | 否 | 否 | 否 | 否 |
| a条目11 | 不清楚 | 不清楚 | 不清楚 | 不清楚 | 不清楚 | 不清楚 | 不清楚 | 不清楚 | 不清楚 | 不清楚 | 不清楚 |
| 文献 | n | 真阳性数(n) | 假阳性数(n) | 假阴性数(n) | 真阴性数(n) | 灵敏度(%) | 特异度(%) |
| Li等[19]20101 | 513 | 53 | 1 | 2 | 49 | 97 | 99 |
| Li等[19]20102 | 513 | 54 | 1 | 1 | 49 | 98 | 99 |
| Li等[19]20103 | 513 | 53 | 0 | 2 | 50 | 96 | 100 |
| Gui等[24]2011 | 151 | 86 | 12 | 9 | 44 | 91 | 79 |
| Qi等[17]2011 | 152 | 57 | 6 | 13 | 28 | 82 | 83 |
| Qu等[26]2011 | 283 | 76 | 12 | 29 | 95 | 72 | 89 |
| Zhou等[20]2011 | 934 | 163 | 4 | 33 | 62 | 83 | 94 |
| Li等[21]2012 | 191 | 74 | 11 | 12 | 34 | 86 | 75 |
| Liu等[25]2012 | 212 | 56 | 5 | 1 | 54 | 98 | 92 |
| Tomimaru等[22]2012 | 216 | 110 | 4 | 16 | 46 | 87 | 92 |
| Shen等[23]2013 | 138 | 37 | 5 | 12 | 44 | 76 | 90 |
| Zhang等[16]20144 | 340 | 69 | 21 | 26 | 104 | 73 | 83 |
| Zhang等[16]20145 | 340 | 76 | 11 | 16 | 114 | 80 | 91 |
| Tan等[15]2014 | 658 | 108 | 10 | 22 | 50 | 83 | 83 |
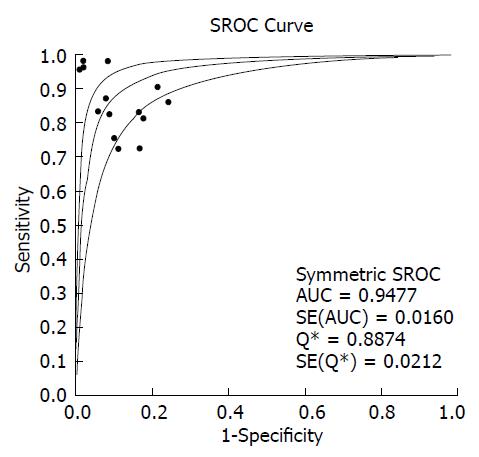
对11篇应用miRNA诊断HCC的文献进行Meta分析, 将从各原始文献提取的2×2表中的数据输入Meta-Disc1.4软件进行分析, 得到灵敏度(sensitivity)范围为72%-98%, 合并后为85%, 其95%CI为0.83-0.87(图2); 特异度(specificity)范围为76%-100%, 合并后为89%, 其95%CI为0.87-0.91(图3); 绘制的SROC曲线, AUC为0.9477(图4); 阳性似然比(positive likelihood ratio, PLR)范围为3.52-97.45, 合并后为7.20, 其95%CI为5.13-10.12(图5); 阴性似然比(negative likelihood ratio, NLR)范围为0.02-0.57, 合并后为0.18, 其95%CI为0.13-0.25(图6); 诊断优势比范围为13.14-2646.00, 合并后为51.09, 其95%CI为28.36-92.03(图7).
诊断性实验的系统评价主要包括文献质量评价和数据分析两方面. 因此在文献检索和筛选的过程中, 需要多名工作者遵循相同的检索策略、纳入和排除标准, 共同商议决定. 以QUADAS质量评价表为判断标准, 将能够提取样本量、真阳性数(true positive, TP)、假阳性(false positive, FP)、假阴性(false negative, FN)、真阴性(true negative, TN)的纳入文献质量进行逐一评价, 进而初步判断诊断性实验研究在方法学设计上的优劣. 本次评价的11篇文献, 均能以病理诊断为金标准, 短时期内将待测实验的结果与之比较, 在相同的检测技术情况下(RT-PCR), 筛选出合格的miRNA标志物(训练组), 再以诊断明确的目标疾病(金标准)或健康对照者的标本对这些标志物进行诊断效能的验证, 从整体设计和技术而言, 是满足诊断性实验的基本要求的. 但在这个过程中有两个方面易产生异质性, 一是疾病谱的构成; 另一个是标本类型的选择. 因为实验目的不同, 可能疾病谱的构成有差异, Li等[19]、Zhou等[20]、Li等[21]、Qi等[17]所采用的疾病标本均是乙型肝炎病毒(hepatitis B virus, HBV)相关的HCC标本, 而其余文献均没有阐明HCC的相关性; Zhou等[20]、Tomimaru等[22]和Shen等[23]采用的是血浆标本, 而剩余9篇文献皆采用的是血清标本, 以上两点对miRNA的筛选可能存在一定影响, 这在Meta分析中是异质性的来源.
基于疾病谱组成和样本类型的不同, miRNA的类型也有所不同. 具体体现在单个RNA的诊断和多个RNA组合联合诊断的效能表现. 以单个RNA为例, Gui等[24](miR-885-5p)、Liu等[25](miR-122)、Qu等[26](miR-16)、Qi等[17](miR-122)、Li等[21](miR-18a)、Tomimaru等[22](miR-21)、Shen等[23](miR-483-5p)和Zhang等[16](miR-143和miR-215)均不相同、诊断界值(cut-off值)也不相同, 这对后面系统评价时的数据分析有很大的影响, 所以我们在数据处理时, 主要以各诊断效能的范围呈现为主, 合并效应只是作为参考. 已知同一个疾病, 可能表达多种不同的miRNAs, 相同的miRNA也会出现在不同的疾病种类中. 如miR-21, 在Tomimaru等[22]的文献中, 他作为HCC的诊断标志物, 灵敏度和特异度分别达87%和92%, 是一个相对较理想的标志物. 另有多篇文献报道miR-21可作为肺癌、结肠癌等癌症诊断标志物, Shen等[23]miR-21诊断各种癌症的文献做了一篇系统评价, 通过对4684例癌症患者及3108例健康对照的比较, 得到miR-21诊断癌症的综合灵敏度和特异度分别为78%和83%. 可见, 虽然miRNA的表达病变特异, 但在不同疾病中的表达有高低之分, 作为诊断标志物, 在追求较高灵敏度的同时更需考虑特异度的问题, 从实际研究来看, 多种miRNA联合甚至联合其他的生物标志优于单纯靠某一种标志物作为诊断手段.
对纳入文献进行文献治疗评估后, 提取数据进行Meta分析, 得到灵敏度范围为72%-98%, 特异度范围为76%-100%, 绘制的SROC曲线, 曲线下面积为0.9477; 阳性似然比范围为3.52-97.45, 合并后为7.20, 其95%CI为5.13-10.12; 阴性似然比范围为0.02-0.57, 合并后为0.18, 其95%CI为0.13-0.25; 诊断优势比范围为13.14-2646.00, 合并后为51.09, 其95%CI为28.36-92.03. SROC曲线中用Q值描述SROC曲线接近图形左上角的程度, 作为诊断试验效能综合测量的评价的又一指标, Q值越大, 诊断试验准确性越好[27]. 本研究分析结果显示曲线下面积为0.9477, Q值为0.8874, 综合其他诊断效能的结果判断, miRNA是诊断HCC较好的生物标志物.
微小RNA(micro RNAs, miRNAs)调控着细胞生命活动的各个环节, 作为诊断标志物在多种疾病的研究层出不穷[包括肝细胞癌(hepatocellular carcinoma, HCC)], 但研究内容和诊断价值各不相同, 基于这种现状, 本文作一系统评价以期了解miRNAs诊断HCC的真正价值.
李孟森, 教授, 海南医学院/海南省肿瘤发生和干预重点实验室; 张倜, 主任医师, 天津肿瘤医院肝胆科, 天津医科大学肿瘤医院
本文就各发表文献的诊断数据运用Meta分析的手段分析他们的诊断价值, 并归类、整理评估各文献的质量、异质性, 从方法学设计、病例纳入等课题设计方面全面评估发表文献的质量.
Li等在课题的方法学设计上合理、诊断数据详实, 尤其是病例选择, 涵盖了目的疾病的相关疾病, 有说服力.
本文与一般综述不一样, 涵盖二次分析; 在系统评价领域中并不止局限于对数据的统计学处理, 更在文献质量和方法学设计上着手, 让读者全面了解待评估的文献.
miRNAs在诊断标志物中的应用一直处于一种研究阶段, 还没有像甲胎蛋白等生物标志物一样进入临床应用, 本文作一系统评价, 意在使其诊断价值更加明确, 为临床诊断及分子靶向治疗提供一定的依据.
诊断价值: 并不是单指某一个指标, 而是包含灵敏度、特异度、阳性预测值、阴性预测值等一系列指标; 异质性: 统计学上的偏倚, 就是产生差异或可能不准确或不可靠的地方.
本文在HCC的早期诊断评价中有较高的价值, 本文从文献筛选、评估、纳入、排除等各个环节均提供了较为充足且有意义的信息, 具有一定的创新性.
编辑: 韦元涛 电编: 闫晋利
| 1. | Imamura K, Akimitsu N. Long Non-Coding RNAs Involved in Immune Responses. Front Immunol. 2014;5:573. [PubMed] [DOI] |
| 2. | Garzon R, Calin GA, Croce CM. MicroRNAs in Cancer. Annu Rev Med. 2009;60:167-179. [PubMed] [DOI] |
| 3. | Korhan P, Erdal E, Atabey N. MiR-181a-5p is downregulated in hepatocellular carcinoma and suppresses motility, invasion and branching-morphogenesis by directly targeting c-Met. Biochem Biophys Res Commun. 2014;450:1304-1312. [PubMed] [DOI] |
| 4. | Ni F, Zhao H, Cui H, Wu Z, Chen L, Hu Z, Guo C, Liu Y, Chen Z, Wang X. MicroRNA-362-5p promotes tumor growth and metastasis by targeting CYLD in hepatocellular carcinoma. Cancer Lett. 2015;356:809-818. [PubMed] [DOI] |
| 5. | Usó M, Jantus-Lewintre E, Sirera R, Bremnes RM, Camps C. miRNA detection methods and clinical implications in lung cancer. Future Oncol. 2014;10:2279-2292. [PubMed] [DOI] |
| 6. | Sozzi G, Boeri M, Rossi M, Verri C, Suatoni P, Bravi F, Roz L, Conte D, Grassi M, Sverzellati N. Clinical utility of a plasma-based miRNA signature classifier within computed tomography lung cancer screening: a correlative MILD trial study. J Clin Oncol. 2014;32:768-773. [PubMed] [DOI] |
| 7. | Langhe R, Norris L, Saadeh FA, Blackshields G, Varley R, Harrison A, Gleeson N, Spillane C, Martin C, O'Donnell DM. A novel serum microRNA panel to discriminate benign from malignant ovarian disease. Cancer Lett. 2015;356:628-636. [PubMed] [DOI] |
| 8. | Wang L, Zhu MJ, Ren AM, Wu HF, Han WM, Tan RY, Tu RQ. A ten-microRNA signature identified from a genome-wide microRNA expression profiling in human epithelial ovarian cancer. PLoS One. 2014;9:e96472. [PubMed] [DOI] |
| 9. | Ruan J, Liu X, Xiong X, Zhang C, Li J, Zheng H, Huang C, Shi Q, Weng Y. miR107 promotes the erythroid differentiation of leukemia cells via the downregulation of Cacna2d1. Mol Med Rep. 2015;11:1334-1339. [PubMed] [DOI] |
| 10. | Kaymaz BT, Cetintaş VB, Aktan C, Kosova B. MicroRNA-520a-5p displays a therapeutic effect upon chronic myelogenous leukemia cells by targeting STAT3 and enhances the anticarcinogenic role of capsaicin. Tumour Biol. 2014;35:8733-8742. [PubMed] [DOI] |
| 11. | Schlageter M, Terracciano LM, D'Angelo S, Sorrentino P. Histopathology of hepatocellular carcinoma. World J Gastroenterol. 2014;20:15955-15964. [PubMed] [DOI] |
| 12. | Colli A, Fraquelli M, Casazza G, Massironi S, Colucci A, Conte D, Duca P. Accuracy of ultrasonography, spiral CT, magnetic resonance, and alpha-fetoprotein in diagnosing hepatocellular carcinoma: a systematic review. Am J Gastroenterol. 2006;101:513-523. [PubMed] [DOI] |
| 13. | Marrero JA. Screening tests for hepatocellular carcinoma. Clin Liver Dis. 2005;9:235-251, vi. [PubMed] [DOI] |
| 14. | Yang N, Ekanem NR, Sakyi CA, Ray SD. Hepatocellular carcinoma and microRNA: new perspectives on therapeutics and diagnostics. Adv Drug Deliv Rev. 2015;81:62-74. [PubMed] [DOI] |
| 15. | Tan Y, Ge G, Pan T, Wen D, Chen L, Yu X, Zhou X, Gan J. A serum microRNA panel as potential biomarkers for hepatocellular carcinoma related with hepatitis B virus. PLoS One. 2014;9:e107986. [PubMed] [DOI] |
| 16. | Zhang ZQ, Meng H, Wang N, Liang LN, Liu LN, Lu SM, Luan Y. Serum microRNA 143 and microRNA 215 as potential biomarkers for the diagnosis of chronic hepatitis and hepatocellular carcinoma. Diagn Pathol. 2014;9:135. [PubMed] [DOI] |
| 17. | Qi P, Cheng SQ, Wang H, Li N, Chen YF, Gao CF. Serum microRNAs as biomarkers for hepatocellular carcinoma in Chinese patients with chronic hepatitis B virus infection. PLoS One. 2011;6:e28486. [PubMed] [DOI] |
| 18. | Whiting P, Rutjes AW, Reitsma JB, Bossuyt PM, Kleijnen J. The development of QUADAS: a tool for the quality assessment of studies of diagnostic accuracy included in systematic reviews. BMC Med Res Methodol. 2003;3:25. [PubMed] [DOI] |
| 19. | Li LM, Hu ZB, Zhou ZX, Chen X, Liu FY, Zhang JF, Shen HB, Zhang CY, Zen K. Serum microRNA profiles serve as novel biomarkers for HBV infection and diagnosis of HBV-positive hepatocarcinoma. Cancer Res. 2010;70:9798-9807. [PubMed] [DOI] |
| 20. | Zhou J, Yu L, Gao X, Hu J, Wang J, Dai Z, Wang JF, Zhang Z, Lu S, Huang X. Plasma microRNA panel to diagnose hepatitis B virus-related hepatocellular carcinoma. J Clin Oncol. 2011;29:4781-4788. [PubMed] [DOI] |
| 21. | Li L, Guo Z, Wang J, Mao Y, Gao Q. Serum miR-18a: a potential marker for hepatitis B virus-related hepatocellular carcinoma screening. Dig Dis Sci. 2012;57:2910-2916. [PubMed] [DOI] |
| 22. | Tomimaru Y, Eguchi H, Nagano H, Wada H, Kobayashi S, Marubashi S, Tanemura M, Tomokuni A, Takemasa I, Umeshita K. Circulating microRNA-21 as a novel biomarker for hepatocellular carcinoma. J Hepatol. 2012;56:167-175. [PubMed] [DOI] |
| 23. | Shen J, Wang A, Wang Q, Gurvich I, Siegel AB, Remotti H, Santella RM. Exploration of genome-wide circulating microRNA in hepatocellular carcinoma: MiR-483-5p as a potential biomarker. Cancer Epidemiol Biomarkers Prev. 2013;22:2364-2373. [PubMed] [DOI] |
| 24. | Gui J, Tian Y, Wen X, Zhang W, Zhang P, Gao J, Run W, Tian L, Jia X, Gao Y. Serum microRNA characterization identifies miR-885-5p as a potential marker for detecting liver pathologies. Clin Sci (Lond). 2011;120:183-193. [PubMed] [DOI] |
| 25. | Liu AM, Yao TJ, Wang W, Wong KF, Lee NP, Fan ST, Poon RT, Gao C, Luk JM. Circulating miR-15b and miR-130b in serum as potential markers for detecting hepatocellular carcinoma: a retrospective cohort study. BMJ Open. 2012;2:e000825. [PubMed] [DOI] |
| 26. | Qu KZ, Zhang K, Li H, Afdhal NH, Albitar M. Circulating microRNAs as biomarkers for hepatocellular carcinoma. J Clin Gastroenterol. 2011;45:355-360. [PubMed] [DOI] |
| 27. | Jones CM, Athanasiou T. Summary receiver operating characteristic curve analysis techniques in the evaluation of diagnostic tests. Ann Thorac Surg. 2005;79:16-20. [PubMed] [DOI] |