修回日期: 2014-09-10
接受日期: 2014-12-18
在线出版日期: 2015-03-18
目的: 建立细胞因子和曲古菌素A(trichostatin A, TSA)联合诱导小鼠胚胎干细胞(embryonic stem cell, ESC)向肝细胞分化的3步法.
方法: ESC在含激活素A的不含白血病抑制因子的培液中培养3 d分化为定形内胚层细胞; 然后加入酸性成纤维细胞生长因子和TSA联合诱导5 d, 再加入肝细胞生长因子(hepatocyte growth factor, HGF)等诱导因子培养5 d, 向肝细胞方向分化, 最后以致瘤素M、地塞米松继续培养5 d形成成熟肝细胞. 自发分化组做阴性对照组不加上述因子, 不含白血病抑制因子(leukemia inhibitory factor, LIF)的培养液进行自发分化培养.
结果: 诱导分化18 d后, 用光镜、免疫荧光、RT-PCR检测显示诱导18 d后, 出现了大量类肝脏细胞表型的上皮细胞, RT-PCR检测显示这些细胞表达成体肝脏细胞特异标记如酪氨酸转氨酶、白蛋白(albumin, ALB)、天冬氨酸转氨酶、甲状腺激素结合蛋白等. 细胞免疫荧光也显示为甲胎蛋白、ALB、细胞角蛋白18阳性, 分化细胞具有成熟肝脏细胞所具有的糖原储存、吲哚菁绿摄取和释放功能. 其分化效率用ALB阳性率表示, 诱导分化率可达57.38%.
结论: 组蛋白去乙酰化酶抑制剂TSA联合细胞因子体外诱导ESC可以成功分化为肝细胞, 从而为体外获得大量肝细胞对肝病的临床细胞移植治疗及其研究提供理论和实践基础.
核心提示: 本实验采用更强组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitor)效应的曲古菌素A(trichostatin A, TSA)联合细胞因子诱导法将胚胎干细胞(embryonic stem cell, ESC)高效诱导分化为成熟有功能的肝细胞, 证实组蛋白去乙酰化酶抑制剂TSA联合细胞因子体外诱导ESC可以成功分化为肝细胞.
引文著录: 朱小波, 李正欣, 顾欣欣, 雷卓, 张洁, 李海涛, 周鸣鸣. 曲古菌素A联合细胞因子体外诱导小鼠胚胎干细胞分化为肝细胞. 世界华人消化杂志 2015; 23(8): 1278-1284
Revised: September 10, 2014
Accepted: December 18, 2014
Published online: March 18, 2015
AIM: To present a novel 3-step procedure to efficiently direct the differentiation of mouse embryonic stem cells (ESCs) into hepatocytes.
METHODS: Mouse ESCs were first induced to differentiate into definitive endoderm cells by three days of activin A treatment. Next, definitive endoderm cells were induced to efficiently differentiate to hepatocytes in the presence of acid fibroblast growth factor (aFGF) and trichostatin A (TSA) in the culture medium for 5 d.
RESULTS: After 10 d of further in vitro maturation, the morphological and phenotypic markers of hepatocytes were characterized using light microscopy, immunofluorescence and RT-PCR. Furthermore, these cells were tested for the functions associated with mature hepatocytes including glycogen storage, indocyanine green uptake and release, and the rate of hepatic differentiation was determined by counting the albumin-positive cells, which showed that the rate of hepatic differentiation was 57.38%.
CONCLUSION: The method presented in this study provides a new resource for hepatocyte transplantation.
- Citation: Zhu XB, Li ZX, Gu XX, Lei Z, Zhang J, Li HT, Zhou MM. Trichostatin A combined with cytokines induces differentiation of embryonic stem cells into hepatocytes. Shijie Huaren Xiaohua Zazhi 2015; 23(8): 1278-1284
- URL: https://www.wjgnet.com/1009-3079/full/v23/i8/1278.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i8.1278
具有自我更新、高度增殖和多向分化的能力的胚胎干细胞(embryonic stem cell, ESC)在体内外可以成功地分化为肝细胞, 为多种难治性肝病、代谢性肝病的细胞替代治疗提供了源源不断的种子细胞来源, 但是其诱导分化的低效率一直是难以解决的关键问题[1,2]. 目前, ESC分化为肝细胞的方法主要有自发分化、体外诱导分化和体内诱导分化[3]. 体外诱导ESC分化为肝细胞是研究的重点, 单层定向分化操作简便, 培养体系简单, 添加适当的细胞因子易获得高比率的分化细胞, 是ESC定向分化和研究早期胚胎发育的理想平台. 表观遗传修饰是细胞内调控基因沉默与激活的一个重要机制, 目前使用表观遗传修饰策略诱导干细胞分化已成为该领域一个新的研究方向. 组蛋白去乙酰化酶抑制剂可通过抑制组蛋白去乙酰化酶使组蛋白超乙酰化, 激活细胞内特异的沉默基因, 从而引起细胞分化. 曲古菌素A(trichostatin A, TSA)是一种组蛋白去乙酰化酶抑制剂, TSA在近期的研究中发现能诱导ESC分化[4], 并对原代培养肝脏细胞维持外源性代谢能力活性, 促进白蛋白(albumin, ALB)分泌和CYP1A1基因转录和功能有重要意义[5]. 这就提示我们应用TSA诱导ESC向肝细胞分化将会极大提高诱导效率, 以期建立一套高效肝细胞体外诱导分化方案, 为肝细胞治疗提供新的细胞来源.
小鼠ESC系(E14), 如皋市人民医院细胞研究室保存; Activin A, 酸性成纤维细胞生长因子(acidic fibroblast growth factor, aFGF)购自 Peprotech(Rocky Hill, NJ); 致瘤素M(oncostatin M, OSM)、肝细胞生长因子(hepatocyte growth factor, HGF)购自R&D System(Minneapolis, MN); 地塞米松(dexamethasone, Dex)、TSA购自Sigma公司; 白血病抑制因子(leukemia inhibitory factor, LIF)购自Chemicon公司.
1.2.1 诱导: 首先培养液中加入Activin A 100 ng/mL的去除LIF的上述培养液培养3 d得到限制性内胚层细胞. 然后在培养液中加人aFGF 30 ng/mL与TSA 20 ng/mL联合诱导5 d以向肝细胞方向分化, 再加入HGF 20 ng/mL等诱导因子继续诱导成熟培养5 d. 最后以OSM 10 ng/mL; Dex 0.1 μmol/L继续培养成熟肝细胞5 d. 每天换液1次. 自发分化组以无饲养层高糖DMEM培养基, 其中添加10%胎牛血清、0.1 mmol/L β-巯基乙醇、1 mmol/L谷氨酰胺、非必需氨基酸等, ESC复苏后于明胶预处理的6孔板中贴壁自发分化18 d.
1.2.2 对诱导分化形成的肝细胞进行形态观察: 用倒置相差显微镜观察倒置相差显微镜下观察分化各阶段的细胞形态.
1.2.3 RT-PCR分析: 使用Invitrogen公司PureLinkTM RNA Mini Kit试剂盒提取细胞总RNA, 用分光光度计进行浓度分析和纯度鉴定, 琼脂糖凝胶电泳检测RNA的质量. 取1 μg RNA进行反转录合成cDNA, 总反应体系25 μL. 反应结束后取5 μL进行PCR反应, 其余-20 ℃保存备用. 10 μL PCR反应体系组成为: Mix(PCR反应预混液, 上海生物工程有限公司)5 μL、模板cDNA 1 μL、上下游引物各0.25 μL(上海生物工程有限公司合成)和ddH2O 3.5 μL; 体系之外再加3-5 μL石蜡油. PCR反应条件: 95 ℃ 5 min; 95 ℃ 30 s, 退火30 s, 72 ℃ 30 s, 30 个循环; 72 ℃ 7 min后冷却至4 ℃保存. 各基因引物序列、片段大小及退火温度如表1, PCR产物用2%琼脂糖凝胶电泳检测.
| 基因 | 上游引物(5'-3') | 下游引物(5'-3') | 片段大小(bp) | 退火温度(℃) | 循环数 |
| AFP | TCGTATTCCAACAGGAGG | AGGCTTTTGCTTCACCAG | 173 | 55 | 25 |
| AAT | AATGGAAGAAGCCATTCGAT | AAGACTGTAGCTGCTGCAGC | 484 | 60 | 25 |
| ALB | AGAAGACACCCTGATTACTCT | TCGAGAAGCAGGTGTCCTTGT | 705 | 55 | 25 |
| TTR | GGCTGAGTCTCTCAATTC | CTCACCACAGATGAGAAG | 223 | 55 | 25 |
| TAT | ACCTTCAATCCCATCCGA | TCCCGACTGGATAGGTAG | 205 | 55 | 25 |
| Oct4 | GCTCAGCCTTAAGAACATGTGTAAGC | GCCTCATACTCTTCTCGTTGGGA | 327 | 60 | 25 |
1.2.4 细胞免疫荧光检测: 所用一抗分别为ALB(1:100), 甲胎蛋白(1:100)、细胞角蛋白CK18(1:100)、FITC标记的羊抗兔IgG(1:100)和TRITC标记的羊抗鼠IgG(1:100). 详细步骤参考各抗体说明书. 荧光显微镜下观察.
1.2.5 PAS糖原染色-过碘酸Schiff反应: 将诱导18 d的细胞, 40 g/L的甲醛固定30 min. 甲醇固定. 1%的过碘酸氧化5 min, PBS洗涤5次, 然后用希夫氏试剂染色15 min. 常规脱水、透明、中性树胶封片. 红紫色染色的积聚物看作糖原储存.
1.2.6 吲哚氰酸(indocyanine green, ICG)摄取和排泌实验: 细胞在含ICG(终浓度1 mg/mL)的培养液中, 37 ℃孵育15 min, 磷酸盐缓冲液洗3次, 倒置显微镜下观察细胞摄取ICG染色情况. 胞浆绿色为阳性. 然后换为正常培养液, 6 h后倒置显微镜下观察细胞排泌ICG情况.
1.2.7 分化效率的检测: 每个试验组随机选择6个孔, 每孔随机选择5个视野(不重叠), 每个视野统计ALB绿色荧光阳性细胞占整个视野DAPI对染细胞总数的比例, 3次重复所得ALB荧光阳性细胞比率的平均数即为该组的肝细胞诱导分化率.
统计学处理 全部数据资料采用STATA6.0软件包进行方差分析和t检验. 数据资料用mean±SD表示, P<0.05为差异具有统计学意义.
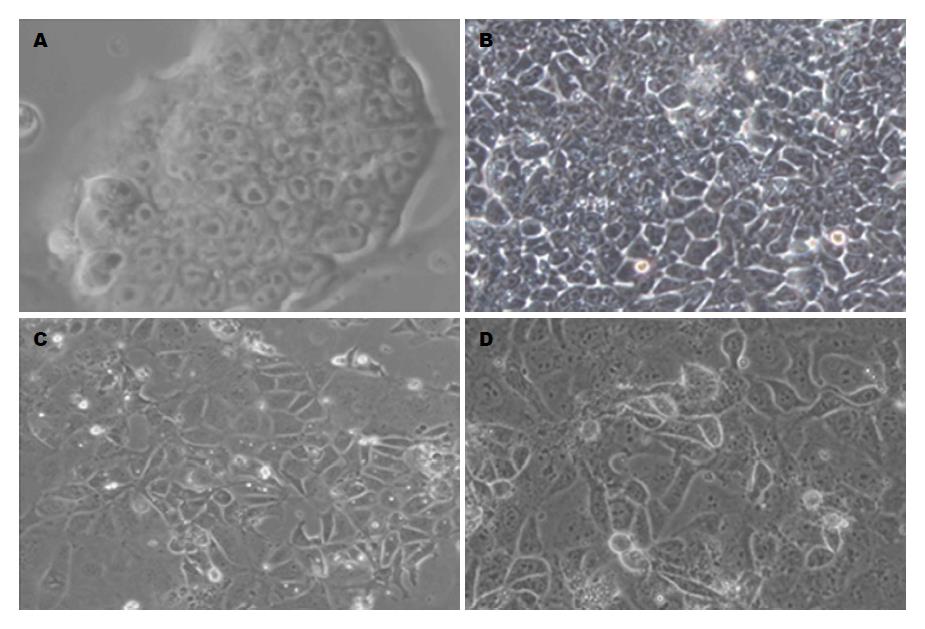
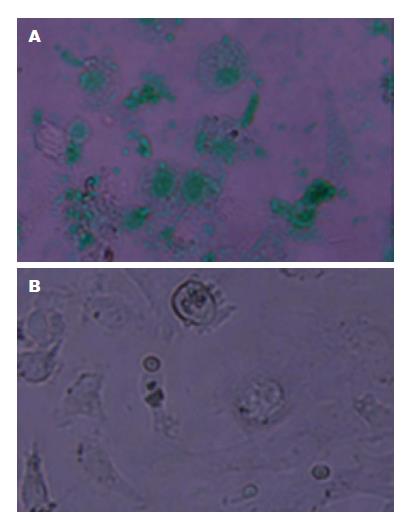
mESC具有与早期胚胎细胞相似的形态特征, 在未分化前呈克隆化生长, 细胞间无界限, 紧密地聚集在一起, 形似鸟巢. ESC在向肝脏细胞诱导过程中, 细胞大量增殖, 在诱导18 d后, 细胞形态单一, 多数为扁平不规则多边形, 部分呈类上皮样细胞; 细胞相互连结, 部分细胞呈双核, 核浆比例大, 部分出现双核或三核, 呈现肝细胞样细胞的形态(图1). 而自发分化对照组, 则以混杂细胞为主, 可见多量成纤维样细胞.
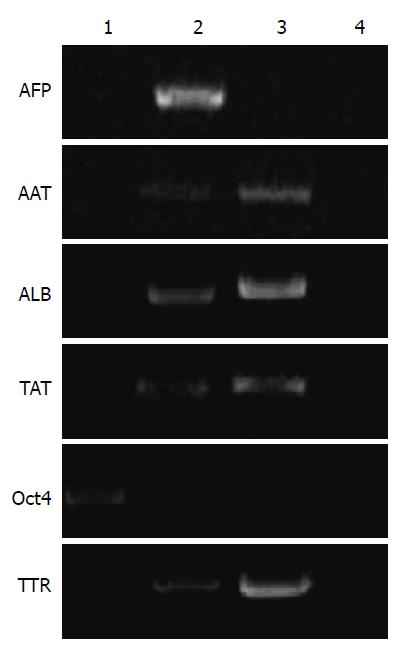
电泳结果显示, 诱导18 d后诱导分化组细胞能够表达成熟肝细胞标志基因ALB、TTR、TAT和AAT以及早期标志基因AFP, 不表达ESC标志基因OCT4, 提示分化组细胞已经具备肝细胞的基因表达特征, 包含不同成熟阶段的肝细胞(图2). 阳性对照组, 小鼠成熟肝脏里除AFP外其他标志物均有表达. 阴性对照组(-R)无条带.
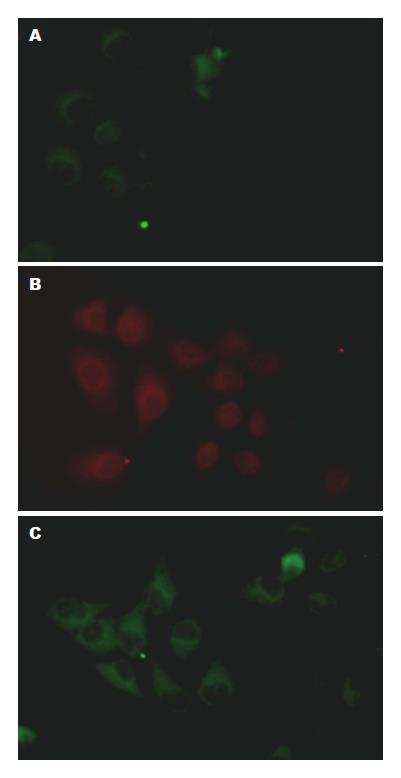
诱导分化第18 d, 行免疫荧光染色检测AFP、ALB、CK18的表达. 可见联合诱导分化组AFP、ALB、CK18均为阳性, 发红色或绿色荧光(图3).
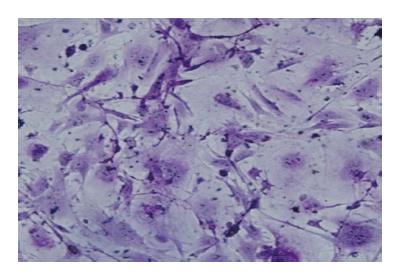
肝脏是进行糖原合成及糖异生的器官, PAS染色可使细胞内碳水化合物特异性着色为红紫色. 图4显示, 诱导18 d后, 可见大量多边形肝细胞样细胞呈红紫色颗粒沉淀, 显示细胞有糖原合成和贮存功能.
ICG的代谢与肝细胞基底细胞膜有机阴离子转运系统有关, 其受体是肝细胞特异性的, 所以ICG的摄取能力通常用作肝细胞特异性的功能标志. 细胞在含ICG(终浓度1 mg/mL)的培养液中, 37 ℃孵育15 min, 磷酸盐缓冲液洗3次, 倒置显微镜下观察细胞染色情况, 胞浆绿色为阳性, 说明诱导分化后的细胞可特异性的摄取ICG. 换回普通培养基常规培养6 h后, 着色细胞的颜色可完全退去, 将ICG排泌出细胞外(图5), 提示我们诱导后的肝细胞样细胞具有一定的肝细胞功能.
各组诱导肝脏细胞分化率由细胞免疫荧光ALB阳性率统计而得, 经各组随机挑取30张ALB免疫荧光照片, ALB阳性细胞数和DAPI核染色数经Image-Pro Plus软件记数, 统计. 自发分化对照组分化率10.34%, 而细胞因子与TSA联合诱导组达57.38%. 细胞因子与TSA联合诱导对ESC诱导肝脏细胞分化率提高效果明显(P<0.05).
目前诱导ESC为肝细胞应用最多的是细胞因子分步干预技术, 通过模拟肝脏细胞分化、增殖和成熟的微环境从而实现对ESC分化过程中特定亚群细胞的纯化和选择性扩增. 如诱导中采用的细胞因子和胞外介质有Activin A、aFGF、HGF、OSM、Dex等[6]. 在诱导分化的早期, 添加Activin A, 是由于他能诱导ESC向定形内胚层细胞分化, 可以提高向肝脏细胞分化效率[7]; 其后加入的aFGF[8], 是由于中胚层分化的心肌细胞能够分泌aFGF, 他是第一个定向诱导前肠内胚层形成肝胚细胞的细胞因子; 在诱导分化的中期加入HGF, HGF是广谱多功能细胞因子, 通过与其受体c-MET的结合, 促进肝脏细胞有丝分裂、细胞形态的形成, 支持诱导肝细胞增殖生长[9]; 在诱导分化的晚期加入OSM、Dex等肝脏细胞促成熟因子, OSM是由造血细胞分泌的, 能诱导胎肝细胞的成熟[10], Dex是一个合成的糖皮质激素, 在肝脏中能够诱导糖原异生酶如磷酸烯醇丙酮酸(phosphoenolpyruvate carboxykinase, PEPCK)、酪氨酸氨基转移酶(tyrosine amino transferase, TAT)以及其他相关肝脏生化酶的产生[11,12], 因此Dex常常作为诱导肝脏细胞成熟时期的必加诱导剂. 但与细胞因子等诱导剂相比, 化学合成的复合物具有半衰期长、作用稳定、效应明确等特点, 因此化合物诱导更适合于干细胞的长期分化诱导过程. 有研究表明, 丁酸钠(NaB)通过其组蛋白去乙酰化酶抑制剂(histone deacetylase inhibitors, HDACi)活性可以介导多种细胞的分化. 此后又发现丙戊酸钠等组蛋白去乙酰化酶抑制剂均可诱导ESC向肝细胞分化, 说明HDACi普遍具有诱导ESC向肝细胞分化作用[13]. 其可能机制为介导了分化过程中细胞周期阻滞、细胞分化和细胞凋亡3种效应, 从而最终得到了形态和功能相对均一的肝细胞.
ESC向肝细胞分化要经历从内胚层、胚肝到成熟肝脏等多个时期, 其中涉及复杂的基因调控过程. 表观遗传修饰(epigenetic modification)是细胞内调控基因沉默与激活的一个重要机制, 他通过引起染色质和核小体构型改变来调控基因转录, 而不涉及基因本身序列的改变. 干细胞的多能性与其胞内广泛的表观遗传特征密切相关, 而运用表观遗传修饰策略诱导干细胞分化已成为该领域一个新的研究方向.
组蛋白乙酰化和去乙酰化是一个重要表观遗传修饰方式. 通常组蛋白乙酰化激活基因转录, 去乙酰化则导致基因沉默, 他们分别受多种组蛋白乙酰化酶和去乙酰化酶控制. HDACi可通过抑制组蛋白去乙酰化酶使组蛋白超乙酰化, 激活细胞内特异的沉默基因, 从而引起细胞分化.
丁酸钠和TSA均是HDACi, 前者是人类结肠中细菌发酵碳水化合物产生的一短链脂肪酸, 属于短链脂肪酸类; 后者是抗真菌药物, 属于氧肟酸类. 其中小分子氧肟酸盐(异羟肟酸)类的TSA属于强效抑制剂, 因为其金属结合区的异羟肟酸能与Zn2+充分接触, 并与HDAC中的组胺酸和酪氨酸等形成氢键, 异羟肟酸是产生高效抑制活性的必需部分; 间隔区恰好与HDAC中狭窄的囊紧密接触, 产生大量范德华力, 表面识别区则很好地结合了边缘残基. 而短链脂肪酸类的NaB强效抑制剂金属结合区的异羟肟酸被一元羧酸取代, 抑制活性大为降低[14]. 因此NaB和TSA均可以诱导细胞分化, NaB在mmol/L浓度级别发挥作用, TSA在nmol/L的级别发挥同样的作用. TSA抑制酶活性是NaB的约106倍, TSA的HDACi效应更强并且不良反应更小[15]. 因此本实验采用更强HDACi效应的TSA联合细胞因子诱导法将ESC高效诱导分化为成熟有功能的肝细胞, 证实组蛋白去乙酰化酶抑制剂TSA联合细胞因子体外诱导ESC可以成功分化为肝细胞, 其诱导分化率可达57.38%. 建立起一种诱导ESC分化为肝细胞的诱导方案, 从而为体外获得大量肝细胞对肝病的临床细胞移植治疗及其研究提供理论和实践基础.
具有自我更新、高度增殖和多向分化的能力的胚胎干细胞(embryonic stem cell, ESC)细胞在体内外可以成功地分化为肝细胞, 为多种难治性肝病、代谢性肝病的细胞替代治疗提供了源源不断的种子细胞来源, 但是其诱导分化的低效率一直是难以解决的关键问题.
傅晓辉, 副教授, 副主任医师, 东方肝胆外科医院
如何高效率的获取肝细胞是细胞替代治疗终末期肝病的核心问题之一. 该研究使用曲古菌素A(trichostatin A, TSA)联合细胞因子在体外分步诱导ESC向肝细胞的定向分化即为了解决这个问题, 为肝细胞替代治的疗进一步研究奠定基础.
相关报道NaB和TSA均可以诱导细胞分化, NaB在mmol/L浓度级别发挥作用, TSA在nmol/L的级别发挥同样的作用. TSA抑制酶活性是NaB的约106倍, TSA的HDACi效应更强并且不良反应更小. 因此本实验采用更强HDACi效应的TSA联合细胞因子诱导法将ESC高效诱导分化为成熟有功能的肝细胞.
本实验采用更强HDACi效应的TSA联合细胞因子诱导法将ESC高效诱导分化为成熟有功能的肝细胞, 证实TSA联合细胞因子体外诱导ESC可以成功分化为肝细胞.
TSA联合细胞因子体外诱导ESC, 诱导分化率可达57.38%, 这种新的高效诱导ESC分化为肝细胞的方法为体外获得大量肝细胞对肝病的临床细胞移植治疗及其研究提供理论和实践基础.
组蛋白去乙酰化酶抑制剂(HDACi): 是一类化合物, 有干扰与组蛋白去乙酰化酶的功能. DDAci通过增加细胞内组蛋白的乙酰化程度, 提高p21等基因的表达水平等途径, 抑制肿瘤细胞的增殖, 诱导细胞分化和/或凋亡.
该研究设计合理, 数据翔实, 结论有说服力. 通过小鼠ESC体外分步定向诱导实验, 为研究高效率的获取肝细胞提供了新的思路.
编辑: 郭鹏 电编: 闫晋利
| 1. | Subramanian K, Owens DJ, Raju R, Firpo M, O'Brien TD, Verfaillie CM, Hu WS. Spheroid culture for enhanced differentiation of human embryonic stem cells to hepatocyte-like cells. Stem Cells Dev. 2014;23:124-131. [PubMed] [DOI] |
| 3. | Deng XG, Qiu RL, Wu YH, Li ZX, Xie P, Zhang J, Zhou JJ, Zeng LX, Tang J, Maharjan A. Overexpression of miR-122 promotes the hepatic differentiation and maturation of mouse ESCs through a miR-122/FoxA1/HNF4a-positive feedback loop. Liver Int. 2014;34:281-295. [PubMed] |
| 4. | Hosseinkhani M, Hasegawa K, Ono K, Kawamura T, Takaya T, Morimoto T, Wada H, Shimatsu A, Prat SG, Suemori H. Trichostatin A induces myocardial differentiation of monkey ES cells. Biochem Biophys Res Commun. 2007;356:386-391. [PubMed] [DOI] |
| 5. | Ellis JK, Chan PH, Doktorova T, Athersuch TJ, Cavill R, Vanhaecke T, Rogiers V, Vinken M, Nicholson JK, M D Ebbels T. Effect of the histone deacetylase inhibitor trichostatin a on the metabolome of cultured primary hepatocytes. J Proteome Res. 2010;9:413-419. [PubMed] [DOI] |
| 6. | Bukong TN, Lo T, Szabo G, Dolganiuc A. Novel developmental biology-based protocol of embryonic stem cell differentiation to morphologically sound and functional yet immature hepatocytes. Liver Int. 2012;32:732-741. [PubMed] |
| 7. | Farzaneh Z, Pakzad M, Vosough M, Pournasr B, Baharvand H. Differentiation of human embryonic stem cells to hepatocyte-like cells on a new developed xeno-free extracellular matrix. Histochem Cell Biol. 2014;142:217-226. [PubMed] [DOI] |
| 8. | Liu T, Zhang S, Xiang D, Wang Y. Induction of hepatocyte-like cells from mouse embryonic stem cells by lentivirus-mediated constitutive expression of Foxa2/Hnf4a. J Cell Biochem. 2013;114:2531-2541. [PubMed] [DOI] |
| 9. | Fauzi I, Panoskaltsis N, Mantalaris A. Enhanced hematopoietic differentiation toward erythrocytes from murine embryonic stem cells with HepG2-conditioned medium. Stem Cells Dev. 2012;21:3152-3161. [PubMed] [DOI] |
| 10. | Shiraki N, Yamazoe T, Qin Z, Ohgomori K, Mochitate K, Kume K, Kume S. Efficient differentiation of embryonic stem cells into hepatic cells in vitro using a feeder-free basement membrane substratum. PLoS One. 2011;6:e24228. [PubMed] [DOI] |
| 11. | Li L, Davidovich AE, Schloss JM, Chippada U, Schloss RR, Langrana NA, Yarmush ML. Neural lineage differentiation of embryonic stem cells within alginate microbeads. Biomaterials. 2011;32:4489-4497. [PubMed] [DOI] |
| 12. | Amimoto N, Mizumoto H, Nakazawa K, Ijima H, Funatsu K, Kajiwara T. Hepatic differentiation of mouse embryonic stem cells and induced pluripotent stem cells during organoid formation in hollow fibers. Tissue Eng Part A. 2011;17:2071-2078. [PubMed] [DOI] |
| 13. | Zhou M, Li P, Tan L, Qu S, Ying QL, Song H. Differentiation of mouse embryonic stem cells into hepatocytes induced by a combination of cytokines and sodium butyrate. J Cell Biochem. 2010;109:606-614. [PubMed] [DOI] |
| 14. | Chen JS, Faller DV, Spanjaard RA. Short-chain fatty acid inhibitors of histone deacetylases: promising anticancer therapeutics? Curr Cancer Drug Targets. 2003;3:219-236. [PubMed] |
| 15. | Sowa Y, Orita T, Minamikawa S, Nakano K, Mizuno T, Nomura H, Sakai T. Histone deacetylase inhibitor activates the WAF1/Cip1 gene promoter through the Sp1 sites. Biochem Biophys Res Commun. 1997;241:142-150. [PubMed] [DOI] |