修回日期: 2015-01-26
接受日期: 2015-01-29
在线出版日期: 2015-03-18
目的: 检测结肠癌患者组织中NIK-IKKβ结合蛋白(NIK, IKKβ-binding protein, NIBP)、磷酸化p100(p-p100)、p52和上皮间质转化(epithelial-mesenchymal transition, EMT)相关通路蛋白: CD44、波形蛋白(Vimentin)和E-钙黏蛋白(E-cadherin)的表达, 探讨NIBP蛋白的表达与非经典核因子-κB(nuclear factor-κB, NF-κB)通路的关系及其在结肠癌发生、发展、浸润和转移中的作用.
方法: 采用免疫组织化学SP法分别检测50例正常结肠黏膜、20例结肠腺瘤以及114例结肠癌患者组织中NIBP、p-p100、p52、CD44、Vimentin和E-cadherin的表达.
结果: 免疫组织化学结果显示有转移结肠癌组织中NIBP、p-p100、p52、CD44和Vimentin的阳性表达均高于无转移结肠癌以及结肠腺瘤和正常结肠黏膜组织, 而E-cadherin则正好相反(P<0.05); 且NIBP、p-p100、p52、CD44、Vimentin和E-cadherin在结肠癌组织中的表达与浸润深度、TNM临床分期、淋巴结转移和远处转移有关(P<0.05); 结肠癌组织中NIBP与p-p100、p52表达之间, CD44与p52、E-cadherin及Vimentin表达之间均存在明显相关性(P<0.05).
结论: NIBP可能通过激活非经典NF-κB信号通路诱导EMT的发生, 从而促进结肠癌的发生、发展、浸润和转移.
核心提示: 本研究通过检测正常结肠黏膜、结肠腺瘤、无转移结肠癌和有转移结肠癌组织中NIK-IKKβ结合蛋白(NIK, IKKβ-binding protein, NIBP)和核因子-κB(nuclear factor-κB, NF-κB)非经典途径相关因子以及上皮间质转化(epithelial-mesenchymal transition, EMT)相关通路蛋白的表达, 了解NIBP在不同结肠病变中的表达及其与NF-κB非经典途径以及EMT的关系, 探讨NIBP调控NF-κB非经典途径影响EMT进程在结肠癌发生、发展、浸润和转移中的意义.
引文著录: 谭林, 刘诗权, 覃蒙斌, 李素艳, 刘宝玉, 诸葛春凤, 徐春燕, 梁梦紫, 彭鹏, 黄杰安. NIBP在结肠癌NF-κB非经典激活通路中的作用及其临床意义. 世界华人消化杂志 2015; 23(8): 1238-1246
Revised: January 26, 2015
Accepted: January 29, 2015
Published online: March 18, 2015
AIM: To investigate the expression of NIK, IKKβ binding protein (NIBP), phosphorylated p100 (p-p100), p52, CD44, Vimentin and E-cadherin in colon carcinoma and to explore their clinical significance.
METHODS: Immunohistochemistry was used to detect the expression of NIBP, p-p100, p52, CD44, E-cadherin and Vimentin in 114 paraffin-embedded colon carcinoma tissues, 20 colon adenoma tissues and 50 normal colon mucosa tissues.
RESULTS: The positive expression of NIBP, p-p100, p52, CD44 and Vimentin in colon cancer tissues with metastasis was much higher than that in colon cancer tissues without metastasis, colon adenoma tissues and normal colon mucosa tissues, while the expression of E-cadherin showed a reverse trend (P < 0.05). The expression of NIBP, p-p100, p52, CD44, Vimentin and E-cadherin in colon cancer tissues was related with depth of invasion, TNM stage, lymph node metastasis and distant metastasis (P < 0.05). There were significant correlations between the expression of p-p100 and p52 or NIBP, and between the expression of CD44 and p52, E-cadherin, or Vimentin.
CONCLUSION: NIBP may regulate the epithelial-mesenchymal transition process by activating the noncanonical nuclear factor-κB (NF-κB) signal pathway and thus play an important role in the development, invasion and metastasis of colon cancer.
- Citation: Tan L, Liu SQ, Qin MB, Li SY, Liu BY, Zhu-Ge CF, Xu CY, Liang MZ, Peng P, Huang JA. Relationship between expression of NIBP and noncanonical NF-κB signaling: Clinical significance in colon carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(8): 1238-1246
- URL: https://www.wjgnet.com/1009-3079/full/v23/i8/1238.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i8.1238
结肠癌是消化系最常见恶性肿瘤之一, 在西方国家中高发, 在我国的发病率亦逐年上升. 浸润转移是影响结肠癌预后的关键因素, 是导致结肠癌患者死亡的主要原因[1]. 然而, 目前有关结肠癌浸润转移的研究众多, 但仍突破有限. 核因子-κB(nuclear factor-κB, NF-κB)诱导激酶-IκB激酶NIK-IKKβ结合蛋白(NIK, IKKβ-binding protein, NIBP)是一种能将NF-κB非经典途径中的关键酶-NIK与经典途径中的关键激活子-IKKβ连接成为三聚体的支架蛋白, 其不仅能通过磷酸化IKKβ从而激活NF-κB经典途径, 还能通过与NIK的结合影响NF-κB非经典途径[2]. 上皮间质转化(epithelial-mesenchymal transition, EMT)是指上皮细胞失去极性以及基膜连接等上皮表型, 转化为具有间质表型的生物学过程, 使细胞获得较高的迁移、浸润、抗凋亡和降解细胞外基质的能力, 与肿瘤的转移密切相关[3,4]. NIBP与NF-κB非经典途径的关系及其与肿瘤的相关研究报道尚不多见. 本研究通过检测正常结肠黏膜、结肠腺瘤、无转移结肠癌和有转移结肠癌组织中NIBP和NF-κB非经典途径相关因子以及EMT相关通路蛋白的表达, 了解NIBP在不同结肠病变中的表达及其与NF-κB非经典途径以及EMT的关系, 探讨NIBP调控NF-κB非经典途径影响EMT进程在结肠癌发生、发展、浸润和转移中的意义.
收集广西医科大学第一附属医院结直肠外科2013-02/2014-02外科手术切除及消化内科肠镜活检的部分标本, 结肠癌标本114例、结肠腺瘤20例、正常结肠黏膜50例(均取自距癌边缘10 cm至切缘的组织). 患者术前均未接受放、化疗, 所有标本均经病理证实. 114例结肠癌患者中男71例, 女43例, 年龄25-84岁(56.3岁±8.6岁); 病理组织学类型管状腺癌93例, 黏液腺癌21例; 形态学类型肿块型34例, 溃疡型80例; 无转移63例, 有转移51例(有淋巴结和/或远处转移); 分化Ⅰ级12例, Ⅱ级83例, Ⅲ级19例; 侵及浅层(黏膜或浅肌层)21例, 侵及深层(深肌层以下)93例; TNM分期Ⅰ期19例, Ⅱ期44例, Ⅲ期30例, Ⅳ期21例; 无淋巴结转移68例, 有淋巴结转移46例; 无远处转移93例, 伴远处转移21例. 术中切取的结肠组织经4%多聚甲醛固定后, 脱水、透明、浸蜡包埋, 制成4 μm厚连续切片, 分别进行HE染色和免疫组织化学染色.
兔抗人NIBP多克隆抗体购自武汉Proteintech公司; 兔抗人磷酸化p100(p-p100)多克隆抗体购自美国Sigma公司; p52、Zeb1、波形蛋白(Vimentin)和E-钙黏蛋白(E-cadherin)多克隆抗体均购自北京博奥森生物技术有限公司; 即用型SP免疫组织化学试剂盒及DAB酶底物显色剂购自北京中杉金桥生物技术有限公司.
免疫组织化学染色: 采用免疫组织化学SP染色法. 常规脱蜡、水化, 以0.01 mol/L柠檬酸高压修复5 min, 3%H2O2室温孵育5-10 min, 正常山羊血清封闭10 min后, 滴加一抗(NIBP浓度为1:100, 其余浓度均为1:200), 孵育过夜, 余步骤严格遵照即用型SP免疫组织化学试剂盒说明书进行. DAB显色, 苏木素复染, 中性树胶封片. 阳性对照由试剂公司提供, 用PBS代替一抗作为阴性对照. 以胞膜/胞质/胞核中出现明显的黄色或黄褐色颗粒视为免疫组织化学染色阳性, 综合染色强度及阳性细胞数量进行半定量分析. 根据免疫阳性细胞染色程度(A): 无染色为0分; 细胞膜或质内见淡黄色颗粒, 明显高于背景为1分, 较多棕黄色颗粒为2分; 大量棕黄色颗粒为3分. 每片随机观察5个视野, 计数500个细胞中染色阳性细胞数(B): 阳性细胞数<5%为0分, 5%-25%为1分, 26%-50%为2分, >50%为3分. A与B相加为其最后得分, 0分判为"-", 1-2分判为"+", 3-4分判为"++", 5-6分判为"+++", 以"++"和"+++"定义为阳性表达, "-"和"+"定义为阴性表达[5].
统计学处理 采用SPSS16.0统计学软件进行分析. 计数资料采用χ2检验, 等级资料用Spearman等级相关分析, 以P<0.05为差异有统计学意义.
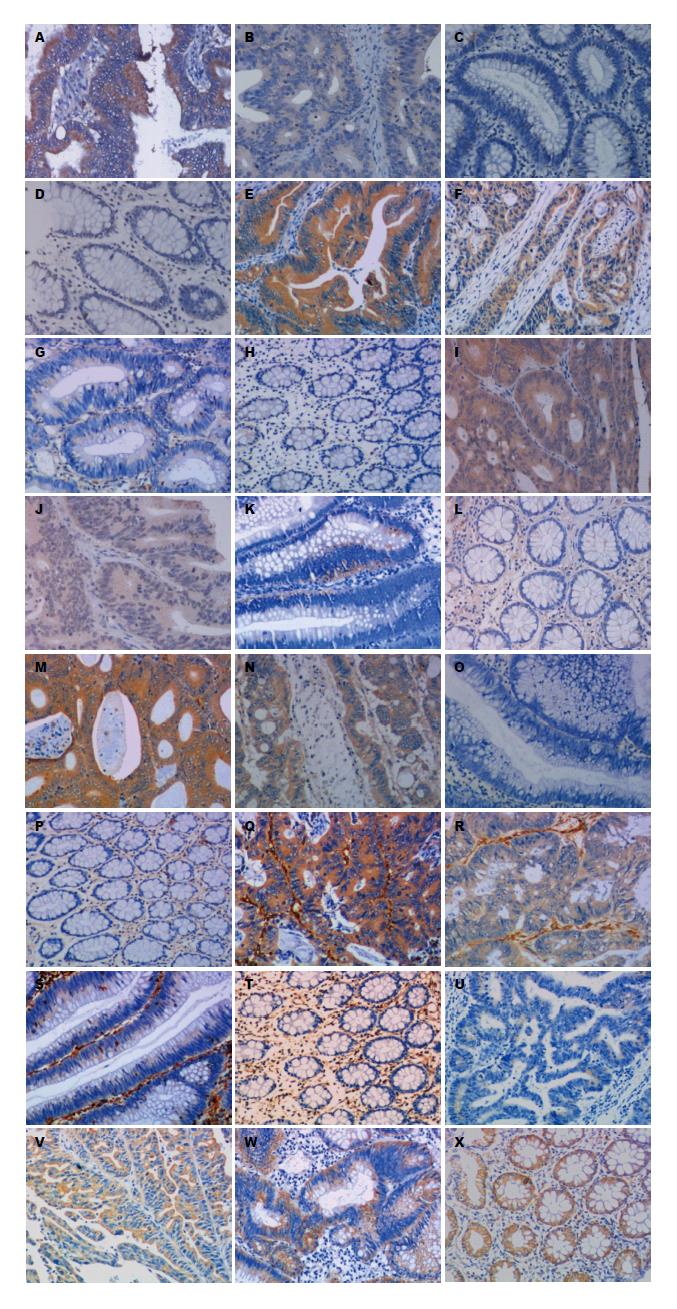
免疫组织化学法检测NIBP、p-p100、p52、CD44、Vimentin和E-cadherin分别在正常结肠黏膜、结肠腺瘤、无转移结肠癌和有转移结肠癌组织中的表达(图1): NIBP、p-p100、CD44、Vimentin和E-cadherin主要表达于胞质和胞膜, p52主要表达于胞质和胞核. NIBP、p-p100、p52、CD44、Vimentin和E-cadherin分别在正常结肠黏膜、结肠腺瘤、无转移结肠癌和有转移结肠癌组织中的阳性表达比较(表1). NIBP、p-p100、p52、CD44、Vimentin在结肠癌组织中的阳性表达明显高于结肠腺瘤及正常肠黏膜, 且在有转移结肠癌组织中的阳性表达明显高于无转移结肠癌组织; E-cadherin在结肠癌组织中阳性表达明显低于结肠腺瘤及正常肠黏膜, 且在有转移结肠癌组织中的阳性表达明显低于无转移结肠癌组织, 差异有统计学意义(P<0.05); 结肠腺瘤和正常结肠黏膜组织中NIBP、p-p100、p52、CD44、Vimentin和E-cadherin的阳性表达差异无统计学意义(P>0.05).
| 结肠组织 | n | NIBP | p-p100 | p52 | CD44 | Vimentin | E-cadherin | ||||||
| - | + | - | + | - | + | - | + | - | + | - | + | ||
| 正常结肠黏膜 | 50 | 40 | 10 | 36 | 14 | 35 | 15 | 37 | 13 | 42 | 8 | 9 | 41 |
| 结肠腺瘤 | 20 | 16 | 4 | 13 | 7 | 13 | 7 | 15 | 5 | 16 | 4 | 4 | 16 |
| 无转移结肠癌 | 63 | 33 | 30 | 32 | 31 | 31 | 32 | 35 | 28 | 40 | 23 | 15 | 48 |
| 有转移结肠癌 | 51 | 37 | 14 | 15 | 36 | 13 | 38 | 17 | 34 | 19 | 32 | 27 | 24 |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 | |||||||
NIBP、p-p100、p52、CD44、Vimentin和E-cadherin的阳性表达与结肠癌患者临床病理特征的关系(表2): 结肠癌组织中NIBP、p-p100、p52、CD44、Vimentin和E-cadherin的阳性表达与浸润深度、TNM临床分期、淋巴结转移和远处转移有关, 差异有统计学意义(P<0.05), 表明在结肠肿瘤浸润深、分化程度低、Dukes'分期晚、有淋巴转移和远处转移者NIBP、p-p100、p52、CD44和Vimentin的阳性表达明显增高, 而E-cadherin的阳性表达则明显降低. 结肠癌组织中NIBP与p-p100、p52的表达均存在明显正相关性(表3), 同时CD44与p52、Vimentin的表达均存在明显正相关性, 而与E-cadherin的表达存在明显的负相关(表4).
| 临床病理特征 | n | NIBP | P值 | p-p100 | P值 | p52 | P值 | CD44 | P值 | Vimentin | P值 | E-cadherin | P值 | ||||||
| - | + | - | + | - | + | - | + | - | + | - | + | ||||||||
| 浸润深度 | 0.009 | 0.033 | 0.015 | 0.032 | 0.013 | 0.018 | |||||||||||||
| 黏膜或浅肌层 | 21 | 14 | 7 | 13 | 8 | 13 | 8 | 14 | 7 | 16 | 5 | 3 | 18 | ||||||
| 深肌层以下 | 93 | 33 | 60 | 34 | 59 | 31 | 62 | 38 | 55 | 43 | 50 | 39 | 54 | ||||||
| TNM分期 | 0.041 | 0.015 | 0.022 | 0.033 | 0.003 | 0.009 | |||||||||||||
| Ⅰ期 | 19 | 10 | 9 | 12 | 7 | 9 | 10 | 13 | 6 | 14 | 5 | 3 | 16 | ||||||
| Ⅱ期 | 44 | 23 | 21 | 20 | 24 | 21 | 23 | 22 | 22 | 26 | 18 | 12 | 32 | ||||||
| Ⅲ期 | 30 | 10 | 20 | 12 | 18 | 12 | 18 | 12 | 18 | 15 | 15 | 17 | 13 | ||||||
| Ⅳ期 | 21 | 4 | 17 | 3 | 18 | 2 | 19 | 5 | 16 | 4 | 17 | 10 | 11 | ||||||
| 淋巴结转移 | 0.001 | 0.007 | 0.008 | 0.022 | 0.027 | 0.000 | |||||||||||||
| 无 | 68 | 34 | 34 | 35 | 33 | 33 | 35 | 37 | 31 | 41 | 27 | 16 | 52 | ||||||
| 有 | 46 | 13 | 33 | 12 | 34 | 11 | 35 | 15 | 31 | 18 | 28 | 26 | 20 | ||||||
| 远处转移 | 0.022 | 0.005 | 0.002 | 0.026 | 0.001 | 0.033 | |||||||||||||
| 无 | 93 | 43 | 50 | 44 | 49 | 42 | 51 | 47 | 46 | 55 | 38 | 30 | 63 | ||||||
| 有 | 21 | 4 | 17 | 3 | 18 | 2 | 19 | 5 | 16 | 4 | 17 | 12 | 9 | ||||||
| p-p100 | 相关性 | P值 | p52 | 相关性 | P值 | |||||
| --+ | ++ | +++ | --+ | ++ | +++ | |||||
| NIBP | 0.457 | 0.000 | 0.482 | 0.000 | ||||||
| --+ | 31 | 13 | 3 | 30 | 13 | 4 | ||||
| ++ | 12 | 24 | 11 | 13 | 22 | 12 | ||||
| +++ | 3 | 8 | 9 | 1 | 9 | 10 | ||||
| p52 | 相关性 | P值 | Vimentin | 相关性 | P值 | E-cadherin | 相关性 | P值 | |||||||
| --+ | ++ | +++ | --+ | ++ | +++ | --+ | ++ | +++ | |||||||
| CD44 | 0.526 | 0.000 | 0.670 | 0.000 | -0.503 | 0.000 | |||||||||
| --+ | 33 | 15 | 4 | 43 | 9 | 0 | 10 | 15 | 27 | ||||||
| ++ | 10 | 22 | 11 | 14 | 24 | 5 | 16 | 18 | 9 | ||||||
| +++ | 1 | 7 | 11 | 2 | 5 | 12 | 16 | 3 | 0 | ||||||
NIBP是一种能将NF-κB非经典途径中的关键酶-NIK与经典途径中的关键激活子-IKKβ连接成为三聚体的支架蛋白, 在2005年首先由Hu教授等[2]在神经细胞中检出, 其分子量为139.34 kDa, 共有1246个氨基酸组成, 与运输蛋白粒子(transport protein particle, TRAAP)共有一段保守序列, 且能与TRAAP复合物的Bet3亚基作用, 因此NIBP可能通过调节NF-κB信号通路在细胞内蛋白质转运过程中发挥作用[6]. NF-κB是核转录因子, 其家族包括5个成员, 即RelA(p65)、RelB、c-Rel、p105-p50(NF-κB1)和p100-p52(NF-κB2), 参与多种生物学过程, 免疫反应、炎症、癌症和细胞死亡[7,8]. NF-κB家族有两个信号激活途径: 分别为依赖IKKβ磷酸化从而促进前体蛋白p105加工成为p65/p50二聚体以及促进p65亚基的磷酸化转运入核发挥相应生物学作用的经典途径; 以及由IKKα介导的促进前体蛋白p100磷酸化以及对其加工处理生成有活性的p52, 形成的p52/RelB复合物转运入核发挥相应作用的非经典途径[9-11]. NF-κB经典途径的激活可通过促进炎症扩散、对抗细胞凋亡、促进细胞增殖、促进肿瘤细胞的浸润和转移, 且与结肠癌的发生、发展、浸润转移密切相关[12-14]. NF-κB非经典途径的激活不仅有促进淋巴器官的成熟和T细胞的分化、调节骨质代谢以及参与淋巴系统肿瘤形成等作用[15], 并且与卵巢癌[16]和乳腺癌[17]等实体恶性肿瘤密切相关. 最近研究[2]发现, NIBP的表达增加可促进IKKβ及其下游的p65磷酸化, 在NF-κB经典途径中发挥激活剂的作用, 而抑制NIBP的表达可减少由NIK介导的NF-κB非经典信号通路活化, 提示NIBP不仅能通过磷酸化IKKβ从而激活NF-κB经典途径, 还能通过与NIK的结合影响NF-κB非经典途径. 最近研究[18]还发现, 在人结肠癌组织中NIBP明显升高, 可能与NF-κB活化有关, 并参与腺瘤向腺癌的演变过程.
本研究结果显示, 有转移结肠癌组织中NIBP以及NF-κB非经典途径的相关因子p-p100和p52的阳性表达明显高于无转移结肠癌以及结肠腺瘤和正常结肠黏膜组织. 此外, NIBP、p-p100和p52在结肠癌组织中的阳性表达与肿瘤浸润深度、TNM临床分期和淋巴结转移以及远处转移有关, 表明NIBP、p-p100和p52的阳性表达在结肠肿瘤浸润深、分化程度低、Dukes'分期晚、有淋巴转移和远处转移者中明显增高, 并且NIBP与p-p100和p52的表达显著正相关. 表明NIBP在结肠癌中高表达, 且可能通过促进前体蛋白p100的磷酸化以及对其加工处理生成有活性的p52而激活NF-κB非经典途径, 进而参与腺瘤向腺癌的演变及结肠癌的浸润转移等过程.
CD44是由位于人类11号染色体短臂(11p13)的基因所编码产生分布极为广泛的细胞表面跨膜糖蛋白, 主要参与异质性黏附, 即肿瘤细胞与宿主细胞和宿主基质的黏附, 在介导恶性肿瘤细胞浸润转移中起重要作用[19,20]. 研究[21]发现, CD44在结直肠癌组织中存在过表达并且与结直肠癌的转移密切相关. 免疫学研究[22]发现, 激活CD44信号通路后细胞会出现形态的变化, 如出现伪足、细胞运动能力增强等, 这一形态学变化类似于肿瘤细胞的EMT. 在包括结直肠癌在内的多种肿瘤中CD44的亚型之间转换可诱导EMT[23]. 近年来, EMT在包括结肠癌在内的多种上皮源性肿瘤的浸润和早期转移中起决定性作用[24-26], 日益成为肿瘤研究关注的热点. EMT的显著特征为细胞失去上皮细胞形态学表现, 如细胞极性及紧密连接消失, 并向间质细胞形态学转化, 如细胞失去相互连接及形成成纤维细胞样外观等[4]; 与此同时, 典型的上皮细胞标志物, 如E-cadherin表达下调、β-catenin从胞膜到胞核易位表达, 而间质表型标志物, 如波形蛋Vimentin、纤连蛋白Fibronectin等表达上调[27,28]. EMT使细胞获得较高的迁移、浸润、抗凋亡和降解细胞外基质的能力, 与肿瘤的转移密切相关. 最近研究[29]发现, 激活的NF-κB非经典途径可通过上调CD44的表达而诱导EMT, 从而促进卵巢癌细胞的浸润及转移. 本研究结果显示, 有转移结肠癌组织中CD44和Vimentin的阳性表达明显高于无转移结肠癌以及结肠腺瘤和正常结肠黏膜组织, 而E-cadherin的表达则正好相反. 进一步分析发现, 肿瘤浸润深、TNM临床分期晚、有淋巴转移和远处转移者CD44和Vimentin的阳性表达明显增高, E-cadherin的阳性表达则明显降低, 此外CD44与Vimentin及p52的表达显著正相关, 而与E-cadherin的表达显著负相关. 说明在结肠癌中已激活的NF-κB非经典途径可能通过上调CD44的表达而促进Vimentin和抑制E-cadherin的表达, 进而达到影响EMT进程促进结肠癌的发生、发展、浸润和转移的作用.
总之, NIBP在结肠癌组织中高表达可能参与了结肠癌的发生、发展、浸润和转移. NIBP可能通过激活由IKKα介导NF-κB非经典途径, 促进前体蛋白p100的磷酸化以及对其的加工处理生成有活性的p52而上调CD44的表达, 进而抑制E-cadherin的表达和促进Vimentin的表达影响EMT进程, 从而在结肠癌的发生、发展、浸润和转移过程中起重要作用. 抑制NIBP的表达有望成为结肠癌治疗的新思路.
结肠癌是消化系最常见恶性肿瘤之一, 在我国的发病率亦逐年上升. 浸润转移是影响结肠癌预后的关键因素, 是导致结肠癌患者死亡的主要原因. 探讨结肠癌浸润转移机制, 寻找调控结肠癌浸润转移的关键因子是改善结肠癌患者预后的关键, 也可为药物或生物治疗提供靶点.
刘宝林, 教授, 中国医科大学附属盛京医院
最近研究发现, 在人结肠癌组织中NIK-IKKβ结合蛋白(NIK, IKKβ-binding protein, NIBP)明显升高, 可能与核因子-κB(nuclear factor-κB, NF-κB)活化有关, 并参与腺瘤向腺癌的演变过程. 上皮间质转化(epithelial-mesenchymal transition, EMT)在包括结肠癌在内的多种上皮源性肿瘤的浸润和早期转移中起决定性作用, 日益成为肿瘤研究关注的热点.
NIBP是一种能将NF-κB非经典途径中的关键酶-NIK与经典途径中的关键激活子-IKKβ连接成为三聚体的支架蛋白, 其不仅能通过磷酸化IKKβ从而激活NF-κB经典途径, 还能通过与NIK的结合影响NF-κB非经典途径.
本研究通过免疫组织化学检测NIBP蛋白在不同结肠病变中的表达, 同时了解其与NF-κB非经典途径以及EMT的关系, 探讨NIBP在结肠癌发生、发展、浸润及转移中的意义, 相关研究报道尚不多见.
NIBP在结肠癌组织中高表达可能参与了结肠癌的发生、发展、浸润和转移. 抑制NIBP的表达有望成为结肠癌治疗的新思路.
上皮间质转化(EMT): 指上皮细胞失去极性以及基膜连接等上皮表型, 转化为具有间质表型的生物学过程, 使细胞获得较高的迁移、浸润、抗凋亡和降解细胞外基质的能力, 与肿瘤的转移密切相关.
本文课题设计合理, 方法科学, 数据分析可靠, 结论可信, 有一定科学研究意义.
编辑: 韦元涛 电编: 闫晋利
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Hu WH, Pendergast JS, Mo XM, Brambilla R, Bracchi-Ricard V, Li F, Walters WM, Blits B, He L, Schaal SM. NIBP, a novel NIK and IKK(beta)-binding protein that enhances NF-(kappa)B activation. J Biol Chem. 2005;280:29233-29241. [PubMed] [DOI] |
| 3. | Tam WL, Weinberg RA. The epigenetics of epithelial-mesenchymal plasticity in cancer. Nat Med. 2013;19:1438-1449. [PubMed] [DOI] |
| 4. | De Craene B, Berx G. Regulatory networks defining EMT during cancer initiation and progression. Nat Rev Cancer. 2013;13:97-110. [PubMed] [DOI] |
| 5. | Liu SQ, Su YJ, Qin MB, Mao YB, Huang JA, Tang GD. Sphingosine kinase 1 promotes tumor progression and confers malignancy phenotypes of colon cancer by regulating the focal adhesion kinase pathway and adhesion molecules. Int J Oncol. 2013;42:617-626. [PubMed] [DOI] |
| 6. | Mir A, Kaufman L, Noor A, Motazacker MM, Jamil T, Azam M, Kahrizi K, Rafiq MA, Weksberg R, Nasr T. Identification of mutations in TRAPPC9, which encodes the NIK- and IKK-beta-binding protein, in nonsyndromic autosomal-recessive mental retardation. Am J Hum Genet. 2009;85:909-915. [PubMed] [DOI] |
| 7. | Hoesel B, Schmid JA. The complexity of NF-κB signaling in inflammation and cancer. Mol Cancer. 2013;12:86. [PubMed] [DOI] |
| 8. | Maier HJ, Schmidt-Strassburger U, Huber MA, Wiedemann EM, Beug H, Wirth T. NF-kappaB promotes epithelial-mesenchymal transition, migration and invasion of pancreatic carcinoma cells. Cancer Lett. 2010;295:214-228. [PubMed] [DOI] |
| 9. | Gray CM, Remouchamps C, McCorkell KA, Solt LA, Dejardin E, Orange JS, May MJ. Noncanonical NF-κB signaling is limited by classical NF-κB activity. Sci Signal. 2014;7:ra13. [PubMed] [DOI] |
| 10. | Thu YM, Richmond A. NF-κB inducing kinase: a key regulator in the immune system and in cancer. Cytokine Growth Factor Rev. 2010;21:213-226. [PubMed] [DOI] |
| 11. | Staudt LM. Oncogenic activation of NF-kappaB. Cold Spring Harb Perspect Biol. 2010;2:a000109. [PubMed] [DOI] |
| 12. | Vaiopoulos AG, Athanasoula KCh, Papavassiliou AG. NF-κB in colorectal cancer. J Mol Med (Berl). 2013;91:1029-1037. [PubMed] [DOI] |
| 13. | 刘 宝玉, 黄 杰安, 刘 诗权, 李 素艳, 徐 春燕, 梁 梦紫, 谭 林, 覃 蒙斌. NF-κB对人结肠癌细胞上皮间质转化及侵袭转移的影响. 世界华人消化杂志. 2014;22:3403-3409. [DOI] |
| 14. | 苏 颖洁, 黄 杰安, 刘 诗权, 黄 娟秀, 钟 月圆, 唐 国都, 姜 海行. 鞘氨醇激酶1和核因子κB p65在结肠癌中的表达及其临床意义. 中华内科杂志. 2012;51:220-224. |
| 15. | Sun SC. The noncanonical NF-κB pathway. Immunol Rev. 2012;246:125-140. [PubMed] [DOI] |
| 16. | Uno M, Saitoh Y, Mochida K, Tsuruyama E, Kiyono T, Imoto I, Inazawa J, Yuasa Y, Kubota T, Yamaoka S. NF-κB inducing kinase, a central signaling component of the non-canonical pathway of NF-κB, contributes to ovarian cancer progression. PLoS One. 2014;9:e88347. [PubMed] [DOI] |
| 17. | Yu J, Wang Y, Yan F, Zhang P, Li H, Zhao H, Yan C, Yan F, Ren X. Noncanonical NF-κB activation mediates STAT3-stimulated IDO upregulation in myeloid-derived suppressor cells in breast cancer. J Immunol. 2014;193:2574-2586. [PubMed] [DOI] |
| 18. | Kim JC, Kim SY, Roh SA, Cho DH, Kim DD, Kim JH, Kim YS. Gene expression profiling: canonical molecular changes and clinicopathological features in sporadic colorectal cancers. World J Gastroenterol. 2008;14:6662-6672. [PubMed] [DOI] |
| 19. | Marhaba R, Zöller M. CD44 in cancer progression: adhesion, migration and growth regulation. J Mol Histol. 2004;35:211-231. [PubMed] |
| 20. | Jiang W, Zhang Y, Kane KT, Collins MA, Simeone DM, di Magliano MP, Nguyen KT. CD44 Regulates Pancreatic Cancer Invasion through MT1-MMP. Mol Cancer Res. 2015;13:9-15. [PubMed] [DOI] |
| 21. | Bendardaf R, Algars A, Elzagheid A, Korkeila E, Ristamäki R, Lamlum H, Collan Y, Syrjänen K, Pyrhönen S. Comparison of CD44 expression in primary tumours and metastases of colorectal cancer. Oncol Rep. 2006;16:741-746. [PubMed] [DOI] |
| 22. | Prochazka L, Tesarik R, Turanek J. Regulation of alternative splicing of CD44 in cancer. Cell Signal. 2014;26:2234-2239. [PubMed] [DOI] |
| 23. | Mashita N, Yamada S, Nakayama G, Tanaka C, Iwata N, Kanda M, Kobayashi D, Fujii T, Sugimoto H, Koike M. Epithelial to mesenchymal transition might be induced via CD44 isoform switching in colorectal cancer. J Surg Oncol. 2014;110:745-751. [PubMed] [DOI] |
| 24. | Tse JC, Kalluri R. Mechanisms of metastasis: epithelial-to-mesenchymal transition and contribution of tumor microenvironment. J Cell Biochem. 2007;101:816-829. [PubMed] [DOI] |
| 25. | Yang J, Weinberg RA. Epithelial-mesenchymal transition: at the crossroads of development and tumor metastasis. Dev Cell. 2008;14:818-829. [PubMed] [DOI] |
| 26. | Okajima M, Kokura S, Ishikawa T, Mizushima K, Tsuchiya R, Matsuyama T, Adachi S, Okayama T, Sakamoto N, Kamada K. Anoxia/reoxygenation induces epithelial-mesenchymal transition in human colon cancer cell lines. Oncol Rep. 2013;29:2311-2317. [PubMed] [DOI] |
| 27. | Thiery JP, Sleeman JP. Complex networks orchestrate epithelial-mesenchymal transitions. Nat Rev Mol Cell Biol. 2006;7:131-142. [PubMed] [DOI] |
| 28. | Lim J, Thiery JP. Epithelial-mesenchymal transitions: insights from development. Development. 2012;139:3471-3486. [PubMed] [DOI] |