修回日期: 2015-01-14
接受日期: 2015-01-23
在线出版日期: 2015-03-18
目的: 本研究观察脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)对食管癌细胞株ECa9706体外增殖和迁移能力的影响以及机制.
方法: 采用MTT和Transwell方法分别观察BDNF以及酪氨酸激酶受体B(tyrosine kinase receptor B, TrkB)抑制剂K252a对ECa9706细胞增殖和迁移能力的影响, 采用实时定量聚合酶链反应(real-time quantitative polymerase chain reaction, qPCR)和Western blot方法分别检测ECa9706细胞中TrkB和磷脂酶C(phospholipase C, PLC)-γ1的mRNA和蛋白表达水平.
结果: BDNF可显著促进ECa9706细胞增殖和迁移能力, 该作用可被K252a拮抗. 与对照组相比, BDNF可诱导TrkB的mRNA和蛋白表达显著增加, 并提高PLC-γ1的蛋白表达水平.
结论: BDNF/TrkB/PLC-γ1在食管癌细胞迁移浸润中具有重要作用.
核心提示: 脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)通过激活受体酪氨酸激酶受体B(tyrosine kinase receptor B, TrkB), 诱导磷脂酶C(phospholipase C, PLC)-γ1的表达上调, 进一步刺激食管癌细胞的增殖和迁移. BDNF/TrkB/PLC-γ1通路在食管癌浸润转移中具有重要意义, 而选择性阻断其关键环节可能成为提高食管癌临床疗效、改善预后的有效途径.
引文著录: 冯睿婷, 梅家转, 栗敏, 赵继智, 白桦, 刘桂举. BDNF对食管癌细胞株ECa9706体外侵袭能力的影响. 世界华人消化杂志 2015; 23(8): 1218-1223
Revised: January 14, 2015
Accepted: January 23, 2015
Published online: March 18, 2015
AIM: To explore the effect of brain-derived neurotrophic factor (BDNF) on the proliferation and migration of ECa9706 cell line in vitro and the underlying mechanism.
METHODS: Cell proliferation and migration were examined by MTT assay and transwell assay, respectively. The mRNA and protein expression levels of tyrosine kinase receptor B (TrkB) and phospholipase C (PLC)-γ1 were detected by real-time quantitative polymerase chain reaction (qPCR) and Western blot.
RESULTS: BDNF enhanced the proliferation and migration of ECa9706 cells significantly in a dose-dependent manner, and this effect was blocked by K252a (a TrkB antagonist). Compared with control cells, BDNF increased the mRNA and protein expression of TrkB, and the protein expression of PLC-γ1.
CONCLUSION: BDNF/TrkB/PLC-γ1 signaling may play an important role in the migration and metastasis of esophageal carcinoma cells.
- Citation: Feng RT, Mei JZ, Li M, Zhao JZ, Bai H, Liu GJ. Effect of brain-derived neurotrophic factor on in vitro metastasis of esophageal carcinoma cell line ECa9706. Shijie Huaren Xiaohua Zazhi 2015; 23(8): 1218-1223
- URL: https://www.wjgnet.com/1009-3079/full/v23/i8/1218.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i8.1218
我国是世界上食管癌发病率最高的国家, 每年全球40万例新发食管患者中, 约30万例为中国人[1,2]. 临床研究数据显示食管癌术后5年的生存率却不足20%[3-5], 食管癌手术失败的重要原因是肿瘤的浸润和转移. 脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)属于神经生长因子家族成员之一, 通过与其高亲和力受体-酪氨酸激酶受体B(tyrosine kinase receptor B, TrkB)结合, 调节多种生物学行为, 如肿瘤细胞增殖、迁移、侵袭等. 近年研究[6-9]表明, 在肝癌等多种原发性肿瘤中均发现BDNF表达上调, 但BDNF与食管癌浸润、转移是否有关系还鲜有报道. 本文在体外实验中研究BDNF对食管癌细胞株ECa9706细胞增殖、迁移的影响, 并探讨其相关机制.
TRIzol试剂购自Introvigen公司, BDNF、MTT、DMSO、K252a购自Sigma公司, 胎牛血清、RPMI 1640培养液购自Gibco公司, Transwell购自Corning公司, PCR试剂盒购自TAKARA公司, 兔抗人TrkB、磷脂酶C(phospholipase C, PLC)-γ1抗体和β-actin抗体购自Abcam公司, 羊抗兔IgG购自Sigma公司. 人食管癌细胞株ECa9706购自中国科学院上海细胞库.
1.2.1 细胞培养: 将ECa9706置于含10%胎牛血清的RPMI 1640培养液中, 在37 ℃、50 mL/L CO2培养箱中培养, 每2-3 d更换培养基1次, 取对数生长期细胞进行实验.
1.2.2 MTT实验: 收集对数期生长的ECa9706细胞, 用0.25%胰蛋白酶消化, 进行细胞计数, 采用新鲜的RPMI 1640培养液制成单细胞悬液, 调整细胞密度为2×104个/mL. 96孔培养板中每孔接种100 μL, 置于37 ℃、50 mL/L CO2的饱和湿度培养箱中, 继续培养12 h. 待细胞贴壁生长良好时, 弃去培养基, 分别加入含有不同浓度BDNF的培养液100 μL, 浓度分别为0、5、10、25、50、100 ng/mL, 以0 ng/mL作为对照. 继续培养48 h后. 每孔加入20 μL 5 mg/mL MTT溶液, 继续培养4 h后, 弃上清液, 加入DMSO溶液100 μL/孔, 置摇床低速振荡10 min, 使结晶物溶解充分. 用全自动酶标仪检测570 nm处各孔的吸光度(A)值, 计算每组细胞增殖率 = 实验组A570/对照组A570×100%. 每组药物设3个复孔, 实验重复2次, 取平均值.
1.2.3 Transwell实验: 收集消化并计数细胞, 调整细胞浓度为5×104个/mL, 吸取400 μL细胞悬液加入到Transwell上室, 各组加入不同浓度的BDNF. 将细胞置于37 ℃、50 mL/L CO2的培养箱内培养10 h. 去除滤膜上层的细胞, 采用40 g/L多聚甲醛固定后行瑞氏吉姆萨染色. 每个滤膜随机选取3个视野, 显微镜下计数滤膜下表面的细胞数, 计算细胞迁移率: 迁移率 = (实验组迁移细胞数/对照组迁移细胞数)×100%. 每组药物设3个复孔, 实验重复2次, 取平均值.
1.2.4 K252a拮抗实验: 实验分为4组: A组(对照组, 不加任何药物), B组(100 ng/mL BDNF), C组(1 nmol K252a), D组(100 ng/mL BDNF+1 nmol K252a), 其中D组在加入BDNF前先加K252a预处理30 min. 其余步骤同1.2.2和1.2.3, 测定细胞增殖率和迁移率.
1.2.5 实时定量聚合酶链反应: 用TRIzol试剂提取细胞总RNA, 测定A260/280为1.8-2.0. M-MLV法逆转录合成cDNA, 取3 μL cDNA进行实时定量聚合酶链反应(real-time quantitative polymerase chain reaction, qPCR)反应, 具体步骤按试剂盒说明书进行. 扩增条件为94 ℃预变性5 min, 94 ℃ 45 s变性, 退火58 ℃ 45 s, 延伸72 ℃ 2 min, 扩增循环均为35个循环. 引物由上海生工生物工程有限公司合成, 序列分别为: TrkB, 上游引物: 5'-CTTATGCTTGCTGGTCTTGG-3', 下游引物: 5'-GGGTATTCTTGCTGCTCTCA-3'; PLC-γ1, 上游引物: 5'-AACACGTACCTCACTGGGGA-3', 下游引物: 5'-CTGCAGTGCTCCTCGATAGA-3'; β-actin, 上游引物: 5'-CTCCATCCTGGCGCTGT-3', 下游引物: 5'-GCTGTCACCTTCACCGTTCC-3'. 结果采用2-△△CT法[10]分析.
1.2.6 Western blot检测: 细胞经冰冷PBS冲洗, 加入预冷的细胞裂解液溶解, 冰上静置30 min后, 于4 ℃、12000 g离心20 min, 收集上清. 采用Bradford法分析定量后调整蛋白浓度一致. 取等量蛋白加入2×SDS上样缓冲液, 煮沸变性5 min. 取60 μg总蛋白质经10%SDS-PAGE电泳分离并转移至PVDF膜. 室温5%脱脂奶粉封闭1 h, 加入兔抗人TrkB和PLC-γ1一抗(1:1000)4 ℃孵育过夜, TBST洗涤3次后, 加入辣根过氧化物酶(horse reddish peroxidase, HRP)标记的羊抗兔二抗(1:8000), 37 ℃孵育2 h, TBST洗涤3次后, ECL发光法显影. 以目的条带与内参β-actin相对灰度值表示其表达水平.
统计学处理 采用SPSS18.0进行统计学分析, 实验据用mean±SD表示, P<0.05表示差异有统计学意义.
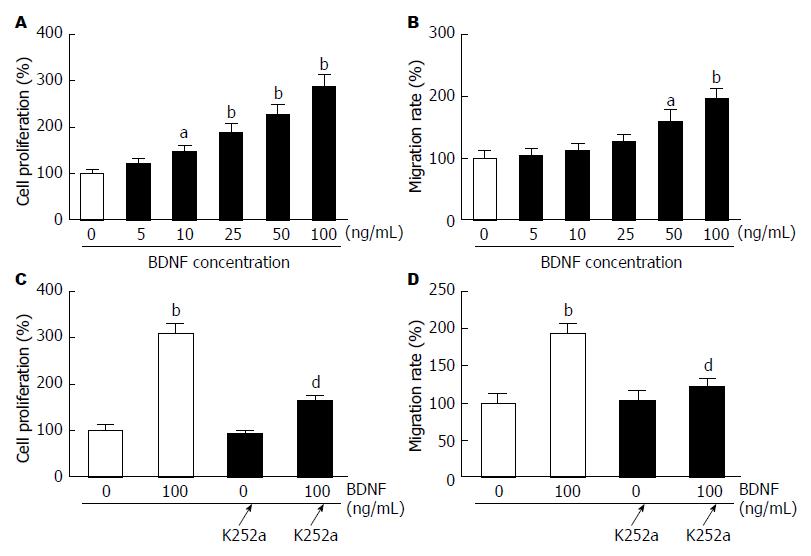
如图1A所示, 浓度为10-100 ng/mL的BDNF对细胞体外增殖有明显的促进作用, 细胞增殖率呈剂量依赖性增高, 与0 ng/mL组相比差异有统计学意义(P<0.05), 其中100 ng/mL时细胞增殖率高达296%. 加入TrkB拮抗剂K252a预处理后, 100 ng/mL组细胞增殖率显著下降(P<0.001), 但对0 ng/mL组无明显影响(图1C).
如图1B所示, BDNF浓度>50 ng/mL时细胞迁移能力显著增强, 与0 ng/mL组相比差异有统计学意义(P<0.05). 浓度低于50 ng/mL时对细胞迁移无显著影响. K252a预处理组细胞迁移率显著下降, 与100 ng/mL组相比差异有统计学意义(P<0.01), 但对0 ng/mL组无明显影响(图1D).
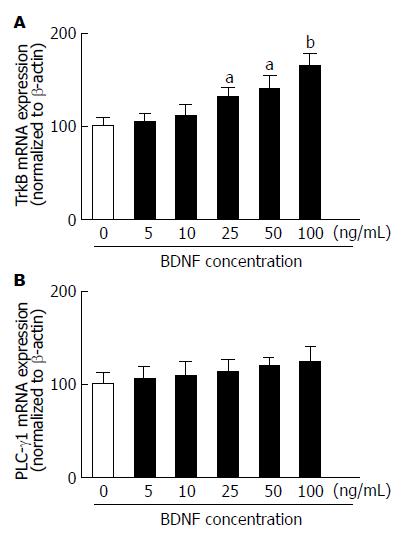
如图2所示, BDNF浓度为25-100 ng/mL时可显著提高TrkB的mRNA表达水平, 与0 ng/mL组相比差异有统计学意义(P<0.05), 但对PLC-γ1的mRNA表达无明显影响.
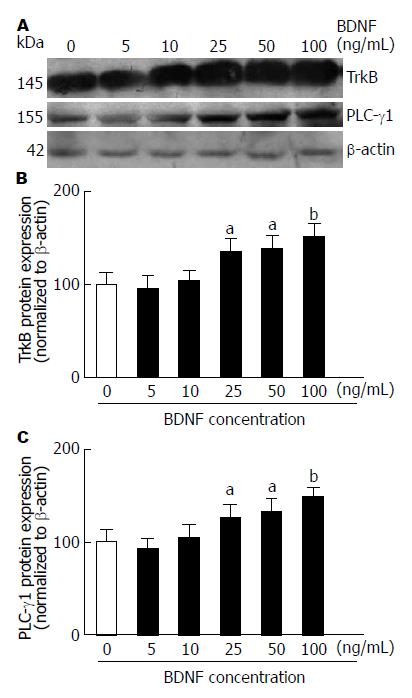
如图3所示, BDNF浓度为25-100 ng/mL时可显著提高TrkB和PLC-γ1的蛋白表达水平, 与0 ng/mL组相比差异有统计学意义(P<0.05).
食管癌是最常见的消化系恶性肿瘤之一, 其死亡率占常见癌症总死亡率的1/4. 食管癌以食管鳞状上皮癌为主, 临床上主要表现为进行性吞咽困难, 并伴有咽下困难、食物反流等症状, 严重影响患者的身体健康. 目前认为, 食管癌细胞的浸润和转移是临床治疗失败的主要原因, 因此, 明确食管癌细胞转移的确切机制是提高治疗效率、改善患者预后的关键.
肿瘤的浸润和转移是肿瘤细胞与周围环境不断相互作用的复杂过程, 包括血管内皮生长因子(vascular endothelial growth factor, VEGF)在内的多种生长因子参与了该过程. 肿瘤细胞通常并行着神经进行转移, 原因可能在于神经束阻力相对较小, 而神经生长因子可能也参与了肿瘤的转移过程. BDNF属于神经生长因子家族成员之一, 是继神经生长因子(nerve growth factor, NGF)之后发现的第二个神经营养因子, 在神经细胞的生长发育、损伤修复中具有重要作用. BDNF通过其受体TrkB介导生物学功能. TrkB是由原癌基因trk编码的神经营养酪氨酸激酶受体家族的成员之一, 通过受体二聚体化以及胞内激酶区特异性酪氨酸残基磷酸化而激活, 介导胞内信号的转导. 近来研究[11-16]表明, BDNF-TrkB通路不仅在神经发育和功能维持中具有重要作用, 还与多种恶性肿瘤密切相关. 在包括神经母细胞瘤以及肾癌、肝癌、肺癌、胃癌等非神经瘤中均发现了BDNF和TrkB的过度表达. 郭大伟等[17]发现干扰BDNF表达可降低人肝细胞癌(hepatocellular carcinoma, HCC)细胞侵袭能力, 提示BDNF信号可能成为阻断HCC进展的新靶点. 徐光辉等[18]的研究发现食管癌与神经之间相互促进, 食管癌细胞可以导向神经轴突向其生长, 而神经也对食管癌细胞的增殖、浸润具有导向作用, 使食管癌细胞沿着神经进行转移, 而且在食管癌细胞中也发现了NGF和BDNF的表达. Tsunoda等[19]已经证实NGF在食管癌患者组织中表达显著高于癌旁组织, 提示癌细胞可能通过分泌NGF诱导神经向其生长, 然而对神经生长具有显著作用的BDNF既然也在食管癌细胞系中表达, 那么是否BDNF也介导了神经导向及肿瘤神经节浸润呢? 目前尚无研究报道. 本研究发现, 外源性BDNF可显著增强ECa9706细胞的增殖和迁移能力, 表明BDNF可能涉及了食管癌细胞的增殖和转移, 而该作用可被TrkB抑制剂K252a所阻断, 也表明了BDNF诱导食管癌细胞增殖和转移的作用是通过TrkB所介导的. 另外, 本研究还发现BDNF可显著提高ECa9706细胞中TrkB的mRNA和蛋白表达, 表明BDNF/TrkB信号通路的激活, 而由该通路介导的生物学效应也显著增强.
BDNF/TrkB通路主要通过3条下游信号介导其生物学效应, 包括丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)、磷脂酰肌醇3激酶/蛋白激酶B(phosphatidyl inositol 3-kinase, PI3K/Akt)和PLC途径[20-22]. PLC分为β、γ、δ三型, 每型又分多种亚型. PLC-γ1亚型是以生长因子受体为中心的多级蛋白质复合物中的重要成员, PLC-γ1活化后可以催化磷脂酰肌醇-4,5-二磷酸(phosphatidylinositol-4,5-bisphosphate, PIP2)分解成三磷酸肌醇(inositol trisphosphate, IP3)和二酰甘油(diacylglycerol, DAG), 后者作为第二信使在细胞内传递其效应[23]. 研究[24-29]表明, PLC-γ1在乳腺癌、结肠癌、前列腺癌、卵巢癌等均高度表达, 其过量表达可引起肿瘤发生、浸润和转移, 提示PLC-γ1在肿瘤发生和发展中具有关键作用. 在最新的研究[30]中发现靶向抑制PLC-γ1可能是预防乳腺癌转移的有效途径. 在司富春等[31]的研究中发现, PLC-γ1在食管癌组织中高度表达, 提示PLC-γ1可能也涉及食管癌的浸润和转移. 本研究中发现BDNF可诱导PLC-γ1的蛋白表达上调, 表明BDNF通过上调TrkB的表达, 进而激活下游PLC-γ1信号途径.
总之, 本研究初步在体外实验中证明了外源性的BDNF可促进食管癌细胞的体外增殖和迁移能力, 同时诱导TrkB和PLC-γ1的表达上调, 提示BDNF/TrkB/PLC-γ1通路在食管癌浸润转移中具有重要意义, 提示了食管癌术后预后较差可能与内源性分泌BDNF所介导的效应有关, 而进一步深入研究BDNF-TrkB/PLC-γ1通路在食管癌中的确切机制, 选择性阻断其关键环节可能成为提高疗效、改善预后的有效途径.
我国是世界上食管癌发病率最高的国家, 临床研究显示食管癌的术后5年生存率极低. 食管癌手术失败的主要原因是肿瘤的浸润和转移. 阐明食管癌浸润和转移的病理机制对于食管癌的治疗、预后及提高患者生存率, 具有十分重要的意义.
李苏宜, 教授, 主任医师, 安徽省肿瘤医院肿瘤营养与代谢治疗科(肿瘤内三科)
脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)/酪氨酸激酶受体B(tyrosine kinase receptor B, TrkB)通路介导了细胞多种生物学行为, 包括肿瘤细胞增殖、迁移、侵袭等. 众多研究均表明BDNF在肝癌等多种原发性肿瘤中高度表达, 而与食管癌的关系还鲜有报道.
已有研究发现神经生长因子(nerve growth factor, NGF)在食管癌组织中表达显著高于癌旁组织, 提示癌细胞可能通过分泌NGF诱导神经向其生长, 并随着神经转移、浸润. 由于BDNF对神经生长有显著的促进作用, 提示BDNF可能参与了肿瘤的神经导向.
本研究在体外实验中证明了BDNF可促进食管癌细胞的增殖和迁移能力, 同时诱导TrkB和磷脂酶C(phospholipase C, PLC)-γ1的表达, 提示BDNF/TrkB/PLC-γ1通路在食管癌浸润转移中具有重要意义.
进一步深入研究BDNF/TrkB/PLC-γ1通路在食管癌中的确切机制, 选择性阻断其关键环节可能成为提高疗效、改善预后的有效途径.
本文较为新颖, 具备一定的文献研究证据支持, 理论的逻辑性也较强. 研究设计较为合理, 指标选择也较为恰当, 数据可信.
编辑: 韦元涛 电编: 闫晋利
| 1. | Jemal A, Siegel R, Xu J, Ward E. Cancer statistics, 2010. CA Cancer J Clin. 2010;60:277-300. [PubMed] [DOI] |
| 3. | Chen W, Zheng R, Zhang S, Zhao P, Li G, Wu L, He J. The incidences and mortalities of major cancers in China, 2009. Chin J Cancer. 2013;32:106-112. [PubMed] [DOI] |
| 4. | Chen W, Zheng R, Zhang S, Zhao P, Li G, Wu L, He J. Report of incidence and mortality in China cancer registries, 2009. Chin J Cancer Res. 2013;25:10-21. [PubMed] [DOI] |
| 5. | Weir HK, Thun MJ, Hankey BF, Ries LA, Howe HL, Wingo PA, Jemal A, Ward E, Anderson RN, Edwards BK. Annual report to the nation on the status of cancer, 1975-2000, featuring the uses of surveillance data for cancer prevention and control. J Natl Cancer Inst. 2003;95:1276-1299. [PubMed] [DOI] |
| 6. | 赵 萌, 张 而立, 贾 晓青. BDNF-TrkB信号传导通路在肝癌中的作用研究进展. 中国现代普通外科进展. 2010;13:730-733. |
| 8. | Nijs J, Meeus M, Versijpt J, Moens M, Bos I, Knaepen K, Meeusen R. Brain-derived neurotrophic factor as a driving force behind neuroplasticity in neuropathic and central sensitization pain: a new therapeutic target. Expert Opin Ther Targets. 2014; Dec 18. [Epub ahead of print]. [PubMed] [DOI] |
| 9. | Lawn S, Krishna N, Pisklakova A, Qu X, Fenstermacher DA, Fournier M, Vrionis FD, Tran N, Chan JA, Kenchappa RS. Neurotrophin Signaling via TrkB and TrkC Receptors Promotes the Growth of Brain Tumor-initiating Cells. J Biol Chem. 2015;290:3814-3824. [PubMed] [DOI] |
| 10. | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 2001;25:402-408. [PubMed] [DOI] |
| 11. | Brodeur GM, Nakagawara A, Yamashiro DJ, Ikegaki N, Liu XG, Azar CG, Lee CP, Evans AE. Expression of TrkA, TrkB and TrkC in human neuroblastomas. J Neurooncol. 1997;31:49-55. [PubMed] |
| 12. | Pearse RN, Swendeman SL, Li Y, Rafii D, Hempstead BL. A neurotrophin axis in myeloma: TrkB and BDNF promote tumor-cell survival. Blood. 2005;105:4429-4436. [PubMed] [DOI] |
| 13. | Yang ZF, Ho DW, Lam CT, Luk JM, Lum CT, Yu WC, Poon RT, Fan ST. Identification of brain-derived neurotrophic factor as a novel functional protein in hepatocellular carcinoma. Cancer Res. 2005;65:219-225. [PubMed] |
| 14. | Lin CY, Hung SY, Chen HT, Tsou HK, Fong YC, Wang SW, Tang CH. Brain-derived neurotrophic factor increases vascular endothelial growth factor expression and enhances angiogenesis in human chondrosarcoma cells. Biochem Pharmacol. 2014;91:522-533. [PubMed] [DOI] |
| 15. | Tomotsuka N, Kaku R, Obata N, Matsuoka Y, Kanzaki H, Taniguchi A, Muto N, Omiya H, Itano Y, Sato T. Up-regulation of brain-derived neurotrophic factor in the dorsal root ganglion of the rat bone cancer pain model. J Pain Res. 2014;7:415-423. [PubMed] [DOI] |
| 16. | Huth L, Rose M, Kloubert V, Winkens W, Schlensog M, Hartmann A, Knüchel R, Dahl E. BDNF is associated with SFRP1 expression in luminal and basal-like breast cancer cell lines and primary breast cancer tissues: a novel role in tumor suppression? PLoS One. 2014;9:e102558. [PubMed] [DOI] |
| 17. | 郭 大伟, 姜 晓峰, 孙 文郁, 朱 磊, 张 弘彬, 侯 学忠, 梁 健. 干扰BDNF表达对97-H细胞侵袭影响及其机制的探讨. 中华肿瘤防治杂志. 2012;19:1295-1307. |
| 19. | Tsunoda S, Okumura T, Ito T, Mori Y, Soma T, Watanabe G, Kaganoi J, Itami A, Sakai Y, Shimada Y. Significance of nerve growth factor overexpression and its autocrine loop in oesophageal squamous cell carcinoma. Br J Cancer. 2006;95:322-330. [PubMed] [DOI] |
| 20. | Schramm A, Schulte JH, Astrahantseff K, Apostolov O, Limpt Vv, Sieverts H, Kuhfittig-Kulle S, Pfeiffer P, Versteeg R, Eggert A. Biological effects of TrkA and TrkB receptor signaling in neuroblastoma. Cancer Lett. 2005;228:143-153. [PubMed] [DOI] |
| 21. | Eggert A, Ikegaki N, Liu XG, Brodeur GM. Prognostic and biological role of neurotrophin-receptor TrkA and TrkB in neuroblastoma. Klin Padiatr. 2000;212:200-205. [PubMed] [DOI] |
| 22. | Sugimoto T, Kuroda H, Horii Y, Moritake H, Tanaka T, Hattori S. Signal transduction pathways through TRK-A and TRK-B receptors in human neuroblastoma cells. Jpn J Cancer Res. 2001;92:152-160. [PubMed] [DOI] |
| 23. | Zhu D, Tan Y, Yang X, Qiao J, Yu C, Wang L, Li J, Zhang Z, Zhong L. Phospholipase C gamma 1 is a potential prognostic biomarker for patients with locally advanced and resectable oral squamous cell carcinoma. Int J Oral Maxillofac Surg. 2014;43:1418-1426. [PubMed] [DOI] |
| 24. | Piccolo E, Innominato PF, Mariggio MA, Maffucci T, Iacobelli S, Falasca M. The mechanism involved in the regulation of phospholipase Cgamma1 activity in cell migration. Oncogene. 2002;21:6520-6529. [PubMed] [DOI] |
| 25. | Wells A, Grandis JR. Phospholipase C-gamma1 in tumor progression. Clin Exp Metastasis. 2003;20:285-290. [PubMed] |
| 26. | Andruska N, Zheng X, Yang X, Helferich WG, Shapiro DJ. Anticipatory estrogen activation of the unfolded protein response is linked to cell proliferation and poor survival in estrogen receptor α-positive breast cancer. Oncogene. 2014; Sep 29. [Epub ahead of print]. [PubMed] [DOI] |
| 27. | Drzewiecka H, Jagodzinski PP. Trichostatin A reduced phospholipase C gamma-1 transcript and protein contents in MCF-7 breast cancer cells. Biomed Pharmacother. 2012;66:1-5. [PubMed] [DOI] |
| 28. | Beloueche-Babari M, Peak JC, Jackson LE, Tiet MY, Leach MO, Eccles SA. Changes in choline metabolism as potential biomarkers of phospholipase C{gamma}1 inhibition in human prostate cancer cells. Mol Cancer Ther. 2009;8:1305-1311. [PubMed] [DOI] |
| 29. | Davies G, Martin TA, Ye L, Lewis-Russell JM, Mason MD, Jiang WG. Phospholipase-C gamma-1 (PLCgamma-1) is critical in hepatocyte growth factor induced in vitro invasion and migration without affecting the growth of prostate cancer cells. Urol Oncol. 2008;26:386-391. [PubMed] [DOI] |
| 30. | Lattanzio R, Marchisio M, La Sorda R, Tinari N, Falasca M, Alberti S, Miscia S, Ercolani C, Di Benedetto A, Perracchio L. Overexpression of activated phospholipase Cγ1 is a risk factor for distant metastases in T1-T2, N0 breast cancer patients undergoing adjuvant chemotherapy. Int J Cancer. 2013;132:1022-1031. [PubMed] [DOI] |