修回日期: 2015-01-19
接受日期: 2015-01-23
在线出版日期: 2015-03-08
目的: 探讨陕西人群中白介素-8(interleukin-8, IL-8) -251A/T、IL-10 -1082A/G单核苷酸基因多态性(single nucleotide polymorphism, SNP)与结直肠癌的遗传易感性.
方法: 采用病例对照研究的方法, 应用等位特异性聚合酶链式反应(allele specific polymerase chain reaction, AS-PCR), 分别检测102例结直肠癌患者和105例健康对照人群中IL-8 -251A/T、IL-10 -1082A/G的基因分布, 运用χ2检验的方法比较2个多态性位点中不同基因型与结直肠癌的易感性.
结果: 在陕西人群中, 结直肠癌组和健康对照组中IL-8 -251A/T位点的3种基因型分布差异有统计学意义(χ2 = 8.278, P = 0.016), A等位基因在结直肠癌组中的频率高于对照组(χ2 = 5.083, P = 0.024), 携带AA基因型的个体更易患结直肠癌(OR = 3.84, 95%CI: 1.44-10.23); 分层分析显示: 携带A等位基因年龄<55岁或吸烟的个体, 相对于年龄≥55岁或非吸烟者更易罹患结直肠癌(P = 0.003). 两组间IL-10 -1082A/G位点的3种基因型分布差异无统计学意义(χ2 = 1.808, P = 0.405).
结论: 相同环境条件下, 陕西人群中携带IL-8 -251A等位基因者增加结直肠癌发生的危险性, 尤其是在年龄<55岁及吸烟的个体中, 考虑IL-8 -251位点的SNP可能是结直肠癌的易感基因; IL-10 -1082A/G与结直肠癌的发病无明显相关性.
核心提示: 本文通过等位基因特异PCR(allele specific PCR)技术检测并分析了陕西人群中白介素-8(interleukin-8, IL-8) -251A/T、IL-10 -1082A/G的基因多态性与结直肠癌的相关性, 结果证实IL-8 -251位点的单核苷酸基因多态性与结直肠癌的发生相关; IL-10 -1082A/G则与结直肠癌的发病无明显相关性.
引文著录: 李红霞, 李媛媛, 宋政军, 和水祥, 郭秦乐. 陕西人群中IL-8、IL-10单核苷酸基因多态性与结直肠癌的易感性. 世界华人消化杂志 2015; 23(7): 1184-1190
Revised: January 19, 2015
Accepted: January 23, 2015
Published online: March 8, 2015
AIM: To explore the association between IL-8 -251A/T and IL-10 -1082A/G polymorphisms and susceptibility to colorectal cancer (CRC) in the population in Shaanxi, China.
METHODS: A case-control study was performed to compare the distribution of genetic frequencies and genotype of IL-8 -251A/T and IL-10 -1082A/G among colorectal cancer patients (n = 102) and control healthy individuals (n = 105) using allele specific PCR (AS-PCR). The relationship between IL-8 -251A/T and IL-10 -1082A/G polymorphisms and susceptibility to colorectal cancer was explored.
RESULTS: There was a significant difference in the distribution of genotype of IL-8 -251A/T between the healthy control group and CRC group (χ2 = 8.278, P = 0.016). The genetic frequency of IL-8 -251A allele in CRC was 0.54 (111/204), which was significantly higher than that of the controls (0.43, 91/210) (χ2 = 5.083; P = 0.024). The subjects carrying AA genotype were more likely to suffer from CRC (OR = 3.84, 95%CI: 1.44-10.23). Stratified analysis suggested that the association between the AA genotype of IL-8 -251A/T and the risk of CRC was more profound in subjects less than 55 years old and smokers. However, no difference was discovered in the distribution of genotype of IL-10 -1082A/G between the CRC group and healthy control group (χ2 = 1.808, P = 0.405).
CONCLUSION: The IL-8 -251AA genotype may be a risk factor of CRC in the population in Shaanxi, and people with A allele may be more likely to suffer from CRC, especially in those less than 55 years old and smokers. No correlation is found between IL-10 -1082A/G polymorphism and the risk of CRC.
- Citation: Li HX, Li YY, Song ZJ, He SX, Guo QY. Association between IL-8 -251A/T and IL-10 -1082A/G genetic polymorphisms and susceptibility to colorectal cancer: A case-control study in a population in Shaanxi. Shijie Huaren Xiaohua Zazhi 2015; 23(7): 1184-1190
- URL: https://www.wjgnet.com/1009-3079/full/v23/i7/1184.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i7.1184
结直肠癌是胃肠道中常见的恶性肿瘤之一, 近年来, 随着人们生活水平的提高, 饮食习惯与结构的改变, 加之人口老龄化趋势影响, 我国结直肠癌的发病率和死亡率增长迅速. 目前, 关于癌症遗传易感性的研究变得越来越深入与广泛, 与癌症相关的易感基因的研究也成了目前的研究热点. 流行病学与临床实验研究均发现炎症与肿瘤的发生密切相关, 白介素-8(interleukin-8, IL-8)、IL-10作为重要的促炎因子与抑炎因子, 其启动子区域的单核苷酸基因多态性(single nucleotide polymorphism, SNP)(IL-8 -251A/T、IL-10 -1082A/G)与多种肿瘤的易感性相关, 但有关IL-8 -251A/T、IL-10 -1082A/G SNP与结直肠癌相关性的研究却较为少见, 且结论存在争议. 因此为了进一步验证IL-8 -251A/T与IL-10 -1082A/G与结直肠癌的相关性, 我们采用病例对照研究的方法, 应用等位特异性聚合酶链式反应(allele specific polymerase chain reaction, AS-PCR)以探讨IL-8 -251A/T、IL-10 -1082A/G SNP与陕西人群中结直肠癌的关系, 为在基因水平研究结直肠癌的发病机制及筛选高危人群提供遗传学依据.
选取2013-06/2014-06在西安交通大学第一附属医院进行结肠镜检查并经病理活检确诊的结直肠癌患者102例作为病例组, 男性61例, 女性41例, 年龄<55岁的38例, ≥55岁的64例, 其中结肠癌55例, 直肠癌47例; 选取同期到医院参加健康体检的105名志愿者设为健康对照组, 男性58例, 女性47例, 年龄<55岁49例, ≥55岁56例. 所选病例组及对照组均为来自陕西西安市及周边市县. 对研究人群的基本资料如吸烟、饮酒、肿瘤家族史等进行问卷调查并收集资料. DNA提取试剂盒购自中国天根生化科技(北京)有限公司; 引物由上海Sangon Biotech股份有限公司合成; Tap酶由大连Takara公司提供; 125 bp marker购自美国Takara公司.
1.2.1 标本采集及基因组DNA提取: 研究对象知情同意后, 采集静脉血2 mL于EDTA抗凝管中, 离心去血清后在剩下的细胞中加入300 µL人红细胞裂解液, 混匀震荡3 min溶解红细胞, 离心30 s沉淀白细胞, 加入细胞裂解液后按TIANGEN公司说明书提取DNA.
1.2.2 PCR扩增目的片段: 参照文献[1]设计引物(表1). IL-8 -251A/T、IL-10 -1082A/G扩增: 25 µL体系: ddH2O 8.5 µL, Tap酶12.5 µL, 上下游引物各0.5 µL, DNA提取液3 µL. 扩增循环参数: 94 ℃预变性4 min, 94 ℃ 30 s, 55 ℃ 30 s(IL-8 -251A/T), 58 ℃ 30 s(IL-10 -1082A/G), 72 ℃ 45 s, 循环35次, 72 ℃延伸7 min. 每次PCR扩增均设立阴性对照.
| 基因 | 引物序列 | 扩增产物大小(bp) |
| IL-8 -251A/T | F: (A) CCACAATTTGGTGAATTATCAAT | 336 |
| F: (T) CCACAATTTGGTGAATTATCAAA | ||
| R: (common) TGCCCCTTCACTCTGTTAAC | ||
| IL-10 -1082A/G | F: (A) ACTACTAAGGCTTCTTTGGGAA | 258 |
| F: (G) CTACTAAGGCTTCTTTGGGAG | ||
| R: (common) CAGTGCCAACTGAGAATTTGG |
1.2.3 基因型分析: 根据特定的引物是否能扩增出相应的片段, 确定是否存在该等位基因, 每个样本同时经两对引物(两个PCR扩增体系)扩增确定基因型, PCR产物经1.5%琼脂糖凝胶电泳确认基因型. 为了提高AS-PCR检测该两个位点的准确性, 随机盲样抽取10%的样本, 再重复2次以提高AS-PCR的可靠性.
统计学处理 用SPSS17.0统计软件包进行统计分析, 采用χ2检验进行各基因型频率的分布差异比较, 以比值比(odds ratio, OR)及95%可信区间(confidence interval, CI)表示相对危险度, 以P<0.05为差异有统计学意义.
结直肠癌和健康对照组在性别、年龄、吸烟史、饮酒史、家族史等变量进行比较, 分布差异均无统计学意义(P>0.05)(表2).
| 临床资料 | 病例组 | 对照组 | χ2值 | P值 |
| 性别 | 0.441 | 0.506 | ||
| 男性 | 61 | 58 | ||
| 女性 | 41 | 47 | ||
| 年龄(岁) | 1.881 | 0.170 | ||
| <55 | 38 | 49 | ||
| ≥55 | 64 | 56 | ||
| 家族史 | 2.556 | 0.110 | ||
| 有 | 8 | 3 | ||
| 无 | 94 | 102 | ||
| 吸烟史 | 3.153 | 0.076 | ||
| 有 | 21 | 33 | ||
| 无 | 81 | 72 | ||
| 饮酒史 | 1.559 | 0.212 | ||
| 有 | 29 | 22 | ||
| 无 | 73 | 83 | ||
| 肿瘤部位 | - | - | ||
| 直肠 | 47 | 0 | ||
| 结肠 | 55 | 0 |
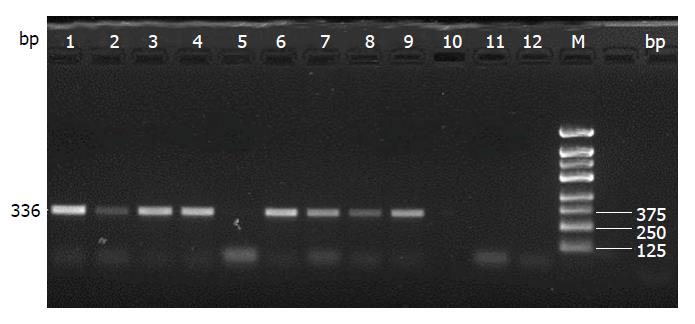
样本分别经A和T引物对扩增后的阳性结果应为336 bp; 仅见A引物对扩增的片段为AA型, 均见相应的片段为AT型; 仅见T引物对扩增的片段为TT型; IL-8 -251A/T位点基因型的电泳结果(图1).
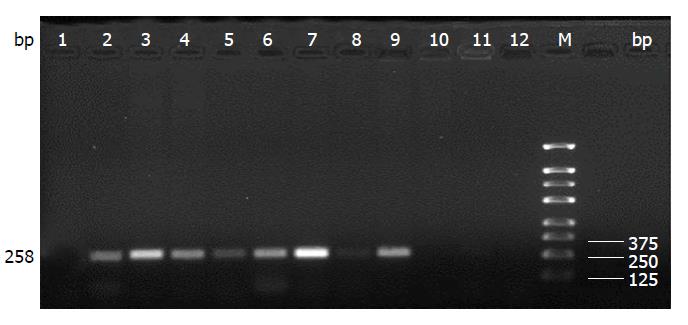
样本分别经A和G引物对扩增后的阳性结果应为258 bp; 仅见A引物对扩增的片段为AA型, 均见相应的片段为AG型; 仅见G引物对扩增的片段为GG型; IL-10 -1082A/G位点基因型的电泳结果(图2).
结直肠癌组和对照组IL-8 -251A/T的基因型和等位基因频率分布结果如表3. 经χ2检验证实两组在基因型分布和等位基因频率之间的差异具有统计学意义(χ2 = 8.278, P = 0.016和χ2 = 5.083, P = 0.024). 分层分析显示: 携带A等位基因年龄<55岁或吸烟的个体, 相对于年龄≥55岁或非吸烟者更易罹患结直肠癌(P = 0.003)(表4).
| 基因型 | n | 频率 | 对照数 | 频率 | OR(95%CI) | P值 |
| AA | 24 | 0.24 | 10 | 0.09 | 3.84(1.44-10.23) | 0.007 |
| AT | 63 | 0.62 | 71 | 0.68 | 2.7(1.20-6.09) | 0.016 |
| TT | 15 | 0.14 | 24 | 0.23 | Ref | |
| Allele A | 111 | 0.54 | 91 | 0.43 | 1.56(1.059-2.300) | 0.024 |
| Allele T | 93 | 0.46 | 119 | 0.57 | Ref |
| 因素 | IL-8 -251A/T | P值 | OR(95%CI) | ||
| AA | AT | TT | |||
| 性别(病例/对照) | |||||
| 男性 | 15/6 | 40/42 | 6/10 | 0.089 | |
| 女性 | 9/4 | 23/29 | 9/14 | 0.191 | |
| 年龄(岁, 病例/对照) | 5.304(1.842-15.273) | ||||
| <55 | 18/7 | 16/33 | 4/9 | 0.003 | |
| ≥55 | 6/3 | 47/38 | 11/15 | 0.360 | |
| 部位 | 0.120 | ||||
| 结肠 | 10 | 39 | 6 | ||
| 直肠 | 14 | 24 | 9 | ||
| 吸烟(病例/对照) | 3.938(0.911-17.014) | ||||
| 是 | 9/4 | 8/14 | 4/15 | 0.003 | |
| 否 | 15/6 | 55/57 | 11/9 | 0.546 | |
| 饮酒(病例/对照) | |||||
| 是 | 12/4 | 10/8 | 7/10 | 0.145 | |
| 否 | 12/6 | 53/63 | 8/14 | 0.144 | |
结直肠癌组和对照组IL-10 -1082A/G的基因型和等位基因频率分布结果如表5. 经χ2检验证实两组在基因型分布和等位基因频率之间的差异无统计学意义(χ2 = 1.808, P = 0.405).
| 基因型 | 病例数(n) | 频率 | 对照数(n) | 频率 | P值 |
| AA | 26 | 0.25 | 20 | 0.19 | 0.405 |
| AG | 66 | 0.65 | 77 | 0.73 | |
| GG | 10 | 0.10 | 8 | 0.08 | |
| Allele A | 118 | 0.58 | 117 | 0.56 | 0.692 |
| Allele G | 86 | 0.42 | 93 | 0.44 |
SNP是人类基因变异的最普遍形式, 近年来, 关于SNP与疾病易感性的研究已成为疾病遗传学研究的主要方面, 其有助于解释不同个体对多种疾病的易感性差异. 既往流行病学和肿瘤分子生物学研究表明炎症和肿瘤的发生密切相关. 炎症因子是参与炎症反应的重要物质, 其与肿瘤易感性的研究是目前的一个热点. IL-8[2-8]、IL-10[9-13]作为炎症因子家族的重要成员, 与多种肿瘤的相关性已得到证实, 如胃癌、食管癌、乳腺癌、口腔癌等, 但其与结直肠癌相关性的报道较少见, 且结论存在分歧. 因此本研究采用病例对照的研究方法, 进一步分析IL-8 -251A/T、IL-10 -1082A/G与结直肠癌的相关性.
IL-8[14]基因位于人类染色体4q12-21, 包含4个外显子、3个内含子及1个启动子区域, 其启动子区域存在1个SNP位点(-251A/T rs4073), 研究证实-251A等位基因的存在会增加IL-8的血浆含量, 与多种肿瘤(胃癌、食管癌、肝癌、乳腺癌、前列腺癌、肺癌)的发生相关, 但国内外关于此位点与结直肠癌相关性的报道却少见. 国外学者Walczak等[15]研究了IL-8 -251T/A、IL-13 -1112C/T基因多态性与炎症性肠病、结直肠癌的相关性, 其结果显示IL-8 -251T/A基因型及A等位基因与炎症性肠病及结直肠癌相关; 同年, Mustapha等[16]研究了马来西亚人中IL-8 -251T/A基因多态性与结直肠癌的相关性, 结果表明, 结直肠癌组中, AA基因型明显增高, -251AA纯合子者有较高的结直肠肠癌发生率(OR = 3.6), 同时证实A等位基因与结直肠癌的高发相关(OR = 1.32); 在本研究中, 我们发现结直肠癌组中IL-8 -251AA基因型及A等位基因的频数明显高于对照组(24/111 vs 10/91), 携带IL-8 -251AA基因型及A等位基因者更易患结直肠癌(OR = 3.84, 95%CI: 1.44-10.23; OR = 1.56, 95%CI: 1.059-2.300), 本实验结果与这两位研究者的研究结果相一致. 在本研究中我们进一步分析了性别、年龄及不良生活方式与结直肠癌的相关性, 结果显示结直肠癌组中, 年龄<55岁携带AA基因型的频数高于年龄≥55岁者(18 vs 6), 携带AA基因型的年龄<55岁者相对于年龄≥55岁者, 结直肠癌的发病风险增加(OR = 5.304, 95%CI: 1.842-15.273). 近年来, 研究[17]发现我国结直肠癌的发病率和死亡率增长迅速, 而且发病逐渐年轻化, 流行病学资料显示我国结直肠癌中位发病年龄为58岁, 比欧美等国家提前12-18年, 本研究发现<55岁的携带AA基因型的研究对象更易发生结直肠癌, 这可能与我国对外开放, 人民生活方式及饮食习惯的改变相关. 另外结直肠癌是多因素疾病, 不良生活方式可增加结直肠癌的发病风险, 多数研究认为吸烟是结直肠癌发病的高危因素, 但未得出统一结论, 研究[18]发现吸烟可能通过免疫抑制, 促进血管新生等机制促进结直肠癌的发生、发展, 本实验发现吸烟人群中, 携带AA基因型的研究对象更易发生结直肠癌(OR = 3.938, 95%CI: 0.911-17.014), 考虑吸烟与易感基因相互作用, 更增加了结直肠癌的发病风险.
Wang等[19]利用Meta分析分析了IL-8 -251T/A基因多态性与癌症的相关性, 结果显示A等位基因携带者与胃癌、鼻咽癌、乳腺癌的高发相关, 与前列腺癌的低发相关, 而与结直肠癌及肺癌之间无相关性; 目前关于IL-8 -251A/T基因多态性与结直肠癌的相关性仍存在争议, 这可能与各项实验研究所选人种及样本量的差异相关.
IL-10[20]是一种多功能的细胞因子, 他具有免疫抑制及抗血管生成的作用. 编码IL-10的基因位于人类染色体1q31-1q32, 包括5个外显子及4个内含子. 研究发现IL-10基因上存在多个多态性位点, 其中最主要的是启动子区域的3个SNP位点: -1082A/G、-819T/C、-592A/C, 这3个位点的突变可影响IL-10 mRNA的翻译从而影响IL-10的表达量. 许多研究发现IL-10启动子区域的SNP与肿瘤的发生、发展相关. Tsilidis等[21]也研究了IL-10基因多态性与结直肠癌的相关性, 研究发现, IL-10 -1082A/G基因多态性与结直肠癌相关, 含G等位基因者会产生更多的IL-10, 从而降低结直肠癌的发生率; Burada等[22]研究发现IL-10 -1082A>G基因多态性与结直肠癌相关, AG基因型患者发生结直肠癌的机率低(OR = 0.63, 95%CI: 0.40-0.98), Miteva等[23]的研究发现IL-10 -1082A/G与结直肠癌的进展相关, 相对于早期结直肠癌患者, 进展期结直肠癌患者中G等位基因及GG基因型频率明显增高, 而此基因多态性与结直肠癌的遗传易感性及预后无明显相关性; 在本实验中, 我们也发现IL-10 -1082A/G各基因型和等位基因频率的分布在结直肠癌及健康对照组中差异无统计学意义(P = 0.405). 造成此争议的主要原因可能在于IL-10 -1082A/G在不同人群中的分布差异.
IL-8、IL-10作为炎症因子家族的重要成员, 其SNP与肿瘤的相关性已得到许多临床实验的研究, 但其与结直肠癌的研究少见, 且结论不统一, IL-8、IL-10 SNP在不同人群中的分布差异及各临床试验所选样本量的不同可能是造成结论差异的主要因素, 因此, IL-8 -251A/T、IL-10 -1082A/G SNP与结直肠癌的遗传易感性仍需进一步的研究.
近年来, 结直肠癌在我国的发病率逐年上升, 而且也逐渐年轻化, 流行病学及临床研究均证实了炎症与肿瘤的相关性, 炎症因子与结直肠相关性的研究也得到国内外多位学者的报道. 白介素-8(inter-leukin-8, IL-8)、IL-10基因多态性与结直肠癌相关性研究却较为少见, 且结论存在分歧. 故为进一步证实IL-8 -251A/T、IL-10 -1082A/G单核苷酸基因多态性与结直肠癌的相关性, 我们进行了此项研究.
许剑民, 教授, 上海市复旦大学附属中山医院普外科; 白雪, 副主任医师, 中国人民解放军北京军区总医院普通外科
单核苷酸基因多态性与肿瘤相关性研究是目前的研究热点, 流行病学及临床研究均证实炎症与肿瘤的发生密切相关, 故近几年国内外多位学者研究了炎症因子基因多态性与肿瘤的相关性, 但IL-8、IL-10基因多态性与结直肠癌相关性研究结论存在分歧, 仍需进一步验证.
Walczak等研究了IL-8 -251T/A、IL-13 -1112C/T基因多态性与炎症性肠病、结直肠癌的相关性, 其结果显示IL-8 -251T/A基因型及A等位基因与炎症性肠病及结直肠癌相关; Mustapha等研究了马来西亚人中IL-8 -251T/A基因多态性与结直肠癌的相关性, 结果表明, 结直肠癌组中, AA基因型明显增高, -251AA纯合子者有较高的结直肠肠癌发生率(OR = 3.6); Tsilidiskk等研究发现, IL-10 -1082A/G基因多态性与结直肠癌相关, 含G等位基因者会产生更多的IL-10, 从而降低结直肠癌的发生率; Miteva等的研究发现IL-10 -1082A/G与结直肠癌的进展相关, 相对于早期结直肠癌患者, 进展期结直肠癌患者中G等位基因及GG基因型频率明显增高, 而此基因多态性与结直肠癌的遗传易感性及预后无明显相关性.
本研究主要通过等位基因特异PCR(allele specific PCR, AS-PCR)技术分析陕西人群中IL-8 -251A/T、IL-10 -1082A/G的基因多态性与结直肠癌的相关性, 研究发现IL-8 -251位点的单核苷酸基因多态性与结直肠癌的高发相关; IL-10 -1082A/G则与结直肠癌的发病无明显相关性.
探讨IL-8 -251A/T、IL-10 -1082A/G单核苷酸基因多态性与陕西人群中结直肠癌的关系, 可为在基因水平研究结直肠癌的发病机制及筛选高危人群提供遗传学依据.
AS-PCR: AS-PCR方法设计了两条特异的正向引物和一条反向引物, 两条特异的正向引物的3'端碱基分别与SNP的两个碱基相同, 其中一条正向特异引物与一个亲本能完全匹配, 能与反向引物一起扩增出PCR产物; 单核苷酸基因多态性(single nucleotide polymorphism, SNP): 主要是指在基因组水平上由单个核苷酸的变异所引起的DNA序列多态性. 他是人类可遗传的变异中最常见的一种. 占所有已知多态性的90%以上.
本文通过AS-PCR技术检测并分析了陕西人群中IL-8 -251A/T、IL-10 -1082A/G的基因多态性与结直肠癌的相关性. 文章总体思路明确, 结果鲜明.
编辑: 韦元涛 电编: 都珍珍
| 3. | Felipe AV, Silva TD, Pimenta CA, Kassab P, Forones NM. lnterleukin-8 gene polymorphism and susceptibility to gastric cancer in a Brazilian population. Biol Res. 2012;45:369-374. [PubMed] [DOI] |
| 4. | Huang Q, Wang C, Qiu LJ, Shao F, Yu JH. IL-8-251A& gt; T polymorphism is associated with breast cancer risk: a meta-analysis. J Cancer Res Clin Oncol. 2011;137:1147-1150. [PubMed] [DOI] |
| 6. | Song JH, Kim SG, Jung SA, Lee MK, Jung HC, Song IS. The interleukin-8-251 AA genotype is associated with angiogenesis in gastric carcinogenesis in Helicobacter pylori-infected Koreans. Cytokine. 2010;51:158-165. [PubMed] [DOI] |
| 7. | Snoussi K, Mahfoudh W, Bouaouina N, Fekih M, Khairi H, Helal AN, Chouchane L. Combined effects of IL-8 and CXCR2 gene polymorphisms on breast cancer susceptibility and aggressiveness. BMC Cancer. 2010;10:283. [PubMed] [DOI] |
| 8. | Wang Z, Wang C, Zhao Z, Liu F, Guan X, Lin X, Zhang L. Association between -251A& gt; T polymorphism in the interleukin-8 gene and oral cancer risk: a meta-analysis. Gene. 2013;522:168-176. [PubMed] [DOI] |
| 9. | Zhu H, Lei X, Liu Q, Wang Y. Interleukin-10-1082A/G polymorphism and inflammatory bowel disease susceptibility: a meta-analysis based on 17,585 subjects. Cytokine. 2013;61:146-153. [PubMed] [DOI] |
| 10. | Liu J, Song B, Bai X, Liu W, Li Z, Wang J, Zheng Y, Wang Z. Association of genetic polymorphisms in the interleukin-10 promoter with risk of prostate cancer in Chinese. BMC Cancer. 2010;10:456. [PubMed] [DOI] |
| 15. | Walczak A, Przybylowska K, Dziki L, Sygut A, Chojnacki C, Chojnacki J, Dziki A, Majsterek I. The lL-8 and IL-13 gene polymorphisms in inflammatory bowel disease and colorectal cancer. DNA Cell Biol. 2012;31:1431-1438. [PubMed] [DOI] |
| 16. | Mustapha MA, Shahpudin SN, Aziz AA, Ankathil R. Risk modification of colorectal cancer susceptibility by interleukin-8 -251T& gt; A polymorphism in Malaysians. World J Gastroenterol. 2012;18:2668-2673. [PubMed] [DOI] |
| 19. | Wang Z, Liu Y, Yang L, Yin S, Zang R, Yang G. The polymorphism interleukin-8 -251A/T is associated with a significantly increased risk of cancers from a meta-analysis. Tumour Biol. 2014;35:7115-7123. [PubMed] [DOI] |
| 21. | Tsilidis KK, Helzlsouer KJ, Smith MW, Grinberg V, Hoffman-Bolton J, Clipp SL, Visvanathan K, Platz EA. Association of common polymorphisms in IL10, and in other genes related to inflammatory response and obesity with colorectal cancer. Cancer Causes Control. 2009;20:1739-1751. [PubMed] [DOI] |
| 22. | Burada F, Dumitrescu T, Nicoli R, Ciurea ME, Rogoveanu I, Ioana M. Cytokine promoter polymorphisms and risk of colorectal cancer. Clin Lab. 2013;59:773-779. [PubMed] |
| 23. | Miteva LD, Stanilov NS, Deliysky TS, Stanilova SA. Significance of -1082A/G polymorphism of IL10 gene for progression of colorectal cancer and IL-10 expression. Tumour Biol. 2014;35:12655-12664. [PubMed] [DOI] |