修回日期: 2014-12-25
接受日期: 2015-01-12
在线出版日期: 2015-03-08
目的: 探讨姜黄素对梗阻性黄疸(obstructive jaundice, OJ)大鼠小肠黏膜屏障的保护作用.
方法: 将♂SD大鼠随机分为3组: 假手术对照(sham operation, SO)组、OJ组、姜黄素治疗(curcumin treatment, Cur)组. 光镜下观察小肠组织形态学改变, 测量肠绒毛高度和黏膜厚度, 采用鲎试剂法检测血浆内毒素水平, 采用放射免疫法检测血清肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-6(interleukin-6, IL-6)水平, 应用分光光度法测定肠组织二胺氧化酶(diamine oxidase, DAO)活性, 采用免疫组织化学方法检测小肠组织中核因子-κB(nuclear factor kappa B, NF-κB)和细胞黏附分子-1(intercellular adhesion molecule-1, ICAM-1)的表达.
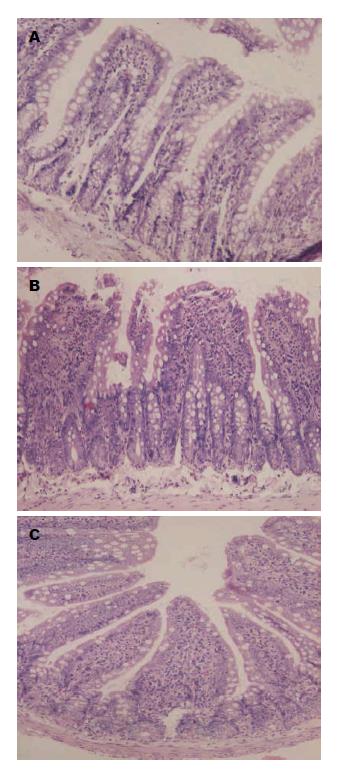
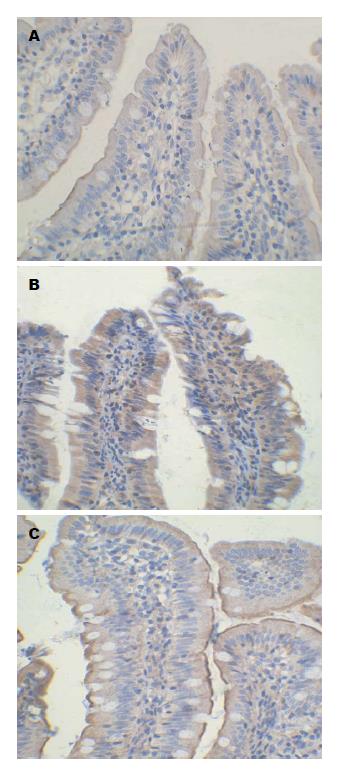
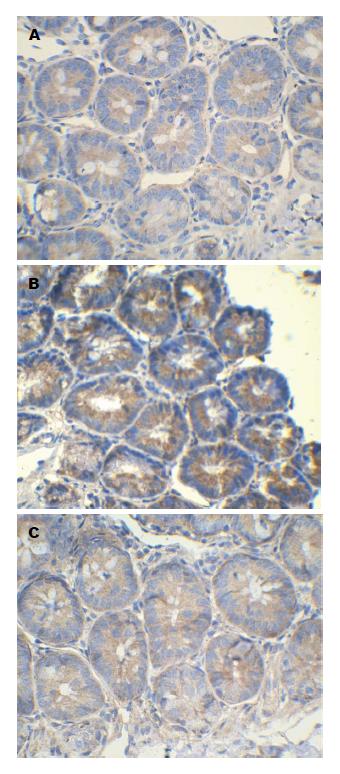
结果: OJ组肠黏膜绒毛排列紊乱, 绒毛稀疏、断裂, 肠黏膜萎缩, 绒毛水肿, 部分上皮细胞坏死脱落, 并可见炎性细胞浸润; Cur组肠黏膜病变较OJ组明显减轻, 肠黏膜绒毛排列整齐, 肠黏膜增厚, 绒毛轻度水肿, 未见明显上皮细胞脱落, 炎性细胞浸润减少; 与SO组比较, OJ组内毒素、TNF-α、IL-6明显增高(P<0.01), DAO活性、肠绒毛高度及黏膜厚度明显降低(P<0.01); Cur组较OJ组内毒素、TNF-α、IL-6明显下降(P<0.05或0.01), DAO活性、肠绒毛高度及黏膜厚度明显升高(P<0.05). OJ组回肠黏膜NF-κB及ICAM-1表达明显高于SO组(P<0.01); Cur组NF-κB及ICAM-1表达明显低于OJ组(P<0.05或0.01).
结论: 姜黄素通过抑制NF-κB、TNF-α、IL-6和ICAM-1等炎症介质, 对小肠黏膜屏障具有保护作用.
核心提示: 本研究通过观察梗阻性黄疸(obstructive jaundice, OJ)大鼠应用姜黄素前后肠组织病理学变化, 应用免疫组织化学方法观察肠组织中核因子-κB(nuclear factor kappa B)、细胞黏附分子-1(intercellular adhesion molecule-1)的表达情况, 检测血浆中肿瘤坏死因子-α(tumor necrosis factor-α)、白介素-6(interleukin-6)含量, 证明了姜黄素对梗阻性黄疸大鼠肠黏膜屏障的保护作用.
引文著录: 侯洪涛, 姜慧卿, 裘艳梅. 姜黄素对梗阻性黄疸大鼠肠黏膜屏障的保护作用. 世界华人消化杂志 2015; 23(7): 1068-1075
Revised: December 25, 2014
Accepted: January 12, 2015
Published online: March 8, 2015
AIM: To investigate the protective action of curcumin on small intestinal mucosal barrier in rats with obstructive jaundice.
METHODS: Thirty-six male SD rats were randomly divided into a sham operated group (SO), an obstructive jaundice group (OJ) and a curcumin treatment group (Cur). Using a light microscope, small intestinal tissue morphological changes were observed, the intestinal villus height and mucosal thickness were measured, the levels of plasma endotoxin were determined by limulus reagent method, the levels of serum tumor necrosis factor-α (TNF-α) and interleukin-6 (IL-6) were determined by radioimmunoassay, intestinal diamine oxidase (DAO) activity was determined by spectrophotometric method, and the expression of nuclear factor kappa B (NF-κB) and intercellular adhesion molecule-1 (ICAM-1) was detected by immunohistochemical method.
RESULTS: In the OJ group, intestinal villi were disordered, sparse and showed fracture and edema, and intestinal mucosal atrophy, epithelial cell necrosis and shedding, and inflammatory cell infiltration were observed. Intestinal mucosal changes in the Cur group were significantly reduced compared with the OJ group: intestinal villi were neatly arranged, intestinal mucosa was thickened, villous edema was mild, there was no obvious epithelial cell loss, and inflammatory cell infiltration was reduced. Compared with the SO group, the levels of endotoxin, TNF-α and IL-6 in the OJ group were significantly increased (P < 0.01), and the intestinal DAO activity, intestinal villus height and mucosal thickness were significantly decreased (P < 0.01). Compared with the OJ group, the levels of endotoxin, TNF-α and IL-6 in the Cur group were significantly decreased (P < 0.05 or 0.01), and the intestinal DAO activity, intestinal villus height and mucosal thickness were significantly increased (P < 0.05). Compared with the SO group, the expression of NF-κB and ICAM-1 in the OJ group was significantly up-regulated (P < 0.01); however, the expression of NF-κB and ICAM-1 in the Cur group was significantly down-regulated compared with the OJ group (P < 0.05 or 0.01).
CONCLUSION: Curcumin protects against intestinal mucosal barrier injury in rats with obstructive jaundice possibly by inhibiting expression of NF-κB, TNF-α, IL-6 and ICAM-1.
- Citation: Hou HT, Jiang HQ, Qiu YM. Protective effect of curcumin on intestinal mucosal barrier in rats with obstructive jaundice. Shijie Huaren Xiaohua Zazhi 2015; 23(7): 1068-1075
- URL: https://www.wjgnet.com/1009-3079/full/v23/i7/1068.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i7.1068
梗阻性黄疸(obstructive jaundice, OJ)是临床上常见的胆道系统疾病, OJ患者可产生脓毒血症、多器官功能障碍等严重并发症, 近年来, 尽管其诊治技术不断革新, 但并发症发生率和病死率仍然较高, 肠源性内毒素血症及革兰氏阴性细菌败血症是其发生的重要因素[1,2]. 人们已经认识到危重患者肠屏障功能是判断预后的重要条件. 近年来危重患者的肠屏障功能已成为研究热点问题, OJ导致肠黏膜屏障功能障碍的机制尚不十分明确, 氧化损伤、胆汁缺乏及肝脏受损等因素参与其中[3-5], 细胞因子和炎症介质是导致肠黏膜屏障功能损伤的重要机制之一[6]. 姜黄素有抗炎、抗氧化、抗癌等多种生物学作用[7,8]. 本研究采用OJ大鼠模型, 观察姜黄素对OJ小肠黏膜屏障的保护作用, 并探讨其可能的机制, 为临床防治OJ引起的小肠黏膜屏障破坏提供理论依据.
健康♂SD大鼠36只, 体质量250 g±25 g, 由河北医科大学实验动物中心提供. 随机分为3组. Ⅰ: 假手术对照(sham operation, SO)组(10只): 开腹后游离胆总管, 但不结扎; Ⅱ: OJ组(13只): 开腹后双重结扎胆总管, 造成肝内外胆管完全梗阻; Ⅲ: 姜黄素治疗(curcumin treatment, Cur)组(13只): 动物模型同OJ组, 自造模当天起用姜黄素灌胃100 mg/(kg•d), 连续14 d. 姜黄素购自美国Sigma公司; 内毒素试剂盒购自湛江安度斯公司, 血清肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)放免试剂盒购自北京普尔伟业公司, 白介素-6(interleukin-6, IL-6)放免试剂盒购自天津九鼎医学公司; 核因子-κB(nuclear factor kappa B, NF-κB)p65多克隆抗体、细胞黏附分子-1(intercellular adhesion molecule-1, ICAM-1)多克隆抗体均购自北京中山生物公司; O-dianisidine、Gadaverine Dihydrochloride、二胺氧化酶(diamine oxidase, DAO)购自美国Sigma公司.
1.2.1 模型制备及标本采集: 实验动物术前12 h禁食, 自由饮水. 用10%水合氯醛(0.3 g/kg)腹腔注射麻醉后, 于上腹正中作3 cm切口进入腹腔, 显露第一肝门, 钝性游离并用3-0号丝线双重结扎胆总管, 然后在两结扎线间横断, 分2层缝合腹壁. 于术后第15天, 分别自门静脉、下腔静脉抽血1、2 mL, 于4 ℃下3000 r/min离心15 min, 得待测血浆及血清, 置-20 ℃冰箱保存备用. 处死动物后, 迅速切取距回盲瓣约10 cm的小肠数段, 每段2 cm, 一部分用生理盐水漂洗后, 迅速放入40 g/L甲醛液中固定, 石蜡包埋; 另一部分小肠经PBS处理后, 立即投入液氮中, 后保存于-70 ℃冰箱内备用.
1.2.2 检测指标: 组织病理学: 将回肠末段组织固定于中性甲醛溶液中, 常规脱水, 石蜡包埋, 切片, HE染色后光镜下观察并摄像. 在单盲情况下用图像分析仪分别测量切片肠黏膜厚度和绒毛高度各10次, 取其均数.
血浆内毒素、血清TNF-α和IL-6测定: 于术后15 d从门静脉抽血1 mL, 采用鲎试剂终点显色法测定血浆内毒素; 自下腔静脉抽2 mL, 采用放射免疫法测定血清TNF-α、IL-6.
小肠组织DAO活性测定: 取肠组织制成组织匀浆, 采用分光光度法, 检测肠组织匀浆DAO活性.
小肠组织NF-κB、ICAM-1蛋白表达的测定: 采用免疫组织化学SP法. 光镜下400倍随机选取5个视野, 采集图像, 应用Image pro plus 6.0专业图像分析软件进行测量, 以阳性细胞染色的平均光密度值来表示抗原的相对表达量.
统计学处理 实验数据以mean±SD表示, 采用SPSS13.0软件进行单因素方差分析(One-way ANOVA), 两组之间比较用SNK-q检验, 以P<0.05为差异有统计学意义.
胆总管结扎48 h后大鼠尿液颜色开始变黄, 4-5 d时全身皮毛开始转黄, 进食量逐渐减少. 术后1 wk及2 wk, OJ大鼠近肝侧胆总管囊状扩张, 肝脏弥漫性肿大, 呈黄褐色. SO组大鼠无死亡, OJ组及Cur组大鼠因黄疸、腹腔感染等原因各死亡3只.
肉眼观察, 大体标本见OJ大鼠小肠黏膜暗褐色色素沉着. 光镜下观察, SO组肠黏膜绒毛排列整齐, 高度一致, 绒毛黏膜完整; OJ组肠黏膜绒毛排列紊乱, 绒毛稀疏、断裂, 肠黏膜萎缩, 绒毛水肿, 部分上皮细胞坏死脱落, 并可见炎性细胞浸润; 与SO组相比, OJ组大鼠回肠黏膜高度及厚度, 变小、变薄, 差异有统计学意义(P<0.01). Cur组肠黏膜病变较OJ组明显减轻, 肠黏膜绒毛排列整齐, 肠黏膜增厚, 绒毛轻度水肿, 未见明显上皮细胞脱落, 炎性细胞浸润减少; 应用姜黄素后肠黏膜高度及厚度情况明显好转, 与OJ组比较差异有统计学意义(P<0.05). Cur组与SO组比较差异有统计学意义(P<0.01)(表1, 图1).
OJ组内毒素浓度比SO组明显升高, 差异有统计学意义(P<0.01); Cur组内毒素浓度与OJ组比较明显下降, 差异有统计学意义(P<0.01); Cur组与SO组比较差异有统计学意义(P<0.01)(表2).
OJ组TNF-α、IL-6浓度比SO组明显升高, 差异有统计学意义(P<0.01); Cur组比OJ组明显下降, 差异有统计学意义(P<0.05); Cur组与SO组比较差异有统计学意义(P<0.05)(表2).
OJ组、Cur组肠组织DAO活性较SO组明显降低, 差异有统计学意义(P<0.01); Cur组较OJ组明显升高, 差异有统计学意义(P<0.05)(表1).
SO组少见NF-κB阳性表达细胞, OJ组中可见大量肠上皮细胞及炎性细胞胞浆及胞核表达NF-κB, 差异有统计学意义(P<0.01), Cur组NF-κB表达低于OJ组(P<0.01), Cur组与SO组比较差异有统计学意义(P<0.01)(表3, 图2).
OJ时肠道的机械屏障和功能屏障会受到不同程度的损伤[9,10]. 肠道是机体最大的细菌和病毒库, 肠道屏障是多器官功能障碍发生发展的动力器官. NF-κB作为参与炎症反应的重要转录调节因子, 在许多炎症反应中发挥枢纽作用[11,12]. 在OJ中, NF-κB对炎症反应的发生、发展以及调控起着重要作用. 当细胞受到细菌产物、细胞因子、氧化应激等胞外信号刺激时, 可激活NF-κB, 活化后的NF-κB, 可增强TNF-α和IL-1β的基因转录, TNF-α和IL-1β进而再激活NF-κB, 还使得IL-6、IL-8产生释放增多, 通过活化NF-κB触发炎症介质的瀑布样反应, 从而使炎症不断扩大、恶化[13,14]. 这些炎性细胞因子均具有细胞毒性作用, 可直接引起肠黏膜组织的水肿及破坏, 还会诱导肠上皮细胞的凋亡并破坏紧密连接的结构和功能, 减弱肠黏膜屏障的功能[15-17]. 姜黄素能够明显抑制NF-κB的激活, 是NF-κB的非特异性抑制剂[18]. 有研究[19]表明OJ时肠黏膜机械屏障的损伤与肠黏膜细胞中NF-κB的表达增加有关. 本实验研究结果显示, 姜黄素能够抑制肠上皮细胞及炎性细胞NF-κB的活化.
TNF-α可激活多形核细胞, 所释放的多种致损伤物质进入血液可造成脏器损伤[20]. 在体外肠上皮细胞株的实验表明, TNF-α可破坏单层细胞的完整性, 减少occludin启动子的活性[21]. TNF-α可诱导肠上皮细胞间紧密连接蛋白分解和功能改变[22], 从而导致肠上皮通透性增加. 此外, TNF-α可上调claudin-2[23], 并诱导上皮细胞凋亡[24], 造成肠上皮通透性增加. 也有研究[25]显示, 在小鼠体内TNF-α的水平升高可导致肌球蛋白轻链激酶(myosin light chain kinase, MLCK)磷酸化, 从而增加肠上皮的通透性. IL-6是启动炎症反应的关键细胞因子, 可间接地反映机体各器官组织损伤的严重程度. 很多致炎因素和炎症介质如TNF-α、IL-1等均可诱导单核细胞、巨噬细胞和血管内皮细胞产生并释放IL-6, 进一步趋化中性粒细胞, 导致组织细胞浸润, 促进肠黏膜炎性损伤. IL-6可使claudin-2的表达增加, 增加了肠上皮通透性[26]. DAO存在于哺乳类动物小肠黏膜绒毛上层, 其活性与黏膜细胞的核酸和蛋白合成密切相关, 其活性变化反映了小肠黏膜的完整性和损伤程度. 本实验结果表明, 姜黄素可以使OJ大鼠TNF-α、IL-6水平降低, 姜黄素可能通过抑制促进TNF-α转录的过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor γ, PPARγ)、NF-κB的活性, 从而减少TNF-α基因的转录[27], 并进一步减少了IL-6表达. OJ大鼠小肠绒毛高度降低, 黏膜厚度变薄, 与既往研究[28]结果一致, 且血浆内毒素水平升高, 小肠DAO活性下降, 小肠黏膜结构和功能受到了严重破坏, 姜黄素干预后小肠黏膜厚度、绒毛高度均得到改善, 内毒素水平下降, DAO活性上升, 说明姜黄素能够减轻肠组织结构损害, 改善肠道黏膜屏障的损伤.
ICAM-1属于免疫球蛋白超家族, 作为免疫调节因子, 通过与受配体的相互作用, 介导白细胞不同亚群间的接触和黏附, 调节白细胞的功能活性和免疫反应. 有研究[29]发现, 组织ICAM-1在OJ引起的小肠黏膜损伤中发挥重要作用, 在OJ时小肠形态和功能的变化与肠组织ICAM-1变化相一致, 肠黏膜上皮细胞的ICAM-1上调, 可促使多形核中性粒细胞(polymorphonuclear neutrophils, PMNs)与上皮细胞黏附和激活, 产生大量炎性介质和溶蛋白酶造成小肠黏膜的直接损伤, 从而增高肠黏膜的通透性, 导致肠道屏障功能失调. 本试验结果显示, 应用姜黄素后, OJ大鼠ICAM-1表达明显降低, 这提示了姜黄素抑制了ICAM-1的表达, 从而降低了PMN的黏附, 阻断了PMN的激活途径, 从而保护小肠的黏膜屏障. 有研究[30]表明NF-κB是ICAM-1的上游调控因子, NF-κB可能从基因转录水平上调控着ICAM-1的表达.
总之, 不同的细胞因子和炎症介质在OJ发展的不同阶段中相互重叠、相互联系、相互影响, 细胞因子和炎症介质是导致OJ肠黏膜屏障损伤的重要机制之一. 小肠形态结构和DAO活性变化表明姜黄素能够保护肠黏膜屏障功能, 减少肠源性内毒素血症的发生. 姜黄素通过抑制NF-κB及TNF-α表达, 减轻了炎症因子引起的肠道损伤作用, 降低了肠黏膜的通透性, 减轻了肠道黏膜屏障的损伤.
梗阻性黄疸是临床上常见的胆道疾病, 其并发症发生率和病死率较高, 肠黏膜屏障功能障碍是导致其发生的重要因素. 近年来危重患者的肠屏障功能已成为研究热点问题, 细胞因子和炎症介质是导致肠黏膜屏障损伤的重要机制. 姜黄素有抗炎、抗氧化等多种生物学作用. 本研究通过观察姜黄素对梗阻性黄疸大鼠小肠黏膜屏障的保护作用, 为临床防治梗阻性黄疸引起的小肠黏膜屏障损伤提供了理论依据.
黎观红, 教授, 江西农业大学动物科技学院
梗阻性黄疸肠黏膜屏障损伤的机制及防治策略.
梗阻性黄疸时常伴有肠道菌群失调, 补充益生菌后可改善肠道菌群, 还可减轻肠黏膜损伤, 降低病菌移位.
姜黄素对溃疡性结肠炎及肠炎大鼠肠黏膜屏障保护作用的研究较多, 本研究采用梗阻性黄疸大鼠模型, 相关研究鲜有报道.
姜黄素为纯天然植物提取物, 安全性高, 姜黄素具有抗炎、抗氧化、抗肝损伤、免疫调节等多种生物学作用, 姜黄素对梗阻性黄疸肠黏膜保护作用的具体机制还有待进一步研究.
肠黏膜屏障: 包括机械屏障、生物屏障、免疫屏障、化学屏障.
本研究为临床防治梗阻性黄疸引起的肠黏膜屏障损伤提供了理论依据. 论文写作简洁、流畅, 数据分析合理正确, 结果可靠.
编辑: 韦元涛 电编: 都珍珍
| 1. | Bedirli A, Kerem M, Ofluoglu E, Salman B, Katircioglu H, Bedirli N, Yilmazer D, Alper M, Pasaoglu H. Administration of Chlorella sp. microalgae reduces endotoxemia, intestinal oxidative stress and bacterial translocation in experimental biliary obstruction. Clin Nutr. 2009;28:674-678. [PubMed] [DOI] |
| 2. | Gencay C, Kilicoglu SS, Kismet K, Kilicoglu B, Erel S, Muratoglu S, Sunay AE, Erdemli E, Akkus MA. Effect of honey on bacterial translocation and intestinal morphology in obstructive jaundice. World J Gastroenterol. 2008;14:3410-3415. [PubMed] [DOI] |
| 3. | Assimakopoulos SF, Maroulis I, Patsoukis N, Vagenas K, Scopa CD, Georgiou CD, Vagianos CE. Effect of antioxidant treatments on the gut-liver axis oxidative status and function in bile duct-ligated rats. World J Surg. 2007;31:2023-2032. [PubMed] [DOI] |
| 4. | Assimakopoulos SF, Vagianos CE, Patsoukis N, Georgiou C, Nikolopoulou V, Scopa CD. Evidence for intestinal oxidative stress in obstructive jaundice-induced gut barrier dysfunction in rats. Acta Physiol Scand. 2004;180:177-185. [PubMed] [DOI] |
| 5. | Keating N, Keely SJ. Bile acids in regulation of intestinal physiology. Curr Gastroenterol Rep. 2009;11:375-382. [PubMed] [DOI] |
| 6. | Badger SA, Jones C, McCaigue M, Clements BW, Parks RW, Diamond T, McCallion K, Taylor MA. Cytokine response to portal endotoxaemia and neutrophil stimulation in obstructive jaundice. Eur J Gastroenterol Hepatol. 2012;24:25-32. [PubMed] [DOI] |
| 7. | Schaffer M, Schaffer PM, Zidan J, Bar Sela G. Curcuma as a functional food in the control of cancer and inflammation. Curr Opin Clin Nutr Metab Care. 2011;14:588-597. [PubMed] [DOI] |
| 8. | Karatepe O, Acet E, Battal M, Adas G, Kemik A, Altiok M, Kamali G, Koculu S, Catay A, Kamali S. Effects of glutamine and curcumin on bacterial translocation in jaundiced rats. World J Gastroenterol. 2010;16:4313-4320. [PubMed] [DOI] |
| 9. | Gümüs M, Tekin R, Firat U, Onder A, Kapan M, Böyük A, Aldemir M, Kilinç C. The effects of pomegranate on bacterial translocation in rats with obstructive jaundice. Eur Rev Med Pharmacol Sci. 2013;17:1488-1494. [PubMed] |
| 10. | Assimakopoulos SF, Scopa CD, Vagianos CE. Pathophysiology of increased intestinal permeability in obstructive jaundice. World J Gastroenterol. 2007;13:6458-6464. [PubMed] [DOI] |
| 11. | Rodrigues CE, Sanches TR, Volpini RA, Shimizu MH, Kuriki PS, Camara NO, Seguro AC, Andrade L. Effects of continuous erythropoietin receptor activator in sepsis-induced acute kidney injury and multi-organ dysfunction. PLoS One. 2012;7:e29893. [PubMed] [DOI] |
| 12. | Chen X, Ji B, Han B, Ernst SA, Simeone D, Logsdon CD. NF-kappaB activation in pancreas induces pancreatic and systemic inflammatory response. Gastroenterology. 2002;122:448-457. [PubMed] [DOI] |
| 13. | Sun Z, Andersson R. NF-kappaB activation and inhibition: a review. Shock. 2002;18:99-106. [PubMed] [DOI] |
| 14. | Fujishima Y, Nishiumi S, Masuda A, Inoue J, Nguyen NM, Irino Y, Komatsu M, Tanaka K, Kutsumi H, Azuma T. Autophagy in the intestinal epithelium reduces endotoxin-induced inflammatory responses by inhibiting NF-κB activation. Arch Biochem Biophys. 2011;506:223-235. [PubMed] [DOI] |
| 15. | Shen ZY, Zhang J, Song HL, Zheng WP. Bone-marrow mesenchymal stem cells reduce rat intestinal ischemia-reperfusion injury, ZO-1 downregulation and tight junction disruption via a TNF-α-regulated mechanism. World J Gastroenterol. 2013;19:3583-3595. [PubMed] [DOI] |
| 16. | Pijls KE, Jonkers DM, Elamin EE, Masclee AA, Koek GH. Intestinal epithelial barrier function in liver cirrhosis: an extensive review of the literature. Liver Int. 2013;33:1457-1469. [PubMed] [DOI] |
| 17. | Zhang Y, Li J. Carbachol ameliorates lipopolysaccharide-induced intestinal epithelial tight junction damage by down-regulating NF-κβ and myosin light-chain kinase pathways. Biochem Biophys Res Commun. 2012;428:321-326. [PubMed] [DOI] |
| 18. | Jobin C, Bradham CA, Russo MP, Juma B, Narula AS, Brenner DA, Sartor RB. Curcumin blocks cytokine-mediated NF-kappa B activation and proinflammatory gene expression by inhibiting inhibitory factor I-kappa B kinase activity. J Immunol. 1999;163:3474-3483. [PubMed] |
| 19. | Xiping Z, Ke W, Yaping Y, Hongchan Z, Qihui C. Protective effect and mechanisms of radix astragali injection on the intestinal mucosa of rats with obstructive jaundice. Mediators Inflamm. 2010;2010:757191. [PubMed] [DOI] |
| 20. | Mole DJ, Taylor MA, McFerran NV, Diamond T. The isolated perfused liver response to a 'second hit' of portal endotoxin during severe acute pancreatitis. Pancreatology. 2005;5:475-485. [PubMed] [DOI] |
| 21. | Mankertz J, Tavalali S, Schmitz H, Mankertz A, Riecken EO, Fromm M, Schulzke JD. Expression from the human occludin promoter is affected by tumor necrosis factor alpha and interferon gamma. J Cell Sci. 2000;113:2085-2090. [PubMed] |
| 22. | Schmitz H, Fromm M, Bentzel CJ, Scholz P, Detjen K, Mankertz J, Bode H, Epple HJ, Riecken EO, Schulzke JD. Tumor necrosis factor-alpha (TNFalpha) regulates the epithelial barrier in the human intestinal cell line HT-29/B6. J Cell Sci. 1999;112:137-146. [PubMed] |
| 23. | Mankertz J, Amasheh M, Krug SM, Fromm A, Amasheh S, Hillenbrand B, Tavalali S, Fromm M, Schulzke JD. TNFalpha up-regulates claudin-2 expression in epithelial HT-29/B6 cells via phosphatidylinositol-3-kinase signaling. Cell Tissue Res. 2009;336:67-77. [PubMed] [DOI] |
| 24. | Gitter AH, Bendfeldt K, Schulzke JD, Fromm M. Leaks in the epithelial barrier caused by spontaneous and TNF-alpha-induced single-cell apoptosis. FASEB J. 2000;14:1749-1753. [PubMed] [DOI] |
| 25. | Clayburgh DR, Barrett TA, Tang Y, Meddings JB, Van Eldik LJ, Watterson DM, Clarke LL, Mrsny RJ, Turner JR. Epithelial myosin light chain kinase-dependent barrier dysfunction mediates T cell activation-induced diarrhea in vivo. J Clin Invest. 2005;115:2702-2715. [PubMed] [DOI] |
| 26. | Suzuki T, Yoshinaga N, Tanabe S. Interleukin-6 (IL-6) regulates claudin-2 expression and tight junction permeability in intestinal epithelium. J Biol Chem. 2011;286:31263-31271. [PubMed] [DOI] |
| 27. | Yu WG, Xu G, Ren GJ, Xu X, Yuan HQ, Qi XL, Tian KL. Preventive action of curcumin in experimental acute pancreatitis in mouse. Indian J Med Res. 2011;134:717-724. [PubMed] [DOI] |
| 28. | Assimakopoulos SF, Scopa CD, Zervoudakis G, Mylonas PG, Georgiou C, Nikolopoulou V, Vagianos CE. Bombesin and neurotensin reduce endotoxemia, intestinal oxidative stress, and apoptosis in experimental obstructive jaundice. Ann Surg. 2005;241:159-167. [PubMed] |
| 29. | 林 木生, 缪 辉来, 包 仕廷, 陈 明, 伊 新, 魏 洪吉. 组织细胞间黏附分子-1在阻塞性黄疸小肠黏膜损伤中的作用及丹参防治机制的研究. 中华实验外科杂志. 2003;20:130-131. |
| 30. | Tian XF, Yao JH, Li YH, Zhang XS, Feng BA, Yang CM, Zheng SS. Effect of nuclear factor kappa B on intercellular adhesion molecule-1 expression and neutrophil infiltration in lung injury induced by intestinal ischemia/reperfusion in rats. World J Gastroenterol. 2006;12:388-392. [PubMed] |