修回日期: 2014-12-15
接受日期: 2014-12-25
在线出版日期: 2015-03-08
目的: 观察白花丹水煎液对四氯化碳(carbon tetrachloride, CCl4)诱导肝纤维化大鼠的干预作用.
方法: 采用CCl4花生油溶液皮下注射诱导SD大鼠肝纤维化造模, 随机分成6组, 分别为空白对照组, 模型对照组, 秋水仙碱阳性对照组(0.25 mg/kg), 白花丹水煎液高、中、低剂量组(8、4、2 g/kg). 用紫外-乳酸脱氢酶法及紫外-苹果酸脱氢酶法分别测定血清谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)的含量, 用钒酸盐氧化法测定血清总胆红素(total bilirubin, TBIL)、直接胆红素(direct bilirubin, DBIL)、间接胆红素(indirect bilirubin, IBIL)的含量; 用放射免疫法观察血清透明质酸(hyaluronic acid, HA)、层黏蛋白(laminin, LN)、Ⅲ型前胶原(procollagen type Ⅲ, P3NP)、Ⅳ型胶原(type Ⅳ collagen, CⅣ)的含量. HE染色法检测肝组织纤维化程度. 用免疫组织化学法染色观察肝组织Ⅰ型和Ⅲ型胶原蛋白、α-肌动蛋白(α-smooth muscle actin, α-SMA)的表达.
结果: 与模型组比较, 白花丹水煎液能显著降低血清ALT、AST、TBIL、DBIL及IBIL含量, 同时也能显著降低血清HA、P3NP、LN、CⅣ的含量; HE染色病理结果显示白花丹水煎液能显著减轻大鼠肝纤维化程度; 免疫组织化学结果显示白花丹水煎液能明显降低大鼠肝脏内Ⅰ型、Ⅲ型胶原蛋白和α-SMA的含量.
结论: 白花丹水煎液具有很好的抗肝纤维化作用, 其机制可能与改善肝功能, 抑制肝细胞变性坏死、促进肝细胞再生以及抑制胶原合成与沉积, 减少细胞外基质(extracellular matrix, ECM)的沉积和促进ECM的降解有关.
核心提示: 白花丹水煎液具有很好的抗肝纤维化作用, 其机制与改善肝功能, 抑制肝细胞变性坏死、促进肝细胞再生以及抑制胶原合成与沉积, 减少细胞外基质(extracellular matrix, ECM)的沉积和促进ECM的降解有关.
引文著录: 段雪琳, 韦燕飞, 廖丹, 彭岳, 刘雪梅, 赵铁建. 白花丹水煎液对四氯化碳诱导肝纤维化大鼠的干预作用. 世界华人消化杂志 2015; 23(7): 1059-1067
Revised: December 15, 2014
Accepted: December 25, 2014
Published online: March 8, 2015
AIM: To investigate the intervention effects of Plumbago zeylanica L. decoction (PZL) on carbon tetrachloride (CCl4)-induced hepatic fibrosis in rats.
METHODS: A model of hepatic fibrosis was established by subcutaneous injection of 40% CCl4 in rats. SD rats were randomly divided into five groups (10 rats in each group): a model group, a positive control group (colchicines 0.25 mg/kg), high-, medium- and low-dose PZL groups. A blank control group was also established. The levels of alanine aminotransferase (ALT) and aspartate aminotransferase (AST) were tested using a ultraviolet-visible pectrophotometer (UV). Serum levels of total bilirubin (TBIL), direct bilirubin (DBIL) and indirect bilirubin (IBIL) were detected by the method of vanadate oxidation. The contents of hyaluronic acid (HA), laminin (LN), procollagen type Ⅲ (P3NP), and type Ⅳ collagen (CⅣ) were detected by radioimmunoassay. HE staining was used to examine the degree of hepatic fibrosis, and the expression of collagen type Ⅰ and Ⅲ and α-SMA in hepatic tissues was detected by immunohistochemistry.
RESULTS: Compared with the model group, the levels of ALT, AST, TBIL, DBIL and IBIL were significantly decreased in the PZL groups. PZL could also significantly reduce the contents of HA, LN, P3NP, and CⅣ. HE staining showed that PZL could significantly reduce the degree of hepatic fibrosis. Immunohistochemistry showed that the expression of collagen type Ⅰ and Ⅲ and α-SMA in hepatic tissues was decreased by PZL (P < 0.05 or P < 0.01), and the effect was dose-dependent.
CONCLUSION: PZL has a protective effect against CCl4-induced liver fibrosis in rats possibly by improving the liver function, inhibiting liver cell degeneration and necrosis, reducing secretion of collagen by hepatic stellate cells and promoting extracellular matrix degradation.
- Citation: Duan XL, Wei YF, Liao D, Peng Y, Liu XM, Zhao TJ. Interventional effects of Plumbago zeylanica L. decoction on CCl4-induced hepatic fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2015; 23(7): 1059-1067
- URL: https://www.wjgnet.com/1009-3079/full/v23/i7/1059.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i7.1059
肝纤维化是指由各种致病因子所致肝内结缔组织异常增生, 导致肝内弥漫性细胞外基质(extracellular matrix, ECM)过度沉淀的病理过程, 是多种慢性肝病发展的共同病理基础, 进一步恶化将会演变为肝硬化、肝癌等, 其发生发展的机制目前尚未完全明确, 因此研究和寻找各种有效途径阻止肝纤维化的发生发展进而防治肝硬化和肝癌具有重要的临床意义[1].
目前研究[2,3]证实肝纤维化发生的中心环节肝星状细胞(hepatic stellate cells, HSC)增生和激活, 激活后的HSC进一步转化为肌成纤维细胞, 后者可大量合成ECM蛋白, 而ECM的大量沉积最终导致了肝纤维化形成. 肝纤维化产生的共同的机制包括坏死、凋亡、可溶性生长因子、转录因子及其信号转导途径在调节HSC行为和促纤维化形成的反应中均发挥着重要作用[4]. 近年来, 有证据[5,6]表明还存在其他不同的ECM生成细胞, 他们都有独特的肝内定位、免疫组织化学和电镜下的表型, 如门静脉区的成纤维细胞和肌成纤维细胞, 位于血管的平滑肌细胞和中央静脉周围的肌成纤维细胞等, 这些细胞在肝纤维化的发生机制中也起了重要作用[7]. 可见肝纤维化的发展是一个有多种细胞因子、多种细胞信号传导通路参与的复杂的全身性病理过程.
我国中草药资源丰富, 在治疗肝纤维化方面具有特色和优势, 白花丹(Plumbago zeylanica L.)具有祛风、散瘀、解毒等功效, 用于治疗肝炎、肝硬化和跌打扭伤等, 本课题组前期实验表明白花丹对化学性肝损害的动物模型有一定的保护作用[8], 具有抑制四氯化碳(carbon tetrachloride, CCl4)所致慢性肝损伤小鼠的肝组织脂质过氧化的作用[9], 体外实验证实白花丹含药血清可以抑制HSC-T6增殖, 诱导其凋亡[10]. 本实验通过CCl4诱导大鼠建立肝纤维化模型, 检测大鼠肝功能、肝纤维化指标以及肝组织Ⅰ型和Ⅲ型胶原蛋白、α-肌动蛋白(α-smooth muscle actin, α-SMA)的表达, 为阐明白花丹抗肝纤维化的机制提供实验依据.
白花丹全草, 购自广西中医药大学国医药店, 经鉴定为白花丹科植物白花丹(Plumbago zeylanica L.); 秋水仙碱, 西双版纳药业有限公司产品, 批号: 090205; CCl4, 广东汕头达濠精细化学品公司生产, 批号: 20090513; 谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST), 总胆红素(total bilirubin, TBIL)、直接胆红素(direct bilirubin, DBIL)、间接胆红素(indirect bilirubin, IBIL)剂盒, 上海科华东菱诊断用品有限公司产品, 批号: 20100318; 透明质酸(hyaluronic acid, HA)、层黏连蛋白(laminin, LN)、Ⅲ型前胶原(procollagen type Ⅲ, P3NP)、Ⅳ型胶原(type Ⅳ collagen, CⅣ)放射免疫分析药盒, 北京北方生物技术研究所产品, 批号: 100320; 胶原Ⅰ第一抗体(CollagenⅠ, Ab-2), 美国Santa Cruz公司生产, 批号: 20090315; 胶原Ⅲ第一抗体(Collagen Ⅲ), 武汉博士德生物工程有限公司生产, 批号: 20090505; α-SMA, 福建迈新生物工程有限公司生产, 批号: 20090323. Sprague Dawley(SD)大鼠, SPF级, 雄雌各半, 体质量150-180 g, 2月龄. 由广西中医学院动物实验中心繁殖生产(实验动物使用许可证: SYXK桂2003-0001). BeckmanSJ-21型冷冻离心机, 北京光明医疗仪器厂; 7180型全自动生化分析仪, 日本日立公司; SN-697型全自动双探头放射免疫γ计数器, 上海核所日环光电仪器有限公司; Cx31-12L02型生物显微镜, 日本Olympus公司; AG135型精密电子天平仪, 瑞士Nikon公司; Z-7803型全自动组织包埋机, 上海跃进医疗器械厂.
1.2.1 动物模型复制及分组给药: SD大鼠, 雄雌各半, 随机分为正常对照组和肝纤维化模型组, 正常对照组皮下注射生理盐水, 余下皮下注射40 g/L CCl4花生油溶液造模, 用量0.3 mL/100 g, 首剂加倍, 2次/wk, 连续4 wk. 4 wk后, 随机抽取大鼠进行肝组织病理学检查, 证实肝纤维化模型已经建立成功. 将造模成功的SD大鼠50只随机分为5组, 即: 模型对照组, 秋水仙碱阳性对照组(0.25 mg/kg), 白花丹水煎液高、中、低剂量组(8、4、2 g/kg). 另外设正常对照组10只, 实验期间各组动物标准饲料, 在同样条件下饲养, 空腹灌胃给药1次/d, 连续灌胃给药5 wk, 空白组和模型组给予等剂量的生理盐水. 末次给药后, 禁食不禁水, 24 h后戊巴比妥钠麻醉, 腹主动脉采血, 分离得血清, 并迅速取出肝组织放入液氮中迅速冷冻后, 转移放置于-80 ℃超低温冰箱保存, 用于相关指标检测.
1.2.2 肝功能指标的测定: 在日立7180全自动生化分析仪(波长340 nm), 分别用紫外-乳酸脱氢酶法及紫外-苹果酸脱氢酶法, 严格按照使用说明书要求, 测定血清ALT、AST的含量. 采用钒酸盐氧化法, 测定TBIL及DBIL含量. 并计算间接胆红素. IBIL含量 = TBIL含量-DBIL含量.
1.2.3 肝纤维化指标的测定: 在SN-697全自动双探头放射免疫γ计数器上, 采用放射免疫法测定各组血清HA、LN、P3NP、CⅣ的含量.
1.2.4 肝组织病理学检查: 处死大鼠后迅速取肝组织, 取距离肝门2 cm处肝组织0.5 cm×1.0 cm大小, 用4%多聚甲醛溶液中固定, 常规脱水, 石蜡包埋, 经石蜡包埋后切片, HE染色, 光镜下观察肝组织纤维化程度.
1.2.5 免疫组织化学方法检测肝组织Ⅰ型和Ⅲ型胶原蛋白、α-SMA的表达: 采用SABC法严格按试剂盒说明书依次操作, 用PBS代替一抗作为阴性对照. 采用Motic Med 6.0 CMIAS彩色图像分析软件, 以细胞浆染成棕黄色细胞为阳性, 选取阳性部位明显的区域采图, 通过显微摄像系统测定其平均光密度值, 计算阳性面积百分比(%).
统计学处理 应用SPSS19.0软件进行统计学处理, 计量资料均采用mean±SD表示, 多组均数比较采用方差分析, 组间差异的显著性采用t检验. 计数资料采用秩和检验, α = 0.05为显著性检验水准. P<0.05为差异具有统计学意义.
与空白组比较, 模型组ALT、AST、TBIL、DBIL、IBIL的含量显著升高(P<0.01), 与模型组比较, 白花丹水煎液各剂量组均能显著降低大鼠血清ALT、AST、TBIL、DBIL、IBIL的含量(P<0.05), 表明白花丹可以通过抑制肝细胞变性坏死、促进肝细胞再生来逆转肝纤维化过程(表1).
| 分组 | ALT(U/L) | AST(U/L) | TBIL(mol/L) | DBIL(mol/L) | IBIL(mol/L) |
| 空白组 | 43.36±6.82 | 150.05±12.41 | 2.56±1.42 | 1.02±0.72 | 1.54±0.60 |
| 模型组 | 116.25±9.62d | 416.07±18.67d | 9.78±1.42d | 4.27±0.76d | 5.26±1.56d |
| 阳性组 | 67.83±18.27a | 215.06±16.82a | 5.07±1.37a | 2.38±1.48a | 2.77±1.14a |
| 白花丹水煎液(g/kg) | |||||
| 8 | 45.68±10.55a | 154.39±20.06a | 2.86±0.81a | 1.51±0.77a | 1.44±0.91a |
| 4 | 56.14±18.11a | 181.57±21.53a | 4.34±1.54a | 2.51±1.71a | 2.92±1.02a |
| 2 | 78.46±15.74a | 257.67±10.87a | 5.09±0.92a | 2.54±1.41a | 2.67±0.71a |
结果显示模型组大鼠血清HA、P3NP、LN、CⅣ的含量显著高于空白组(P<0.01), 与模型组比较, 白花丹水煎液各剂量组均能显著降低大鼠血清HA、P3NP、LN、CⅣ的含量, 差异有统计学意义(P<0.05或P<0.01). 表明白花丹水煎液能通过降低HSC细胞的胶原蛋白分泌功能、促进ECM降解等途径逆转肝纤维化过程(表2).
| 分组 | HA | P3NP | LN | CⅣ |
| 空白组 | 50.17±16.25 | 5.67±2.01 | 18.41±1.63 | 8.59±1.68 |
| 模型组 | 310.05±24.52d | 39.17±0.98d | 92.68±3.57d | 51.68±3.82d |
| 阳性组 | 125.19±5.13b | 12.11±1.61b | 29.98±4.11b | 16.27±1.81b |
| 白花丹水煎液(g/kg) | ||||
| 8 | 54.61±12.39b | 5.12±1.04b | 16.97±2.26b | 7.65±1.51b |
| 4 | 105.21±14.61b | 9.83±0.88b | 28.41±1.75b | 14.16±1.68b |
| 2 | 138.77±16.25a | 13.14±1.81a | 32.92±1.63a | 17.12±3.76a |
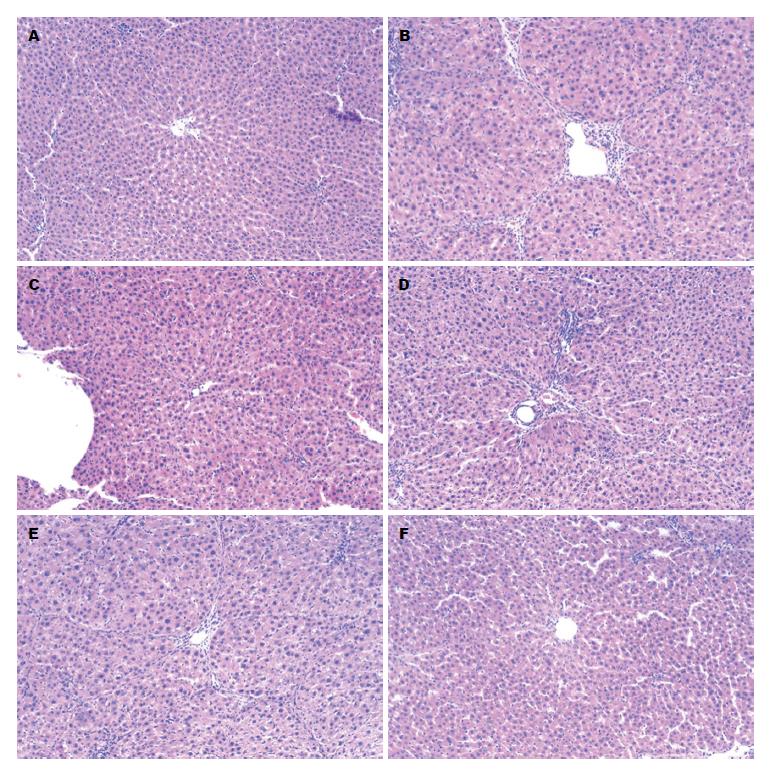
空白组大鼠肝组织肝小叶与汇管区结构正常, 肝细胞呈索状排列, 无明显肝细胞坏死, 无间质扩增, 纤维主要分布于汇管区和中央静脉周围. 模型组肝小叶正常结构严重破坏, 肝索排列紊乱, 可见肝细胞点状坏死, 有少量炎性细胞浸润, 肝细胞空泡变性散在分布, 间质增生明显, 纤维间隔形成明显, 其界板破坏严重, 分割、包绕肝小叶, 有半数以上样本形成较完整的假小叶. 使用白花丹干预后, 肝小叶结构明显改善, 肝小叶多呈放射状分布, 纤维间隔较少, 肝细胞坏死、炎性细胞浸润少见, 汇管区结缔组织增生不明显, 仅少数低浓度组样本有不完全性假小叶(图1).
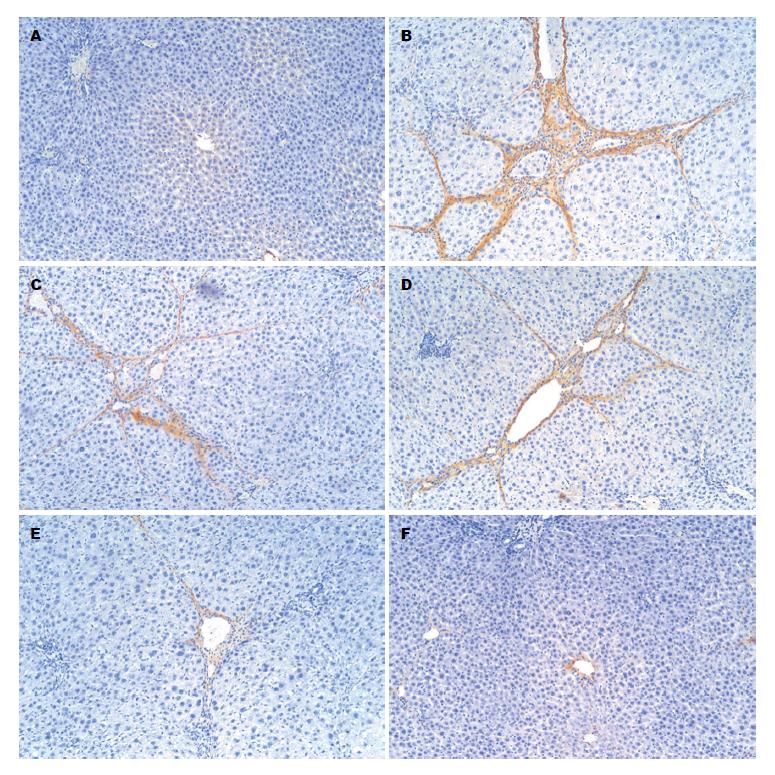
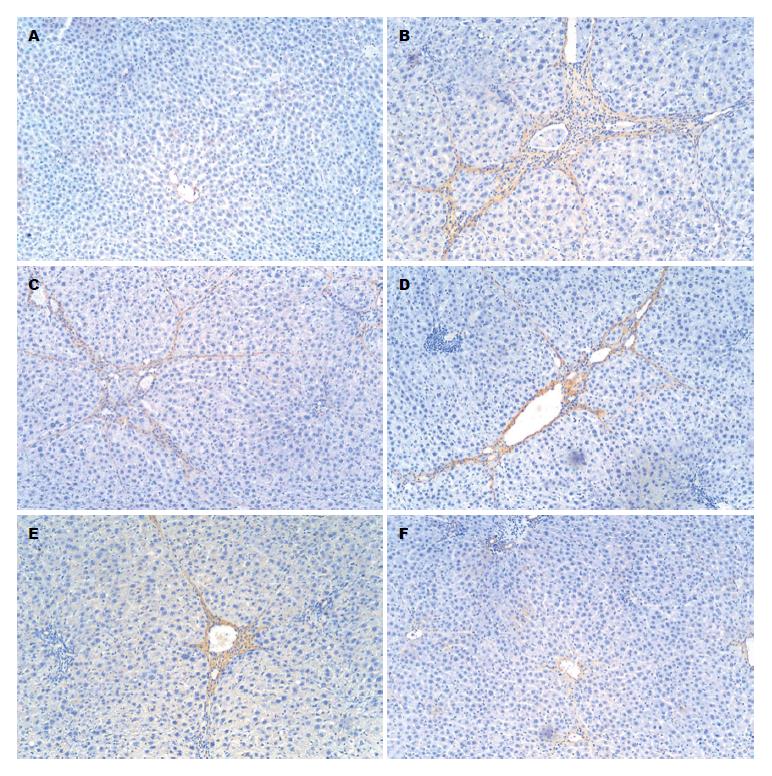
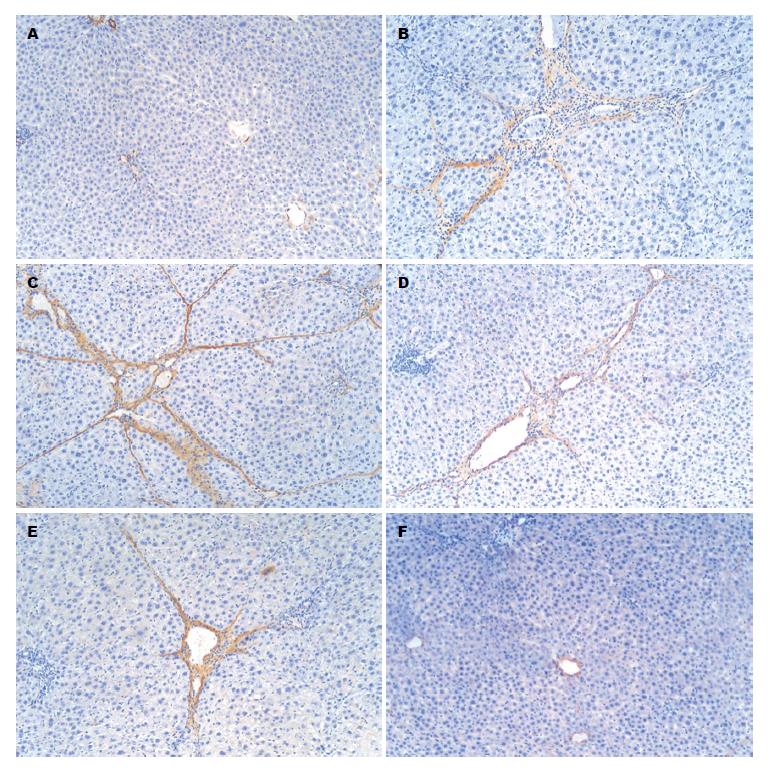
免疫组织化学结果表明, 模型组大鼠肝组织Ⅰ型和Ⅲ型胶原蛋白、α-SMA表达呈强阳性, 与空白组比较差异有统计学意义(P<0.01). 与模型组比较, 白花丹水煎液各剂量组肝组织Ⅰ型和Ⅲ型胶原蛋白、α-SMA表达水平显著下降, 差异有统计学意义(P<0.05或P<0.01)(表3, 图2-4).
肝纤维化, 是指肝脏受到炎症等损伤因素的持续刺激肝细胞发生坏死, 肝脏中胶原蛋白等ECM的增生与降解失去平衡, 导致肝脏内纤维结缔组织异常沉积的病理过程[11]. 目前, 其形成的机制普遍认为是由于某些致病因子(如病毒、酒精、胆汁淤积、血吸虫、Wilson病、亲肝毒性物质、脂肪肝及心衰等)引起肝枯否氏细胞的激活, 进而分泌多种细胞因子, 并与血小板、肝窦内皮细胞和肝细胞等分泌多种细胞因子共同作用于HSC, 使其激活, 转化为肌成纤维细胞(myofibroblast, MFB), 并通过旁分泌与自分泌作用方式, 使HSC增殖, 随之合成产生大量的ECM, 最终导致其在肝内大量沉积, 逐渐形成肝纤维化[12-14].
化学损伤模型是最为常用的肝纤维化动物模型, 而CCl4是最常用、最可靠的诱导动物形成化学损伤肝纤维化模型的药物. 该药诱导的模型具有方法简便、易操作、模型稳定、容易重复等优点[15,16]. CCl4腹腔注射后, 可以直接进入肝细胞, 破坏肝细胞膜及其结构, 使肝细胞变性坏死[17]. CCl4也是诱导大鼠肝纤维化模型的最经典和最广泛的应用的肝毒性物质[18], 经肝细胞细胞色素P450依赖性混合功能氧化酶的代谢, 生成活性的三氯甲基自由基及氯甲基自由基, 启动脂质过氧化作用, 导致肝细胞损伤、变性、坏死. 长期反复刺激可以诱导肝纤维化形成. CCl4诱导的肝纤维化动物模型在形态学、生物化学、细胞和分子改变等方面与人肝纤维化相似[19]. 故本实验选择CCl4成功复制了肝纤维化的动物造模.
目前肝纤维化的血清标志物主要有HA、LN、CⅣ、P3NP[20,21]. HA是一种广泛存在于细胞外基质中的高分子多糖, 肝纤维化时HSC合成HA增加, 而肝内皮细胞对HA降解能力下降, 导致血清中HA水平明显增高, 其增高程度与肝组织炎症和纤维化程度呈正相关, 可作为抗肝纤维化药物治疗动态观察指标[22]. LN是一种糖蛋白, 主要存在于基底膜, 反映基底膜的更新率. 星状细胞可大量分泌LN和CⅣ, 随着肝纤维化进展而合成增加, 血清中LN明显增高. CⅣ在肝内合成和代谢, 在肝纤维化发展过程中, 肝组织CⅣ过量合成, 出现肝窦毛细血管化, 使血液中CⅣ异常增加, 可能是最早增生的纤维, CⅣ被认为是反映胶原蛋白生成出现最早的重要指标[23]. LN及CⅣ是血管胆管基底膜骨架的主要胶原成分, 肝窦内无明显沉着. PCⅢ反映肝内Ⅲ型胶原的合成情况, 其血清含量与肝纤维化程度一致, 并与血清T-球蛋白水平明显相关. 所以测定HA、LN、CⅣ、P3NP的含量是观察白花丹提取物对肝纤维化治疗的直接指标.
在肝纤维化时, ECM的量和质均发生显著变化, 以Ⅰ型胶原和Ⅲ型胶原为主的ECM成分可较正常肝脏增加3-8倍[24,25]. 另外, 肝脏在受损时, HSC被激活转化为肌成纤维样细胞(myofibroblast-like cells, MFBLC)后, 可发生大量增殖并表达平滑肌α-SMA, 该蛋白具有收缩功能, 成为肝纤维化形成的另一重要因素. 所以测定Ⅰ型胶原和Ⅲ型胶原、α-SMA的表达水平是观察白花丹提取物对肝纤维化治疗的最直接指标[26,27].
白花丹来源于蓝雪科蓝雪属, 主要分布于我国西南省份, 是广西特产的药用植物[28]. 性味: 辛苦涩、温有毒. 功能: 祛风、散瘀、解毒. 广西壮医称其为"巅邦"(dien bang)或"裸端"(godon), 民间用于散疮, 消肿, 通经活络, 治疗蛇伤, 风湿乳腺炎以及慢性气管炎等症[29]. 现代药理学研究[10,30]表明, 白花丹具有治疗肝炎、肝硬化和跌打扭伤的功效, 对肝癌细胞生长呈现明显抑制作用; 本实验研究发现, 能显著降低大鼠血清ALT、AST、TBIL、DBIL及IBIL的含量, 提示其具有很好的保肝作用, 可能与抑制肝细胞变性坏死、促进肝细胞再生来逆转肝纤维化过程有关. 同时白花丹水煎液也能显著降低大鼠血清HA、P3NP、LN、CⅣ的含量, 降低大鼠肝脏内Ⅰ型、Ⅲ型胶原蛋白和α-SMA的含量, 表明其抗肝纤维化的作用可能与抑制胶原合成与沉积, 减少ECM的沉积和促进ECM的降解有关.
肝纤维化发生过程中, 肝脏中胶原蛋白等细胞外基质(extracellular matrix, ECM)增生与降解失去平衡, 以Ⅰ型胶原和Ⅲ型胶原最为显著. 另外, 肝星状细胞(hepatic stellate cells, HSC)被激活转化为肌成纤维样细胞后, 可发生大量增殖并表达平滑肌α-肌动蛋白, 该蛋白成为肝纤维化形成的另一重要因素.
牛英才, 研究员, 齐齐哈尔医学院医药科学研究所
白花丹具有祛风、散瘀、解毒等功效, 用于治疗肝炎、肝硬化和跌打扭伤等, 研究表明白花丹对化学性肝损害的动物模型有一定的保护作用, 具有抑制四氯化碳(carbon tetrachloride, CCl4)所致慢性肝损伤小鼠的肝组织脂质过氧化的作用, 然而白花丹抑制肝细胞变性坏死、促进肝细胞再生以及抑制胶原合成与沉积, 减少ECM的沉积和促进ECM的降解是亟需解决的问题.
李荣华等通过体外实验证实白花丹能抑制大鼠HSC增殖、促进活化的HSC-LX2凋亡. Srinivas等研究表明其能明显抑制ME-180细胞增殖, 诱导子宫癌细胞凋亡.
白花丹能否通过抑制肝细胞变性坏死、促进肝细胞再生以及抑制胶原合成与沉积, 减少ECM的沉积和促进ECM的降解目前未见报道, 而本文通过CCl4诱导大鼠建立肝纤维化模型, 探讨了白花丹抗肝纤维化的作用机制.
本文从改善肝功能, 抑制肝细胞变性坏死、促进肝细胞再生以及抑制胶原合成与沉积, 减少ECM的沉积和促进ECM的降解等方面阐明了白花丹的抗肝纤维化的作用及机制, 为防治肝纤维化提供了参考.
细胞外基质: 是由动物细胞合成并分泌到胞外、分布在细胞表面或细胞之间的大分子, 主要是一些多糖和蛋白, 或蛋白聚糖.
本文研究设计合理, 方法正确, 结果可信, 具有一定的创新性和学术价值, 为开发利用白花丹治疗肝纤维化作出理论和实验依据.
编辑: 郭鹏 电编: 都珍珍
| 3. | 杨 新疆, 齐 翠花, 郑 勇, 曹 玉文, 李 睿, 宋 丽秀, 赵 强, 陈 卫刚. SB203580对肝纤维化大鼠肝脏Ⅰ、Ⅲ型胶原蛋白表达的影响. 世界华人消化杂志. 2014;22:310-318. [DOI] |
| 9. | 赵 铁建, 钟 振国, 方 卓, 付 杰军, 覃 玉智, 段 雪琳, 廖 丹. 白花丹水煎液对四氯化碳慢性肝损伤小鼠肝组织脂质过氧化的影响. 广西医科大学学报. 2006;23:725-726. |
| 10. | 李 荣华, 彭 岳, 赵 铁建, 韦 燕飞, 谢 海源, 廖 丹, 方 卓, 刘 雪梅. 白花丹对大鼠肝星状细胞增殖、凋亡及细胞周期的影响. 世界华人消化杂志. 2009;17:1171-1177. [DOI] |
| 11. | Perez Aguilar RC, Honoré SM, Genta SB, Sánchez SS. Hepatic fibrogenesis and transforming growth factor/Smad signaling activation in rats chronically exposed to low doses of lead. J Appl Toxicol. 2014;34:1320-1331. [PubMed] [DOI] |
| 12. | Hintermann E, Ehser J, Bayer M, Pfeilschifter JM, Christen U. Mechanism of autoimmune hepatic fibrogenesis induced by an adenovirus encoding the human liver autoantigen cytochrome P450 2D6. J Autoimmun. 2013;44:49-60. [PubMed] [DOI] |
| 13. | Parsons CJ, Takashima M, Rippe RA. Molecular mechanisms of hepatic fibrogenesis. J Gastroenterol Hepatol. 2007;22 Suppl 1:S79-S84. [PubMed] [DOI] |
| 14. | Friedman SL. Stellate cells: a moving target in hepatic fibrogenesis. Hepatology. 2004;40:1041-1043. [PubMed] [DOI] |
| 16. | 黄 小丽, 郭 晓云, 姜 海行, 覃 山羽, 罗 薇, 马 诗家, 卢 东红, 陈 梅, 王 家旭, 杨 显文. Th17及Th1细胞在四氯化碳致肝纤维化小鼠模型中的表达及关系. 世界华人消化杂志. 2014;22:1826-1833. [DOI] |
| 18. | Lee HS, Huang GT, Chen CH, Chiou LL, Lee CC, Yang PM, Chen DS, Sheu JC. Less reversal of liver fibrosis after prolonged carbon tetrachloride injection. Hepatogastroenterology. 2001;48:1312-1315. [PubMed] |
| 19. | Constandinou C, Henderson N, Iredale JP. Modeling liver fibrosis in rodents. Methods Mol Med. 2005;117:237-250. [PubMed] [DOI] |
| 21. | Sebastiani G, Castera L, Halfon P, Pol S, Mangia A, Di Marco V, Pirisi M, Voiculescu M, Bourliere M, Alberti A. The impact of liver disease aetiology and the stages of hepatic fibrosis on the performance of non-invasive fibrosis biomarkers: an international study of 2411 cases. Aliment Pharmacol Ther. 2011;34:1202-1216. [PubMed] [DOI] |
| 22. | Qu W, Huang H, Li K, Qin C. Danshensu-mediated protective effect against hepatic fibrosis induced by carbon tetrachloride in rats. Pathol Biol (Paris). 2014;62:348-353. [PubMed] [DOI] |
| 24. | Lu J, Chen B, Li S, Sun Q. Tryptase inhibitor APC 366 prevents hepatic fibrosis by inhibiting collagen synthesis induced by tryptase/protease-activated receptor 2 interactions in hepatic stellate cells. Int Immunopharmacol. 2014;20:352-357. [PubMed] [DOI] |
| 30. | 徐 东伟, 刘 同祥, 东 珍, 路 畅. 民族药白花丹化学成分及抗肿瘤作用的研究进展. 中央民族大学学报(自然科学版). 2014;23:63-66. |