修回日期: 2015-01-09
接受日期: 2015-01-16
在线出版日期: 2015-02-28
目的: 通过对胃腺癌患者的腹腔灌洗液检测多巴脱羧酶(dopa decarboxylase, DDC)mRNA表达, 评估DDC成为预测胃腺癌腹膜微转移的新指标的可能性.
方法: 收集南昌大学第二附属医院胃肠外科87例胃腺癌患者的腹腔灌洗液, 应用实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, QRT-PCR)方法相对定量检测并比较DDC mRNA的表达. 12例非癌症患者腹腔灌洗液作为阴性对照.
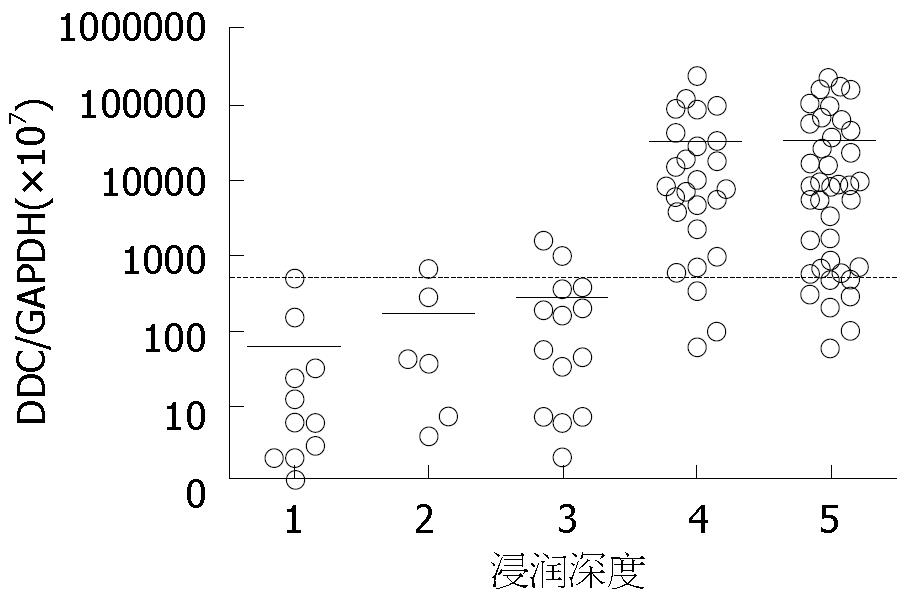
结果: 87例胃腺癌患者中, T1有6例, T2有14例, T3有28例, T4有39例, DDC mRNA的表达在不同T分级(浸润深度分级)DDC mRNA的相对表达值(×107)分别为: T1, 168±21; T2, 283±87; T3, 31162±4261; T4, 35310±6593. 非癌症组腹腔灌洗液中, DDC mRNA相对表达值(×107)为: 60.28±19.00. 此外, DDC的表达还与组织分化程度、病理分化类型、是否有淋巴结转移等有关系. 胃腺癌腹腔灌洗液应用常规腹腔细胞学检查(conventional intraperitoneal cytology, CY)检查, 11例阳性(CY+), 阳性率为13%(11/87). 11例(CY+)中有9例DDC mRNA表达相对值结果高于临界值, 归类于DDC+, DDC的敏感性为86%(9/11), 此外, 在10例T1患者和14例T2患者中DDC+为2例, 且非癌症组中均未见DDC+, DDC的特异性为92%(22/24). 表明腹腔灌洗液中DDC在胃腺癌不同浸润深度下差异性表达(P<0.05), 具有较好的敏感性和特异性.
结论: 应用QRT-PCR技术可以有效检测腹腔灌洗液中DDC mRNA表达, DDC可能成为预测胃癌腹膜转移的可靠指标.
核心提示: 本文针对胃腺癌患者的腹腔灌洗液检测多巴脱羧酶(dopa decarboxylase, DDC), 以评估DDC是否可预测胃腺癌腹膜微转移. 结果发现有腹膜转移的患者其腹腔灌洗液中DDC mRNA表达显著增高, 并且与胃癌分化程度、病理分化类型、是否有淋巴结转移等有关系. 灵敏性远远高于腹腔冲洗液中细胞学检查.
引文著录: 韩曲, 邓子清, 辛林, 曹家庆, 胡小云, 毛盛勋. 胃腺癌腹腔灌洗液多巴脱羧酶的表达分析和临床应用. 世界华人消化杂志 2015; 23(6): 959-963
Revised: January 9, 2015
Accepted: January 16, 2015
Published online: February 28, 2015
AIM: To detect the mRNA expression of dopa decarboxylase (DDC) in intraperitoneal lavage fluid from patients with gastric adenocarcinoma, and to evaluate the possibility of using DDC expression in intraperitoneal lavage fluid as a new predictor of peritoneal micrometastasis of gastric adenocarcinoma.
METHODS: Intraperitoneal lavage fluid samples were collected from 87 patients with gastric adenocarcinoma treated in the Second Affiliated Hospital of Nanchang University. Quantitative real-time polymerase chain reaction (QRT-PCR) was used to detect the DDC mRNA expression in intraperitoneal lavage fluid. Intraperitoneal lavage fluid samples from 12 non-cancer patients were used as negative controls.
RESULTS: In the 87 patients with gastric adenocarcinoma, the number of patients with T1, T2, T3 and T4 stage disease was 6, 14, 28 and 39, respectively. The relative expression levels (×107) of DDC mRNA in different T stages (invasion grade) were: T1, 168 ± 21; T2, 283 ± 87; T3, 31162 ± 4261; T4, 35310 ± 6593; and 60.28 ± 19.00 in non-cancer group. The expression of DDC was also correlated with the degree of tumor differentiation, pathological type and lymph node metastasis. Conventional intraperitoneal cytology (CY) revealed positive results (CY+) in 11 patients, and the positive rate was 13% (11/87). In 9 of 11 CY+ cases, the DDC mRNA expression was higher than the critical value (classified as DDC+), and the sensitivity of DDC detection was 86% (9/11). In addition, only two DDC+ cases were found in the 10 patients with T1 and 14 with T2 disease, and no DDC+ result was observed in the non-cancer group. The DDC specificity was 92% (22/24). Differential expression of DDC in intraperitoneal lavage fluid was noted in gastric adenocarcinoma with different depth of invasion (P < 0.05).
CONCLUSION: QRT-PCR can effectively detect DDC mRNA expression in intraperitoneal lavage fluid, which may become a new reliable predictor of peritoneal metastasis of gastric adenocarcinoma.
- Citation: Han Q, Deng ZQ, Xin L, Cao JQ, Hu XY, Mao SX. Clinical significance of dopa decarboxylase expression in gastric peritoneal lavage in patients with gastric adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(6): 959-963
- URL: https://www.wjgnet.com/1009-3079/full/v23/i6/959.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i6.959
胃癌的发病率虽然在过去的几十年里有所下降, 但是仍然是全世界癌症死亡的第二大原因[1]. 早期胃癌无特异性临床症状, 容易忽视, 我国大多数胃癌患者就医时已届进展期[2]. 腹膜播散转移是胃癌复发的常见形式之一, 预后较差, 目前转移机制仍不明确, 治疗也没有统一的标准. 实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, QRT-PCR)技术[3]是指在PCR反应体系中加入荧光标记的探针或引物, 通过检测累积的荧光信号实时监测整个反应过程, 并根据标准曲线对待测模板进行定量分析. 我们用此技术检测胃癌的腹腔灌洗液, 可以敏感地分析出胃癌腹膜微转移基因, 发现有多种基因在胃癌的腹腔灌洗液中出现高表达[4]. 研究[5]认为, 多巴脱羧酶(dopa decarboxylase, DDC)广泛参与细胞的增殖、凋亡和血管生成, 与癌症的发生发展联系密切. DDC在神经母细胞瘤、小细胞肺癌表达升高, 其mRNA表达水平已经可以作为生物标志物的微小残留病变的检测[6], 但是在胃癌腹膜转移的研究甚少, 本实验检测胃腺癌腹腔灌洗液DDC mRNA的表达情况, 旨在评估DDC成为预测胃腺癌腹膜微转移的新指标的可能性.
选取2012-09/2013-06南昌大学第二附属医院胃肠外科87例行腹腔镜胃癌根治术的胃腺癌患者为实验组, 术前收集腹腔灌洗液, 应用QRT-PCR方法定量检测DDC mRNA的表达. 选取12例非癌症腹腔镜手术患者为阴性对照组. 以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)作为内参照. 为了标准化各样品中的RNA的量, 本文以DDC mRNA表达量与内参GAPDH mRNA表达量的比值(DDC的表达相对值)进行比较分析, 并规定以非癌症组中此比值的上限为临界值, 实验组中高于此值称作DDC+. RNA提取试剂盒(北京全式金生物技术有限公司), 反转录试剂盒(北京普洛麦格生物技术有限公司).
1.2.1 腹腔灌洗液的收集和总RNA提取与逆转录: 经腹腔镜探查后, 用一次性吸氧管沿戳卡孔注入生理盐水150 mL至腹腔, 轻轻搅动后吸出, 如已有腹水者直接吸出, 混血者弃用. 收集腹腔灌洗液约100 mL, 以1800 r/min离心10 min, 取沉渣细胞做脱落细胞学检查. 用RNA提取试剂盒TRIzol法提取细胞总RNA. 用反转录试剂盒将总RNA逆转录成cDNA第一链.
1.2.2 引物序列和QRT-PCR: 以下述DDC、GAPDH引物进行PCR扩增. 引物及标准品的制备均由Takara宝生物工程(大连)有限公司完成. DDC上游引物序列: 5'-TCTGACAGAGCCCAGACACCA-3'; 下游引物序列: 5'-CGTCCCTCAATGCCTTCCA-3'; 扩增片段为257 bp. 用GAPDH作为内参, GAPDH上游引物序列: 5'-GTTGGAGGTCGGAGTCAACGG-3'; 下游引物序列: 5'-GAGGGATCTCGCTCCTGGAGGA-3'; 扩增片段长度: 240 bp. 实时荧光定量核酸扩增荧光检测仪购自美国MJ Reserarch公司, 按上述引物序列扩增各分子指标, ABI Prism 7300型实时定量系统分析各基因表达情况.
统计学处理 实验数据应用软件IBM SPSS20.0分析, 采用t检验、方差分析对数据结果进行分析. P<0.05为差异有统计学意义.
为了标准化各样品中的RNA的量, 本文以DDC mRNA表达量与内参GAPDH mRNA表达量的比值(DDC的表达相对值)进行比较分析, 并规定以非癌症组中此比值的上限为临界值, 实验组中高于此值称作DDC+. 87例胃腺癌患者腹腔灌洗液中, 25例DDC+, 表达阳性率为29%(25/87). 不同浸润深度下, DDC的表达相对值是不同的, 不同T分级(浸润深度分级)DDC mRNA表达相对值(×107)分别为(图1): T1, 168±21; T2, 283±87; T3, 31162±4261; T4, 35310±6593. 而非癌症组腹腔灌洗液中, DDC mRNA表达相对值(×107)为: 60.28±19. 进一步将是否侵犯浆膜层分为浆膜阴性组(T1, T2)和浆膜阳性组(T3, T4), 组间差异有统计学意义(P<0.05), DDC的表达相对值与是否侵犯浆膜层有关, 即说明DDC的表达相对值与浸润深度有关.
在非癌症组与胃腺癌组腹腔灌洗液中均可检测到DDC mRNA的表达, 且后者明显高于前者(P<0.05). 我们将DDC mRNA表达相对值与相关病理特征因素比较后发现(表1): DDC的表达相对值与组织分化程度有关, 组织分化程度越低, DDC的表达相对值越高. 此外, DDC mRNA表达相对值还与淋巴转移情况相关, 而与肿瘤的生长方式、浆膜类型无明显关系(P<0.05).
| 变量 | DDC mRNA | P值 | |
| 阳性 | 阴性 | ||
| 性别 | 0.733237 | ||
| 男 | 18 | 43 | |
| 女 | 7 | 19 | |
| 分化程度 | 0.002314 | ||
| 高分化 | 8 | 31 | |
| 低分化 | 17 | 31 | |
| 浸润深度 | 0.007332 | ||
| T1, T2 | 3 | 31 | |
| T3, T4 | 22 | 41 | |
| 淋巴结转移 | 0.037622 | ||
| 阴性 | 2 | 17 | |
| 阳性 | 23 | 45 | |
11例脱落细胞学检查呈阳性(CY+). 11例(CY+)中有9例DDC表达相对值结果高于临界值, 归类于DDC+, DDC的敏感性为86%(9/11), 此外, 在10例T1和14例T2患者中DDC-为22例, 且非癌症组中均未见DDC+, DDC的特异性为92%(22/24). 因此, DDC在胃腺癌腹腔灌洗液的表达中具有很好的敏感性与特异性(表2).
| 浸润深度 | n | DDC QRT-PCR阳性 | 脱落细胞学 |
| 原发性肿瘤 | |||
| T1 | 6 | 0(0) | 0(0) |
| T2 | 14 | 2(14) | 1(7) |
| T3 | 28 | 9(32) | 4(14) |
| T4 | 39 | 14(36) | 6(15) |
| 总计 | 87 | 25(29) | 11(13) |
| 非癌症 | 12 | 0(0) | 0(0) |
腹腔转移是胃癌患者复发的常见因素之一. RT-PCR技术可以在短时间内使产物扩增百万倍, 敏感地检测特定组织如外周血、骨髓、淋巴结、脑脊液、腹腔灌洗液中mRNA的表达, 已经成为检查微转移的标准之一[7]. 常见的分子标记有癌胚抗原(carcino-embryonic antigen, CEA)、甲胎蛋白、角蛋白19等, Yonemura等[8]通过使用CY和基质金属蛋白酶(matrix metalloproteinase-7, MMP-7)的mRNA的RT-PCR方法的组合增加了检测的灵敏度到62%. 目前常用的用于腹腔灌洗液检测标记是CEA, 但是CEA不是所有间皮细胞都会表达, 假阴性率较高, 因而找到一种更加敏感的标志物显得尤为重要.
DDC又称色氨酸脱羧酶, 是氨基酸脱羧酶的一种, 可通过催化L-3,4-二羟基苯丙氨酸和L-5-羟色氨酸脱羧合成具有重要生理活性的神经递质多巴胺和5-羟色胺[9]; 同时还可催化部分芳香氨基酸脱羧生成对应的生物胺, 广泛参与细胞的增殖、凋亡和血管生成[10]. 见于一些组织和器官, 如肾上腺、肾脏、肝脏和胰腺, 还见于中枢和外周神经系统中的胺能细胞. DDC在一些神经内分泌性质的肿瘤如小细胞肺癌、前列腺癌、嗜铬细胞瘤中高表达, 在低分化的腺癌中表达尤为明显. 但近年研究认为, DDC在一些肿瘤如非小细胞肺癌、结直肠癌中也有高表达. 在神经母细胞瘤中, DDC mRNA表达水平已经可以作为生物标志物的微小残留病变的检测. 研究[11-14]结果表明, 生物胺与真核细胞的L-氨基酸脱羧酶联系密切, 可能参与重要的细胞功能合成过程. 例如, 鸟氨酸脱羧酶涉及聚胺, 他们是细胞增殖的重要调节剂, 在肿瘤发生的生物合成中发挥关键作用. 此外, 神经递质组胺, 由L-组氨酸脱羧酶产生, 参与生理过程, 如胃酸分泌、过敏反应、炎症、平滑肌收缩和细胞增殖. 但是, 组胺在癌和肿瘤发展的潜在意义尚不明确[15]. 儿茶酚胺和五羟色胺也参与重要的细胞生物过程, 因此DDC广泛地参与癌症的发展[10,16].
20例未浸润浆膜(T1、T2期)的患者脱落细胞学检查阳性为1例, 用QRT-PCR检测DDC+为2例, 67例浸润浆膜(T3、T4期)的患者运用脱落细胞学检查10阳性, 而用QRT-PCR方法检测DDC+达23例, 表明运用QRT-PCR技术检测可以提高阳性率, 侵犯浆膜组与未侵犯浆膜组的DDC表达差异有统计学意义(P<0.05), 表明DDC的表达与浸润程度有关系. 此外, DDC的表达还与细胞分化、局部淋巴转移和腹膜转移有关系. 本文结果显示, 腹腔冲洗液的DDC应用QRT-PCR检测有着较高的特异性和敏感性, DDC的敏感性为86%(9/11), 特异性为92%(22/24). 相对于CEA, 这种方法可能成为预测胃癌患者腹膜转移的可靠指标, 但是还需更多的实验和大规模, 长期的随访研究验证.
总之, 应用QRT-PCR技术可以有效检测腹腔灌洗液中DDC mRVA表达, 腹腔灌洗液DDC可能成为预测胃癌腹膜转移的可靠指标. DDC虽然在胃癌腹膜播散的过度表达, 但DDC在这种传播中的作用目前还不清楚, 因此仍需进一步循证医学的验证.
应用实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, QRT-PCR)技术可以敏感地检测出胃腺癌腹腔灌洗液中的转移细胞, 本文选取多巴脱羧酶(dopa decarboxylase, DDC)作为检测的目的基因, 探讨DDC成为预测胃腺癌腹膜微转移的新指标的可能性.
赵青川, 教授, 主任医师, 西京医院消化外科
经过简便的方法检测和评估微转移的状态, 从而采取不同的处理措施, 使患者能得到最好的治疗案.
既往微转移的检测主要倾向于腹腔脱落细胞的检测, 但是阳性率低, 结果不能充分反应实际情况.
本文应用QRT-PCR技术, 探索性检测DDC基因, 探索其用于胃腺癌腹膜微转移的新指标的可能性.
腹腔脏器的癌肿细胞转移给患者的预后造成了极大的危害, 应用QRT-PCR技术可以有效地增加检测的灵敏度, 可以大幅提高临床的检出率.
本文语言流畅, 结果对临床诊治具有重要意义.
编辑: 韦元涛 电编: 闫晋利
| 1. | Nagini S. Carcinoma of the stomach: A review of epidemiology, pathogenesis, molecular genetics and chemoprevention. World J Gastrointest Oncol. 2012;4:156-169. [PubMed] [DOI] |
| 3. | Jensen EC. Real-time reverse transcription polymerase chain reaction to measure mRNA: use, limitations, and presentation of results. Anat Rec (Hoboken). 2012;295:1-3. [PubMed] [DOI] |
| 4. | Sakakura C, Hagiwara A, Nakanishi M, Shimomura K, Takagi T, Yasuoka R, Fujita Y, Abe T, Ichikawa Y, Takahashi S. Differential gene expression profiles of gastric cancer cells established from primary tumour and malignant ascites. Br J Cancer. 2002;87:1153-1161. [PubMed] [DOI] |
| 5. | Gazdar AF, Helman LJ, Israel MA, Russell EK, Linnoila RI, Mulshine JL, Schuller HM, Park JG. Expression of neuroendocrine cell markers L-dopa decarboxylase, chromogranin A, and dense core granules in human tumors of endocrine and nonendocrine origin. Cancer Res. 1988;48:4078-4082. [PubMed] |
| 7. | Mori M, Mimori K, Ueo H, Tsuji K, Shiraishi T, Barnard GF, Sugimachi K, Akiyoshi T. Clinical significance of molecular detection of carcinoma cells in lymph nodes and peripheral blood by reverse transcription-polymerase chain reaction in patients with gastrointestinal or breast carcinomas. J Clin Oncol. 1998;16:128-132. [PubMed] |
| 8. | Yonemura Y, Fujimura T, Ninomiya I, Kim BS, Bandou E, Sawa T, Kinoshita K, Endo Y, Sugiyama K, Sasaki T. Prediction of peritoneal micrometastasis by peritoneal lavaged cytology and reverse transcriptase-polymerase chain reaction for matrix metalloproteinase-7 mRNA. Clin Cancer Res. 2001;7:1647-1653. [PubMed] |
| 9. | Florou D, Scorilas A, Vassilacopoulou D, Fragoulis EG. DDC (DOPA decarboxylase (aromatic L-amino acid decarboxylase). Atlas Genet Cytogenet Oncol Haematol. 2011;15:942-950. |
| 10. | Berry MD, Juorio AV, Li XM, Boulton AA. Aromatic L-amino acid decarboxylase: a neglected and misunderstood enzyme. Neurochem Res. 1996;21:1075-1087. [PubMed] [DOI] |
| 11. | Chakroborty D, Sarkar C, Basu B, Dasgupta PS, Basu S. Catecholamines regulate tumor angiogenesis. Cancer Res. 2009;69:3727-3730. [PubMed] [DOI] |
| 12. | Rubí B, Maechler P. Minireview: new roles for peripheral dopamine on metabolic control and tumor growth: let's seek the balance. Endocrinology. 2010;151:5570-5581. [PubMed] [DOI] |
| 13. | Ganguly S, Basu B, Shome S, Jadhav T, Roy S, Majumdar J, Dasgupta PS, Basu S. Dopamine, by acting through its D2 receptor, inhibits insulin-like growth factor-I (IGF-I)-induced gastric cancer cell proliferation via up-regulation of Krüppel-like factor 4 through down-regulation of IGF-IR and AKT phosphorylation. Am J Pathol. 2010;177:2701-2707. [PubMed] [DOI] |
| 14. | He Q, Yuan LB. Dopamine inhibits proliferation, induces differentiation and apoptosis of K562 leukaemia cells. Chin Med J (Engl). 2007;120:970-974. [PubMed] |
| 15. | Medina MA, Quesada AR, Núñez de Castro I, Sánchez-Jiménez F. Histamine, polyamines, and cancer. Biochem Pharmacol. 1999;57:1341-1344. [PubMed] [DOI] |
| 16. | Lang PA, Kempe DS, Akel A, Klarl BA, Eisele K, Podolski M, Hermle T, Niemoeller OM, Attanasio P, Huber SM. Inhibition of erythrocyte "apoptosis" by catecholamines. Naunyn Schmiedebergs Arch Pharmacol. 2005;372:228-235. [PubMed] [DOI] |