修回日期: 2014-12-05
接受日期: 2014-12-25
在线出版日期: 2015-02-28
目的: 研究蛋白酶体抑制剂硼替佐米(bortezomib, Bor)对大鼠肝纤维化动物模型肝纤维化肝细胞损害的保护作用, 并探讨其保护机制.
方法: 将30只SD大鼠随机分为正常饮食组(normal diet group, ND组)、肝纤维化对照组(liver fibrosis group, LF组)和Bortezomib干预组(bortezomib group, Bor组), 每组处死大鼠后收集肝脏标本, 分别进行HE和Masson染色了解肝纤维化水平、p65免疫组织化学染色检测核因子κB(nuclear factor-kappa B, NF-κB)活性、实时定量PCR检测转化生长因子β1(transforming growth factor β1, TGF-β1) mRNA水平、Western blot检测TGF-β1蛋白表达.
结果: HE和Masson染色发现Bor组的肝纤维化水平较LF组低; Bor组的NF-κB p65亚基阳性染色率(4.72±1.20)明显低于LF组(9.05±1.33)(P<0.05); 实时定量PCR显示 Bor组TGF-β1 mRNA相对表达量(0.96±0.23)明显低于LF组(1.64±0.26)(P<0.05); Western blot检测结果显示Bor组(1.34±0.06)明显低于LF组(1.72±0.14)(P<0.05).
结论: Bor可以通过下调TGF-β1表达、降低核因子NF-κB的活性, 减少肝细胞凋亡的发生, 减轻肝纤维化程度, 从而降低肝纤维化造成的肝细胞损害程度.
核心提示: 肝星状细胞的活化是肝纤维化发生的中心环节, 针对肝星状细胞活化和增殖的信号通路及细胞因子都可能有效抑制肝纤维化的发生发展. 转化生长因子β1(transforming growth factor β1)可促使肝细胞凋亡, 抑制肝细胞再生及影响肝功能; 核因子κB(nuclear factor-kappa B, NF-κB)在肝脏的急性以及慢性损伤过程起着重要的介导作用. 硼替佐米(bortezomib, Bor)是一类新型的蛋白酶体抑制剂, 其通过抑制NF-κB抑制蛋白(inhibitor of κB, IκB)的降解, 阻止NF-κB的活化. 因此, 对于Bor在肝纤维化中的作用, 是一个极为值得期待的试验研究.
引文著录: 潘雯, 陈旭平, 苏松, 陶中桦. 硼替佐米对大鼠肝纤维化动物模型NF-κB和TGF-β1表达的调控. 世界华人消化杂志 2015; 23(6): 894-900
Revised: December 5, 2014
Accepted: December 25, 2014
Published online: February 28, 2015
AIM: To assess the protective effect of the proteasome inhibitor bortezomib on liver fibrosis in rats and to explore the possible mechanism.
METHODS: Thirty SD rats were randomized into three groups: a normal diet group (ND group), a liver fibrosis group (LF group) and a bortezomib group (Bor group). After treatment, the rats in each group were sacrificed. Hepatic fibrosis was assessed by HE and Masson trichrome staining. The expression of nuclear factor-kappa B (NF-κB) p65 was assessed by immunohistochemistry. Real-time PCR was employed to detect the transforming growth factor β1 (TGF-β1) mRNA level in liver samples. The expression of TGF-β1 protein was determined by Western blot analysis.
RESULTS: The hepatic fibrosis level in the Bor group was significantly lower than that in the LF group as revealed by HE and Masson staining. The positive rate of NF-κB p65 subunit was significantly lower in the Bor group than in the LF group (4.72 vs 9.05, P < 0.05). The expression of TGF-β1 mRNA was significantly lower in the Bor group than in the LF group (0.96 vs 1.64, P < 0.05). The expression of TGF-β1 protein was also significantly lower in the Bor group than in the LF group (1.34 vs 1.72, P < 0.05).
CONCLUSION: These findings suggest that bortezomib reduces hepatocyte injury in rats with hepatic fibrosis possibly by suppression of NF-κB activation and TGF-β1 expression.
- Citation: Pan W, Chen XP, Su S, Tao ZH. Bortezomib regulates NF-κB and TGF-β1 expression in hepatic fibrosis in a rat model. Shijie Huaren Xiaohua Zazhi 2015; 23(6): 894-900
- URL: https://www.wjgnet.com/1009-3079/full/v23/i6/894.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i6.894
肝纤维化(liver fibrosis)是多种慢性肝病进展至肝硬化的中间过程, 对肝纤维化进行早期诊断、早期治疗, 预防肝硬化的发生、发展, 对肝病患者的生命质量具有重要的意义. 核因子κB(nuclear factor-kappa B, NF-κB)的激活是诱导肝纤维化的重要因素, 而转化生长因子β受体(transforming growth factor β receptor, TGF-βR)Ⅱ可以通过诱导核因子κB抑制蛋白(inhibitor of κB, IκB)的表达来抑制NF-κB的活性[1,2]. 硼替佐米(bortezomib, Bor)是一类新型的蛋白酶体抑制剂, 可以通过抑制IκB泛素化来阻止NF-κB的活化[3], 因此Bor在肝纤维化中的作用, 是一个极为值得期待的试验研究.
健康♂SD大鼠, 购自泸州医学院动物实验中心, 体质量180-200 g, 10-16 wk; Bor由德国杜伊斯堡-埃森大学赠送; Masson三色染色液购自广州威佳科技有限公司; 兔抗大鼠NF-κB p65多克隆抗体购自美国Bioworld公司;羊抗兔二抗及DAB显色剂购自美国DAKO公司; TRIzol RNA分离试剂试剂购自Invitrogen 公司; Real-time PCR MasterMix(SYBR Green)购自Bio-Rad公司.
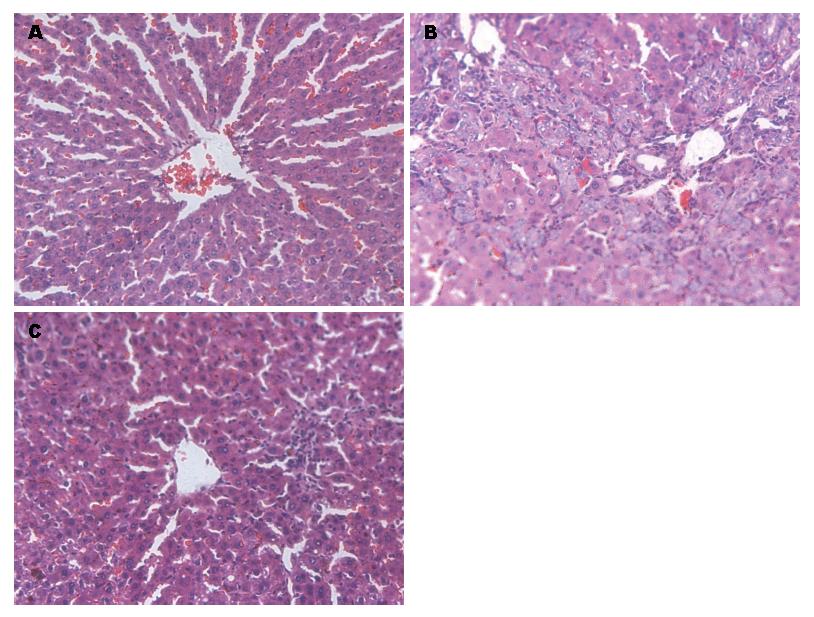
1.2.1 动物模型建立与分组: 将大鼠随机分成3组, 即正常饮食组(normal diet group, ND组)、肝纤维化对照组(liver fibrosis group, LF组)和Bor干预组(Bor组). ND组给予正常饮食, LF组参照刘东璞等[4]报道的方法, 采用CCl4复合法建立大鼠肝纤维化模型, 即采用高脂低蛋白食物(以玉米面为饲料, 加0.5%胆固醇, 实验第1、2周加20%猪油), 300 mL/L乙醇为唯一饮料, 皮下注射CCl4(第1次用0.5 mL/100 g体质量, 以后每隔3 d皮下注射40%油剂CCl4 0.3 mL/100 g体质量), 实验第4周形成肝纤维化. Bor组在大鼠肝纤维化模型建立后4、8、12、16 d经腹腔分别注射Bor 1 mg/kg(NS稀释). 每组处死大鼠后收集肝脏标本甲行醛固定保存或-80 ℃冷冻保存, 进行病理学观察和其他实验室检测.
1.2.2 肝脏病理学观察: 所取肝组织标本用40 g/L甲醛固定. 光镜检查的组织块用石蜡包埋, HE染色观察肝脏病理学改变. Masson染色观察肝脏纤维化改变, 利用MIAS医学图像分析软件分析并计算胶原纤维占视野总面积的百分比, 了解肝纤维化程度.
1.2.3 NF-κB p65蛋白测定: 采用免疫组织化学链霉菌抗生物素蛋白-过氧化物酶(SP)连接法检测. 操作按照试剂盒说明书进行. 根据胞核染色程度和核染色细胞百分率进行综合评分[5]. 染色强度: 无染色0分, 低度染色(黄色) 1分, 中度染色(棕黄色) 2分, 强染色(棕褐色) 3分; 核染色细胞占计数细胞百分率: ≤5%为0分, 5.1%-25.0%为1分, 25.1%-50.0%为2分, >50%为3分. 将每张切片两项得分相乘为其最后得分: <1分计为"-", 1-3分计为"+", 4-6分计为"++", 7-9分计为"+++".
1.2.4 采用Real-time PCR测定各组TGF-β1 mRNA表达: 将待测组肝组织匀浆后, 按TRIzol说明书抽提总RNA, 取5 μg RNA逆转录合成cDNA, 进行Real-time PCR. 将逆转录产物用于PCR扩增, 反应条件: 95 ℃预变性3 min, 95 ℃变性10 s, 60 ℃退火30 s, 循环40次. 在Bio-Rad CFX 96TM荧光定量PCR分析系统上进行, 熔解曲线自动生成, 每个样本行3次Real-time PCR, 以β-actin为内参照, 目的基因相对含量以2-△△Ct表示. TGF-β1引物: 上游5'-GAAAGCCCTGTATTCCGTCTCC-3', 下游为5'-GCAACAATTCCTGGCGTTACCT-3', 扩增片段长度为130 bp, β-actin引物: 上游5'-ACCACCATGTACCCAGGCAT-3', 下游5'-CCGGACTCATCGTACTCCTG-3', 扩增片段长度169 bp.
1.2.5 Western blot检测TGF-β1蛋白表达: 提取肝脏组织蛋白质样品, BCA法进行蛋白质定量. 每泳道10 μg蛋白, 8%十二烷基磺酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳分离后湿转至PVDF膜, 封闭, 加兔抗大鼠TGF-β1(1:100), 4 ℃孵育过夜, 洗膜. 加HRP标记的二抗IgG室温孵育1 h, ECL试剂发光, X线胶片曝光, 显影, 定影. 扫描测定条带光密度值, 以与GADPH的比值作为其表达强度.
统计学处理 实验数据以mean±SD表示, 用SPSS13.0统计软件分析, 两组间采用t检验, P<0.05为差异具有统计学意义.
2.1.1 HE染色观察肝脏纤维化改变: 光镜下ND组肝组织结构基本正常; LF组可见肝细胞空泡变性、灶状坏死, 汇管区有明显的炎性细胞浸润; Bor组肝组织结构损害明显改善(图1).
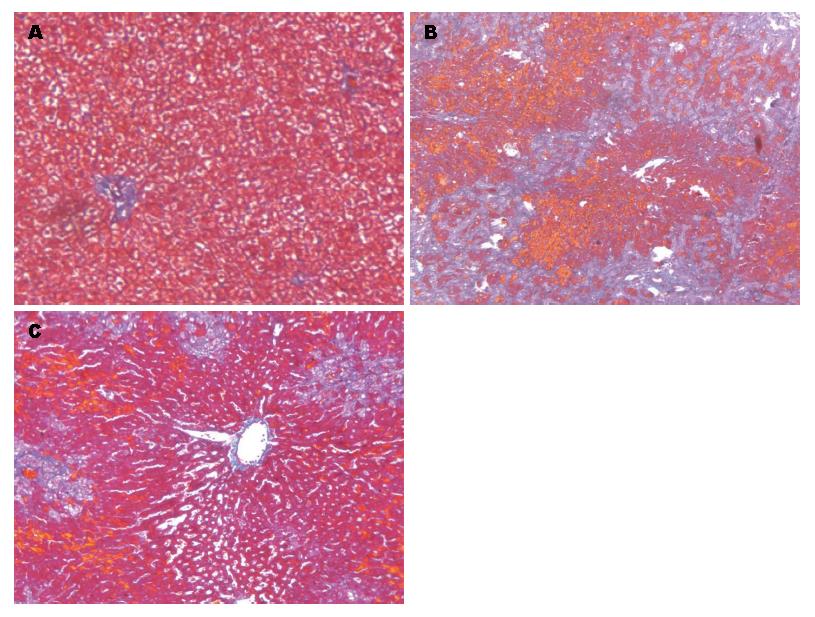
2.1.2 Masson染色观察肝脏纤维化改变: Masson染色较HE染色更易区别胶原纤维与肌纤维, 即胶原纤维成蓝色, 肌纤维呈红色, 且能更直观显示汇管区周边纤维架桥形成情况. 结果显示ND组肝小叶结构正常, 肝细胞索排列有序, 无明显胶原纤维增生. LF组(0.212±0.044)和Bor组(0.165±0.016)较ND组(0.008±0.002)比较, 胶原纤维占视野总面积的百分比均显著性升高(P<0.01); 而Bor的胶原纤维面密度明显低于LF组(P<0.05)(图2).
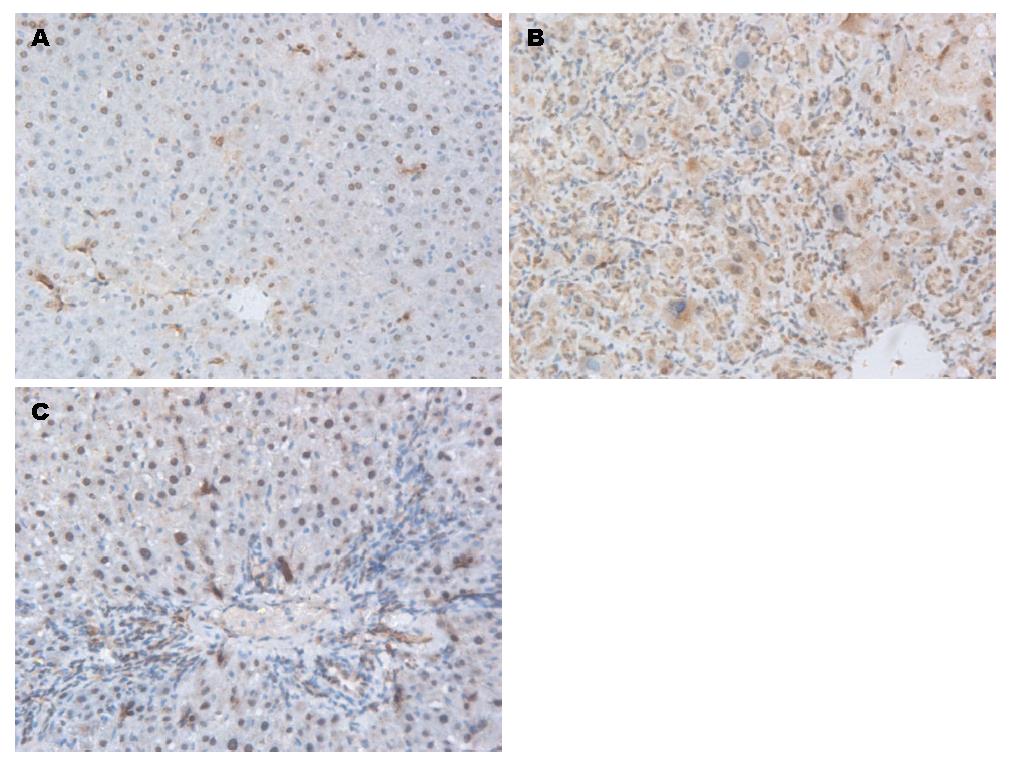
免疫组织化学检测NF-κB p65亚基表达结果显示ND组仅少量胞质内染色, 未见胞核染色. LF组(9.05±1.33)和Bor组(4.72±1.24)均可见成棕黄色的颗粒表达于细胞胞质和胞核内, 其平均染色率于ND组(0.98±0.82)比较, 均显著性升高(均P<0.01); 而Bor的NF-κB p65亚基阳性染色率明显低于LF组(P<0.05)(图3).
Real-time PCR结果显示TGF-β1 mRNA相对表达水平(2-△△Ct): LF组(1.64±0.26)和Bor组(0.96±0.23)表达均显著高于ND组(0.63±0.38)(均P<0.01); 而Bor组明显低于LF组(P<0.05).
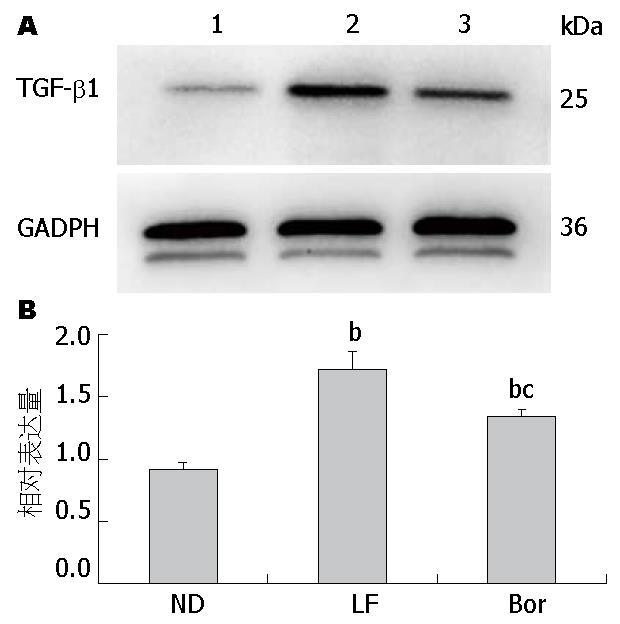
结果显示LF组(1.72±0.14)和Bor组(1.34±0.06)表达TGF-β1蛋白水平均显著高于ND组(1.03±0.08)(均P<0.01); 而Bor组明显低于LF组(P<0.05)(图4).
肝纤维化是肝脏受到多种理化因素作用, 引起肝细胞脂肪变、坏死及炎症等, 并且在坏死区发生胶原纤维, 纤维组织增生形成小的条索但尚未互相连接形成间隔而改建肝小叶结构时, 称为肝纤维化. 对多数慢性肝病患者都有不同程度的肝纤维化, 其中25%-40%可发展成肝硬化甚至肝癌而导致死亡, 通过有效的治疗是可以逆转已经形成的肝纤维化的[6]. 因此, 阻断肝纤维化已成为慢性肝病治疗中的关键问题. 目前临床上针对肝纤维化的治疗手段依然非常有限, 治疗效果不甚满意.
研究[7-15]表明, 肝星状细胞(hepatic stellate cells, HSCs)的活化是肝纤维化发生的中心环节, 针对肝星状细胞活化和增殖的信号通路及细胞因子都可能有效抑制肝纤维化的发生发展. HSCs的激活的早期启动以依赖旁分泌机制为主, 后期的持续还与激活HSCs的自身分泌TGF-β有关. TGF在肝纤维化发展过程中通过Ras/ERK和STATs途径激活Smads信号, 激活HSCs, 活化后的HSCs表达TGF-β受体[16]. Arias等[17]报道将TGF-β反义mRNA的腺病毒载体用于胆管结扎大鼠肝纤维化动物模型, 可在基因转录、翻译水平阻止Ⅰ型胶原mRNA的表达, 预防肝纤维化. TGF-β及其受体拮抗剂、TGF-β1中和抗体、可溶性TGF-βRⅡ型受体及针对TGF-β的RNAi等在动物实验中均可抑制肝星状细胞活化、降低肝脏胶原等细胞外基质含量、减轻肝纤维化程度, 其中TGF-βRⅡ可以通过诱导IκB的表达来抑制NF-κB的活性[18]. TGF-β1是已知最强的纤维化诱导因子[19], 在HSC激活并转化为成肌纤维细胞的过程中发挥重要作用, 可调节HSCs的活化及ECM蛋白的合成. 在CCl4诱导的肝纤维化模型中以及肝纤维化患者中, 都发现TGF-β1蛋白及mRNA的表达升高. 在慢性肝损伤时, 成肌纤维细胞中的TGF-β和血小板衍生生长因子(platelet derived growth factor, PDGF)能够传递pSmad2L/C和pSmad3L/C的促纤维化效应, 由于pSmad3L缺乏诱导Smad7活化的能力, 因此将导致成肌纤维细胞的纤维化病变, 并最终快速发展为肝纤维化[20-22]. 因此, 通过阻断TGF-β1信号通路, 可以达到预防和逆转肝纤维化的作用.
NF-κB是一类具有转录激活功能的蛋白质, 属于NF-κB/Rel蛋白家族, 结构中存在Rel蛋白间聚合及与IκB的结合位点[23]. Canbay等[1]和Nanji等[24]在大鼠酒精性肝损伤模型中发现, 急性肝损伤时伴随着NF-κB的活化, 其活化可通过NF-κB依赖性通路激活肝脏内的Kupffer细胞, 从而造成Fas、TNF-α、IL-1基因的表达上调, 导致肝细胞炎症, 诱发肝细胞凋亡, 造成肝功能损害. Nanji等[24]、Keto等[25]及Elsharkawy[26]等多个研究小组在包括Cs在内的不同慢性肝损伤模型中均发现NF-κB在肝纤维化组织中的高表达现象, 提示NF-κB有介导肝纤维化的作用. 通常情况下, NF-κB与其内源性抑制物IκB结合, 以复合体的形式存在于细胞质内, 并无生物活性; 受到各种损伤因素刺激时, 如细胞因子、脂多糖(lipopolysaccharide, LPS)、氧自由基等, IκB即被蛋白激酶磷酸化而被蛋白酶体降解, 从而释放NF-κB并进入细胞核与相应的靶基因相结合, 启动细胞因子、细胞黏附分子、NO合成酶(nitric oxide synthase, NOS)和环氧合成酶-2(cyclooxygenase-2, COX-2)等基因转录, 导致前列腺素、促炎细胞因子、氧自由基等炎性介质大量产生, 引发炎症反应[27-30]. 因此, 抑制蛋白酶体作用, 避免IκB的降解, 是阻断NF-κB激活、进而防止发生肝纤维化的有效手段.
Bor是一类新型的蛋白酶体抑制剂, 其通过抑制26S蛋白酶体的作用抑制IκB的降解, 使NF-κB仍旧隔离于细胞质中, 而不能与细胞核内的DNA结合产生转录作用. 目前研究表明, Bor可以通过稳定IκB来阻止肿瘤细胞中NF-κB的活化, 从而抑制肿瘤细胞的增殖. 该药物为美国食品药品监督管理局(Food and Drug Administration, FDA)批准的第一个已供临床应用的蛋白酶体抑制剂, 临床始用于治疗初治或复发性、难治性多发性骨髓瘤. 由于对蛋白酶体特异、强效的抑制作用, 该药物也同时在治疗造血组织恶性肿瘤、进展性实体瘤方面获得突破性进展[30]. Lee等[31]通过动物实验表明, 使用Bor可以有效减轻类风湿性关节炎的组织损害和胶原沉着, 这提示Bor也可以尝试用于治疗炎症性疾病. NF-κB、TGF-β1的活化最终可导致肝纤维化的发生, 通过本实验我们发现, Bor可降低核因子NF-κB的活性, 下调TGF-β1表达, 减少肝细胞凋亡的发生, 减轻肝纤维化程度, 为延缓肝纤维化的进程、防止肝硬化的发生发展提供了新的思路.
硼替佐米(bortezomib, Bor)是一类新型的蛋白酶体抑制剂; 转化生长因子β1(transforming growth factor β1, TGF-β1)是已知最强的纤维化诱导因子, 通过阻断TGF-β1信号通路, 可以达到预防和逆转肝纤维化的作用; 核因子κB(nuclear factor-kappa B, NF-κB)有介导肝纤维化的作用, 阻断NF-κB激活, 防止发生肝纤维化的有效手段. 硼替佐米对大鼠肝纤维化动物模型NF-κB-TGF-β1通路的影响, 是一个极为值得期待的试验研究.
董蕾, 教授, 博士生导师, 西安交通大学第二附属医院消化内科
Bor通过降低核因子NF-κB的活性, 下调TGF-β1的表达, 能减轻肝纤维化程度, 为制定肝纤维化的治疗方案提供了新的思路, 同时也为进一步拓宽该类药物的应用范围, 提供理论支持.
Nencioni等报道, 由于对蛋白酶体特异、强效的抑制作用, 该药物也同时在治疗造血组织恶性肿瘤、进展性实体瘤方面获得突破性进展. Lee等通过动物实验表明, 使用Bor可以有效减轻类风湿性关节炎的组织损害和胶原沉着, 这提示Bor也可以尝试用于治疗炎症性疾病.
本文通过分别检测正常饮食组、肝纤维化对照组和Bor组的NF-κB p65活性、TGF-β1 mRNA及TGF-β1蛋白表达水平, 了解Bor对大鼠肝纤维化动物模型NF-κB-TGF-β1通路的影响, 并探讨其机制.
Bor是美国食品药品监督管理局(Food and Drug Administration, FDA)批准的第一个已供临床应用的蛋白酶体抑制剂, 临床始用于治疗初治或复发性、难治性多发性骨髓瘤. 通过本实验研究, 为制定肝纤维化的治疗方案提供了新的思路, 同时也为进一步拓宽该类药物的应用范围, 提供理论支持.
课题综合设计较为科学、合理, 具有一定新意, 实验方法科学, 结果较为可信.
编辑: 郭鹏 电编: 闫晋利
| 1. | Canbay A, Guicciardi ME, Higuchi H, Feldstein A, Bronk SF, Rydzewski R, Taniai M, Gores GJ. Cathepsin B inactivation attenuates hepatic injury and fibrosis during cholestasis. J Clin Invest. 2003;112:152-159. [PubMed] [DOI] |
| 2. | Anan A, Baskin-Bey ES, Bronk SF, Werneburg NW, Shah VH, Gores GJ. Proteasome inhibition induces hepatic stellate cell apoptosis. Hepatology. 2006;43:335-344. [PubMed] [DOI] |
| 3. | Hideshima T, Chauhan D, Richardson P, Mitsiades C, Mitsiades N, Hayashi T, Munshi N, Dang L, Castro A, Palombella V. NF-kappa B as a therapeutic target in multiple myeloma. J Biol Chem. 2002;277:16639-16647. [PubMed] [DOI] |
| 8. | Rosenbloom J, Castro SV, Jimenez SA. Narrative review: fibrotic diseases: cellular and molecular mechanisms and novel therapies. Ann Intern Med. 2010;152:159-166. [PubMed] [DOI] |
| 13. | 郭 顺根, 戴 敏, 张 玮, 谢 艳爽. 肝纤维化发生发展与信号转导途径. 中国组织化学与细胞化学杂志. 2003;12:106-111. |
| 14. | 宋 仕玲, 龚 作炯, 张 全荣. TGF-β及Smad与肝纤维化. 国外医学•消化系疾病分册. 2003;23:206-209. |
| 15. | 李 定国, 陈 颖伟. 肝纤维化研究现状及展望. 上海第二医科大学学报. 2005;25:101-102. |
| 16. | Inagaki Y, Mamura M, Kanamaru Y, Greenwel P, Nemoto T, Takehara K, Ten Dijke P, Nakao A. Constitutive phosphorylation and nuclear localization of Smad3 are correlated with increased collagen gene transcription in activated hepatic stellate cells. J Cell Physiol. 2001;187:117-123. [PubMed] [DOI] |
| 17. | Arias M, Sauer-Lehnen S, Treptau J, Janoschek N, Theuerkauf I, Buettner R, Gressner AM, Weiskirchen R. Adenoviral expression of a transforming growth factor-beta1 antisense mRNA is effective in preventing liver fibrosis in bile-duct ligated rats. BMC Gastroenterol. 2003;3:29. [PubMed] [DOI] |
| 18. | Azuma M, Motegi K, Aota K, Yamashita T, Yoshida H, Sato M. TGF-beta1 inhibits NF-kappaB activity through induction of IkappaB-alpha expression in human salivary gland cells: a possible mechanism of growth suppression by TGF-beta1. Exp Cell Res. 1999;250:213-222. [PubMed] [DOI] |
| 20. | Yoshida K, Matsuzaki K. Differential Regulation of TGF-β/Smad Signaling in Hepatic Stellate Cells between Acute and Chronic Liver Injuries. Front Physiol. 2012;3:53. [PubMed] [DOI] |
| 23. | Hoffmann A, Levchenko A, Scott ML, Baltimore D. The IkappaB-NF-kappaB signaling module: temporal control and selective gene activation. Science. 2002;298:1241-1245. [PubMed] [DOI] |
| 24. | Nanji AA, Jokelainen K, Rahemtulla A, Miao L, Fogt F, Matsumoto H, Tahan SR, Su GL. Activation of nuclear factor kappa B and cytokine imbalance in experimental alcoholic liver disease in the rat. Hepatology. 1999;30:934-943. [PubMed] [DOI] |
| 25. | Kato J, Sato Y, Inui N, Nakano Y, Takimoto R, Takada K, Kobune M, Kuroiwa G, Miyake S, Kohgo Y. Ethanol induces transforming growth factor-alpha expression in hepatocytes, leading to stimulation of collagen synthesis by hepatic stellate cells. Alcohol Clin Exp Res. 2003;27:58S-63S. [PubMed] [DOI] |
| 26. | Elsharkawy AM, Mann DA. Nuclear factor-kappaB and the hepatic inflammation-fibrosis-cancer axis. Hepatology. 2007;46:590-597. [PubMed] [DOI] |
| 27. | Karin M, Lin A. NF-kappaB at the crossroads of life and death. Nat Immunol. 2002;3:221-227. [PubMed] [DOI] |
| 29. | 高 小玲. IKB激酶的进展. 国外医学•临床生物化学与检验学分册. 2004;25:539-541. |
| 30. | Nencioni A, Grünebach F, Patrone F, Ballestrero A, Brossart P. Proteasome inhibitors: antitumor effects and beyond. Leukemia. 2007;21:30-36. [PubMed] [DOI] |
| 31. | Lee SW, Kim JH, Park YB, Lee SK. Bortezomib attenuates murine collagen-induced arthritis. Ann Rheum Dis. 2009;68:1761-1767. [PubMed] [DOI] |