修回日期: 2014-12-17
接受日期: 2014-12-25
在线出版日期: 2015-02-28
目的: 采用荟萃分析的方法对Ⅰ型干扰素治疗溃疡性结肠炎(ulcerative colitis, UC)的有效性进行系统评价.
方法: 检索PubMed、EMBASE、CNKI中国期刊全文数据库、CBM中国生物医学文献数据库、万方数据库中所有关于Ⅰ型干扰素治疗UC的随机对照研究. 应用比值比(odds ratio, OR)及其95%CI为疗效分析统计量, 采用RevMan5.1进行荟萃分析, 比较干扰素与安慰剂治疗UC的有效缓解率及严重不良反应发生率.
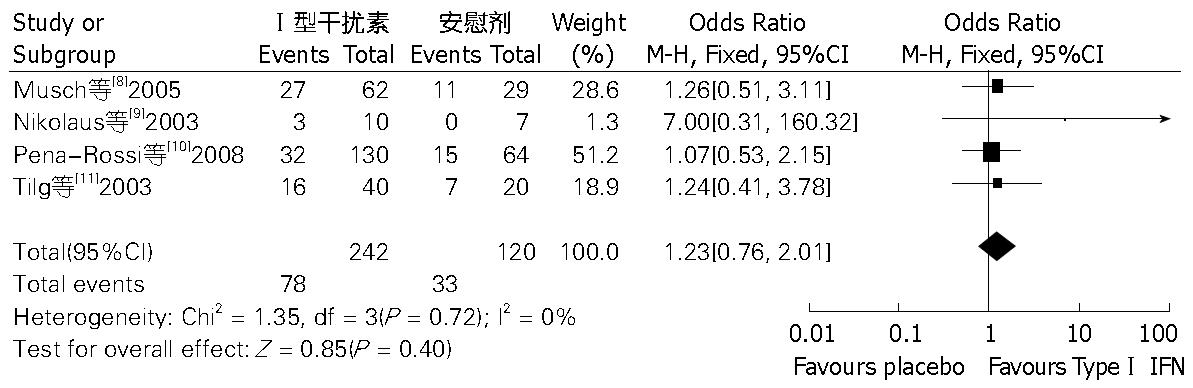
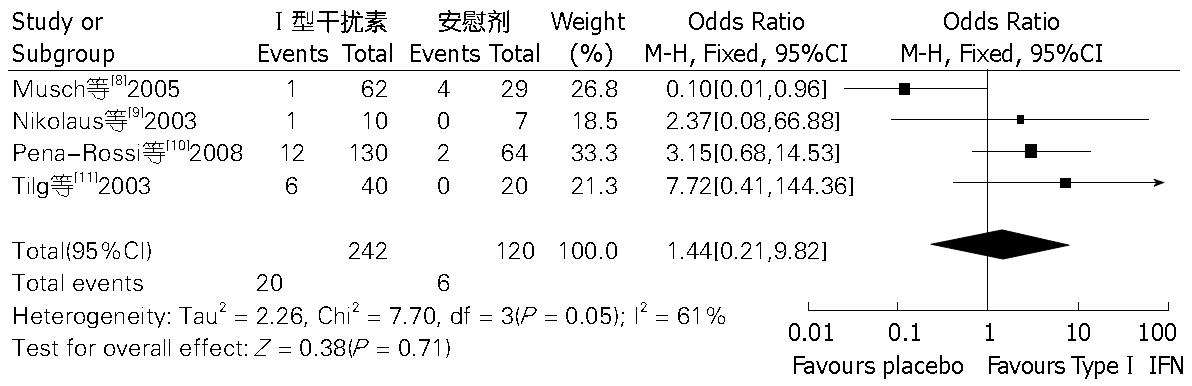
结果: 共4篇文献纳入荟萃分析. 结果显示, Ⅰ型干扰素治疗UC与安慰剂相比, 有效缓解率无明显差异(OR = 1.23, 95%CI: 0.76-2.01, P = 0.40), 严重不良反应发生率无明显差异(OR = 1.44, 95%CI: 0.21-9.82, P = 0.71).
结论: 应用Ⅰ型干扰素治疗UC患者, 其疗效不优于安慰剂.
核心提示: 本文通过荟萃分析的方法对Ⅰ型干扰素治疗溃疡性结肠炎(ulcerative colitis, UC)的有效性进行系统评价, 结果显示, Ⅰ型干扰素与安慰剂治疗UC在有效缓解率、严重不良反应发生率方面无明显差异. 因此可得知, Ⅰ型干扰素治疗UC患者, 其疗效不优于安慰剂.
引文著录: 李虎, 冯玉光, 张红梅, 张小茜, 仲华, 葛振宇. Ⅰ型干扰素治疗溃疡性结肠炎有效性的荟萃分析. 世界华人消化杂志 2015; 23(6): 1005-1010
Revised: December 17, 2014
Accepted: December 25, 2014
Published online: February 28, 2015
AIM: To assess the clinical effects of type I interferons in the treatment of patients with ulcerative colitis (UC).
METHODS: Randomized controlled trials investigating type I interferons for treatment of UC were identified by searching PubMed, EMBASE, CNKI, CBM, and WanFang Data. Odds ratio (OR) with 95% confidence interval (CI) was calculated using RevMan 5.1. Primary outcomes were remission rate and the incidence of serious adverse events.
RESULTS: Four studies met the inclusion criteria. The results showed that there was no significant difference between interferons and placebo in the remission rate or the incidence of serious adverse events (OR = 1.23, 95%CI: 0.76-2.01, P = 0.40; OR = 1.44, 95%CI: 0.21-9.82, P = 0.71).
CONCLUSION: Administration of type I interferons in patients with UC is not superior to placebo therapy.
- Citation: Li H, Feng YG, Zhang HM, Zhang XQ, Zhong H, Ge ZY. Meta-analysis of utility of type Ⅰ interferons in treatment of ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2015; 23(6): 1005-1010
- URL: https://www.wjgnet.com/1009-3079/full/v23/i6/1005.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i6.1005
溃疡性结肠炎(ulcerative colitis, UC)是一种病因及发病机制尚未完全明确的慢性炎症性肠道疾病, 病程迁延, 反复发作, 近年来发病率逐渐上升, 并有癌变趋势[1]. 许多患者因对传统治疗如水杨酸制剂、糖皮质激素和免疫抑制剂无反应而不得不接受手术治疗[2]. 干扰素(interferon, IFN)具有免疫调节、抗病毒和抗癌特性. 目前已被成功用来治疗一些慢性炎症疾病, 如多发性硬化[3,4]和慢性病毒性肝炎[5]. 在一些开放性研究中, 显示干扰素可以使UC患者获得临床缓解[6], 但在一部分随机对照研究中, 结论并不一致. 因此, 本文旨在通过荟萃分析方法, 系统评价Ⅰ型干扰素对UC治疗的有效性和不良反应情况, 以便指导临床用药.
检索PubMed、EMBASE、CNKI中国期刊全文数据库、CBM中国生物医学文献数据库、万方数据库, 截止日期为2014-09. 英文检索词为"ulcerative colitis"、"interferons"和"random controlled trial", 中文检索词为"溃疡性结肠炎"、"干扰素"和"随机对照试验". 筛选国内外有关干扰素对UC治疗疗效的随机对照试验, 并追溯参考文献进行全面检索. 两名研究者独立评阅, 根据纳入标准进行筛选, 若有异议咨询第3名研究者.
1.2.1 纳入标准: (1)研究设计为前瞻性或回顾性的随机对照试验, 语言限中文、英文; (2)试验组治疗措施为干扰素治疗; (3)UC患者年龄不受限制; (4)全文或摘要均纳入.
1.2.2 排除标准: (1)基础性研究、观察性研究; (2)综述或者系统评价; (3)无法获得全文且无法提取数据的研究; (4)研究药物非干扰素.
1.2.3 数据提取及质量评价: 根据预先绘制的表格, 对主要数据进行整理, 包括第一作者、发表年份、国家、试验设计、试验方法、纳入人数、疗程及试验质量. 由两名研究者独立提取, 如有异议向第3名研究者咨询后定论. 质量评价采用Jadad评分量表[7]进行评分,主要由随机分配方法、盲法和随访三部分组成, 总分为0-5分, 0-2分为低质量研究, 3-5分为高质量研究.
统计学处理 采用Cochrane协作网提供的RevMan5.1统计软件进行Meta分析. Ⅰ型干扰素治疗UC的有效性及不良反应发生率以比值比(odds ratio, OR)及其95%可信区间(confidence interval, CI)为效应指标. 用Chi-square检验评估各项研究间是否存在统计学异质性, I2检验评估异质性大小. 当I2>50%, 说明研究间存在显著异质性, 采用随机效应模型计算合并统计量; 反之, 采用固定效应模型计算结果. 并采用敏感性分析检验结果的稳定性, 采用倒漏斗图法评价发表偏倚.
通过计算机检索相关数据库, 严格按照纳入和排除标准, 最后共有5项随机对照试验符合入选要求而被采用. 其中4项研究[8-11]比较了Ⅰ型干扰素与安慰剂在UC治疗中有效性及不良反应情况, 1项[12]研究比较的是Ⅰ型干扰素与强的松灌肠剂在UC治疗中的区别. 荟萃分析基于以上4项针对Ⅰ型干扰素与安慰剂对照的研究, 各研究数据提取特征及质量评分如表1.
| 第一作者 | 发表年份 | 国家 | 试验设计 | 试验方法 | 试验例数 | 疗程(wk) | Jadad评分 |
| Musch等[8] | 2005 | 德国、捷克共和国 | 多中心RCT | 试验组1:3MIUIFN-β-1a, 皮下注射, 3次/wk | 32 | 8 | 4 |
| 试验组2:1MIUIFN-β-1a, 皮下注射, 3次/wk | 30 | 8 | |||||
| 对照组:安慰剂对照 | 29 | 8 | |||||
| Nikolaus等[9] | 2003 | 比利时、加拿大、德国 | 多中心RCT | 试验组:IFN-β-1a皮下注射, 3次/wk | 10 | 4-8 | 4 |
| 对照组:安慰剂对照 | 7 | 4-8 | |||||
| Pena-Rossi等[10] | 2008 | 欧洲多国家 | 多中心RCT | 试验组1:44gIFN-β-1a, 皮下注射, 3次/wk | 65 | 8 | 5 |
| 试验组2:66gIFN-β-1a, 皮下注射, 3次/wk | 65 | 8 | |||||
| 对照组:安慰剂对照 | 64 | 8 | |||||
| Tilg等[11] | 2003 | 奥地利、比利时、德国、法国 | 多中心RCT | 试验组1:Peg-IFN0.5mg/kg, 皮下注射, 1次/wk | 19 | 12 | 3 |
| 试验组2:Peg-IFN1.0mg/kg, 皮下注射, 1次/wk | 21 | 12 | |||||
| 对照组:安慰剂对照 | 20 | 12 |
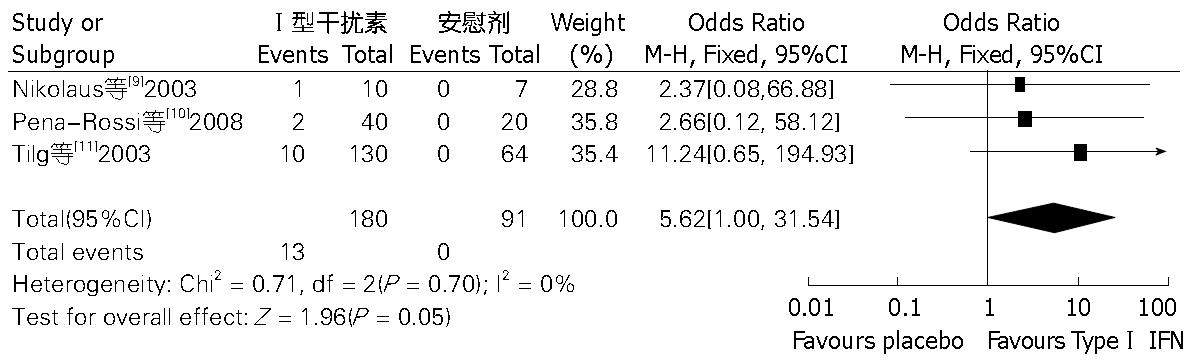
(1)4项[8-11]研究比较了Ⅰ型干扰素与安慰剂对照组在UC治疗中有效缓解率, 各研究间不存在显著异质性(I2 = 0%, P = 0.72), 采用固定效应模型, 计算得出, OR值为1.23(95%CI: 0.76-2.01, P = 0.40), 此荟萃分析结果提示, 两组之间在UC治疗有效缓解率方面无明显差异(图1); (2)4项研究[8-11]比较了两组严重不良反应发生率, 各研究间存在显著异质性(I2 = 61%, P = 0.05), 采用随机效应模型, 计算得出, OR值为1.44(95%CI: 0.21-9.82, P = 0.71), 此荟萃分析结果提示, 两组之间严重不良反应发生率差异无统计学意义(图2); (3)3项研究[9-11]比较了两组在UC治疗中因不良反应退出治疗的患者例数, 各研究间不存在显著异质性(I2 = 0%, P = 0.70), 采用固定效应模型, 计算得出, OR值为5.62(95%CI: 1.00-31.54, P = 0.05), 此荟萃分析结果提示, Ⅰ型干扰素与安慰剂相比, 在UC治疗中, 更易因不良反应退出治疗, 两者差异有统计学意义(图3).
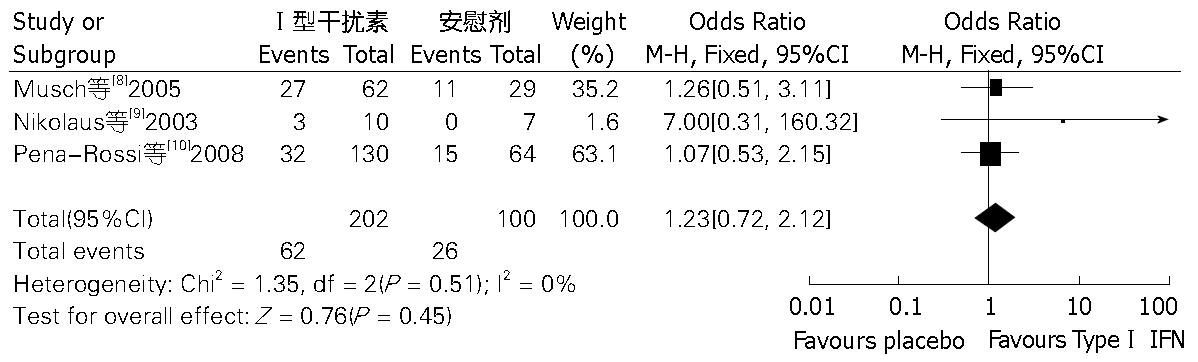
在以上4项研究中, 因3项[8-10]研究采用普通干扰素与安慰剂对照, 而1项研究[11]采用长效干扰素(聚乙二醇干扰素)与安慰剂对照, 故将其剔除后进行敏感性分析. 经卡方检验得各研究间不存在显著异质性(I2 = 0%, P = 0.51), 采用固定效应模型, 计算得出, OR值为1.23(95%CI: 0.72-2.12, P = 0.45), 结果提示两组之间在UC治疗中有效缓解率方面无明显差异, 与原结果一致, 在一定程度上反映合并结果的可靠性(图4).
截止目前, UC的病理生理机制仍不清楚, 发作期与缓解期交替变更, 缺乏特异且有效的治疗方法[13]. 各种治疗手段并无明确标准, 临床上如何选择相应治疗手段仍不明确.
干扰素具有较强的免疫调节功能, 有两种主要类型: Ⅰ型干扰素(interferons, IFNs)(α, β亚型)和Ⅱ型(γ亚型)[14]. Ⅰ型干扰素可以通过增加抗炎因子的表达, 增强T淋巴细胞和NK细胞的功能, 并且抑制肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、IFN-γ、促炎因子的释放来发挥免疫调节作用[15-17]. 而UC涉及肠道炎症及免疫反应综合作用的多个方面, 因而IFN作为UC辅助治疗的手段成为可能.
本文通过检索相关数据库, 系统评价了Ⅰ型干扰素治疗UC的疗效及不良反应情况. 结果显示, 与安慰剂相比, Ⅰ型干扰素在UC治疗中有效缓解率、严重不良反应发生率均无明显差异性. 同时, Musch等[8]和Tilg等[11]研究发现, 两组在内镜活动指数分数方面无明显差异, Musch等[8]研究发现两组在达到缓解所需时间亦无明显差异.
虽然随机对照试验结果显示干扰素治疗UC无更好地疗效, 但在一些开放性的临床试验中, Ⅰ型干扰素对UC患者治疗具有较好疗效. Sümer等[6]的研究给予28例水杨酸、激素治疗无效的患者IFN-α-2a治疗, 23例患者达到临床、内镜下缓解. Musch等[18]的研究给予25例激素抵抗的患者IFN-β-1b治疗, 88%的患者达到缓解. 但仍有少数报道显示干扰素治疗可能会加剧UC的恶化[19-22]. 干扰素在UC治疗过程中会出现不良反应, 如类似流感样症状(发热、头痛不适)、脱发、关节痛、肌痛, 也会引起自身免疫性疾病如甲状腺疾病、糖尿病[23,24]及静脉血栓形成、癫痫发作[11]等严重不良反应. 干扰素治疗的不良反应, 也提示了在UC治疗中不能得到广泛应用.
本系统评价纳入的研究同质性较好, 涉及欧洲多国家多中心的随机对照试验, 所有研究均严格按照明确的纳入和排除标准纳入分析, 根据Jadad评分, 各研究质量评分均较高, 因此产生的偏倚较少. 但仍存在一定的局限性, 缺乏亚洲等其他国家的研究数据, 且纳入研究的总人数相对较少(试验组为242例, 对照组为120例), 均可提示本研究存在潜在的异质性和可能的偏倚.
总之, 现有文献资料显示, Ⅰ型干扰素在UC治疗方面, 其疗效并不优于安慰剂. 在一些开放性的非随机对照研究中, 干扰素治疗UC已取得一定疗效, 但也有使UC病情恶化的报道, 这可能有赖于干扰素的种类、剂量、治疗方式、疗程等多方面因素. 如何降低干扰素治疗过程中引起的不良反应是未来研究需密切关注的问题. 因本荟萃分析纳入研究数量不多, 样本量偏小, 更为准确的结论还需大样本多中心随机对照试验来加以验证.
干扰素具有免疫调节方面作用, 目前已被成功用来治疗一些慢性炎症性疾病, 而溃疡性结肠炎(ulcerative colitis, UC)涉及肠道炎症及免疫反应综合作用多个方面, 因而干扰素作为UC辅助治疗手段成为可能.
刘杰民, 副主任医师, 贵州省人民医院消化内镜科
多项研究表明, 干扰素治疗UC患者可提高有效缓解率, 但是也有结果不一致的报道, 本研究对I型干扰素治疗UC的安慰剂随机对照试验进行荟萃分析, 系统评价干扰素治疗UC的有效性和不良反应情况, 为临床应用提供依据.
Madsen等的研究显示干扰素与强的松灌肠剂治疗UC在临床活动指数与生活质量改善方面有显著意义, 从一定角度反映干扰素治疗UC的有效性.
本文通过荟萃分析对I型干扰素和安慰剂治疗UC的缓解率和不良反应方面的多个独立研究的结果进行系统的定性或定量评价. 能将以往的研究结果更为客观地反映出来, 得出更为真实的科学结论.
本研究系统评价了Ⅰ型干扰素治疗UC的有效性和不良反应情况, 分析得出I型干扰素治疗UC患者, 其疗效不优于安慰剂, 为临床用药提供科学可靠的参考依据.
漏斗图(funnel plots): 以研究的效应估计值为横坐标, 研究精度(如研究的标准误、标本含量等)为纵坐标画出的散点图. 根据图形的不对称程度判断荟萃分析中发表偏倚的有无.
本文通过荟萃分析, 系统评价I型干扰素治疗溃疡性结肠炎的有效性, 分析严谨, 结论可靠, 对指导临床用药有一定价值.
编辑: 郭鹏 电编: 闫晋利
| 1. | Kappelman MD, Farkas DK, Long MD, Erichsen R, Sandler RS, Sørensen HT, Baron JA. Risk of cancer in patients with inflammatory bowel diseases: a nationwide population-based cohort study with 30 years of follow-up evaluation. Clin Gastroenterol Hepatol. 2014;12:265-273.e1. [PubMed] [DOI] |
| 2. | Dwarakanath AD, Yu LG, Brookes C, Pryce D, Rhodes JM. 'Sticky' neutrophils, pathergic arthritis, and response to heparin in pyoderma gangrenosum complicating ulcerative colitis. Gut. 1995;37:585-588. [PubMed] [DOI] |
| 3. | Liu C, Blumhardt LD. Randomised, double blind, placebo controlled study of interferon beta-1a in relapsing-remitting multiple sclerosis analysed by area under disability/time curves. J Neurol Neurosurg Psychiatry. 1999;67:451-456. [PubMed] [DOI] |
| 4. | PRISMS Study Group and the University of British Columbia MS/MRI Analysis Group. PRISMS-4: Long-term efficacy of interferon-beta-1a in relapsing MS. Neurology. 2001;56:1628-1636. [PubMed] |
| 5. | Hoofnagle JH, Seeff LB. Peginterferon and ribavirin for chronic hepatitis C. N Engl J Med. 2006;355:2444-2451. [PubMed] [DOI] |
| 6. | Sümer N, Palabiyikoğlu M. Induction of remission by interferon-alpha in patients with chronic active ulcerative colitis. Eur J Gastroenterol Hepatol. 1995;7:597-602. [PubMed] |
| 7. | Jadad AR, Moore RA, Carroll D, Jenkinson C, Reynolds DJ, Gavaghan DJ, McQuay HJ. Assessing the quality of reports of randomized clinical trials: is blinding necessary? Control Clin Trials. 1996;17:1-12. [PubMed] [DOI] |
| 8. | Musch E, Andus T, Kruis W, Raedler A, Spehlmann M, Schreiber S, Krakamp B, Malek M, Malchow H, Zavada F. Interferon-beta-1a for the treatment of steroid-refractory ulcerative colitis: a randomized, double-blind, placebo-controlled trial. Clin Gastroenterol Hepatol. 2005;3:581-586. [PubMed] [DOI] |
| 9. | Nikolaus S, Rutgeerts P, Fedorak R, Steinhart AH, Wild GE, Theuer D, Möhrle J, Schreiber S. Interferon beta-1a in ulcerative colitis: a placebo controlled, randomised, dose escalating study. Gut. 2003;52:1286-1290. [PubMed] |
| 10. | Pena-Rossi C, Schreiber S, Golubovic G, Mertz-Nielsen A, Panes J, Rachmilewitz D, Shieh MJ, Simanenkov VI, Stanton D, Graffner H. Clinical trial: a multicentre, randomized, double-blind, placebo-controlled, dose-finding, phase II study of subcutaneous interferon-beta-la in moderately active ulcerative colitis. Aliment Pharmacol Ther. 2008;28:758-767. [PubMed] [DOI] |
| 11. | Tilg H, Vogelsang H, Ludwiczek O, Lochs H, Kaser A, Colombel JF, Ulmer H, Rutgeerts P, Krüger S, Cortot A. A randomised placebo controlled trial of pegylated interferon alpha in active ulcerative colitis. Gut. 2003;52:1728-1733. [PubMed] |
| 12. | Madsen SM, Schlichting P, Davidsen B, Nielsen OH, Federspiel B, Riis P, Munkholm P. An open-labeled, randomized study comparing systemic interferon-alpha-2A and prednisolone enemas in the treatment of left-sided ulcerative colitis. Am J Gastroenterol. 2001;96:1807-1815. [PubMed] [DOI] |
| 13. | Taba Taba Vakili S, Taher M, Ebrahimi Daryani N. Update on the management of ulcerative colitis. Acta Med Iran. 2012;50:363-372. [PubMed] |
| 14. | Ghosh S, Chaudhary R, Carpani M, Playford R. Interfering with interferons in inflammatory bowel disease. Gut. 2006;55:1071-1073. [PubMed] [DOI] |
| 15. | Shibuya H, Hirohata S. Differential effects of IFN-alpha on the expression of various TH2 cytokines in human CD4+ T cells. J Allergy Clin Immunol. 2005;116:205-212. [PubMed] [DOI] |
| 16. | Brassard DL, Grace MJ, Bordens RW. Interferon-alpha as an immunotherapeutic protein. J Leukoc Biol. 2002;71:565-581. [PubMed] |
| 17. | Graber JJ, Ford D, Zhan M, Francis G, Panitch H, Dhib-Jalbut S. Cytokine changes during interferon-beta therapy in multiple sclerosis: correlations with interferon dose and MRI response. J Neuroimmunol. 2007;185:168-174. [PubMed] [DOI] |
| 18. | Musch E, Andus T, Malek M. Induction and maintenance of clinical remission by interferon-beta in patients with steroid-refractory active ulcerative colitis-an open long-term pilot trial. Aliment Pharmacol Ther. 2002;16:1233-1239. [PubMed] [DOI] |
| 19. | Tursi A. Rapid onset of ulcerative colitis after treatment with PEG-interferon plus ribavirin for chronic hepatitis C. Inflamm Bowel Dis. 2007;13:1189-1190. [PubMed] [DOI] |
| 20. | Watanabe T, Inoue M, Harada K, Homma N, Uchida M, Ogata N, Funada R, Hasegawa K, Soga K, Shibasaki K. A case of exacerbation of ulcerative colitis induced by combination therapy with PEG-interferon alpha-2b and ribavirin. Gut. 2006;55:1682-1683. [PubMed] |
| 21. | Sprenger R, Sagmeister M, Offner F. Acute ulcerative colitis during successful interferon/ribavirin treatment for chronic hepatitis. Gut. 2005;54:438-439; author reply 439. [PubMed] |
| 22. | Mavrogiannis C, Papanikolaou IS, Elefsiniotis IS, Psilopoulos DI, Karameris A, Karvountzis G. Ulcerative colitis associated with interferon treatment for chronic hepatitis C. J Hepatol. 2001;34:964-965. [PubMed] [DOI] |
| 23. | Borg FA, Isenberg DA. Syndromes and complications of interferon therapy. Curr Opin Rheumatol. 2007;19:61-66. [PubMed] [DOI] |