修回日期: 2014-12-12
接受日期: 2014-12-18
在线出版日期: 2015-02-18
目的: 探讨上皮-间质转化(epithelial-mesenchymal transition, EMT)标志物E-钙黏蛋白(E-cadherin)和波形蛋白(Vimentin)在新疆维吾尔族、汉族结肠癌组织中的表达及其与患者临床病理因素之间的关系, 并分析其对术后复发转移的预测价值.
方法: 应用免疫组织化学的方法(SP法)检测经手术切除、术后病理明确诊断的41例维吾尔族、58例汉族结肠癌组织标本及距癌组织5 cm以上的正常结肠黏膜组织中的E-cadherin和Vimentin表达情况并与患者临床病理资料以及术后复发转移进行相关性分析.
结果: 维吾尔族患者中青年、分化差、伴淋巴结转移、远处转移的比值比分别为68.3%(28/41)、73.2%(30/41)、70.7%(29/41)、36.6%(15/41), 汉族分别为43.1%(25/58)、48.3%(28/58)、48.3%(28/58)、15.5%(9/58), 两民族间比值比差异均有统计学意义(P<0.05). E-cadherin和Vimentin在新疆维吾尔族、汉族结肠癌组织中的阳性表达率分别为87.8%(36/41)、86.2%(50/58)(P>0.05)和9.76%(4/41)、3.45%(2/58)(P>0.05), 癌旁组织中的E-cadherin阳性表达为100%, 而Vimentin未检测到表达, 两者在癌组织与癌旁组织中的表达差异有统计学意义(P<0.05). E-cadherin与Vimentin的表达呈负相关(r = -0.81, P<0.05). E-cadherin的表达与肿瘤分化程度、淋巴结转移、远处转移、TNM分期及术后复发转移相关(P<0.05), Vimentin表达与淋巴结转移、远处转移、术后复发转移相关(P<0.05).
结论: 结肠癌组织中可出现一定程度的EMT. 联合检测结肠癌患者E-cadherin和Vimentin的表达水平可作为判断结肠癌组织EMT状态并预测结肠癌病程和复发转移的指标.
核心提示: 结直肠癌是消化系常见恶性肿瘤之一, 以手术为主的综合治疗是其主要治疗手段, 然而术后复发转移是导致患者预后不良及死亡的主要原因, 本文就联合检测上皮-间质转化(epithelial-mesenchymal transition)标志物E-钙黏蛋白(E-cadherin)和波形蛋白(Vimentin)来预测术后复发转移进行探讨.
引文著录: 李龙龙, 赵泽亮, 王海江. E-cadherin和Vimentin在新疆维吾尔族、汉族结肠癌中的表达及其临床意义. 世界华人消化杂志 2015; 23(5): 839-845
Revised: December 12, 2014
Accepted: December 18, 2014
Published online: February 18, 2015
AIM: To detect the expression of E-cadherin and Vimentin in colon cancer and to analyze their clinical significance.
METHODS: Immunohistochemistry was adopted to detect the expression of E-cadherin and Vimentin in colon cancer specimens and tumor-adjacent colonic mucosa tissue specimens from 41 Uygur and 58 Han patients with pathologically diagnosed colon cancer. The relationship between E-cadhertin and Vimentin expression and clinicopathological factors was analyzed.
RESULTS: The percentages of patients with young/middle age, poor differentiation, lymph node metastasis, and distant metastasis were significantly different between Uygur and Han patients (68.3% vs 43.1%, 73.2% vs 48.3%, 70.7% vs 48.3%, 36.6% vs 15.5%, P < 0.05). The positive rates of E-cadherin and Vimentin expression in colon cancer tissues did not differ significantly between Han and Uygur patients (87.8% vs 86.2%, 9.76% vs 3.45%, P > 0.05), although significant differences were noted between colon cancer and normal colon mucosa tissues (100% and 0%) (P < 0.05). There was a negative correlation between E-cadherin and Vimentin expression (r = -0.81, P < 0.05). The expression of E-cadherin was correlated with tumor differentiation, lymph node metastasis, distant metastasis and TNM stage (P < 0.05). The expression of Vimentin was correlated with lymph node metastasis, distant metastasis and TNM stage (P < 0.05).
CONCLUSION: Epithelial-mesenchymal transition (EMT) occurs in colon cancer. Simultaneous detection of E-cadherin and Vimentin expression may help assess EMT in colon cancer tissue and predict recurrence and metastasis.
- Citation: Li LL, Zhao ZL, Wang HJ. Clinical significance of E-cadherin and Vimentin expression in Han and Uygur colon cancer patients from Xinjiang. Shijie Huaren Xiaohua Zazhi 2015; 23(5): 839-845
- URL: https://www.wjgnet.com/1009-3079/full/v23/i5/839.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i5.839
结直肠癌是消化系中最常见的恶性肿瘤之一, 在西方发达国家其发病率高居恶性肿瘤第2位, 死亡率居恶性肿瘤第3位[1]. 2009年我国结直肠癌发病率为29.44/10万, 占全部恶性肿瘤的10.30%, 死亡病例则占7.88%, 发病率和死亡率均高于世界平均水平且仍在逐年升高, 新疆也因其地域和人口学特征成为我国结直肠癌高发区[2-4]. 目前结直肠癌的主要治疗手段依然是手术联合辅助放化疗, 但即使原发灶及转移灶成功切除, 超过一半的患者仍会出现复发及转移[5]. 由此, 发掘潜在的结直肠癌复发转移的生物学机制并在治疗结直肠癌的过程中施加干预措施显得尤为重要. 国内外许多研究[6,7]表明, 上皮-间质转化(epithelial-mesenchymal transition, EMT)在结直肠癌的复发转移中起到关键性作用. 上皮标志物E-钙黏蛋白(E-cadherin)表达减弱而间质标志物波形蛋白(Vimentin)表达上调被认为是EMT过程的标志[8,9]. 本文对维吾尔族、汉族结肠癌组织中E-cadherin和Vimentin的表达进行检测, 拟探讨E-cadherin和Vimentin在新疆维吾尔族、汉族结肠癌中的表达及其与结肠癌临床病理因素之间的关系, 分析其对术后复发转移的预测价值.
收集新疆医科大学附属肿瘤医院胃肠外科2009-01/2014-01收治的术前未行任何放化疗及其他药物治疗的经外科手术切除及术后病理明确诊断的41例维吾尔族、58例汉族结肠癌组织及癌旁组织标本, 均经40 g/L甲醛固定, 常规石蜡包埋, 厚4 μm连续切片. 维吾尔族患者中男性21例, 女性20例, 年龄28-75岁, 平均年龄53.07岁±12.93岁, 高分化腺癌5例, 中分化腺癌14例, 低分化腺癌15例, 黏液腺癌5例, 印戒细胞癌2例, 伴淋巴结转移24例, 远处转移10例; 汉族患者中男35例, 女23例, 年龄34-83岁, 平均年龄62.24岁±11.67岁, 高分化腺癌5例, 中分化腺癌17例, 低分化腺癌20例, 黏液腺癌13例, 印戒细胞癌3例, 伴淋巴结转移32例, 远处转移8例. 将高、中分化腺癌划为分化较好组, 低分化、黏液腺癌、印戒细胞癌划为分化较差组. 所有患者均按美国癌症联合会(American Joint Committee On Cancer, AJCC)的TNM标准进行分期.
E-cadherin抗体和Vimentin抗体均购自福州迈新生物公司, 免疫组织化学SP试剂盒、免疫组织化学二抗和DAB显色试剂均购自北京中杉金桥生物公司.
1.2.1 免疫组织化学检测: 严格按照试剂盒说明书操作步骤检测E-cadherin和Vimentin在结肠癌组织及癌旁组织中的表达. E-cadherin和Vimentin抗体工作浓度为1∶150, 以PBS缓冲液代替一抗作为阴性对照. 染色强度判定标准: 0分为无色, 1分为淡黄色或黄色; 2分为棕黄色; 3分为棕褐色(染色深浅需与背景着色相对比); 阳性细胞所占百分比判定标准: 0分为阴性, 1分阳性细胞≤10%, 2分为11%-75%, 3分为≥75%. 两者积分相乘, 判定0分为阴性(-), 1-6分为阳性(+), 6-9分为强阳性(++).
1.2.2 随访: 患者出院后1年内随访1次/3 mo, 第1年后随访1次/6 mo. 本研究随访率88.9%(88/99), 生存时间为3-58 mo, 平均21.45 mo, 中位生存时间为16 mo. 随访方式为门诊随访、住院随访、随访信及电话联系等. 随访截止日期为2014-05.
统计学处理 采用SPSS17.0统计软件对数据进行统计分析, 率的比较用χ2检验, 相关分析用Spearman检验, Kaplan-Meier法构建生存曲线, 曲线比较用Log-rank检验, 预后影响因素分析用Cox比例风险模型. P<0.05为差异有统计学意义.
维吾尔族、汉族患者年龄、分化程度、TNM分期和术后复发转移的构成比差异有统计学意义(表1).
| 患者特征 | n | 民族 | χ2值 | P值 | E-cadherin表达 | χ2值 | P值 | Vimentin表达 | χ2值 | P值 | |||
| 维 | 汉 | + | - | + | - | ||||||||
| 年龄(岁) | 6.13 | <0.05 | 0.33 | >0.05 | 0.060 | >0.05 | |||||||
| ≥60 | 46 | 13 | 33 | 39 | 7 | 2 | 44 | ||||||
| <60 | 53 | 28 | 25 | 47 | 6 | 4 | 49 | ||||||
| 性别 | 0.81 | >0.05 | 2.52 | >0.05 | 0.000 | >0.05 | |||||||
| 男性 | 56 | 21 | 35 | 46 | 10 | 3 | 53 | ||||||
| 女性 | 43 | 20 | 23 | 40 | 3 | 3 | 40 | ||||||
| 分化程度 | 6.14 | <0.05 | 4.18 | <0.05 | 0.710 | >0.05 | |||||||
| 分化较好 | 41 | 11 | 30 | 39 | 2 | 1 | 40 | ||||||
| 分化较差 | 58 | 30 | 28 | 47 | 11 | 5 | 53 | ||||||
| 淋巴结转移 | 1.00 | >0.05 | 4.48 | <0.05 | 3.040 | <0.05 | |||||||
| 无 | 42 | 17 | 25 | 40 | 2 | 0 | 42 | ||||||
| 有 | 57 | 24 | 33 | 46 | 11 | 6 | 51 | ||||||
| 远处转移 | 1.81 | >0.05 | 20.80 | <0.001 | <0.05 | ||||||||
| 无 | 81 | 31 | 50 | 78 | 3 | 2 | 79 | ||||||
| 有 | 18 | 10 | 8 | 10 | 8 | 4 | 14 | ||||||
| TNM分期 | 4.95 | <0.05 | 4.48 | <0.05 | >0.05 | ||||||||
| Ⅰ-Ⅱ | 42 | 12 | 30 | 40 | 2 | 0 | 42 | ||||||
| Ⅲ-Ⅳ | 57 | 29 | 28 | 46 | 11 | 6 | 51 | ||||||
| 复发转移 | 5.81 | <0.05 | 19.43 | <0.001 | 8.676 | <0.05 | |||||||
| 无 | 75 | 26 | 49 | 72 | 3 | 1 | 74 | ||||||
| 有 | 24 | 15 | 9 | 14 | 10 | 5 | 19 | ||||||
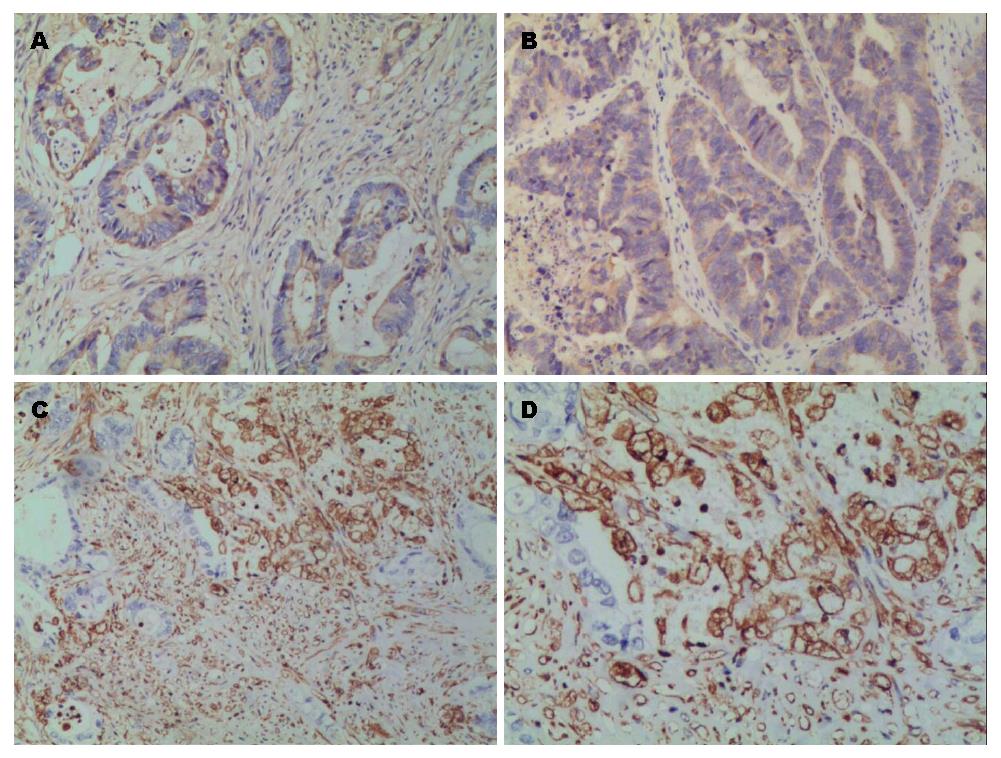
E-cadherin表达于癌组织的细胞质, 部分在细胞膜上, 阴性表达为无色或淡黄色(图1A, B), Vimentin表达于癌组织的细胞浆为棕黄色或棕褐色(图1C, D). 99例结肠癌患者癌组织及癌旁组织中E-cadherin和Vimentin阳性表达例数分别为86例(86.87%)和99例(100.00%)(χ2 = 13.914, P<0.01), 6例(6.06%)和0例(0.00%)(χ2 = 4.297, P<0.05); 维吾尔族患者结肠癌组织两者的表达例数分别为36例(87.80%)、4例(9.76%), 汉族患者分别为50例(86.21%)和2例(3.45%). 两民族间表达无明显统计学意义(P>0.05)(表2). 结肠癌组织及癌旁组织中E-cadherin和Vimentin表达差异具有统计学意义(P<0.05)(表1), E-cadherin阳性86例, 阴性13例, Vimentin阳性6例, 阴性93例, 两者表达呈负相关(r = -0.81, P<0.05).
| 民族 | n | E-cadherin | Vimentin | ||
| + | - | + | - | ||
| 汉族 | 58 | 50 | 8 | 2 | 56 |
| 维族 | 41 | 36 | 5 | 4 | 37 |
| r值 | 0.023 | 0.130 | |||
| P值 | >0.05 | >0.05 | |||
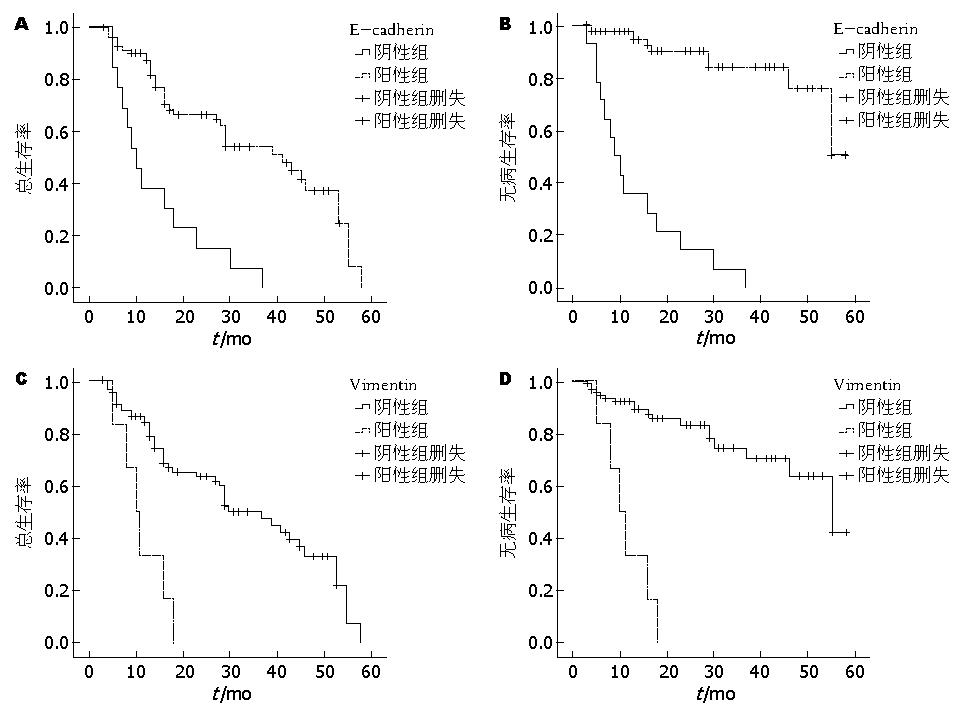
结肠癌组织中E-cadherin的阴性表达在肿瘤分化程度、有无淋巴结转移、远处转移、TNM分期、术后复发转移的构成比差异有统计学意义(P<0.05); Vimentin的阳性表达与有无淋巴结转移、远处转移、术后复发转移的构成比差异有统计学意义(P<0.05), 而与肿瘤分化程度、TNM分期差异无统计学意义(P>0.05)(表1). Cox比例风险模型多因素分析显示, E-cadherin和Vimentin的异常表达情况以及淋巴结转移和远处转移与肿瘤的复发转移相关(表3). E-cadherin和Vimentin阴性表达与阳性表达的K-M曲线均提示在总生存期(overall survival, OS)及无病生存期(disease-free survival, DFS)存在明显差异(Log-rank, P<0.05)(图2).
| 因素 | 偏回归系数 | 偏回归系数标准误 | 统计量(Wald) | 自由度 | P值 | 相对危险度 |
| E-cadherin | 1.607 | 0.747 | 4.626 | 1 | 0.031 | 4.988 |
| Vimentin | 2.454 | 0.676 | 13.173 | 1 | 0.000 | 11.636 |
| 淋巴结转移 | -1.603 | 0.498 | 10.373 | 1 | 0.001 | 0.201 |
| 远处转移 | 2.201 | 0.547 | 16.178 | 1 | 0.000 | 9.032 |
结直肠癌具有明显的区域性分布差异, 其发病率在不同地区可相差数十倍[10]. 近年来, 我国结直肠癌发病率不断攀升, 其中又以结肠癌上升为快[2]. 结直肠癌是由环境、饮食以及生活方式与遗传因素协同作用的结果, 其危险因素包括饮食因素(高动物脂肪、高动物蛋白、高能量和低纤维素)、遗传因素(家族性腺瘤性息肉病和遗传性非息肉病性结直肠癌)和致病因素(结直肠腺瘤、溃疡性结肠炎、息肉病). 地域辽阔的新疆是一个多民族聚居的地区, 尤以汉族、维吾尔族人为多, 气候干燥, 冬季漫长, 使得饮食中以高脂肪、高蛋白、高热卡、低维生素食物为主, 且维吾尔族人民喜食牛羊肉及奶制品, 这种饮食习惯与结直肠癌的发生密切相关[4], 这也可能是导致结直肠癌是新疆地区第三高发恶性肿瘤[11]的原因. 相关调查发现, 维吾尔族结直肠癌患者中以青年女性、分化程度低、分期晚、复发转移者居多[12]. 本研究结果亦显示在维吾尔族患者中青年、分化差、分期晚及合并转移者比值比较高, 差异有统计学意义, 在女性、合并淋巴结转移、远处转移比值比稍高, 但差异无统计学意义, 与本研究中维吾尔族患者样本量较少、病理分期差异较大可能存在一定关系.
E-cadherin是EMT过程中最具特征性的分子标记, 其表达缺失被认为是发生EMT的标志[13]. 其表达下调或缺失后使得细胞间黏附能力下降, 癌细胞易从原发病灶游离, 渗透至血液循环内, 在这个过程中还要逃避机体的免疫监视系统, 进而渗出血管并在远处器官增殖, 最终在远处器官形成了肉眼可见的微小转移灶. 相关研究[14]发现, E-cadherin表达下调或缺失与结直肠癌的不良预后关系密切, 高表达时可阻止肿瘤侵袭、转移, 延长恶性肿瘤进程. 本实验发现, E-cadherin在结肠癌组织中的表达明显较正常肠黏膜低, 并且分化程度越低、伴淋巴结转移、远处转移及TNM分期较晚的肿瘤组织中表达越低, 差异有统计学意义(P<0.05). Cox比例风险模型单因素及多因素分析亦发现其表达缺失与患者术后易复发转移相关, 而两民族间的表达未发现明显差异性, 提示其可作为预测患者术后复发转移的指标, 不受民族因素的影响. E-cadherin表达的具体调节机制与多种机制有关, 包括基因突变和启动子甲基化, 目前已发现包括锌指蛋白Snail、E盒结合锌指蛋白(zinc finger E-box-binding protein, ZEB)以及具有碱性螺旋-环-螺旋结构的Twist在内的多种调节因子通过不同途径调节其表达[15,16].
Vimentin是蛋白中间纤维家族的重要成分, 广泛表达于正常细胞间质, 具有维持细胞及细胞器形态、促进细胞黏附及移行、参与细胞有丝分裂及细胞分化、创伤愈合、信号传导、移植免疫及细胞凋亡等重要机械学及生物学功能. 其在胃肠道肿瘤、前列腺癌、中枢神经系统肿瘤、乳腺癌、恶性黑色素瘤以及肺癌等多种上皮来源的恶性肿瘤中呈高表达状态[8,17]. 相关研究[18]证明, Vimentin在EMT过程中也起到重要作用, 阻断表达可以使已经产生EMT的细胞再次上皮化, 且能减弱肿瘤细胞的侵袭能力, 试验中敲除70%的Vimentin即可显著减弱肿瘤细胞的侵袭转移能力. 本实验中结肠癌组织中表达明显高于正常肠黏膜, 且阳性表达多出现在E-cadherin表达下调或丢失的肿瘤细胞, 其阳性表达与合并淋巴结转移、远处转移及术后复发转移相关, Cox比例风险模型单因素及多因素分析均显示, 其表达增强是患者术后复发转移的相关因素, 说明检测Vimentin可作为预测结肠癌患者术后复发转移的指标. 但其表达与肿瘤分化程度及TNM分期本研究尚未发现明显相关性, 考虑与本研究样本量较少、肿瘤组织分化程度及病理分期的差异较大有关.
在肿瘤发生发展过程中上皮表达丢失即E-cadherin表达下调或丢失合并间质标志物Vimentin表达升高, 提示肿瘤发生EMT, Loboda等[19]发现, EMT的发生是导致结肠癌术后复发转移的危险因素. 本研究中E-cadherin和Vimentin表达呈负相关, 且多出现在肿瘤分化程度低, 伴淋巴结转移及远处转移的患者, 说明在结肠癌发生发展过程中出现了EMT, 并且伴随EMT的发生, 肿瘤恶性程度及术后复发转移风险也相应升高. E-cadherin和Vimentin异常表达的患者其OS及DFS均较对照组低, 说明伴有EMT的结肠癌患者预后更差. 以上研究结果均证明联合检测EMT标志物E-cadherin和Vimentin表达可作为预测结肠癌术后复发转移的生物学指标.
通过本研究及结合相关文献报道, 我们推测在结肠癌组织中发生了一定程度的EMT, 使得结肠癌细胞侵袭转移能力增强, 更容易发生复发转移, 而EMT标志物E-cadherin和Vimentin的异常表达为我们提供了一个可检测的靶点, 为结肠癌患者术后继续治疗提供一定参考. 但两者在EMT过程中的具体作用机制仍有待研究证实.
结直肠癌是消化系中最常见的恶性肿瘤之一, 复发转移是导致患者预后不良及死亡的主要因素, 上皮-间质转化(epithelial-mesenchymal transition, EMT)在复发转移中起到关键性作用, 检测EMT标志物E-钙黏蛋白(E-cadherin)和波形蛋白(Vimentin)表达水平可作为预测结肠癌术后复发转移的生物学指标.
卢宁, 副主任医师, 兰州军区乌鲁木齐总医院肿瘤科
上皮标志物E-cadherin常被用来检测结直肠癌EMT状态, 而间质标志物Vimentin近年来在多种恶性肿瘤中亦备受关注, 本文就联合检测EMT标志物E-cadherin和Vimentin表达水平作为预测结肠癌术后复发转移的生物学指标进行探讨.
相关研究证明, Vimentin在EMT过程中起到重要作用, 阻断表达可以使已经产生EMT的细胞再次上皮化, 且能减弱肿瘤细胞的侵袭能力, 试验中敲除70%的Vimentin即可显著减弱肿瘤细胞的侵袭转移能力, Vimentin可能成为结直肠癌治疗的潜在靶点.
国内就联合检测EMT标志物E-cadherin和Vimentin在结直肠癌中的表达研究不多, 而新疆因其地域和人口学特征是我国结直肠癌高发地区, 结合地域特征联合检测两者表达, 以分析其对术后复发转移的预测价值的研究甚少.
联合检测两者在结直肠癌组织中的表达, 为结直肠癌患者的治疗、疗效观察和预后判断提供思路, 后续深入分子水平研究, 两者有望成为结直肠癌治疗新策略.
上皮-间质转化: 是指上皮细胞失去极性, 失去与基底膜的连接等上皮表型, 通过特定程序转化为具有间质表型的生物学过程, 从而获得了较高的侵袭、迁移、抗凋亡及降解细胞外基质的能力.
本研究目标明确, 设计合理, 实验数据可靠, 具有一定的创新性, 研究有一定的科学意义.
编辑: 韦元涛 电编: 都珍珍
| 1. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013. CA Cancer J Clin. 2013;63:11-30. [PubMed] [DOI] |
| 4. | 邵 红梅, 冯 瑞, 朱 红, 谢 娟. 中国人群结直肠癌危险因素的Meta分析. 中国慢性病预防与控制. 2014;22:174-177. |
| 5. | Geoghegan JG, Scheele J. Treatment of colorectal liver metastases. Br J Surg. 1999;86:158-169. [PubMed] [DOI] |
| 6. | Hur K, Toiyama Y, Takahashi M, Balaguer F, Nagasaka T, Koike J, Hemmi H, Koi M, Boland CR, Goel A. MicroRNA-200c modulates epithelial-to-mesenchymal transition (EMT) in human colorectal cancer metastasis. Gut. 2013;62:1315-1326. [PubMed] [DOI] |
| 7. | Deng J, Xu X. Epithelial-mesenchymal transition and cancer metastasis. Chinese-German J Clinical Oncology. 2011;10:125-133. [DOI] |
| 8. | Satelli A, Li S. Vimentin in cancer and its potential as a molecular target for cancer therapy. Cell Mol Life Sci. 2011;68:3033-3046. [PubMed] [DOI] |
| 9. | Makrilia N, Kollias A, Manolopoulos L, Syrigos K. Cell adhesion molecules: role and clinical significance in cancer. Cancer Invest. 2009;27:1023-1037. [PubMed] [DOI] |
| 10. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 13. | Ye J, Wu D, Shen J, Wu P, Ni C, Chen J, Zhao J, Zhang T, Wang X, Huang J. Enrichment of colorectal cancer stem cells through epithelial-mesenchymal transition via CDH1 knockdown. Mol Med Rep. 2012;6:507-512. [PubMed] [DOI] |
| 14. | Bruun J, Kolberg M, Nesland JM, Svindland A, Nesbakken A, Lothe RA. Prognostic Significance of β-Catenin, E-Cadherin, and SOX9 in Colorectal Cancer: Results from a Large Population-Representative Series. Front Oncol. 2014;4:118. [PubMed] [DOI] |
| 15. | Thiery JP, Acloque H, Huang RY, Nieto MA. Epithelial-mesenchymal transitions in development and disease. Cell. 2009;139:871-890. [PubMed] [DOI] |
| 16. | Yang J, Weinberg RA. Epithelial-mesenchymal transition: at the crossroads of development and tumor metastasis. Dev Cell. 2008;14:818-829. [PubMed] [DOI] |
| 17. | Toiyama Y, Yasuda H, Saigusa S, Tanaka K, Inoue Y, Goel A, Kusunoki M. Increased expression of Slug and Vimentin as novel predictive biomarkers for lymph node metastasis and poor prognosis in colorectal cancer. Carcinogenesis. 2013;34:2548-2557. [PubMed] [DOI] |
| 18. | McInroy L, Määttä A. Down-regulation of vimentin expression inhibits carcinoma cell migration and adhesion. Biochem Biophys Res Commun. 2007;360:109-114. [PubMed] [DOI] |
| 19. | Loboda A, Nebozhyn MV, Watters JW, Buser CA, Shaw PM, Huang PS, Van't Veer L, Tollenaar RA, Jackson DB, Agrawal D. EMT is the dominant program in human colon cancer. BMC Med Genomics. 2011;4:9. [PubMed] [DOI] |