修回日期: 2014-12-22
接受日期: 2014-12-31
在线出版日期: 2015-02-18
目的: 探讨蓝莓对酒精性肝损伤大鼠的保护作用及可能机制.
方法: 48只健康SD大鼠随机均分为4组: 正常组、蓝莓组、异甘草酸镁组及模型组. 除正常组不灌胃乙醇溶液, 给予等体积生理盐水外, 其余各组均使用560 mL/L的乙醇溶液灌胃. 蓝莓组与异甘草酸镁组在灌乙醇溶液1 h后分别灌服蓝莓原浆及异甘草酸镁溶液. 4 wk后处死所有大鼠. HE染色观察各组肝脏形态变化, 采用自动生化仪检测血清谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)含量; Elisa法测定肝组织匀浆中超氧化物歧化酶(superoxide dismutase, SOD)活性、肿瘤坏死因子α(tumor necrosis factor alpha, TNF-α)及白介素-8(interleukin 8, IL-8)的含量; RT-PCR、Western blot检测大鼠肝组织中Toll样受体4(Toll-like receptor 4, TLR4)的表达.
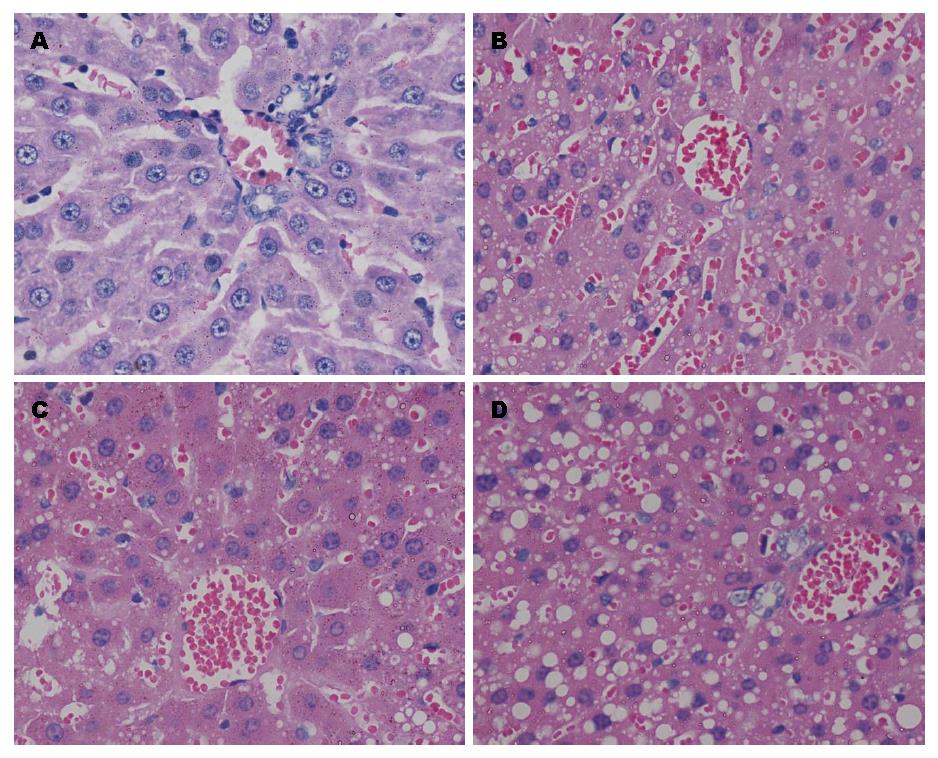
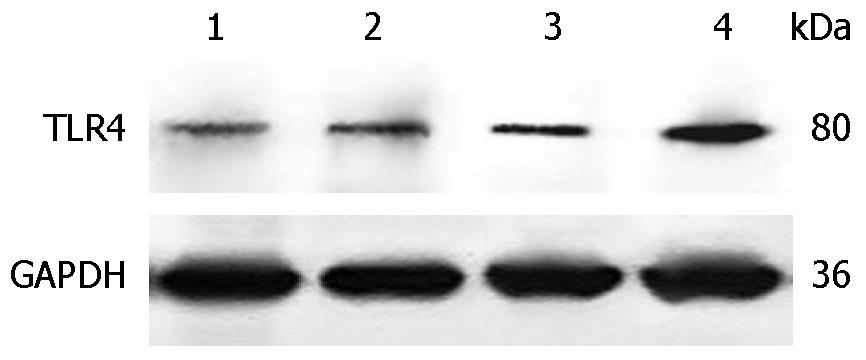
结果: 正常组大鼠HE染色未见异常, 模型组HE病理切片出现弥漫性空泡, 部分区域出现炎症细胞浸润, 蓝莓组与异甘草酸镁组明显少见. 与蓝莓组及异甘草酸镁组比较, 模型组大鼠血清ALT、AST、TG、TC含量明显升高(F = 47.984, 14.974, 149.338, 94.896, 均P<0.01); 蓝莓组及异甘草酸镁组肝组织中SOD的蛋白活性明显高于模型组(F = 35.390, P<0.01), 而TNF-α、IL-8含量、TLR4 mRNA和蛋白质的表达明显低于模型组(F = 76.250, 37.971, 141.932, 62.750, 均P<0.01).
结论: 蓝莓对酒精性肝损伤大鼠有较好的保护的作用, 其机制可能与下调肝组织中TLR4的表达, 并降低肝组织中TNF-α、IL-8的含量, 提高SOD活性相关.
核心提示: 本研究通过观察蓝莓对酒精性肝损伤大鼠干预后的肝组织表现、血清肝功能生化指标、超氧化物歧化酶(superoxide dismutase)活性及相关炎症因子Toll样受体4(Toll-like receptor 4, TLR4)的变化, 证明蓝莓可以抑制酒精性肝损伤大鼠肝组织TRL4蛋白的表达, 增强机体抗氧化能力, 起到保护肝脏的作用.
引文著录: 黄超, 任婷婷, 王豫萍, 程明亮. 蓝莓对酒精性肝损伤大鼠肝组织TLR4表达的影响. 世界华人消化杂志 2015; 23(5): 754-760
Revised: December 22, 2014
Accepted: December 31, 2014
Published online: February 18, 2015
AIM: To investigate the protective effect of blueberry in rats with alcoholic hepatic injury and explore the possible mechanism.
METHODS: Forty-eight healthy SD rats were randomly divided into a control group, a blueberry group, a magnesium isoglycyrrhizinate group and a model group. The rats in the control group were given physiological saline, and other groups were all given 56 mL/L ethanol solution intragastrically. The blueberry group and magnesium isoglycyrrhizinate group were, respectively, given blueberry juice and magnesium isoglycyrrhizinate solution 1 h after intragastric alcohol infusion. All SD rats were sacrificed after 4 wk. Pathological changes in the hepatic tissue were assessed by hematoxylin-eosin (HE) staining, and alanine aminotransferase (ALT), aspartate aminotransferase (AST), triglyceride (TG) and total cholesterol (TC) in serum were detected with automatic biochemical analyzer. The activity an of superoxide dismutase (SOD), the contents of tumor necrosis factor alpha (TNF-α) and interleukin 8 (IL-8) in liver homogenates were determined by enzyme linked immunosorbent assay (ELISA). The expression of Toll-like receptor 4 (TLR4) in liver tissue was detected by reverse transcription-PCR (RT-PCR) and Western blot.
RESULTS: In the control group, hepatocytes were intact, and no vacuoles were observed. In the model group, vacuoles were noted in the cytoplasm of hepatocytes. The degree of cytoplasmic vacuolation was significantly alleviated in the blueberry group and magnesium isoglycyrrhizinate group. The levles of ALT, AST, TG, and TC in the model group were significantly higher than those in the blueberry group and magnesium isoglycyrrhizinate group (F = 47.984, 14.974, 149.338, 94.896, P < 0.01 for all). Compared with the model group, the activities of SOD in liver homogenates were significantly higher (F = 33.102, P < 0.01) and the contents of TNF-α and IL-8 in liver homogenates were significantly lower (F = 76.250, 37.971, P < 0.01 for both) in the blueberry group and magnesium isoglycyrrhizinate group. The expression of hepatic TLR4 in the model group was significantly higher than that in the blueberry group and magnesium isoglycyrrhizinate group (F = 141.932, 62.750, P < 0.01 for both).
CONCLUSION: Blueberry exerts a protective effect on alcoholic hepatic injury in rats, and the mechanism might be associated with down-regulating the expression of TLR4, reducing the contents of hepatic TNF-α and IL-8, and up-regulating the activity of hepatic SOD.
- Citation: Huang C, Ren TT, Wang YP, Cheng ML. Effect of blueberry on hepatic expression of TLR4 in a rat model of alcoholic liver injury. Shijie Huaren Xiaohua Zazhi 2015; 23(5): 754-760
- URL: https://www.wjgnet.com/1009-3079/full/v23/i5/754.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i5.754
过度饮酒已成为全球肝脏疾病的一个主要致病因素[1], 不及时防治将发展为肝衰竭甚至肝癌. 临床上对酒精所造成的肝损伤治疗尚无特效药物[2], 因此寻找一种对酒精性肝损伤具有防治作用的物质有重大意义. 研究[3]发现乙醇代谢引起的炎症免疫反应与氧化应激是引起肝脏损害的主要因素. 而Toll样受体4(Toll-like receptor 4, TLR4)是机体免疫反应的关键因子, 参与多种免疫过程[4]. 已有研究[5]证实, 乙醇代谢所造成的肝损伤与TLR4表达增加有关. 同时乙醇代谢还会产生大量氧自由基, 引起脂质过氧化加重肝功能的受损. 而蓝莓富含花青素、绿原酸、黄酮素等多种生物活性成分, 有明确的抗氧化、抗炎作用, 具有极高的营养价值[6]. 本研究以大鼠酒精性肝损伤为模型, 探讨蓝莓对酒精性肝损伤的保护作用及可能机制.
♀SD大鼠48只, 8周龄, 体质量150 g±20 g; 购自贵阳医学院动物实验中心(动物批号SYXK黔2012-0001, 伦理学文件批号1403070); 蓝莓(贵州省麻江蓝莓种植基地), -20 ℃储存, 使用时榨汁; 无水乙醇(川东化剂, GB/678-2002); 异甘草酸镁(天晴甘美, H20051942); 总RNA提取纯化试剂盒(Biomiga生物有限公司, R6311); SYBR® Premix Ex
Taq™ Ⅱ (Tli RNaseH Plus)、RT reagent Kit with gDNA Eraser(Perfect Real Time)(宝生物工程有限公司, RR047A); TLR4、GAPDH引物(宝生物工程有限公司, W12979, W12336); TLR4抗体(Abcam, ab8376); 羊抗兔二抗(上海基因工程部, GK500710); GAPDH兔抗鼠抗体(武汉博士德生物技术有限公司, 21260-1-ap); BCA蛋白定量试剂购(Biomiga, PW0104); ECL化学发光试剂(百乐公司, WBKLS0100); 肿瘤坏死因子α(tumor necrosis factor alpha, TNF-α)检测试剂盒(酶联生物, ml002859); 白介素-8(interleukin 8, IL-8)检测试剂盒(酶联生物, ml002885); 超氧化物歧化酶(superoxide dismutase, SOD)蛋白活性检测试剂盒(酶联生物, ml016361); 核酸定量仪(Amersham GeneQant™280); 荧光定量PCR仪(达安, DA7600); 超高速离心机(TGL-16G); 高速低温离心机(Sigma3K15); 电子天平(JA10003B); 紫外可见分光光度计(上海奥析科学仪器有限公司, 752); MSS全波长酶标仪(BioTec, ELX808); 电泳仪(北京市六一仪器厂, 1DYCZ-24DN); 显微镜图像采集系统(OLYMPUS, Olympus BX41); 凝胶成像系统(BIO-RAD, GelDocXR).
1.2.1 动物分组及处理: 48只♀SD大鼠适应性喂养1 wk后, 随机分均为正常组(A组), 蓝莓组(B组), 异甘草酸镁组(C组)及模型组(D组). 除A组不灌服乙醇溶液, 给予等体积生理盐水灌胃外, 其余各组均使用560 mL/L的乙醇溶液10 mL/(kg•d)灌胃, 连续灌胃4 wk. A组: 常规喂养, 灌服生理盐水; B组: 灌服乙醇同D组, 1 h后给予蓝莓原浆15 mL/(kg•d)灌胃; C组: 灌服乙醇同D组, 灌服乙醇1 h后, 异甘草酸镁溶液15 mL/(kg•d)灌胃; D组: 灌服乙醇, 1 h后灌服同B、C组相同体积的生理盐水. 造模结束时, 大鼠麻醉后处死. 留取血液, 常规制备血清于-80 ℃保存; 取相同部位肝组织用40 g/L中性甲醛固定用于制备HE染色切片, 剩余肝组织-80 ℃保存.
1.2.2 生化指标检测: 生化分析仪检测大鼠血清中谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)含量的变化.
1.2.3 肝组织中IL-8、TNF-α蛋白含量及SOD活性检测: 取各组大鼠肝组织, 严格遵照试剂说明书用ELISA法检测肝组织中IL-8、TNF-α蛋白含量, 测定SOD活性.
1.2.4 Western blot检测各组大鼠肝组织TLR4蛋白的表达: 依照试剂说明书提取蛋白并测定蛋白含量, 取蛋白质样品40 μg, 10%SDS-PAGE电泳, 转膜, 封闭. 而后用TLR4抗体(1∶1000)、4 ℃孵育过夜, 二抗(1∶3000)室温1 h, ECL曝光显影, Gel Doc EQ凝胶成像仪扫描, Quantity One软件分析结果. 以GAPDH表达水平作为内参, 目标蛋白的表达量以其蛋白灰度值与内参蛋白灰度值的对比值表示.
1.2.5 RT-PCR检测TLR4 mRNA的表达: 实验过程中总RNA提取、cDNA合成及PCR反应体系严格按照试剂盒说明书中的操作步骤进行. 取100 mg肝组织提取RNA并测定浓度. 将提取的RNA逆转录合成cDNA后加入引物行RT-PCR检测(引物序列及扩增大小如表1). 实验过程中以GAPDH作为内参对照, 进行标准转换得到各组样本的拷贝数(Ct值). 以Ct值均数来得出目的基因的表达量.
| 引物名称 | 序列 | 扩增大小(bp) |
| TLR4 | F:5'-CAGGTCGAATTGTATCGCCTT-3' | 399 |
| R:5'-CCTGTGAGGTCGTTGAGGTTAG-3' | ||
| GAPDH | F:5'-GTTGTCTCCTGCGACTTCA-3' | 293 |
| R:5'-GTTGTCTCCTGCGACTTCA-3' |
统计学处理 应用SPSS19.0统计软件分析, 数据资料用mean±SD表示. 多组间对比采用单因素方差分析; 组间两两对比时, 方差齐的情况采用LSD法, 方差不齐的情况采用Tamhane's法, P<0.05为差异有统计学意义.
A组肝组织HE染色未见异常. D组肝组织HE染色可见肝细胞弥漫性气球样变、脂肪变性, 部分区域可见炎性细胞浸润. B组和C组肝细胞以中央静脉为中心呈放射状排列, 较D组肝细胞气球样变及脂肪变性明显少见(图1).
与A组对比, B、C、D组血清ALT、AST、TG、TC含量明显增高(F = 47.984, 14.974, 149.338, 94.896, 均P<0.01); 与D组对比, B、C组血清ALT、AST、TG、TC含量明显降低(均P<0.01); 而B组与C组对比差异无统计学意义(均P>0.05)(表2).
与A组对比, B、C、D组肝组织匀浆中IL-8、TNF-α蛋白含量明显增高(F = 37.971, 76.250, 均P<0.01); 与D组对比, B、C组肝组织匀浆IL-8、TNF-α蛋白含量明显降低(均P<0.01); 而B组与C组对比差异无统计学意义(均P>0.05)(表3).
与A组对比, 肝组织匀浆中B、C、D组SOD活性明显降低(F = 35.390, P<0.01); 与D组对比, B、C组肝组织匀浆中SOD活性明显升高(P<0.01); 而B组与C组对比差异无统计学意义(P>0.05)(表3).
世界卫生组织报告[7]显示, 2012年全球每10 s就有1人死于饮酒, 而饮酒所造成的肝损害是主要死亡原因之一. 由于酒精性肝损伤的发病机制不十分明确, 临床上尚无特效治疗药物. 近年来研究[8]表明, 乙醇代谢引起的肝脏炎症免疫反应和氧化应激对酒精性肝损伤的发生发展起着主导作用. 研究[9-12]发现, 长期或大量饮酒会导致体内肠道微生态失衡, 造成细菌大量增长, 肠黏膜通透性增加, 致使肠源性内毒素在肝脏积累. 而内毒素中的主要成分脂多糖(lipopolysaccharides, LPS)是TLR4特异性识别配体. LPS与TLR4结合后, TLR4表达将增加并激活肝内枯否细胞, 使下游细胞因子和炎性因子如TNF-α、IL-8等大量释放[13,14], 引起肝脏炎症反应. 另一方面, 乙醇在肝脏中的代谢会使肝细胞积累大量活性氧, 造成细胞内脂质过氧化损伤并抑制SOD等抗氧化酶系活性[15]. 同时有研究[16]发现乙醇代谢引起的氧化应激不仅造成细胞脂质过氧化, 还能增加TLR4在肝组织中的表达, 导致乙醇诱导的肝损伤加重. 因此我们推测, 乙醇代谢引起TLR4表达的变化及机体氧化应激与酒精性肝损伤有着密切的关系.
异甘草酸镁, 是中华医学会《酒精性肝病诊疗指南(2010年修订版)》[17]中推荐治疗酒精性肝病药物之一, 能通过增强肝脏的抗氧化、抗炎能力, 保护肝脏的功能. 故本研究使用异甘草酸镁作为药物阳性对照组, 来推测蓝莓对酒精性肝损伤的作用机制.
蓝莓, 又被称为越橘. 被英国权威营养学家列为"15种健康食品之首". Ozcelik等[18]在动物实验上显示蓝莓能有效防治对乙酰氨基酚诱导的肝脏毒性, 其保护作用可归结为蓝莓的抗氧化和抗炎活性. Gong等[19]研究发现, 蓝莓提取物花青素明显拮抗氯化镉引起的小鼠肝损伤, 减轻肝脏脂质过氧化和炎症免疫反应. 我课题组前期研究[20,21]也表明, 蓝莓能够通过其所含的抗氧化、抗炎等活性物质对急、慢性肝损伤能够起到较好的保护作用.
本次研究发现, 蓝莓组和异甘草酸镁组大鼠血清中ALT、AST、TG、TC含量无统计学差异(均P>0.05), 但较模型组显著降低(均P<0.01), 且HE染色病理结果也发现蓝莓组、异甘草酸镁组大鼠肝细胞中脂肪沉积、炎细胞浸润程度明显低于模型组. 提示蓝莓具有保护乙醇代谢引起的肝功能损害、血脂代谢紊乱的作用, 并能拮抗肝细胞脂肪的沉积和炎症免疫反应. 此外, 蓝莓组及异甘草酸镁组大鼠肝组织中TLR4的表达及肝组织匀浆中TNF-α、IL-8的含量明显低于模型组(均P<0.01), 而蓝莓组与异甘草酸镁组对比无统计学差异(均P>0.05), 表明蓝莓可能通过抑制TLR4的表达进而调节肝组织中TNF-α及IL-8的释放, 改善乙醇代谢时肝脏炎症的发生. 同时, 蓝莓组及异甘草酸镁组大鼠肝组织匀浆中SOD的活性明显高于模型组(P<0.01), 蓝莓组与异甘草酸镁组对比无统计学差异(P>0.05), 提示蓝莓还能够通过增强肝细胞的抗氧化能力, 对抗乙醇代谢引起的氧化应激起到对肝脏的保护作用.
总之, 乙醇代谢引起的SOD活性下降及TLR4表达增加可能是酒精性肝损伤的相关机制, 而蓝莓对酒精性肝损伤的保护作用可能与其高含量的抗炎、抗氧化物质调控此机制有关. 一方面抑制了TLR4蛋白的信号传导通路避免其过度激活, 减少了下游炎性因子TNF-α及IL-8的释放; 另一方面提高了机体的抗氧化应激能力, 避免了氧化应激的过度发生. 从炎症免疫反应及氧化应激这两个方面的拮抗作用, 对酒精性肝损伤的发生发展起到了较好的保护效果. 而蓝莓对酒精性肝损伤保护作用的深入机制有待进一步的研究.
过量饮酒已成为全球慢性肝病的主要致病因素, 由于其发病机制复杂, 临床尚无特效药物. 研究发现, 乙醇代谢引起的炎症免疫反应及氧化应激是造成酒精性肝损伤的主要因素. 而蓝莓富含花青素、绿原酸、黄酮素等多种活性成分, 具有明确的抗炎、抗氧化作用, 对急慢性肝损伤均有较好的防治效果. 因此, 蓝莓对酒精性肝损伤是否具有防治作用以及通过何种机制值得深入探讨.
陈国凤, 主任医师, 中国人民解放军第302医院肝纤维化诊疗中心
目前研究表明, Toll样受体4(Toll-like receptor 4, TLR4)在肝实质细胞、肝内枯否细胞中均有大量表达, 其介导的炎症免疫反应是各种急慢性肝损伤的重要发病机制. 这意味着TLR4很可能参与了酒精性肝损伤的发生发展. 但其详细机制尚不十分明确. 而蓝莓是否能够对酒精性肝损伤起到一定的保护作用以及是否通过调节TLR4的表达来实现, 未见相关报道.
Peng等研究发现, 乙醇的过量摄入会引起肠源性内毒素在肝脏积累, 而内毒素的主要成分脂多糖与肝脏中TLR4特异性结合后将上调TLR4的表达, 并最终激活枯否细胞介导炎症免疫反应. 提示TLR4可能参与酒精性肝损伤的发生发展.
本研究通过RT-PCR、Western blot及ELISA法观察蓝莓对酒精性肝损伤大鼠肝组织中TLR4的表达及SOD活性的影响, 从炎症免疫反应和氧化应激两个方面阐述了蓝莓对酒精性肝损伤的保护作用, 为防治酒精性肝损伤提供了新的切入点.
蓝莓有效地改善乙醇代谢引起的肝脏炎症相关因子TLR4及其下游因子的表达, 并增强了机体的抗氧化应激能力, 对酒精性肝损伤起到了较好的拮抗作用, 为临床治疗酒精性肝病提供了新的思路与方法.
脂多糖(1ipopolysaccharides, LPS): 是革兰氏阴性细菌细胞壁成分. 细菌死亡溶解或破坏后释放, 其毒性成分主要为类脂质A. 能与TLR4特异性结合介导炎症反应; 枯否细胞: 是固定于肝血窦窦壁的巨噬细胞, 具有吞噬和清除肝血窦中细菌、异物和衰老红细胞的作用, 并参与免疫调节.
课题设计合理, 结果可信, 结论可靠. 有实用价值, 值得进一步研究.
编辑: 郭鹏 电编: 都珍珍
| 1. | Suk KT, Kim MY, Baik SK. Alcoholic liver disease: treatment. World J Gastroenterol. 2014;20:12934-12944. [PubMed] [DOI] |
| 2. | Gao B, Bataller R. Alcoholic liver disease: pathogenesis and new therapeutic targets. Gastroenterology. 2011;141:1572-1585. [PubMed] [DOI] |
| 3. | Liu J, Wang L. Baclofen for alcohol withdrawal. Cochrane Database Syst Rev. 2011;CD008502. [PubMed] [DOI] |
| 5. | Zmijewski E, Lu S, Harrison-Findik DD. TLR4 signaling and the inhibition of liver hepcidin expression by alcohol. World J Gastroenterol. 2014;20:12161-12170. [PubMed] [DOI] |
| 7. | World Health Organization. Global status report on alcohol and health 2014. Geneva: WHO 2014; . |
| 9. | Liu Y, Yin H, Zhao M, Lu Q. TLR2 and TLR4 in autoimmune diseases: a comprehensive review. Clin Rev Allergy Immunol. 2014;47:136-147. [PubMed] [DOI] |
| 11. | Yan AW, Fouts DE, Brandl J, Stärkel P, Torralba M, Schott E, Tsukamoto H, Nelson KE, Brenner DA, Schnabl B. Enteric dysbiosis associated with a mouse model of alcoholic liver disease. Hepatology. 2011;53:96-105. [PubMed] [DOI] |
| 12. | Miller AM, Horiguchi N, Jeong WI, Radaeva S, Gao B. Molecular mechanisms of alcoholic liver disease: innate immunity and cytokines. Alcohol Clin Exp Res. 2011;35:787-793. [PubMed] [DOI] |
| 13. | Peng JH, Cui T, Sun ZL, Huang F, Chen L, Xu L, Feng Q, Hu YY. Effects of Puerariae Radix Extract on Endotoxin Receptors and TNF-α Expression Induced by Gut-Derived Endotoxin in Chronic Alcoholic Liver Injury. Evid Based Complement Alternat Med. 2012;2012:234987. [PubMed] [DOI] |
| 14. | Guijarro-Muñoz I, Compte M, Álvarez-Cienfuegos A, Álvarez-Vallina L, Sanz L. Lipopolysaccharide activates Toll-like receptor 4 (TLR4)-mediated NF-κB signaling pathway and proinflammatory response in human pericytes. J Biol Chem. 2014;289:2457-2468. [PubMed] |
| 15. | Liu J, Wang X, Liu R, Liu Y, Zhang T, Fu H, Hai C. Oleanolic acid co-administration alleviates ethanol-induced hepatic injury via Nrf-2 and ethanol-metabolizing modulating in rats. Chem Biol Interact. 2014;221:88-98. [PubMed] |
| 16. | Wei J, Huang Q, Huang R, Chen Y, Lv S, Wei L, Liang C, Liang S, Zhuo L, Lin X. Asiatic acid from Potentilla chinensis attenuate ethanol-induced hepatic injury via suppression of oxidative stress and Kupffer cell activation. Biol Pharm Bull. 2013;36:1980-1989. [PubMed] |
| 18. | Ozcelik E, Uslu S, Burukoglu D, Musmul A. Chitosan and blueberry treatment induces arginase activity and inhibits nitric oxide production during acetaminophen-induced hepatotoxicity. Pharmacogn Mag. 2014;10:S217-S224. [PubMed] [DOI] |
| 19. | Gong P, Chen FX, Wang L, Wang J, Jin S, Ma YM. Protective effects of blueberries (Vaccinium corymbosum L.) extract against cadmium-induced hepatotoxicity in mice. Environ Toxicol Pharmacol. 2014;37:1015-1027. [PubMed] [DOI] |