修回日期: 2014-12-24
接受日期: 2014-12-30
在线出版日期: 2015-02-18
目的: 观察清热化湿舒胃方对KM小鼠感染幽门螺旋杆菌(Helicobacter pylori, H. pylori)动物模型血清中一氧化氮(nitric oxide, NO)含量和胃组织中诱导性一氧化氮合酶(inducible nitric oxide synthase, iNOS)表达的影响.
方法: 在复制KM小鼠H. pylori感染模型的基础上, 分为清热化湿舒胃方组、三联抗生素治疗组、清热化湿舒胃方结合三联抗生素组和模型对照组, 并分别进行干预和治疗. 治疗结束后采用硝酸还原酶法测定各组小鼠血清中的NO含量, 采用免疫组织化学法测定各组小鼠胃组织中iNOS的表达量.
结果: 所建立的H. pylori感染小鼠模型出现H. pylori在胃组织大量定植并造成胃黏膜慢性炎症损伤, 体内NO含量和胃组织iNOS表达显著升高; 清热化湿舒胃方干预后胃黏膜慢性炎症评分、体内NO含量和胃组织iNOS表达显著降低, 其与三联抗生素联用对H. pylori的根除效果优于单用三联抗生素.
结论: 清热化湿舒胃方具有修复H. pylori感染所致胃黏膜炎症损伤的作用, 其机制可能与降低胃组织iNOS活性表达和体内NO释放有关.
核心提示: 本实验对比清热化湿舒胃方与三联抗生素及二者联合用药对幽门螺旋杆菌(Helicobacter pylori)感染小鼠根除率及其胃黏膜中一氧化氮(nitric oxide)及诱导性一氧化氮合酶(inducible nitric oxide synthase)水平的影响. 进一步揭示了清热化湿舒胃方修复胃黏膜的作用机制, 为清热化湿舒胃方的临床应用与推广提供了实验依据与理论支持.
引文著录: 陈智龙, 吕永慧, 王玎, 涂星. 清热化湿舒胃方对幽门螺旋杆菌感染小鼠体内NO和胃组织iNOS表达的影响. 世界华人消化杂志 2015; 23(5): 711-718
Revised: December 24, 2014
Accepted: December 30, 2014
Published online: February 18, 2015
AIM: To observe the effects of Qingre Huashi Shuwei Fang on the content of nitric oxide (NO) in blood and the expression of inducible nitric oxide synthase (iNOS) in gastric tissue in mice with Helicobacter pylori (H. pylori) infection.
METHODS: After the successful induction of H. pylori infection in mice, the model mice were treated with Qingre Huashi Shuwei Fang, triple therapy (amoxicillin, esomeprazole sodium and clarithromycin), or Qingre Huashi Shuwei Fang combined with triple therapy. Non-treated model rats or normal rats were used as controls. After treatment, the content of NO in blood was determined by the Griess method, and the expression of iNOS in gastric tissue was detected by immunohistochemistry.
RESULTS: In the model group, chronic inflammation in gastric tissue was observed, and the content of NO in blood and the expression of iNOS in gastric tissue increased significantly. The content of NO in blood and the expression of iNOS were significantly decreased in the Qingre Huashi Shuwei Fang group. The H. pylori eradication in the Qingre Huashi Shuwei Fang combined with triple therapy group was better than that in the triple therapy group.
CONCLUSION: Qingre Huashi Shuwei Fang can reduce gastric mucosal injury caused by H. pylori infection, and this may have a relationship with its negative effect on the expression and release of iNOS in gastric tissue.
- Citation: Chen ZL, Lv YH, Wang D, Tu X. Effects of Qingre Huashi Shuwei Fang on serum nitric oxide and expression of inducible nitric oxide synthase in gastric tissue in mice with Helicobacter pylori infection. Shijie Huaren Xiaohua Zazhi 2015; 23(5): 711-718
- URL: https://www.wjgnet.com/1009-3079/full/v23/i5/711.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i5.711
幽门螺旋杆菌(Helicobacter pylori, H. pylori)是慢性萎缩性胃炎、消化性溃疡的重要致病因素之一[1,2], 其在胃窦部位定植后迅速繁殖并释放各种毒素, 直接引起黏膜上皮细胞的损害并激活炎症细胞使黏膜的炎症反应加重, 导致溃疡的形成[3,4]. 有研究[5-7]表明, 一氧化氮(nitric oxide, NO)在这一过程中起到不可忽视的作用, 且H. pylori感染可引起胃黏膜上皮细胞中诱导性一氧化氮合酶(inducible nitric oxide synthase, iNOS)活性增强. 清热化湿舒胃方主要由姜厚朴、佩兰、蒲公英、广藿香、紫苏梗等11味药物组成, 前期研究[8]表明其对H. pylori感染所致的胃炎具有一定的临床疗效, 但其作用机制尚不明确. 本研究拟采用H. pylori感染的KM小鼠作为研究对象, 探讨清热化湿舒胃方单用及与三联抗生素合用时对模型小鼠血清中NO的含量和胃组织中iNOS的表达量的影响, 初步探讨其作用机制.
66只KM小鼠, SPF级, 体质量35 g±5 g, 6-8周龄, 雌雄各半, 购自广州中医药大学实验动物中心, 许可证号: SCXK(粤)2013-0020. 实验操作在广州中医药大学第一附属医院实验中心SPF级动物实验设施中完成, 许可证号: SYXK(粤)2013-0092.
SⅡ悉尼H. pylori菌株(澳大利亚悉尼大学微生物实验室). 注射用乳糖酸阿奇霉素(批号: B130600812, 哈药集团制药总厂); 克拉霉素分散片(批号: 0081401003, 宜昌长江药业有限公司); 阿莫西林胶囊(批号: 40300201, 珠海联邦制药股份有限); 埃索美拉唑镁肠溶片(批号: 1405127, 阿斯利康制药有限公司). 清热化湿舒胃方水煎液: 取姜厚朴、佩兰、蒲公英、广藿香、紫苏梗、枳壳、茯苓、白术、熟党参、黄芩、甘草11味药, 加双蒸水清洗3次, 再加水煎煮20 min去渣, 于60 ℃水浴中浓缩成1 kg/L的流浸膏, 1000 r/min离心5 min, G4过滤, 密封后隔水煮沸消毒, 4 ℃冰箱保存备用. 一氧化氮试剂盒(南京建成生物工程研究所), 一氧化氮合酶试剂盒(福州迈新生物技术有限公司). 兔抗鼠多克隆抗体(日本株式会社同仁化学研究所).
Leika1900冰冻及石蜡切片机(德国Leika公司), OLYMPUS CHC型光学显微镜(日本OLYMPUS光学工业株式会社), Motic数码显微镜(厦门Motic实业有限公司), Sartorius AA-160型电子读数天平(北京赛多利斯仪器系统有限公司), 雷磁pHST-4A pH计(上海精密科学仪器有限公司).
1.2.1 试液的配制: 抗生素混合液的配制: 精密称取500 mg氨芐青霉素溶液、100 mg庆大霉素溶液和1250 mg阿奇霉素, 以无菌生理盐水稀释并定容至25 mL, 4 ℃下保存. 埃索美拉唑镁溶液: 埃索美拉唑镁肠溶片研成细粉, 精密称取20 mg, 以无菌生理盐水稀释并定容至50 mL, 4 ℃下保存. 克拉霉素溶液: 克拉霉素分散片研成细粉, 精密称取250 mg, 以无菌生理盐水稀释并定容至20 mL, 4 ℃下保存. 阿莫西林溶液: 精密称取阿莫西林胶囊内容物500 mg, 以无菌生理盐水稀释并定容至25 mL, 4 ℃下保存.
1.2.2 H. pylori菌株及培养: 采用含有VacA和CagA的国际标准菌株SⅡ, 采用布氏肉汤, 改良Skirrow培养基于厌氧箱中37 ℃微需氧(5%O2, 10%CO2, 85%N2)培养7 d. 并采用革兰氏染色法、尿素酶试验和过氧化氢酶试验进行鉴别. 鉴别后用无菌接种环从培养基上收集H. pylori菌落于无菌生理盐水中制成混悬液, 比浊法调整混悬液浓度为1×109 CFU/mL.
1.2.3 H. pylori感染小鼠模型的制备和药物干预: 66只KM小鼠随机分为H. pylori模型组4组(n = 54)和正常组(n = 12), 共5组. 模型组小鼠第1-3天每天灌胃抗生素混合液0.5 mL/只; 从第4天起, 每天禁食12 h后, 灌胃现配H. pylori混悬液0.5 mL/只, 连续7 d. 正常组小鼠每天灌胃无菌生理盐水0.5 mL/只. 造模结束后模型组有两只小鼠死亡, 将剩余52只H. pylori感染小鼠随机分为H. pylori感染模型组(model group, MG, n = 12)、中药组(Chinese medicine group, CG, n = 12)、三联抗生素组(triple therapy group, TG, n = 14)、中药组+三联抗生素组(CTG, n = 14)4组. CG组小鼠每天灌胃清热化湿舒胃方水煎剂0.8 mL; TG组小鼠每天灌胃0.13 mL埃索美拉唑溶液、0.13 mL阿莫西林溶液和0.104 mL克拉霉素溶液; CTG组每天灌胃0.13 mL埃索美拉唑溶液、0.13 mL阿莫西林溶液和0.104 mL克拉霉素溶液, 2 h后再灌胃清热化湿舒胃方水煎剂0.8 mL; MG组和正常组(normal group, NG)每天灌胃无菌生理盐水0.8 mL, 给药周期为14 d. 末次给药后4 h, 各组小鼠腹腔注射10%水合氯醛麻醉, 腹腔主动脉采血, 所采的血液存于Ep管内, 1000 r/min离心5 min后取上清液, 并做好标记, 备用. 取血完毕后的各组小鼠, 取出胃, 沿胃大弯剪开, 用无菌生理盐水冲洗残留物后取完整的胃组织切为2部分, 做好标记, 备用.
药物干预阶段, 小鼠三联抗生素治疗方案参照2012年《第四次全国幽门螺杆菌感染处理共识报告》[9]中标准三联药物用量, 经成人与小鼠体表面积比例换算得出.
1.2.4 H. pylori定植情况的判断和胃黏膜慢性炎症评分: 取一部分胃组织, 采用革兰染色涂片镜检、尿素酶试验和过氧化氢酶试验. 3种检测方法中只要有两种为阳性即认定小鼠胃黏膜有H. pylori感染, 只有1种阳性为可疑感染, 但不计算在内, 3项阴性者诊断为无H. pylori感染. 剔除可疑感染和无H. pylori感染的各组小鼠的血清和胃组织. 将有H. pylori感染的小鼠胃组织用40 g/L甲醛固定, 石蜡切片, 进行Giemsa染色, 并于400倍显微镜下观察5个切片视野, 以H. pylori数量多少进行计分判断其定植情况, 评分标准如表1[10]. 并观察黏膜固有层慢性炎症细胞(淋巴细胞、浆细胞及嗜酸性粒细胞)和中性粒细胞浸润情况, 对固有层慢性炎症程度进行计分, 标准如表2[11].
| 分数 | 评分标准 |
| 0分 | 任何胃小凹内均观察不到H. pylori定植 |
| 1分 | 少量H. pylori定植且不是每个胃小凹内都能观察到(1-2个细菌/胃小凹) |
| 2分 | H. pylori定植量低但在多数胃小凹内可观察到(3-10个细菌/胃小凹) |
| 3分 | 所有胃小凹内均有中量到多量的H. pylori(11-20个H. pylori/胃小凹) |
| 4分 | 大量定植, 所有胃小凹内均满布H. pylori(>20个H. pylori/胃小凹) |
| 分数 | 评分标准 |
| 0分 | 未见或偶见炎症细胞 |
| 1分 | 轻度的多灶性分布 |
| 2分 | 轻度的广泛分布或中度的多灶性分布 |
| 3分 | 轻度广泛分布并中度多灶性分布或重度多灶性分布 |
| 4分 | 中度广泛分布 |
| 5分 | 中度广泛分布并重度多灶性分布 |
| 6分 | 重度广泛分布 |
1.2.5 血清中NO的含量测定: 取有H. pylori感染的各组小鼠血清, 按照NO试剂盒说明书采用硝酸还原酶法检测血清中NO的含量.
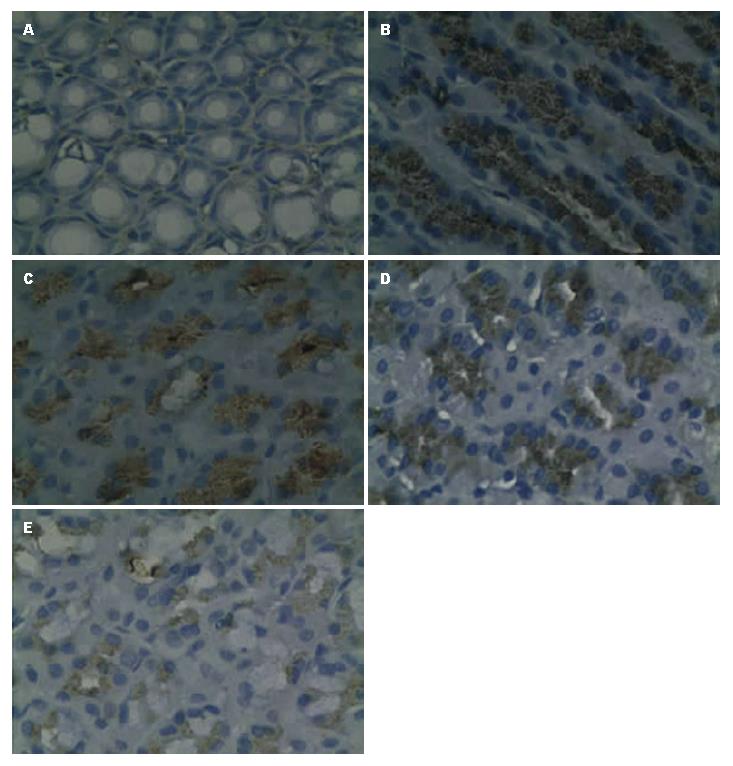
1.2.6 胃组织中iNOS的表达量测定: 取有H. pylori感染的各组小鼠的另一部分胃组织放入4%多聚甲醛/PBS中固定24 h后, 脱水、透明、石蜡包埋, 进行免疫组织化学染色. 具体操作为制作5 μm石蜡切片, 贴敷于玻璃载片上, 用3%H2O2去离子水孵育10 min, 以消除内源性过氧化物酶活性; 蒸馏水冲洗后以PBS浸泡5 min, 滴加正常血清孵育15 min, 倾去, 不洗涤. 滴加1∶100的一抗(兔抗鼠多克隆抗体), 37 ℃孵育2 h, PBS冲洗3次×3 min; 滴加二抗(IgG), 室温孵育1 h, PBS冲洗3次×3 min; 滴加SP, 室温孵育1 h, PBS冲洗3次×3 min; 显色剂DAB-H2O2显色; 自来水冲洗, 脱水、透明、封片. 同时以PBS代替第一抗体, 作阴性对照试验. 反应切片用Olympus显微镜进行形态学观察, 然后用HMIAS-2000高清晰度彩色医学图文分析系统分析, 每组切片在400倍物镜下随机取5个视野, 经灰度调节后, 测定阳性细胞平均光密度.
统计学处理 采用SPSS13.0软件进行数据处理和分析, 计量资料数据以mean±SD表示. 若数据符合正态分布, 方差齐性, 多组数据采用单因素方差分析(One-way ANOVA), 两两比较采用LSD进行分析, 自身的前后对照采用配对t检验; 若数据不符合正态分布或方差不齐, 则采用非参数检验中的多个独立样本Kruskal-Wallis H检验, 两两比较采用SNK-q进行分析. 以P<0.05为差异有统计学意义.
革兰氏染色后显微镜下可见H. pylori呈典型的螺旋状或S状弯曲, 偶见杆状或圆球状, 菌体一端或两端有多根带鞘鞭毛, 染色呈阴性, 运动活泼(图1); 快速尿素酶试验可见与细菌尿素酶比色定性检测试剂接触部分在2 min左右变成紫红色, 而空白培养基无颜色改变; 过氧化氢酶试验发现与过氧化氢接触部位出现大量的气泡, 呈阳性.
经革兰染色涂片镜检、尿素酶试验和过氧化氢酶试验, 发现有H. pylori感染的MG组小鼠12只, CG小鼠11只, CTG组小鼠10只, TG组小鼠10只, 其余9只小鼠未见明显的H. pylori感染. 对各组小鼠进行H. pylori定植判断结果如表3.
由结果可见, 与模型组比较, 清热化湿舒胃方组、三联抗生素组和联合用药组H. pylori定植评分显著下降(P<0.05), 表明经上述3种干预治疗后, 小鼠胃组织中H. pylori显著减少, 且三联抗生素组对H. pylori的根除效率显著高于清热化湿舒胃方组(P<0.05), 而三联抗生素组与联合用药组差异无统计学意义. 由结果可见, 与模型组比较, 清热化湿舒胃方组、三联抗生素组和联合用药组胃黏膜慢性炎症评分显著下降(P<0.05), 且清热化湿舒胃方组的效果显著高于三联抗生素组(P<0.05), 两者联用可显著增强其对胃黏膜慢性炎症的修复作用. 结果提示, 清热化湿舒胃方与三联抗生素联用对H. pylori感染所致的慢性胃炎的疗效最佳, 其主要机制可能与三联抗生素主要发挥根除H. pylori的作用, 而清热化湿舒胃方主要发挥修复胃黏膜炎症的作用有关.
与正常组比较, 有H. pylori感染的模型小鼠胃组织中NO含量显著升高(P<0.05); 与模型组比较, 各给药组小鼠胃组织中NO含量均显著下降(P<0.05), 且三联抗生素组小鼠胃组织中NO含量显著高于清热化湿舒胃方组和联合用药组(P<0.05, P<0.05), 但清热化湿舒胃方组和联合用药组差异无统计学意义(P>0.05) (表4). 与正常组比较, 有H. pylori感染的模型小鼠胃组织中iNOS的表达量显著升高(P<0.05); 与模型组比较, 清热化湿舒胃方组和联合用药组小鼠胃组织中iNOS表达量均显著下降(P<0.05), 但三联抗生素组差异无统计学意义(P>0.05); 小鼠胃组织中iNOS的表达量在清热化湿舒胃方组和联合用药组差异无统计学意义(P>0.05) (表4, 图2).
调查研究[12]表明, H. pylori在全世界范围感染率超过50%, 我国平均感染率为55%. 目前大量的研究[13,14]证实H. pylori与慢性胃炎、胃溃疡、胃癌的发生、发展有密切关系, 是极其重要的始动因素. 临床上多采用两种抗生素加质子泵抑制剂作为根除H. pylori的首选药物. 但近年来, 随着抗生素的广泛使用及不规范的治疗, 抗生素的耐药性逐年升高, 三联疗法清除率已经普遍下降. 且该法存在患者依从性差、不良反应大和抗生素耐药等缺点[15]. 现今推荐抗生素四联疗法清除H. pylori的方案存在重金属铋累积残留的隐患. 而中药复方具有相对安全, 不良反应小, 耐药性少, 不会引起肠道菌群失调等优势, 已被最新的H. pylori清除共识意见所推荐[9], 成为辅助根除H. pylori的研究热点[16,17].
本研究采用的建模方法成功地建立了小鼠胃感染H. pylori模型, 方法简便, 效果稳定, 可用于抗H. pylori药物的实验研究. 本研究表明, 采用清热化湿舒胃方联合三联抗生素有明显的根除H. pylori作用, 其作用可能与修复胃黏膜慢性炎症有关, 疗效比三联抗生素效果佳.
在H. pylori感染引起慢性胃炎、消化性溃疡的过程中, NO具有重要的作用. 正常情况下, 胃黏膜血管内皮细胞和神经细胞中的iNOS作用于L-精氨酸, 产生生理需要的NO, 调节胃黏膜血流量、胃酸分泌和黏液分泌, 起到保护胃黏膜的作用. 当胃黏膜发生炎症时, 细菌内毒素及炎细胞分泌和释放大量的细胞因子等诱导iNOS表达增强, 产生大量的NO, 过量的NO可与超氧阴离子与过氧化氢等结合从而介导组织细胞脂质过氧化和细胞毒性作用, 可杀伤入侵的细菌、真菌等微生物和肿瘤细胞、有机异物等[18-20], 一定程度上具有诱发机体产生炎症和免疫反应的作用, 进而导致胃黏膜的损伤[21,22]. 有学者运用一氧化氮合酶抑制剂氨基胍(AG)发现可明显降低组织器官等相关损伤与炎症反应[23,24]. 魏房等[25]研究发现iNOS有促进肿瘤血管生成而促进胃癌的转移的作用. 本研究发现, 感染H. pylori小鼠iNOS的表达和NO含量均较正常组显著增加, 提示iNOS活性增高, NO过量释放是H. pylori致慢性炎症、消化性溃疡的机制之一. 而以清热化湿舒胃方及清热化湿舒胃方联合三联抗生素治疗后, iNOS表达和NO量均显著降低, 且两者之间差异无统计学意义, 提示清热化湿舒胃方能够修复H. pylori所致胃黏膜慢性炎症且该修复作用与三联抗生素无关, 其机制可能与调控iNOS的表达及NO的释放有关.
清热化湿舒胃方是广州中医药大学附属广州市中医医院临床使用10余年的中药复方, 对急慢性胃炎、浅表性胃炎和萎缩性胃炎等有较好的治疗效果, 主要由姜厚朴、佩兰、蒲公英、广藿香、紫苏梗、枳壳、茯苓、白术、熟党参、黄芩、甘草等11味药组成. 目前研究[16,26]表明, 黄芩、蒲公英[27]已证实对H. pylori有较强的杀灭作用; 并有相关研究[28]提示黄芩苷可通过下调iNOS基因转录和蛋白表达, 降低LPS诱导的巨噬细胞NO生成, 抑制炎症反应. 王嫦鹤等[29]研究发现白术内酯Ⅰ对可抑制NO、iNOS等炎症介质的释放或过强表达, 进而减轻实验小鼠体内免疫反应, 降低组织损伤. 茯苓具有免疫调节作用和较强的抗氧化作用, 能提高动物体内自由基清除酶的活力[30], 而过量的NO可与超氧阴离子与过氧化氢等结合形成的活性代谢产物是H. pylori致病的主要因素之一, 清热化湿舒胃方抗H. pylori所致炎症可能与黄芩、白术、茯苓降低组织中NO及iNOS的表达与生成, 进而减轻炎症反应, 起到保护胃黏膜的作用有关. 清热化湿舒胃方既能直接杀灭H. pylori, 清除H. pylori引起的一些致病因素, 还能调节免疫系统, 增强胃黏膜抵御H. pylori的能力, 其根除H. pylori效果虽不及西药的三联疗法, 但对胃黏膜慢性炎症的修复作用更佳, 且不存在耐药性、不良反应及致肠道菌群失调等问题, 具有较好的应用前景, 有待进一步开发研究.
幽门螺旋杆菌(Helicobacter pylori, H. pylori)在全世界范围感染率超过50%, 我国平均感染率为55%. 目前大量的研究证实H. pylori与慢性胃炎、胃溃疡、胃癌的发生、发展有密切关系, 是极其重要的始动因素.
陈卫昌, 教授, 苏州大学附属第一医院消化内科
目前研究多集中于开发清除H. pylori更优方案. 现临床上主流的采用三联抗生素疗法存在患者依从性差、不良反应大和抗生素耐药等缺点. 而中药复方因其具有不良反应小, 耐药性少, 不会引起肠道菌群失调等优势, 正成为辅助根除H. pylori的研究热点.
目前大量研究表明, 清热化湿类中药及成方对H. pylori有较强的杀灭作用, 且对于胃黏膜修复作用优于单纯三联抗生素疗法. 然而其促进黏膜修复的机制尚不甚清晰, 有待进一步研究以明确.
本研究首次观察了清热化湿舒胃方联合三联抗生素对H. pylori感染实验小鼠胃黏膜内一氧化氮(nitric oxide, NO)及诱导性一氧化氮合酶(inducible nitric oxide synthase, iNOS)含量的影响. 有助于进一步阐明清热化湿类中药方剂对胃黏膜产生修复作用的机制.
清热化湿舒胃方联合三联抗生素根除H. pylori感染疗效确切. 通过对比发现清热化湿舒胃方可进一步降低胃黏膜中NO及iNOS含量, 促进胃黏膜修复. 对比单纯三联抗生素治疗不良反应少, 疗效更佳, 有较大的临床应用前景.
NO: 是由胃黏膜血管内皮细胞和神经细胞中的iNOS作用于L-精氨酸而产生的. NO具有调节胃黏膜血流量、胃酸分泌和黏液分泌, 保护胃黏膜的作用. 炎症刺激可诱导iNOS表达增强, 产生大量的NO与超氧阴离子与过氧化氢等结合从而介导组织细胞脂质过氧化和细胞毒作用, 可杀伤病菌、肿瘤细胞及有机异物等引发炎症.
本研究科学的将清热化湿舒胃方对H. pylori感染小鼠体内NO及胃组织内iNOS的影响进行了观察与研究. 发现该中药复方不仅有效辅助三联抗生素治疗方案进行H. pylori清除, 同时还可显著降低实验鼠体内NO及iNOS的表达, 从而起到减轻胃黏膜炎症反应, 促进修复的作用. 一定程度上揭示了清热化湿类中药复方治疗H. pylori相关性胃炎的作用机制, 具有一定的创新性.
编辑: 韦元涛 电编: 都珍珍
| 1. | Repetto O, Zanussi S, Casarotto M, Canzonieri V, De Paoli P, Cannizzaro R, De Re V. Differential proteomics of Helicobacter pylori associated with autoimmune atrophic gastritis. Mol Med. 2014;20:57-71. [PubMed] [DOI] |
| 2. | Arnold IC, Hitzler I, Müller A. The immunomodulatory properties of Helicobacter pylori confer protection against allergic and chronic inflammatory disorders. Front Cell Infect Microbiol. 2012;2:10. [PubMed] [DOI] |
| 5. | Cherdantseva LA, Potapova OV, Sharkova TV, Belyaeva YY, Shkurupiy VA. Association of Helicobacter pylori and iNOS production by macrophages and lymphocytes in the gastric mucosa in chronic gastritis. J Immunol Res. 2014;2014:762514. [PubMed] [DOI] |
| 6. | 王 丽, 周 源, 姜 德建, 李 元建. 一氧化氮合酶抑制物在胃黏膜损伤中的作用与机制. 国际病理科学与临床杂志. 2006;26:1-6. |
| 8. | 陈 芳. 清热化湿法联合西药治疗HP相关性胃炎临床疗效观察. 广州: 广州中医药大学 2013; . |
| 9. | 刘 文忠, 谢 勇, 成 虹, 吕 农华, 胡 伏莲, 张 万岱, 周 丽雅, 陈 烨, 曾 志荣, 王 崇文. 第四次全国幽门螺杆菌感染处理共识报告. 现代消化及介入诊疗. 2012;17:358-363. |
| 11. | 刘 翔. 胃内菌群对H. pylori定植的影响和双歧杆菌治疗. 长沙: 中南大学 2007; . |
| 14. | Wang YZ, Cao YQ, Wu JN, Chen M, Cha XY. Expression of nitric oxide synthase in human gastric carcinoma and its relation to p53, PCNA. World J Gastroenterol. 2005;11:46-50. [PubMed] [DOI] |
| 21. | Hsu DZ, Liu MY. Involvement of nitric oxide in gastric protection of epinephrine in endotoxin intoxication in rats. Toxicology. 2004;204:203-208. [PubMed] [DOI] |
| 22. | Raij L. Nitric oxide in the pathogenesis of cardiac disease. J Clin Hypertens (Greenwich). 2006;8:30-39. [PubMed] [DOI] |
| 23. | 李 柏峰, 刘 永锋, 夏 丽萍, 程 颖, 成 东华, 王 晓东, 李 铁民, 赵 宁. iNOS抑制剂对大鼠胰腺缺血/再灌注损伤的保护作用. 世界华人消化杂志. 2005;13:44-48. |