修回日期: 2014-12-10
接受日期: 2014-12-15
在线出版日期: 2015-02-08
目的: 探讨β-连环素(β-catenin)和血管内皮生长因子(vascular endothelial growth factor, VEGF)在肝细胞癌中的表达以及相关性.
方法: 应用免疫组织化学方法检测48例肝细胞癌及16例正常肝组织β-catenin及VEGF的表达情况.
结果: β-catenin在正常组织呈正常表达, 在肝细胞癌中异常表达, VEGF在正常细胞呈阴性, 肝细胞癌中高表达(P<0.05); 在肝细胞癌组织中, VEGF的高表达和β-catenin异常表达有相关性(P<0.05, r = 0.361); β-catenin和VEGF的异常表达与临近组织侵犯、肿瘤直径相关(P<0.05).
结论: 在肝癌组织中, β-catenin和VEGF的表达有关联性; β-catenin在肝癌组织的表达和VEGF的高表达与肿瘤直径、临近组织侵犯相关.
核心提示: 在肝癌组织中, β-连环素(β-catenin)和血管内皮生长因子(vascular endothelial growth factor, VEGF)的表达有关联性; β-catenin在肝癌组织的表达和VEGF的高表达与肿瘤直径、临近组织侵犯相关.
引文著录: 范正军, 杨飞龙, 朱广灿. β-连环素和血管内皮生长因子在肝细胞癌中的表达及意义. 世界华人消化杂志 2015; 23(4): 665-670
Revised: December 10, 2014
Accepted: December 15, 2014
Published online: February 8, 2015
AIM: To investigate the expression of β-catenin and vascular endothelial growth factor (VEGF) in hepatocellular carcinoma (HCC) and to analyze their significance.
METHODS: The expression of β-catenin and VEGF was detected in 48 HCC and adjacent HCC tissues and 16 normal liver tissues by immunohistochemical method.
RESULTS: The expression of β-catenin was normal in the 16 cases of normal liver tissues but abnormal in HCC. The expression of VEGF was normal in normal liver tissues but high in HCC tissues (P < 0.05). There was a association between the abnormal expression of β-catenin and the high expression of VEGF in HCC tissues (P < 0.05, r = 0.361). The abnormal expression of β-catenin and VEGF were positively correlated with invasion to adjacent tissues and tumor diameter (P < 0.05).
CONCLUSION: The expression of VEGF was associated with expression of β-catenin in HCC, abnormal expression of β-catenin and high expression of VEGF were related to tumor diameter and invasion of adjacent tissues.
- Citation: Fan ZJ, Yang FL, Zhu GC. Significance of expression of β-catenin and VEGF in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(4): 665-670
- URL: https://www.wjgnet.com/1009-3079/full/v23/i4/665.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i4.665
Wnt信号通路在胚胎发育、成年机体组织再生及多种生理过程中均有重要的作用, 其经典传导通路, 即Wnt/β-连环素蛋白(β-catenin)的致肿瘤作用及促血管生成作用是近年的研究热点[1]. β-catenin是Wnt信号通路经典传导模式中的关键蛋白. Wnt信号通路与血管生理关系密切, 有促血管生成的作用. 已有研究[2]表明, 肿瘤的发生、转移伴随有新生血管的形成. 血管内皮生长因子(vascular endothelial growth factor, VEGF)是强效、特异的促肿瘤血管生长因子. β-catenin和VEGF在多种肿瘤发生、发展的作用, 特别是在结直肠癌等的作用已见报道[3], 但两者在肝细胞癌中的作用还需更进一步、更加深入的研究. 本研究通过检测β-catenin和VEGF在肝细胞癌中的表达, 初步探讨二者之间的关联.
收集2012-05/2013-04郑州大学第一附属医院肝胆外科手术切除的48例肝癌组织石蜡包埋标本. 16例石蜡包埋正常肝组织取自郑州大学第一附属医院病理科. 48例肝癌患者术前均未接受针对肿瘤的治疗, 术后病理诊断均证实为肝细胞肝癌, 其中男39例, 女9例, 平均年龄51.63岁±10.55岁. 主要试剂β-catenin一抗及VEGF一抗购自Bioworld公司, 工作浓度1:200, SP试剂盒购自康为公司. 本研究获相关患者知情同意并报郑州大学第一附属医院伦理委员会批准.
1.2.1 免疫组织化学染色: 标本固定、包埋、切片后65 ℃烤30 min, 依次脱蜡水化, 加3%的双氧水10 min后蒸馏水洗片3次, 枸橼酸盐缓冲液中水浴修复抗原后PBS洗2次, 5%BSA室温下孵育20 min, 加一抗后4 ℃冰箱中过夜; PBS洗3次后加滴加辣根过氧化物酶标记的Ⅱ抗, 37 ℃孵育30 min, PBS洗3次后加SP液37 ℃孵育1 h. PBS洗5次, DAB染色、苏木素液复染、脱水、封片、光镜观察.
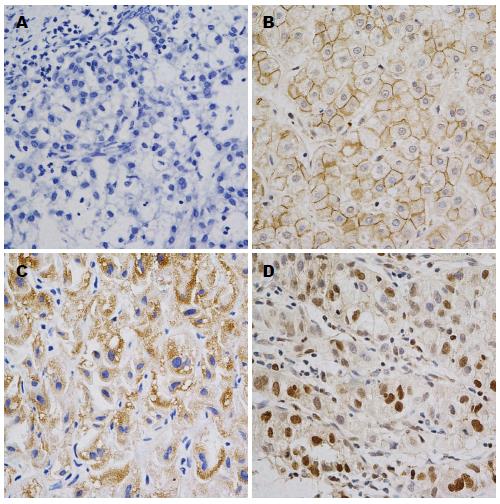
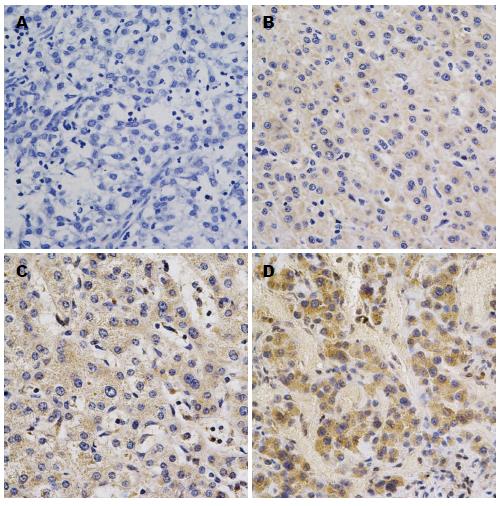
1.2.2 结果判定: β-catenin染色结果依据Maruyama等[4]的方法, 从细胞膜、细胞质、细胞核3方面进行综合判断, 细胞膜阳性表达细胞率>70%正常表达, 不足判定为表达减弱或缺失; 胞浆或胞核阳性表达细胞率>10%判定为异位表达. 异常表达包括细胞膜表达减弱或缺失和异位表达. VEGF染色结果依据许良中等[5]的方法, 从染色强度和染色细胞所占百分比两方面进行综合判断, 染色强度无着色0分, 淡黄色1分, 棕黄色2分, 棕褐色3分; 着色细胞占计数细胞百分比率为0者, 记0分, <10%为1分, 10%-50%为2分, 51%-75%为3分, >75%为4分. 染色强度与阳性细胞百分比相乘, <3分者为阴性, ≥3分者为阳性.
统计学处理 采用SPSS21.0进行统计学分析. 无序多分类数据使用χ2检验或Fisher确切概率法, 以P<0.05为差异有统计学意义.
β-catenin在正常肝细胞的表达定位于细胞膜, 胞浆及细胞核极少见染色(图1B), 在肝癌细胞内可见到胞浆及核内染色(图1D), 肝癌组织与正常肝组织之间的表达差异有统计学意义(P<0.05)(表1); VEGF在正常肝组织阴性表达(图2B), 在肝癌组织(图2D)高表达, 差异有统计学意义(P<0.05)(表2).
从β-catenin和VEGF的表达和临床病理特征关系的研究中可以看出: β-catenin的异常表达和VEGF的高表达与性别、年龄、甲胎蛋白(α-fetoprotein, AFP)水平、乙型肝炎无相关性(P>0.05), 与周围组织侵犯及肿瘤直径相关(P<0.05)(表3).
| 类别 | n | β-catenin | P值 | VEGF | P值 | ||
| 正常表达 | 异常表达 | + | - | ||||
| 年龄(岁) | |||||||
| <40 | 4 | 2 | 2 | >0.05 | 3 | 1 | >0.05 |
| <60 | 37 | 8 | 29 | 26 | 11 | ||
| ≥60 | 7 | 4 | 3 | 2 | 5 | ||
| 性别 | |||||||
| 男 | 39 | 9 | 30 | >0.05 | 28 | 11 | >0.05 |
| 女 | 9 | 5 | 4 | 3 | 6 | ||
| 分化程度 | |||||||
| 高 | 8 | 5 | 3 | >0.05 | 6 | 2 | >0.05 |
| 中 | 35 | 8 | 27 | 22 | 13 | ||
| 低 | 5 | 1 | 4 | 3 | 2 | ||
| AFP(μg/mL) | |||||||
| <400 | 23 | 8 | 15 | >0.05 | 14 | 9 | >0.05 |
| ≥400 | 25 | 6 | 19 | 17 | 8 | ||
| 乙型肝炎 | |||||||
| 有 | 37 | 9 | 28 | >0.05 | 23 | 14 | >0.05 |
| 无 | 11 | 5 | 6 | 8 | 3 | ||
| 组织侵犯 | |||||||
| 有 | 11 | 0 | 11 | <0.05 | 11 | 0 | <0.05 |
| 无 | 37 | 14 | 23 | 20 | 17 | ||
| 肿瘤直径(cm) | |||||||
| <2 | 3 | 3 | 0 | <0.05 | 0 | 3 | <0.05 |
| <5 | 21 | 7 | 14 | 12 | 9 | ||
| <10 | 22 | 4 | 18 | 17 | 5 | ||
| ≥10 | 2 | 0 | 2 | 2 | 0 | ||
β-catenin是Wnt信号通路经典传导通路中的关键蛋白, 正常情况下, β-catenin结合于由肠腺瘤息肉蛋白(adenomatous polyosis coli, APC)、酪蛋白激酶(casein kinase, CK)、Axin等组成降解复合体上, 并被糖原合成激酶(glycogen synthase kinase-3β, GSK-3β)等磷酸化, 并经β-TrCP(beta-transducin repeats-containing proteins)作用后被降解, 这一过程使β-catenin在胞浆内维持在低浓度[6]. 由此, 正常情况下, β-catenin主要定位于细胞膜, 本实验通过组织免疫组织化学方法检测正常肝组织中β-catenin的表达, 发现其表达主要定位于细胞膜, 胞内少见. 当Wnt通路中某一环节出现异常, 致使降解复合体的稳定性遭到破坏, 就会导致β-catenin在细胞质内异常积聚, 进而进入细胞核, 激活核内相关因子, 发挥其病理作用及致癌作用[7].
本研究以免疫组织化学方法检测肝细胞癌组织中β-catenin表达, 发现细胞膜染色缺失, 以及胞浆与细胞核异常染色(图1), 表明β-catenin在肝细胞癌组织中呈现异常表达, 且较之正常组织, 这种异常表达有统计学差异(P<0.05), 提示β-catenin的异常表达与肝癌的发生关系密切. β-catenin与人类肿瘤的关系最先在家族性腺瘤息肉病(familiar adenomatous polyposis, FAP)中被发现[8], FAP最终会发展成大肠癌. 既往有研究[4,9]表明, β-catenin在大肠癌中呈异常表达, 表现为细胞膜表达缺失, 而在胞浆以及细胞核内呈现异常的高表达. 本实验发现其在肝细胞癌中呈现相似的表达情况.
本实验检测到VEGF在肝癌组织中异常高表达, 且与肿瘤周围组织侵犯及肿瘤大小有关, 提示VEGF可能促进肝癌的生长和侵袭. VEGF是一种高效、特异的促肿瘤血管生成因子. 已有研究[2]表明, 当恶性肿瘤生长到一定体积时, 就需要新生血管来促进肿瘤进一步生长, 新生血管的形成也是肿瘤侵袭转移的必要条件[10].
同时, 本实验中发现, 在肝癌组织中, β-catenin和VEGF的表达具有关联性(P<0.05, r = 0.361)(表4). 这提示Wnt/β-catenin信号通路可能通过其促血管生成作用, 影响肝癌的生长和侵袭. 同时, Wnt通路在血管生成中起到重要作用, 动物实验研究发现, Wnt通路的异常, 可以导致毛细血管网络发育的异常[11,12], 并且, 人类家族性渗出性玻璃体视网膜病变(familial exudative vitreoretinopathy, FEVR)的发病, 直接与Wnt/β-catenin有关[13,14]. 这些证据表明, Wnt/β-catenin通路和血管生理病理密切相关. VEGF可能是Wnt/β-catenin信号通路的下游靶基因. Easwaran等[15]研究发现, VEGF基因启动子区含有与β-catenin/T细胞因子(T-cell factor, TCF)的结合位点, 在正常结肠上皮细胞中转染β-catenin后能够显著上调VEGF mRNA和蛋白表达. 在肝癌中可能也存在同样的机制.
由此可见, β-catenin和VEGF在肝细胞癌的发生发展及侵袭性中, 发挥重要作用. 由于Wnt/β-catenin信号通路中的基因突变, 致使细胞膜β-catenin的表达缺失, 影响细胞间的黏附; 其在胞浆内异常积聚, 激活核内TCF、淋巴增强因子(lymphoid enhancer factor, LEF)等下游靶基因, 进而影响VEGF等的表达, 加快肿瘤发展及侵袭性. 本实验初步探讨β-catenin和VEGF在肝细胞癌中的表达及其关联性, 而进一步明确二者在肝细胞癌中的作用机制, 仍需大样本、多方法深入、细致研究, 并应与临床肝癌的治疗紧密结合.
肝细胞癌是人类消化系最常见的恶性肿瘤之一, 其发生、发展及侵袭转移机制是研究热点问题. β-连环素(β-catenin)和血管内皮生长因子(vascular endothelial growth factor, VEGF)被证实与多种肿瘤的方发生及侵袭相关, 本研究旨在探讨其在肝细胞癌的表达及意义.
庹必光, 教授, 遵义医学院附属医院消化科
β-catenin蛋白的致肿瘤作用及其与血管生理病理的作用是近年的研究热点.
β-catenin和VEGF在多种肿瘤发生、发展的作用, 特别是在结直肠癌等的作用已见报道, 但两者在肝细胞癌中的作用还需更进一步、更加深入的研究.
检测β-catenin和VEGF在肝细胞癌中的表达, 并分析其关联性.
β-catenin和VEGF可能成为临床上肝细胞癌治疗的靶点.
β-连环素(β-catenin): 是Wnt信号通路经典传导通路中的关键蛋白, 正常情况下定位于细胞膜; 血管内皮生长因子(VEGF): 是强效、特异的促肿瘤血管生长因子.
本研究发现β-catenin和VEGF的异常表达和高表达, 两者之间表达相关, 其结果有重要的临床价值.
编辑: 韦元涛 电编:闫晋利
| 1. | Klaus A, Birchmeier W. Wnt signalling and its impact on development and cancer. Nat Rev Cancer. 2008;8:387-398. [PubMed] [DOI] |
| 2. | Folkman J. Tumor angiogenesis: therapeutic implications. N Engl J Med. 1971;285:1182-1186. [PubMed] [DOI] |
| 3. | Calviello G, Resci F, Serini S, Piccioni E, Toesca A, Boninsegna A, Monego G, Ranelletti FO, Palozza P. Docosahexaenoic acid induces proteasome-dependent degradation of beta-catenin, down-regulation of survivin and apoptosis in human colorectal cancer cells not expressing COX-2. Carcinogenesis. 2007;28:1202-1209. [PubMed] [DOI] |
| 4. | Maruyama K, Ochiai A, Akimoto S, Nakamura S, Baba S, Moriya Y, Hirohashi S. Cytoplasmic beta-catenin accumulation as a predictor of hematogenous metastasis in human colorectal cancer. Oncology. 2000;59:302-309. [PubMed] [DOI] |
| 6. | Clevers H, Nusse R. Wnt/β-catenin signaling and disease. Cell. 2012;149:1192-1205. [PubMed] [DOI] |
| 7. | Jamieson C, Sharma M, Henderson BR. Targeting the β-catenin nuclear transport pathway in cancer. Semin Cancer Biol. 2014;27:20-29. [PubMed] |
| 8. | Nishisho I, Nakamura Y, Miyoshi Y, Miki Y, Ando H, Horii A, Koyama K, Utsunomiya J, Baba S, Hedge P. Mutations of chromosome 5q21 genes in FAP and colorectal cancer patients. Science. 1991;253:665-669. [PubMed] [DOI] |
| 9. | Li VS, Ng SS, Boersema PJ, Low TY, Karthaus WR, Gerlach JP, Mohammed S, Heck AJ, Maurice MM, Mahmoudi T. Wnt signaling through inhibition of β-catenin degradation in an intact Axin1 complex. Cell. 2012;149:1245-1256. [PubMed] [DOI] |
| 10. | Folkman J. Role of angiogenesis in tumor growth and metastasis. Semin Oncol. 2002;29:15-18. [PubMed] [DOI] |
| 11. | Monkley SJ, Delaney SJ, Pennisi DJ, Christiansen JH, Wainwright BJ. Targeted disruption of the Wnt2 gene results in placentation defects. Development. 1996;122:3343-3353. [PubMed] |
| 12. | Jeays-Ward K, Hoyle C, Brennan J, Dandonneau M, Alldus G, Capel B, Swain A. Endothelial and steroidogenic cell migration are regulated by WNT4 in the developing mammalian gonad. Development. 2003;130:3663-3670. [PubMed] [DOI] |
| 13. | MacDonald IM, Sasi R. Molecular genetics of inherited eye disorders. Clin Invest Med. 1994;17:474-498. [PubMed] |
| 14. | Robitaille J, MacDonald ML, Kaykas A, Sheldahl LC, Zeisler J, Dubé MP, Zhang LH, Singaraja RR, Guernsey DL, Zheng B. Mutant frizzled-4 disrupts retinal angiogenesis in familial exudative vitreoretinopathy. Nat Genet. 2002;32:326-330. [PubMed] [DOI] |
| 15. | Easwaran V, Lee SH, Inge L, Guo L, Goldbeck C, Garrett E, Wiesmann M, Garcia PD, Fuller JH, Chan V. beta-Catenin regulates vascular endothelial growth factor expression in colon cancer. Cancer Res. 2003;63:3145-3153. [PubMed] |