修回日期: 2014-12-30
接受日期: 2015-01-04
在线出版日期: 2015-02-08
目的: 本课题应用PCR和基因测序等技术, 观察免疫接种后慢性乙型肝炎病毒(hepatitis B virus, HBV)感染者的PreS2基因变异情况, 进而初步探讨乙型肝炎疫苗免疫失败与PreS2基因变异之间的相互关系; 为进一步探索新的HBV抗病毒基因治疗靶点提供理论基础.
方法: 收集昆明市延安医院和昆明市第三人民医院免疫接种后慢性HBV感染者的血液标本共47例, 从血清标本中提取HBV DNA; 用PCR法扩增PreS2基因片段; 扩增后的基因片段进行DNA序列分析. 扩增出PCR产物的有35例, 上海生工测序最终完成测序的有32例, 其中男18例, 女14例, 年龄19-56岁, 平均年龄32.75岁±10.22岁. 32份样本的HBV PreS2基因片段测序后, 以GenBank数据库中登录号为NC_003977.1的HBV DNA全基因序列为参照, 用Chromas软件分析测序图及BLASTN对测序结果进行比对分析后, 采用SPSS11.5统计软件进行统计分析.
结果: 32例标本中PreS2基因全部出现点突变(100%), 其中2例出现缺失突变(6.3%), 提示可能存在Ile、Tyr、Phe、Gly、Arg等氨基酸的缺失, 32例标本均未发现PreS2起始密码子ATG的变异, 点突变共发生517次, PreS2基因碱基突变有11种类型: G-A、A-G、T-C、A-T、G-T、C-T、G-C、A-C、C-G、C-A、T-A. 11种不同类型的点突变在突变例数率及突变次数率方面均不全相同, 其中A-T的突变例数较多, G-A的突变次数较多, 差异有统计学意义(P<0.05). PreS2基因不同部位点突变比较结果显示PreS2基因前端、中段、末端点突变率不全相同, 其中中段(nt45-99), 即PreS2基因的56-110位点突变率较高, 前端突变率较低, 差异有统计学意义(P<0.05).
结论: PreS2基因变异与免疫失败可能存在相关关系, 这将为今后深入研究乙型肝炎疫苗免疫失败的发生机制并用于指导临床实践提供理论基础. 同时, 进一步确定PreS2基因变异位点, 并针对这些靶点设计相应的基因治疗方法, 也可能成为今后乙型肝炎疫苗免疫研究的新方向.
核心提示: 本课题收集了一定数量的珍贵的免疫接种后乙型肝炎病毒(hepatitis B virus, HBV)感染患者的血清标本, 观察了免疫接种后慢性HBV感染者的PreS2基因变异情况, 研究结果提示PreS2基因变异与免疫失败可能存在相关关系, 这将为今后深入研究乙型肝炎疫苗免疫失败的发生机制并用于指导临床实践提供理论基础.
引文著录: 龙云, 杨莉, 曹向红, 李晓进. 免疫接种后HBV感染者PreS2基因变异的情况. 世界华人消化杂志 2015; 23(4): 547-555
Revised: December 30, 2014
Accepted: January 4, 2015
Published online: February 8, 2015
AIM: To observe hepatitis B virus (HBV) PreS2 gene mutations in patients after hepatitis B vaccine immunization, and to discuss the relationship between hepatitis B vaccine immunization failure and PreS2 gene mutations.
METHODS: Forty-seven blood samples were collected from patients with chronic HBV infection after hepatitis B vaccine immunization who were treated at the Kunming Yan'an Hospital and the Third People's Hospital. HBV DNA was extracted from serum samples, and PreS2 gene fragments were amplified by PCR. The amplified gene fragments were analyzed by DNA sequencing. PCR products were obtained in 35 cases, and DNA sequencing was performed in 32 cases. There were 18 males and 14 females, and their age ranged from 19 to 56 years, with a mean value of 32.75 ± 10.22. The sequences of the amplifed PreS2 gene fragment sequences were analyzed with Chromas software and compared with sequenced deposited in Genbank with BLASTN. The results were analyzed using SPSS11.5 software.
RESULTS: The rate of PreS2 point mutations was 100% in the 32 specimens, including two (6.3%) cases of deletion mutations (6.3%), indicating that there may be deletion of amino acids such as Ile, Tyr, Phe, Gly, and Arg. Variation in the preS2 start codon (ATG) was not found in the 32 cases. There were a total of 517 point mutations, and preS2 base mutations had 11 types, namely, G-A, A-G, T-C, A-T, G-T, C-T, G-C, A-C, C-G, C-A, and T-A. The rate of different types of point mutations and the number of cases with different types of point mutations varied, with the rate of G-A mutation being highest and the greatest number of cases having the A-T mutation (P < 0.05). The rate of point mutations in different regions of the PreS2 gene also varied, with the middle region (nt 45-99) having a higher mutation rate and the upstream region having a lower mutation rate (P < 0.05).
CONCLUSION: There may be a correlation between PreS2 gene mutations and immunization failure, which will provide a theoretical basis for further study of the mechanism of hepatitis B vaccine immunization failure and guide the clinical practice. Gene therapy targeting these PreS2 gene mutations may become a new research direction of hepatitis B vaccine immunization.
- Citation: Long Y, Yang L, Cao XH, Li XJ. Hepatitis B virus PreS2 gene mutations in patients after hepatitis B vaccine immunization. Shijie Huaren Xiaohua Zazhi 2015; 23(4): 547-555
- URL: https://www.wjgnet.com/1009-3079/full/v23/i4/547.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i4.547
乙型肝炎至今尚无特效的治疗药物, 控制的关键在预防. 接种乙型肝炎疫苗已成为预防乙型肝炎病毒(hepatitis B virus, HBV)感染最安全、最有效的手段[1]. 然而, 接种乙型肝炎疫苗后的免疫应答受多种因素的影响, 约10%成年人和5%儿童接种疫苗后乙型肝炎表面抗体始终阴性或达不到保护阈值, 重新成为HBV的易感者, 这种现象称为乙型肝炎疫苗免疫失败[2]. 免疫失败者因不能受到乙型肝炎疫苗的有效保护, 成为HBV感染的高危人群. 目前认为, 乙型肝炎疫苗免疫失败与多种因素有关, 其中, 免疫逃逸HBV中和抗体的变异株的感染引起了广泛的重视. HBV是一种高变异病毒. 他在复制过程中因DNA聚合酶和逆转录酶缺乏校正功能, 使其可能发生一个核苷酸(点突变)或多个核苷酸的变异. HBV S基因编码表面抗原(hepatitis B surface antigen, HBsAg). HBsAg是乙型肝炎疫苗的主要成分, 是诊断感染的重要依据. S基因区又分为S区、PreS2及PreS1区3段. 其中PreS2基因与病毒的感染性和活动性复制有密切关系, 可作为判断HBV感染者是否有病毒活动性和较大传染性的新标志. 本研究旨在研究乙型肝炎疫苗免疫失败的肝炎患者PreS2基因变异率, 并初步探讨乙型肝炎疫苗免疫失败与PreS2基因变异之间的相互关系; 为进一步探索新的HBV抗病毒基因治疗靶点提供可能理论基础.
共收集47例免疫接种后慢性HBV感染者的血液标本, 来源于昆明市延安医院和昆明市第三人民医院2012-11/2013-07的门诊患者, 其中扩增出PCR产物的有35例, 上海生工测序最终完成测序的有32例(HBV DNA拷贝水平不同), 其中男18例, 女14例, 年龄19-56岁, 平均年龄32.75岁±10.22岁.
入选标准: 既往曾有乙型肝炎疫苗接种史(中国于1988年普及接种乙型肝炎疫苗, 2002年卫生部将乙型肝炎疫苗列入基础免疫免费接种项目); 目前至少有一项现症HBV感染病原学依据: (1)血清HBsAg阳性; (2)血清HBV DNA阳性; (3)血清乙型肝炎核心抗体-免疫球蛋白M(hepatitis B core antibody-immunoglobulin M, 抗HBc-IgM)阳性; (4)肝组织核心抗原(hepatitis B core antigen, HBcAg)和/或HBsAg阳性, 或HBV DNA阳性. 纳入对象包括慢性乙型肝炎、乙型肝炎肝硬化、携带者、隐匿性慢性乙型肝炎(具体参照2010年版慢性乙型肝炎防治指南).
排除标准: 合并非HBV感染因素引起的急慢性肝炎, 如甲型肝炎、丙型肝炎、丁型肝炎、酒精、遗传代谢、淤胆、循环障碍、药物、毒物、脂肪肝、自身免疫等引起的肝损害; 原发性肝癌患者.
从免疫接种后慢性HBV感染者血清标本中提取HBV DNA; PreS2基因引物由上海生工生物工程技术服务有限公司合成. 上游引物SPS2为5'-TCAGGCTCAGGGCATA-3'(nt3092-3107), 下游引物ASPS2为5'-AACCCCGCCTGTAACACGAG-3'(nt193-212). 用PCR法扩增PreS2基因片段; 扩增的PreS2基因片段经琼脂糖凝胶电泳鉴定及回收纯化后送往上海生工生物工程技术服务有限公司进行测序(测序仪器为ABI PRISM 3730, 测序试剂为BigDye terminator v3.1). 每份标本均进行正反双向测序. HBV DNA PreS2基因序列与GenBank数据库中编号NC_003977.1的HBV标准株全基因序列为参照, 应用NCBI BLASTN序列分析工具对序列测定结果进行比较, 确定核苷酸的突变位点, 对正反双向的测序结果进行比对验证, 当同一位点存在一种以上序列峰型, 且每种均达到总峰值的25%以上时, 报告为突变/未突变序列共存.
统计学处理 采用SPSS11.5统计软件进行统计分析, 符合率比较采用Kappa一致性检验. P<0.05为差异具有统计学意义.
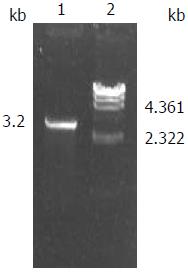
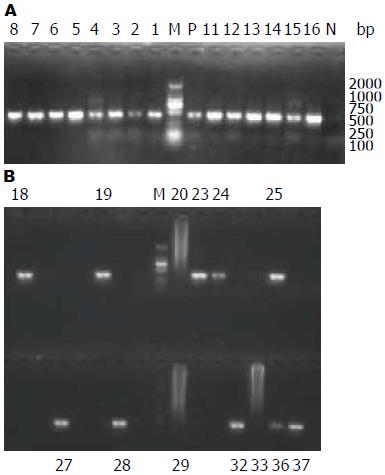
HBV DNA大小约3.2 kb, 位置在3.2 kb的凝胶条带即含有所需的目的DNA片段(图1). 利用自行设计的引物P1(SPS2)、P2(ASPS2)成功扩增出HBV PreS2抗原基因片段, PCR产物经琼脂糖凝胶分析显示扩增片段约342 bp, 与预期片段符合, 且无非特异扩增现象. 电泳后样本(sample, S)PreS2基因片段的条带位于marker 250 bp与500 bp条带之间, 和阳性对照(positive, P)的条带一致. 空白对照(N)未发现条带(图2). 32份样本的HBV PreS2基因片段测序后, 与GenBank数据库中基因型相对应的HBV标准株NC_003977.1用BLASTN进行多序列比对. 部分标本测序结果如图3. 以GenBank数据库中登录号为NC_003977.1的HBV DNA全基因序列为参照, 用BLASTN对序列测定结果进行比对, 进行定位与分析, 对正反双向的测序结果进行比较验证. 采用Chromas软件分析测序图, 当同一位点存在一种以上的序列峰型, 且每种均达到总峰值的25%以上时, 疑似为突变/未突变序列共存(杂合子峰). 将疑似为杂合子峰的测序图位点与测序结果的文本序列和基因库中的比对结果相比较, 一个位点的多个样本相比较, 确定核苷酸的可能突变位点. 部分标本测序结果用BLASTN进行比对分析的结果如图4. 实验结果表明, 32例标本中PreS2基因全部出现点突变(100%), 其中2例出现缺失突变(6.3%), 提示可能存在Ile、Tyr、Phe、Gly、Arg等氨基酸的缺失, 32例标本均未发现PreS2起始密码子ATG的变异, 点突变共发生517次, PreS2基因碱基突变有11种类型: G-A、A-G、T-C、A-T、G-T、C-T、G-C、A-C、C-G、C-A、T-A. 11种不同类型的点突变在突变例数率及突变次数率方面均不全相同, 其中A-T的突变例数较多, G-A的突变次数较多, 差异有统计学意义(P<0.05). PreS2基因不同部位点突变比较结果显示PreS2基因前端、中段、末端点突变率不全相同, 其中中段(nt45-99), 即PreS2基因的56-110位点突变率较高, 前端突变率较低, 差异有统计学意义(P<0.05)(表1, 2).
| PreS2突变碱基 | 突变(n) | 未突变(n) | 例数率值(%) | 突变次数 | 次数率值(%) |
| G-A | 24 | 8 | 75.0 | 104 | 20.1 |
| A-G | 24 | 8 | 75.0 | 84 | 16.2 |
| T-C | 27 | 5 | 84.3 | 52 | 10.0 |
| A-T | 30 | 2 | 93.7 | 50 | 9.6 |
| C-T | 25 | 7 | 78.1 | 45 | 8.7 |
| G-C | 22 | 10 | 68.7 | 42 | 8.1 |
| A-C | 28 | 4 | 87.5 | 28 | 5.4 |
| C-G | 25 | 7 | 78.1 | 25 | 4.8 |
| C-A | 20 | 12 | 62.5 | 21 | 4.0 |
| G-T | 20 | 12 | 62.5 | 46 | 8.8 |
| T-A | 20 | 12 | 62.5 | 20 | 3.8 |
| χ2值 | 19.01 | 312.78 | |||
| P值 | <0.05 | <0.05 | |||
| PreS2基因 | 点突变次数 | 率值(%) |
| 前端(nt3205-3215, nt1-44) | 132 | 25.5 |
| 中段(nt45-99) | 219 | 42.3 |
| 末端(nt100-154) | 166 | 32.1 |
| 总计 | 517 | 100.0 |
| χ2值 | 31.02 | |
| P值 | <0.05 | |
HBV感染目前已是全球性的公共卫生问题, 控制慢性HBV感染的关键仍然在于预防. 乙型肝炎疫苗接种是目前预防和控制HBV感染流行和传播的最有效措施[3]. 应用0、1、6 mo程序接种乙型肝炎疫苗后, 约90%成年人和95%的儿童和青少年可产生抗-HBs, 其水平≥10 mIU/mL. 然而, 在疫苗的使用中, 仍有一个难以解决的问题, 那就是疫苗接种后表现出无应答或低应答(疫苗无应答是指接种乙型肝炎疫苗后抗-HBs水平<10 mIU/mL; 疫苗低应答是指抗-HBs水平在10-99 mIU/mL)[4], 即乙型肝炎疫苗免疫失败. 免疫失败者由于不能得到乙型肝炎疫苗的有效保护, 和未接受免疫接种者共同成为HBV感染的高危人群. 研究[2]表明成年人和儿童接种疫苗后的免疫失败率约为10%和5%, 目前研究认为乙型肝炎疫苗免疫失败与众多因素有关, 如疫苗的质量; 疫苗的接种部位、剂量、途径及次数; 疫苗佐剂; 母亲血清中病毒含量; 接种者的体质量指数; 潜在的隐匿性感染; 免疫应答异常; 遗传; 病毒免疫逃逸突变株的出现; 检测方法不同等[5]. 在上述诸多影响乙型肝炎疫苗接种效果的因素中, 病毒免疫逃逸突变株的出现已引起广泛关注, 成为目前国内外学者极为重视的研究方向.
HBV属于嗜肝DNA病毒科, 由于HBV复制过程中HBV DNA聚合酶缺乏校正功能, 导致HBV容易发生突变. HBV可以在慢性持续性感染的过程中发生自然变异, 也可以因各种抗HBV治疗, 如干扰素的使用等诱发病毒变异, 也可以受人体免疫应答或疫苗接种的影响, 使病毒在免疫压力下发生变异. 乙型肝炎疫苗明显具有免疫选择基因变异株的作用, 长期推广乙型肝炎疫苗后, HBV基因变异株有可能在免疫后人群中流行而成为新的公共卫生问题. 美国、新加坡、日本、英国及世界其他地区大量研究[6-8]报告显示: 联合应用乙型肝炎高效免疫球蛋白和乙型肝炎疫苗母婴阻断失败者, DNA直接测序法检测, 表面抗原氨基酸置换率约为10%-40%. 据调查, 我国单纯乙型肝炎疫苗免疫后携带者表面抗原氨基酸置换率为31%, 比未免疫携带者高6倍[9]. 实验研究结果均显示: HBV表面抗原基因变异株同野毒株一样, 有致病力和传播能力. 病毒免疫逃逸株的生物学特性常发生改变, 尤其是HBV编码蛋白发生变异, 可以导致HBV感染致病机制的变化, 是影响慢性HBV感染发生、发展的重要因素之一[10].
HBV基因组全长约3.2 kb, 为部分双链环状DNA, 他可以分为4个开放读码框, 分别为S、C、P和X区. HBV S基因区主要编码HBsAg, HBsAg有重要的生物学意义, 是诊断HBV感染的重要依据. S基因区可分为S区、PreS1区和PreS2区3段. 在HBV全基因范围内, 免疫阻断失败儿童最易发生变异的区域为S区的"a"决定簇(124-147AA), 人均核苷酸变异率达l.0%, 氨基酸变异率达2.3%[11]. 经多年研究发现, PreS抗原具有可被肝细胞识别的表位, 其相应抗体可能有一定的中和作用如阻止HBV对肝细胞的附着、膜穿透及被肝细胞内吞. PreS抗原具有可被T和B淋巴细胞识别的表位, 具有较强的免疫原性, 对诱导T淋巴细胞活化、增强细胞与体液免疫可能发挥重要作用[12,13]. Milich等[14]将PreS与S抗原一并注入S抗原无应答模型小鼠, 发现PreS抗原可显著提高小鼠抗-HBs应答水平, 征服小鼠对S抗原的无应答. 另有几个随机对照试验亦显示PreS+S抗原疫苗能够较迅速地诱导抗体应答并显著提高抗-HBs平均滴度[15-17]. 还有研究[18]指出, 对S抗原疫苗无应答者复种一针PreS+S抗原疫苗, 共效果明显优于复种一针与前相同的S抗原疫苗. 这些重要发现催生了含重组PreS抗原的第3代乙型肝炎疫苗的研究与开发. 上述研究表明, PreS抗原在HBV感染和复制过程中起重要作用, 是诱导产生抗-HBs的重要决定簇, 能提高抗-HBs的阳转率和滴度. 而PreS区的突变, 尤其是保守区内的突变, 可能也和病毒的免疫逃逸及乙型肝炎疫苗免疫失败有关.
PreS2抗原作为HBV的衣壳蛋白, 其不仅存在于病毒颗粒表面, 亦可出现在非传染性的球形颗粒表面, 具有调节对S蛋白的免疫应答及控制病毒颗粒装配等功能, 从而促进病毒的免疫清除[19,20]. 孙剑等[21]研究表明, PreS2抗原与病毒血清学指标中乙型肝炎病毒e抗原(hepatitis B e antigen, HBeAg)的关系最为密切, PreS2抗原和HBeAg几乎均可完整反映感染者肝内HBV复制、血清具有强传染性. PreS2抗原在指示乙型肝炎隐性感染者HBV复制、乙型肝炎传染性方面比HBeAg更为优越和可靠. 另外, 王中兴等[22]报道PreS2可较好地反映HBV DNA存在或病毒活跃程度. PreS2确实是反映HBV复制及传染性的又一可靠的指标, 可作为判断HBV感染者是否有病毒活动性和较大传染性的新标志[23]. PreS2变异可终止中蛋白合成, 改变大、中、小蛋白比例, 使肝细胞内储积的大蛋白的细胞不良反应及肝细胞对炎性细胞因子敏感性的提高, 导致疾病的进展[24]. 另外, PreS2具有可被T和B淋巴细胞识别的表位, 具有较强的免疫原性, 对诱导T淋巴细胞活化、增强细胞与体液免疫可能发挥重要作用[12,13]. 而T、B细胞识别表位的缺失可导致相应抗原决定簇的丢失, 从而使病毒得以逃避宿主免疫清除, 导致免疫失败. 武力等[25]研究发现PreS2变异主要影响表面蛋白的表达, 改变了B细胞识别位点, PreS2起始密码变异株造成M蛋白的缺失与重型肝炎相关, 可能是导致严重肝病的因素之一. 国外报道认为PreS2起始密码变异株的感染可能与急性暴发性肝炎发生有关存在差异. 研究[26]发现, 30-49位氨基酸是重型肝炎变异比较集中的位点, 此区域位于PreS2区的T细胞表位内. 王梅等[27]从HBV基因型角度研究发现, 与B基因型相比, C型HBV感染者更易发生PreS2起始码、PreS区缺失变异, PreS基因变异与肝病进展及预后相关. 丁静娟等[28]研究表明PreS2起始码点变异检出率在肝细胞癌(hepatocellular cancer, HCC)、肝硬化(liver cirrhosis, LC)组较慢性肝炎(chronic hepatitis, CH)组高, 提示PreS基因变异与疾病进展有关. 而Rizzetto等[29]报道, 含PreS1、PreS2及S抗原的新型乙型肝炎疫苗可引发对普通疫苗无应答者的抗体反应. 提高乙型肝炎疫苗的免疫应答率. 上述研究均表明PreS2是反映HBV复制及传染性的重要指标, 其在调控HBV复制及促进病毒的免疫清除方面具有重要意义, PreS2基因变异与肝病进展及预后相关, 还可能是影响乙型肝炎疫苗免疫失败重要因素之一, 故研究PreS2基因突变与乙型肝炎疫苗免疫失败的关系具重要意义.
我们的研究发现32例标本中PreS2基因全部出现点突变, 其中2例出现缺失突变, 提示可能存在Ile、Tyr、Phe、Gly、Arg等氨基酸的缺失, 32例标本均未发现PreS2起始密码子ATG的变异, 点突变共发生517次, PreS2基因碱基突变有11种类型: G-A、A-G、T-C、A-T、G-T、C-T、G-C、A-C、C-G、C-A、T-A. 11种不同类型的点突变在突变例数率及突变次数率方面均不全相同, 其中A-T的突变例数较多, G-A的突变次数较多. PreS2基因不同部位点突变比较结果显示PreS2基因前端、中段、末端点突变率不全相同, 其中中段(nt45-99), 即PreS2基因的56-110位点突变率较高, 前端突变率较低.
既往研究表明, PreS2起始码点突变和前S区缺失变异是HBV前S基因变异的主要模式. 李兰娟等[26]观察了20例重型肝炎PreS2基因变异情况, 其中有2例PreS2基因起始密码子发生变异(ATG→ACT、ATG→ATA), 8例发生前S区缺失突变. 王梅等[27]分析了160份基因型为B型及C型HBV感染者标本, 其中81例B型HBV感染者中PreS2起始码点突变者仅为1例(1.23%), 前S区缺失变异者为16例(19.75%), 而79例C型HBV感染者中PreS2起始码点突变例数为34例(43.04%), 前S区缺失变异者为29例(36.71%), 与B基因型相比, C型HBV感染者更易发生PreS2起始码、PreS区缺失变异. 丁静娟等[28]收集了138份无症状携带者(hepatitis B virus carriers, AsC)、CH、LC、HCC患者标本研究PreS2起始码点突变和前S区缺失变异情况, 结果显示HCC、LC组PreS区缺失变异检出率及PreS2起始码变异检出率均高于ASC及CH组, PreS区缺失变异检出率及PreS2起始码变异检出率在HBeAg阴性组均高于HBeAg阳性组. 上述研究表明PreS2起始码点突变和PreS区缺失变异的检出率受多种因素影响, 如HBV基因型、肝炎活动度、肝病的进展分期以及血清中HBeAg的滴度等. 故本实验中32例标本均未发现PreS2起始密码子ATG的变异, 2例出现缺失突变(6.3%), 这与本实验样本量相对较小有关, 32例标本中14例为HBeAg阴性, 18例HBeAg阳性(56.25%), HBeAg阳性标本所占比例较大, 可能影响PreS区缺失变异检出率及PreS2起始码变异检出率. 本实验标本来源中无症状HBV携带者居多, 根据以往的实验结果, 可能会出现检出率偏低的情况. 另外由于实验条件有限, 本实验未对32例HBV感染者进一步行HBV基因分型, 故也不能排除不同HBV基因分型对PreS区缺失变异检出率及PreS2起始码变异检出率的影响. 边涛等[30]在PreS区段序列突变分析中发现在34-174位PreS氨基酸中, 共发生56次突变. 其中36-67, 154-182为突变发生比较集中区域, 分别位于PreSl的前端和PreS2的末端, 且变异程度较S蛋白高. 本研究结果显示PreS2基因前端、中段、末端点突变率不全相同, 其中中段(nt45-99), 即PreS2基因的56-110位点突变率较高, 末端其次, 前端突变率相对较低, 与以往报道有所不同, 可能需进一步增大样本含量观察. 仅就本实验的研究结果而言, PreS2基因碱基突变的类型以A-T、G-A、A-G的突变次数及例数较多, 对此目前国内外尚无相关报道. 不同碱基突变与免疫失败之间是否具有相关关系仍需进一步研究.
由于HBV可以受人体免疫应答或疫苗接种的影响, 使病毒在免疫压力下发生变异, 也可以在慢性持续性感染的过程中发生自然变异, 就本实验而言, 尚不能确定PreS2基因变异与免疫失败的具体作用关系, 是PreS2基因变异影响了乙型肝炎疫苗的免疫应答导致免疫失败, 还是乙型肝炎疫苗的接种影响了PreS2基因变异, 何者处于主导地位, 尚需进行深入的研究. 在本实验中, 我们收集了一定数量的珍贵的免疫接种后HBV感染患者的血清标本, 检测了PreS2基因变异的情况, 创新性地在免疫失败人群中研究并探讨PreS2基因变异与免疫失败的可能关系, 为今后深入探索免疫失败机制奠定了理论基础. 由于乙型肝炎疫苗接种知识在广大人群中缺乏普及, 导致相当比例的接种者认为乙型肝炎疫苗可终身免疫, 不了解抗体会随时间延长滴度逐渐下降以至失去保护力, 也不知道乙型肝炎疫苗会出现免疫失败的情况, 这就导致乙型肝炎疫苗接种后人群门诊乙型肝炎血清学标志物复诊率低, 故实验标本较难获得, 实验结果受到样本量低的影响. 乙型肝炎疫苗免疫失败与众多因素有关, 如疫苗的质量; 疫苗的接种部位、剂量、途径及次数; 疫苗佐剂; 母亲血清中病毒含量; 接种者的体质量指数; 潜在的隐匿性感染; 免疫应答异常; 遗传; 病毒免疫逃逸突变株的出现; 检测方法不同等. 故本实验在免疫失败后人群中观察PreS2基因变异的情况仅为描述性研究, 不能排除上述诸多因素的影响, 尚不能确定PreS2基因变异与免疫失败的具体作用关系. 另外, PreS2起始码点突变和PreS区缺失变异的检出率受多种因素影响, 如HBV基因型、肝炎活动度、肝病的进展分期以及血清中HBeAg的滴度等. 本实验样本量相对较小, 标本来源中无症状HBV携带者居多, HBeAg阳性标本所占比例较大, 可能影响PreS区缺失变异检出率及PreS2起始码变异检出率. 另外由于实验条件有限, 本实验未对32例HBV感染者进一步行HBV基因分型及进行肝组织穿刺病理学检查, 故也不能排除不同HBV基因分型及不同肝炎活动度对PreS区缺失变异检出率及PreS2起始码变异检出率的影响. 因此, 进一步加大样本含量, 对免疫失败后HBV感染者进行HBV基因分型、向患者普及肝穿刺活检相关知识, 提高临床肝穿刺活检技术的安全性, 使患者普遍接受肝穿刺活检操作, 从不同HBV基因型及不同肝炎活动度及肝病进展分期方面深入研究PreS2基因变异与免疫失败的作用关系, 将是今后进一步研究的方向之一. 同时, 进一步确定PreS2基因变异位点, 并针对这些靶点设计相应的基因治疗方法, 也可能成为今后乙型肝炎疫苗免疫研究的新方向.
本课题应用PCR和基因测序等技术, 观察免疫接种后慢性HBV感染者的PreS2基因变异情况. 研究显示, 32例标本中PreS2基因全部出现点突变(100%), 2例出现缺失突变(6.3%), 未发现PreS2起始密码子ATG的变异, 点突变共发生517次, PreS2基因碱基突变有11种类型: G-A、A-G、T-C、A-T、G-T、C-T、G-C、A-C、C-G、C-A、T-A. 11种不同类型的点突变在突变例数率及突变次数率方面均不全相同, 其中A-T的突变例数较多, G-A的突变次数较多, 差异有统计学意义(P<0.05). PreS2基因不同部位点突变比较结果显示PreS2基因前端、中段、末端点突变率不全相同, 其中中段(nt45-99), 即PreS2基因的56-110位点突变率较高, 前端突变率较低, 差异有统计学意义(P<0.05). 本研究结果提示PreS2基因变异与免疫失败可能存在相关关系, 这将为今后深入研究乙型肝炎疫苗免疫失败的发生机制并用于指导临床实践提供理论基础.
接种疫苗后乙型肝炎表面抗体始终阴性或达不到保护阈值, 称为乙型肝炎疫苗免疫失败. 乙型肝炎疫苗免疫失败与多种因素有关, 其中免疫逃逸乙型肝炎病毒(hepatitis B virus, HBV)中和抗体的变异株的感染引起了广泛的重视. HBV S基因编码表面抗原(hepatitis B surface antigen, HBsAg). HBsAg是乙型肝炎疫苗的主要成分, 是诊断感染的重要依据. S基因区又分为S区、PreS2及PreS1区3段. 其中PreS2基因与病毒的感染性和活动性复制有密切关系, 可作为判断HBV感染者是否有病毒活动性和较大传染性的新标志. 故研究PreS2基因突变与乙型肝炎疫苗免疫失败的关系具重要意义.
白浪, 副教授, 四川大学华西医院感染性疾病中心
HBV S基因变异可以使乙型肝炎疫苗或免疫球蛋白保护无效, 发生免疫逃逸, 最终导致免疫失败. PreS基因在HBV感染和复制过程中起重要作用, 是诱导产生抗-HBs的重要决定簇. 而PreS区的突变, 尤其是保守区内的突变, 可能也和病毒的免疫逃逸及乙型肝炎疫苗免疫失败有关. PreS2基因与病毒的感染性和活动性复制有密切关系, 可作为判断HBV感染者是否有病毒活动性和较大传染性的新标志. 目前研究较多的是S区基因变异与"免疫逃逸"及临床肝病的关系. 而对于PreS2基因变异与免疫接种后HBV感染之间的关系鲜有报道. 本文为今后深入探索免疫失败机制并为解决免疫失败问题奠定了一定理论基础.
Milieh等将PreS与S抗原一并注入S抗原无应答模型小鼠, 发现PreS抗原可显著提高小鼠抗-HBs应答水平, 征服小鼠对S抗原的无应答. 这表明, PreS抗原在HBV感染和复制过程中起重要作用, 是诱导产生抗-HBs的重要决定簇, 能提高抗-HBs的阳转率和滴度. 而PreS区的突变, 尤其是保守区内的突变, 可能也和病毒的免疫逃逸及乙型肝炎疫苗免疫失败有关.
免疫逃逸株的出现与乙型肝炎疫苗免疫失败密切相关. S基因变异可以使乙型肝炎疫苗或免疫球蛋白保护无效, 发生免疫逃逸. PreS2抗原与病毒的感染性和活动性复制也有密切关系. 目前研究较多的是S区基因变异与"免疫逃避"及临床肝病的关系. 而对于PreS2基因变异与免疫接种后HBV感染之间的关系鲜有报道. 该研究收集了一定数量的珍贵的免疫接种后HBV感染患者的血清标本, 观察了免疫接种后慢性HBV感染者的PreS2基因变异情况, 特别在免疫失败人群中初步研究并探讨PreS2基因变异与免疫失败的可能关系, 为今后深入探索免疫失败机制并为解决免疫失败问题奠定了一定理论基础.
本研究收集了一定数量的珍贵的免疫接种后HBV感染患者的血清标本, 观察了免疫接种后慢性HBV感染者的PreS2基因变异情况, 该研究结果提示PreS2基因变异与免疫失败可能存在相关关系, 这将为今后深入研究乙型肝炎疫苗免疫失败的发生机制并用于指导临床实践提供理论基础.
乙型肝炎疫苗免疫失败: 是指乙型肝炎疫苗按规范流程接种后表现出无应答或低应答(无应答是指接种疫苗后抗-HBs水平<10 mIU/mL; 低应答是指抗-HBs水平在10-99 mIU/mL). 免疫失败者由于不能得到乙型肝炎疫苗的有效保护, 和未接受免疫接种者共同成为HBV感染的高危人群.
本研究收集了一定数量的珍贵的免疫接种后HBV感染患者的血清标本, 观察了免疫接种后慢性HBV感染者的PreS2基因变异情况, 特别在免疫失败人群中初步研究并探讨PreS2基因变异与免疫失败的可能关系, 为今后深入探索免疫失败机制并为解决免疫失败问题奠定了一定理论基础.
编辑: 韦元涛 电编:闫晋利
云南省科技厅应用基础研究自筹经费基金资助项目, No. 2010ZC196
| 1. | Herbert M, Butler AV, Roome AP, Caul EO. Comparison of intradermal and intramuscular hepatitis B vaccination in university students. Vaccine. 1989;7:395-396. [PubMed] [DOI] |
| 3. | Zuckerman J, Langer B. Hepatitis B vaccination in a school age population: a feasibility study. J Med Virol. 2005;76:47-54. [PubMed] [DOI] |
| 4. | Sjogren MH. Prevention of hepatitis B in nonresponders to initial hepatitis B virus vaccination. Am J Med. 2005;118 Suppl 10A:34S-39S. [PubMed] [DOI] |
| 5. | McMahon BJ, Bruden DL, Petersen KM, Bulkow LR, Parkinson AJ, Nainan O, Khristova M, Zanis C, Peters H, Margolis HS. Antibody levels and protection after hepatitis B vaccination: results of a 15-year follow-up. Ann Intern Med. 2005;142:333-341. [PubMed] |
| 6. | Ogura Y, Kurosaki M, Asahina Y, Enomoto N, Marumo F, Sato C. Prevalence and significance of naturally occurring mutations in the surface and polymerase genes of hepatitis B virus. J Infect Dis. 1999;180:1444-1451. [PubMed] [DOI] |
| 7. | Poovorawan Y, Theamboonlers A, Chongsrisawat V, Sanpavat S. Molecular analysis of the a determinant of HBsAg in children of HBeAg-positive mothers upon failure of postexposure prophylaxis. Int J Infect Dis. 1998;2:216-220. [PubMed] [DOI] |
| 8. | Ngui SL, O'Connell S, Eglin RP, Heptonstall J, Teo CG. Low detection rate and maternal provenance of hepatitis B virus S gene mutants in cases of failed postnatal immunoprophylaxis in England and Wales. J Infect Dis. 1997;176:1360-1365. [PubMed] |
| 9. | Xia G, Nainan OV, Jia Z, Wang JJ, Liu HB, Li RC, Cao HL, Liu CB, Margolis HS. [Prevalence of mutants in the determinant region of hepatitis B surface antigen among Chinese carriers after receiving only active postexposure immunoprophylaxis]. Zhonghua Shiyan He Linchuang Bingduxue Zazhi. 2001;15:212-215. [PubMed] |
| 10. | 郭 敏卓, 伊 瑶, 陈 斯勇, 白 玉, 贾 志远, 毕 胜利. 乙型肝炎病毒表面抗原基因点突变对HBsAg抗原性的影响. 中华实验和临床病毒学杂志. 2008;2:48-50. |
| 11. | 陈 陶阳, 金 晏, 朱 宇, 倪 正平, 郭 霞, 施 平凡, 陆 建华, 朱 源荣, 钱 耕荪, 屠 红. 乙肝疫苗母-婴阻断失败者病毒全基因变异分析. 中华微生物学和免疫学杂志. 2009;6:538-543. |
| 12. | Gerlich WH, Deepen R, Heermann KH, Krone B, Lu XY, Seifer M, Thomssen R. Protective potential of hepatitis B virus antigens other than the S gene protein. Vaccine. 1990;8 Suppl:S63-S68; discussion S79-S80. [PubMed] [DOI] |
| 13. | Ferrari C, Penna A, Bertoletti A, Cavalli A, Valli A, Schianchi C, Fiaccadori F. The preS1 antigen of hepatitis B virus is highly immunogenic at the T cell level in man. J Clin Invest. 1989;84:1314-1319. [PubMed] [DOI] |
| 14. | Milich DR, McLachlan A, Chisari FV, Kent SB, Thorton GB. Immune response to the pre-S(1) region of the hepatitis B surface antigen (HBsAg): a pre-S(1)-specific T cell response can bypass nonresponsiveness to the pre-S(2) and S regions of HBsAg. J Immunol. 1986;137:315-322. [PubMed] |
| 15. | Yerushalmi B, Raz R, Blondheim O, Shumov E, Koren R, Dagan R. Safety and immunogenicity of a novel mammalian cell-derived recombinant hepatitis B vaccine containing Pre-S1 and Pre-S2 antigens in neonates. Pediatr Infect Dis J. 1997;16:587-592. [PubMed] [DOI] |
| 16. | Maroudas NG. Adhesion and spreading of cells on charged surfaces. J Theor Biol. 1975;49:417-424. [PubMed] |
| 17. | Young MD, Rosenthal MH, Dickson B, Du W, Maddrey WC. A multi-center controlled study of rapid hepatitis B vaccination using a novel triple antigen recombinant vaccine. Vaccine. 2001;19:3437-3443. [PubMed] |
| 18. | Zuckerman JN, Zuckerman AJ, Symington I, Du W, Williams A, Dickson B, Young MD. Evaluation of a new hepatitis B triple-antigen vaccine in inadequate responders to current vaccines. Hepatology. 2001;34:798-802. [PubMed] [DOI] |
| 21. | 王 剑, 盘 晓娟, 刘 平娥, 唐 冬英, 彭 丽花, 蒋 光清, 陈 友元, 蒋 秋云. 乙肝病毒前S2抗原与乙肝血清标志物的相关性及其临床意义. 细胞与分子免疫学杂志. 2006;22:623-624. |
| 23. | 孙 剑. 乙肝病毒S基因变异研究进展. 国外医学: 病毒学分册. 1999;6:84-88. |
| 26. | 李 兰娟, 吴 炜, 陈 瑜, 盛 吉芳. 重型乙型肝炎患者血清HBV前S2基因变异的观察. 中华微生物学和免疫学杂志. 2003;23:303. |
| 29. | Rizzetto M, Zanetti AR. Progress in the prevention and control of viral hepatitis type B: closing remarks. J Med Virol. 2002;67:463-466. [PubMed] [DOI] |
| 30. | 边 涛, 张 勇, 曹 彦强. 乙肝疫苗长期免疫地区低龄人群乙型肝炎病毒基因序列与突变现状. 中华实验和临床病毒学杂志. 2008;22:205-207. |