修回日期: 2014-12-17
接受日期: 2014-12-18
在线出版日期: 2015-02-08
目的: 研究荔枝核总黄酮(total flavonoids of litchi, TFL)对人肝星状细胞LX2增殖的影响及其相关作用机制.
方法: 使用不同浓度(7.8125、15.6250、31.2500、62.5000、125.0000 µg/mL)TFL处理LX2. 采用CCK-8法检测细胞的增殖活力, 通过流式细胞仪分析各组细胞周期的分布, 使用RT-PCR和Western blot技术测定细胞中p27基因mRNA和蛋白的表达.
结果: TFL作用48、72 h可抑制LX2细胞增殖, 且随着时间延长, 抑制效果更加明显. TFL处理72 h后可测得LX2细胞被阻滞在S期, 且明显上调p27基因的mRNA和蛋白的表达.
结论: TFL抑制人肝星状细胞增殖并将其阻滞在S期, 该作用机制可能与p27表达上调相关.
核心提示: 目前尚缺乏确切有效的抗肝纤维化药物, 但中药抗肝纤维化展现良好的发展前景. 本课题组前期研究已证实荔枝核总黄酮(total flavonoids of litchi, TFL)的抗肝纤维化作用可能与抑制肝细胞的凋亡有关. 本实验通过体外实验, 进一步探讨TFL抗肝纤维化机制, 表明TFL对LX2细胞具有增殖抑制及S期阻滞的作用, 其作用机制可能与p27表达上调相关.
引文著录: 徐伶俐, 罗伟生, 谭宁, 徐庆, 徐宾, 诸葛福艳. p27在荔枝核总黄酮抑制人肝星状细胞LX2增殖过程中的表达及其意义. 世界华人消化杂志 2015; 23(4): 539-546
Revised: December 17, 2014
Accepted: December 18, 2014
Published online: February 8, 2015
AIM: To investigate the effect of total flavonoids of litchi (TFL) on the proliferation of LX2 human hepatic stellate cells and to explore the underlying mechanism.
METHODS: LX2 cells treated with different concentrations (7.8125, 15.6250, 31.2500, 62.5000, and 125.0000 µg/mL) of TFL were examined for cell growth inhibition using CCK-8. Flow cytometry was used to analyze the changes in cell cycle distribution of LX2 cells. The expression of p27 mRNA and protein in LX2 cells was determined by real-time quantitative PCR and Western blot, respectively.
RESULTS: Exposure to TFL caused significant dose- and time-dependent inhibition of LX2 cell proliferation. TFL induced S-phase cell cycle arrest as shown by flow cytometric analysis. In addition, expression of p27 mRNA and protein in LX2 cells was upregulated in the treatment groups.
CONCLUSION: TFL treatment inhibits LX2 cell proliferation and arrests cells at S phase, and the mechanism may be associated with the upregulation of p27 expression.
- Citation: Xu LL, Luo WS, Tan N, Xu Q, Xu B, Zhu-Ge FY. Total flavonoids of litchi suppress proliferation of LX2 human hepatic stellate cells by upregulating p27 expression. Shijie Huaren Xiaohua Zazhi 2015; 23(4): 539-546
- URL: https://www.wjgnet.com/1009-3079/full/v23/i4/539.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i4.539
肝纤维化是肝硬化的早期可逆阶段, 及早控制肝纤维化的发生发展, 可降低肝硬化的发生率, 对疾病的预后改善至关重要[1,2]. 目前, 肝纤维化治疗方法主要包括: 祛除肝病的原发致病因素, 如戒酒、抗病毒治疗等; 抑制炎症和宿主免疫反应, 常用药物有糖皮质激素、水飞蓟素等[3]. 但常规西医药对抗肝纤维化的疗效仍不确切, 部分药物还可产生较大不良反应, 治疗效果不理想[4].
传统中药制剂如扶正化瘀法和扶正化瘀方、复方鳖甲软肝片、复方861合剂、强肝软坚汤等则在抗肝纤维化治疗上得到了大量肯定[5,6]. 与此同时, 抑制肝纤维化的相关中药研究也受到了广泛重视, 许多总黄酮提取物对抗肝纤维化的作用已通过大量科学研究得以证实, 如木棉花总黄酮、黄芪总黄酮、鬼针草总黄酮等[7-11]. 荔枝核总黄酮(total flavonoids of litchi, TFL)同属于黄酮类提取物, 是荔枝核中具有药理活性的主要成分之一, 已有相关研究证明TFL有抑制鸭乙型肝炎病毒(duck hepatitis B virus, DHBV)及抗肝纤维化等作用, 其抗肝纤维化作用机制可能与抑制肝细胞的凋亡有关[12,13]. 本研究通过体外实验, 探讨TFL对人肝星状细胞人肝星状细胞(LX2)增殖的影响作用及相关分子机制, 为抗肝纤维化中药开发与应用提供新的实验基础.
LX2细胞株购自中国科学院上海生科院细胞资源中心. TFL购自南京泽朗医药科技有限公司, 纯度80%. 将TFL粉末溶于二甲基亚砜(dimethyl sulfoxide, DMSO)试剂中, 配置成20 mg/mL的贮存液, 0.22 µm微孔滤器过滤除菌, 避光常温保存. DMEM高糖培养液购自GIBCO公司, 货号: C11995500BT; 胎牛血清FBS购自Corille公司, 货号: C1015-05; CCK-8(Cell Counting Kit-8)试剂盒购自上海同仁化学研究所, 货号: CK04; PrimeScriptTM RT Master Mix(Perfect Real Time)购自大连宝生物公司, 货号: RR036A; SYBR® Premix Ex TaqTM Ⅱ(Tli RNase H Plus)购自宝生物公司, 货号: RR820A; TRIzol提取盒购自MRC公司, 货号: TR118; p27单克隆抗体购自CST公司, 货号: #2552; β-actin单克隆抗体购自SANTA CRUZ公司, 货号: SC-47778; Pierce®Goat Anti-Mouse IgG抗体购自Thermo公司, 货号#31431; Pierce®Goat Anti-Mouse IgG抗体购自Thermo公司, 货号#31466.
1.2.1 细胞培养: 将冻存LX2细胞置于37 ℃水浴锅中快速复温直至完全融化, 接种细胞于10%FBS的DMEM(含青霉素+链霉素)培养基中, 在37 ℃、50 mL/L CO2及饱和湿度的培养箱中培养. 采用0.25%胰蛋白酶消化传代, 待细胞生长稳定后即开始实验.
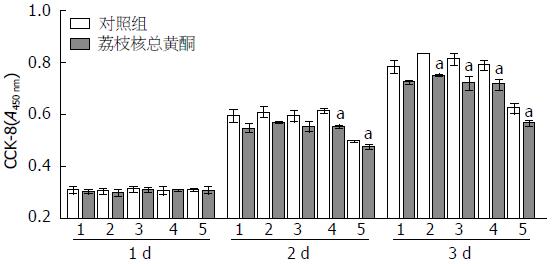
1.2.2 CCK-8法检测TFL对LX2增殖的影响: 0.25%胰蛋白酶消化收集细胞, 用含10%FBS的DMEM培养液配成单细胞悬液, 接种于96孔培养板中, 每孔2000个细胞. 待细胞贴壁后, 加不同体积TFL贮存液使得药物终浓度为7.8125、15.6250、31.2500、62.5000、125.0000 µg/mL, 对照组加等体积的DMSO, 每个浓度设3个复孔. 待药物作用24、48、72 h后, 分别吸去培养基, 并加入CCK-8试剂100 µL/孔, 于培养箱中继续培养2 h. 培养完成后, 将96孔板置于光栅型连续波长酶标仪(infinite M200 PRO仪器)中, 设定波长为450 nm, 检测各孔吸光度(A)值. 依次记录加药后第1、2、3天A值并依此计算细胞抑制率. 细胞抑制率(%) = (实验对照组A450值-干预加药组A450值)/实验对照组A450值×100%.
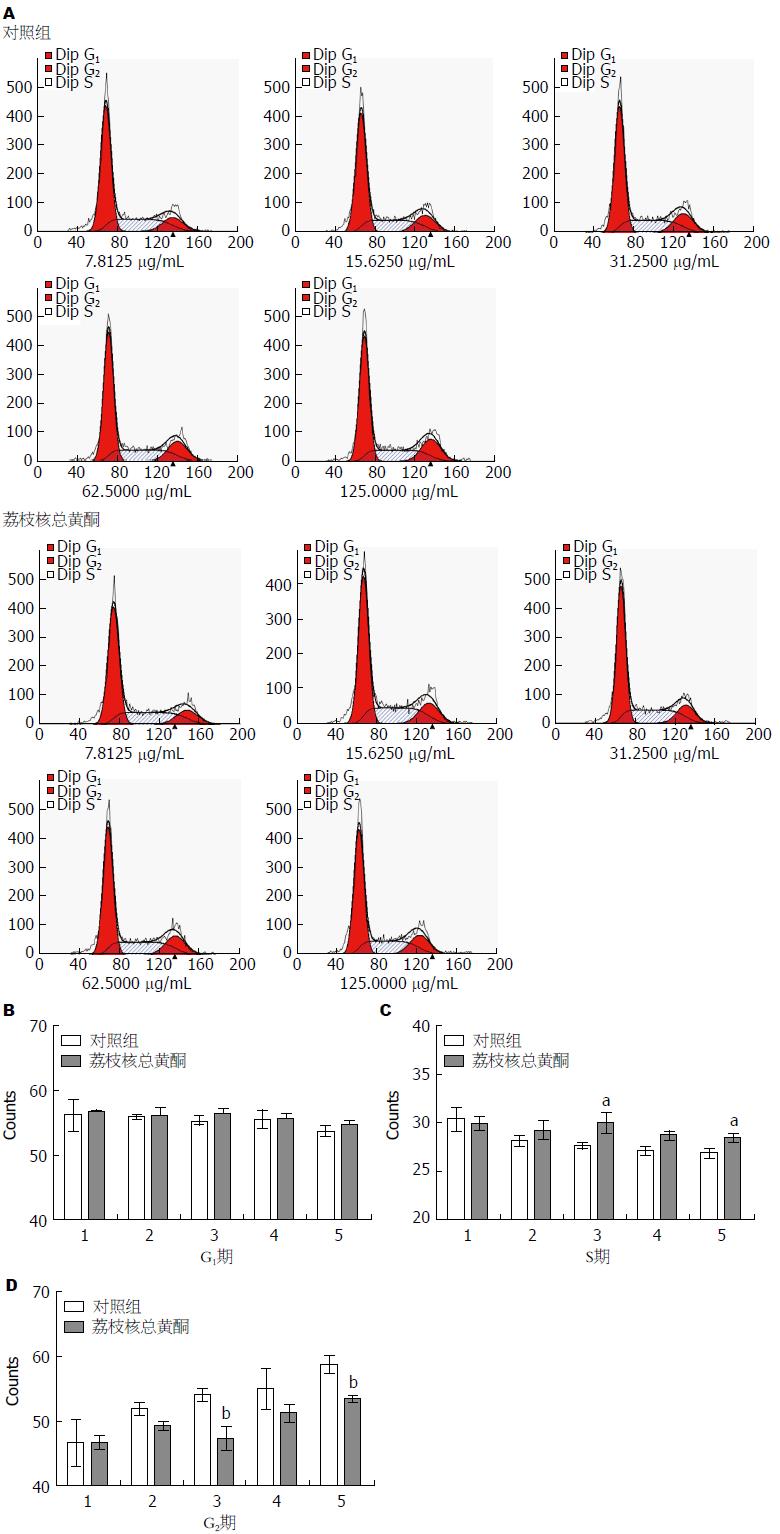
1.2.3 流式细胞仪检测TFL对LX2细胞周期的影响: 胰酶消化收集细胞, 完全培养基混悬细胞, 将细胞悬液以2.5×105个/皿计数种植于6 cm培养皿中. 待细胞贴壁后, 加药将细胞分成TFL不同浓度干预组(TFL终浓度为7.8125、15.6250、31.2500、62.5000、125.0000 µg/mL), 对照组加等体积的DMSO(加药方式同1.2.2), 继续培养72 h. 培养结束后, 胰酶消化, 分别收集不同浓度组细胞, 重悬于PBS缓冲液中, 随即加入-20 ℃冰预冷乙醇(乙醇终浓度>700 mL/L)固定, -20 ℃保存. 待检测时, 去除固定液, PBS洗涤2遍后加入染液(PI终浓度为50 µg/mL, RNaseA终浓度为100 µg/mL), 37 ℃避光孵育30 min, 过滤, 用流式细胞仪(BD FACS AriaⅢ)检测.
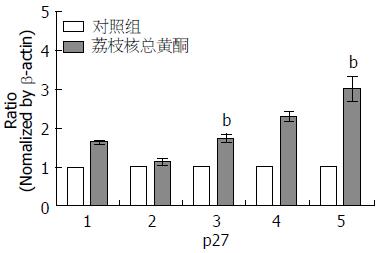
1.2.4 p27基因实时荧光定量PCR的检测: 将细胞接种于6 cm培养皿中, 分组加药(步骤同1.2.3). 继续培养72 h后, 用TRIzol试剂盒提取各组细胞内的总RNA, 计算RNA纯度, 逆转录合成cDNA. 按SYBR® Premix Ex TaqTMⅡ说明书进行实时荧光定量PCR检测, 内参照为β-actin. 引物如下: p27: 上游: 5'-CTCTGAGGACACGCATTTGGTGGA-3', 下游: 5'-GGCATTTGGGGAACCGTCTGAAAC-3'; β-actin-160: 上游: 5'-AAGTGTGACGTGGACATCCGCAAAG-3', 下游: 5'-ACTTGCGCTCAGGAGGAGCAATGAT-3'. 采用美国ABI 7500Fast实时荧光定量PCR仪进行检测, 设定反应条件如下: 55 ℃ 3 min; 95 ℃ 10 min; 95 ℃ 15 s, 65 ℃ 15 s, 72 ℃ 30 s, 40个循环.
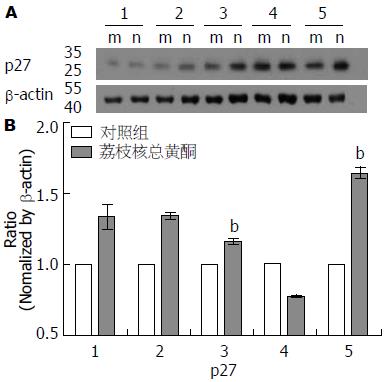
1.2.5 p27蛋白表达的Western blot检测: 将细胞接种于6 cm培养皿中, 分组加药(步骤同1.2.3). 继续培养72 h后, 吸弃上清, PBS清洗1遍, 加入适量RIPA蛋白裂解液(含上样缓冲液), 均匀铺满皿底, 至冰上充分裂解. 裂解完全后, 采用细胞刮取皿中蛋白, 收集于EP管中. 蛋白质变性: 99 ℃, 20 min. 取蛋白样品进行SDS-PAGE凝胶电泳(6%浓缩胶, 12%分离胶), 蛋白分离完全后, 通过半干式转膜仪将胶上蛋白转移至硝酸纤维素膜上. 裁取含目的蛋白的硝酸纤维素膜, 5%脱脂奶粉室温封闭1 h, 在目的条带中加入对应的p27和内参β-actin的一抗, 4 ℃孵育过夜, TBST洗膜10 min×5次, 加入辣根过氧物酶标记的IgG二抗, 室温孵育1 h, TBST洗膜5 min×5次. ECL化学发光显色, Image J软件进行图像分析.
统计学处理 采用SPSS16.0统计学软件进行统计分析. 符合正态分布的计量资料以mean±SD表示. 每一浓度加药组与其对照组间均数比较采用LSD-t检验, P<0.05为差异有统计学意义.
TFL不同浓度加药组各自与相应的对照组进行比较, 采用SPSS16.0进行两独立样本t检验. 如图1所示, 加药后第3天, 可发现TFL明显抑制LX2细胞增殖, 此时7.8125、15.6250、31.2500、62.5000、125.0000 µg/mL的不同浓度TFL对LX2细胞抑制率依次为7.42%±5.66%、9.88%±0.73%、11.55%±3.35%、9.47%±3.67%、9.12%±5.35%, TFL最小剂量加药组与对照组差异无统计学意义(P>0.05), 而15.6250、31.2500、62.5000、125.0000 µg/mL TFL加药组相对各对照组的差异性均具有统计学意义(P<0.05).
TFL不同剂量分别作用于LX2细胞, 并设置相应的对照组, 各加药组与同浓度对照组间进行比较. 在药物作用72 h后收集各组细胞进行PI单染流式细胞检测. 结果显示随着TFL药物浓度的增大, LX2细胞周期分布可发生改变. 如图2所示, 7.8125、15.6250 µg/mL加药组和对照组细胞周期分布差异不具有统计学意义. 而31.2500、62.5000、125.0000 µg/mL加药组相较对照组G0/G1期细胞数改变差异无统计学意义(P>0.05), S期细胞量明显增多(P<0.05), G2/M期细胞量则相应减少, 此期改变部分具有差异性, 提示TFL可将LX2细胞阻滞在S期.
TFL不同剂量分别作用于LX2细胞, 并设置相应的对照组, 各加药组与同浓度对照组间进行比较. 在药物作用72 h后提取各组mRNA, 逆转录合成cDNA, 在PCR仪上进行扩增并检测各组p27基因的表达量. 结果显示: 15.6250 µg/mL加药组与对照组p27 mRNA表达量差异无统计学意义(P>0.05). 而7.8125、31.2500、62.5000、125.0000 µg/mL加药组p27 mRNA相较于对照组表达水平升高, 差异具有统计学意义(P<0.05). 7.8125、15.6250、31.2500、62.5000、125.0000 µg/mL TFL作用组p27 mRNA表达量分别为其对照组的1.64倍±0.04倍、1.12倍±0.08倍、1.74倍±0.10倍、2.30倍±0.14倍、3.01倍±0.32倍, 提示TFL可促进LX2 p27基因表达上调(图3).
TFL不同剂量分别作用于LX2细胞, 并设置相应的对照组. 作用72 h后提取各组总蛋白, Western blot法检测各组p27蛋白的表达量, 各加药组与同浓度对照组间进行比较, 分析p27蛋白表达的改变. 该结果显示: 7.8125、15.6250、31.2500、62.5000、125.0000 µg/mL加药组与对照组p27蛋白表达量差异均具有统计学意义(P<0.05). 除62.5000 µg/mL组外, 加药组p27蛋白表达水平均相较于对照组升高. 7.8125、15.6250、31.2500、62.5000、125.0000 µg/mL TFL作用组p27蛋白表达量分别为其对照组的1.33倍±0.09倍、1.34倍±0.02倍、1.16倍±0.02倍、0.77倍±0.01倍、1.64倍±0.04倍(图4). Western blot与PCR检测结果不完全相符, 可能是由于Western blot技术中存在转膜效率、抗体孵育条件、曝光时间等不完全可控因素导致结果不稳定, 但两种技术所测得的p27 mRNA及蛋白变化趋势基本相符, 我们仍可认为, TFL具有促进LX2细胞p27基因的蛋白上调的作用.
肝纤维化是机体发生慢性肝损伤时产生的一种损伤修复反应, 与肝硬化是同一疾病的两个阶段. 他的形成主要包括以下3个步骤: 肝细胞的凋亡、间充质干细胞的增殖及细胞外基质的沉积. 而肝星状细胞正是细胞外基质的主要来源, 他可通过控制总细胞数及每个细胞的胞外基质分泌量来实现肝纤维化[14,15]. 因此抑制肝星状细胞的增殖及其胞外基质分泌量可达到抗肝纤维化的目的. 本研究CCK-8实验结果显示, TFL对LX2细胞的增殖具有抑制作用.
真核细胞的增殖主要由细胞周期所调节. 细胞周期由4个步骤组成: M期, 分裂期; G1期, DNA合成前期; S期, DNA合成期; G2期, DNA合成后期. 当细胞周期未能正常运转, 即发生周期阻滞时, 细胞增殖亦会受到影响[16]. 细胞周期的阻滞是通过DNA损伤关卡来完成的, 包括G0/G1、S、G2/M关卡[17,18]. 干预细胞周期运转中的3个关卡之一, 就可能达到抑制细胞增殖的作用[19-21]. 本次流式细胞周期结果显示肝星状细胞LX2经TFL干预后, 细胞周期阻滞在S期. 由此我们可以推断TFL将LX2阻滞在S期与抑制其增殖具有密切相关性.
细胞周期是一个高度有序的运转过程, 受包括周期蛋白(Cyclins)、周期蛋白依赖激酶(cyclin dependent kinases, CDKs)、周期蛋白依赖激酶抑制剂(cyclin-dependent kinase inhibitors, CKIs)在内的复杂机制调控. CDKs中有4种(CDK1, 2, 4, 6)直接参与了细胞周期调控, 为调控系统的核心组分. Cyclins为CDKs的活化因子, 能够与CDKs紧密结合, 刺激他们的催化活性[22]. Cyclins分为4类: G1细胞周期蛋白(G1 cyclins)、G1/S细胞周期蛋白(G1/S cyclins)、S细胞周期蛋白(S cyclins)和M细胞周期蛋白(M cyclins). 第1类负责对细胞外因子作出反应, 控制细胞周期的进入, 后2类则直接参与细胞周期控制事件. 每1个Cyclin-CDK复合物都依次启动下1个复合物的激活, 从而确保细胞周期进程有序地进行[23]. CDK活性异常, 可致细胞周期分布发生相应改变. 增加细胞周期蛋白的降解以及减少细胞周期蛋白基因表达均可降低CDK的活性, 而CKIs则为抑制其活性的另一种方式. CKIs能结合并灭活Cyclin-CDK复合物, 阻滞细胞周期进程[24]. CKI分为INK家族和Cip/Kip家族. INK家族包括p15INK4b、p16INK4a、p18INK4c、p19INK4d, 他们为绝对的抑制因子, 能特异性地针对CDK4和CDK6的单体, 通过减少细胞周期蛋白的结合亲和力来起作用. Cip/Kip家族包括p21、p27、p57, 其中p21、p27蛋白的氨基端负责CDK的抑制功能[25]. p27不仅抑制G1/S-CDKs(CyclinE-CDK2)[26], 也一样抑制了S-CDKs(CyclinA-CDK2). CDK2-CyclinA-p27复合物的结构显示: p27的细胞周期蛋白结合部分与周期蛋白A的疏水斑作用, p27的CDK结合区域广泛地与激酶的亚单位相互作用, 这些相互作用完全扭曲和部分拆散了在激酶活性位点上方的氨基端突出结构, 也直接阻碍了ATP的结合位点, 完全破坏了酶的催化功能[27]. p27抑制S-CDKs(CyclinA-CDK2)复合物, 可产生S期阻滞现象, 也早已通过大量研究得以证实. 雷公藤甲素可通过上调p21、p27, 下调CyclinA、CDC25A, 使得人黑色素瘤细胞A375.S2发生S期阻滞[28]; 桑黄中提取的多糖作用于人结直肠癌细胞HT-29及人肝癌细胞HepG2后, 可激活p27kip1-CyclinA/D1/E-CDK2分子途径, p27表达上调, 诱导细胞发生S期阻滞[29,30]. 也有研究[31]显示: 盐酸加替沙星可诱导人胰腺癌细胞Panc-1产生S期阻滞, p27干扰小RNA转染入该细胞后可大大抑制该药物所诱导产生的周期阻滞现象, 也就是说盐酸加替沙星使Panc-1发生S期阻滞是依赖p27而产生的. 本实验通过荧光定量PCR和免疫印迹法检测各组p27在RNA和蛋白水平上的表达量, 结果提示随着TFL浓度增大, 加药组p27的mRNA和蛋白量较对照组明显升高.
综合以上实验结果, 我们尚可推断出TFL对LX2具有增殖抑制及S期阻滞的作用, 并且初步探讨了该作用机制可能与p27分子具有密切关系, 但有关S期阻滞的具体作用机制及p27的上、下游作用因子尚待进一步研究.
肝纤维化是肝硬化的早期可逆阶段, 及早控制肝纤维化的发生发展, 对疾病的预后改善至关重要. 但常规西医药治疗效果不理想, 近年来药理及药效学研究证实荔枝核及其活性成分具有抗肝损伤、抗病毒、抗肿瘤和降糖调脂等作用. 其抗肝损伤方面的作用是众多学者研究的热点及焦点.
刘绍能, 主任医师, 中国中医科学院广安门医院消化科
文献报道荔枝核总黄酮(total flavonoids of litchi, TFL)有抑制鸭乙型肝炎病毒(duck hepatitis B virus, DHBV)及抗肝纤维化等作用, 其抗肝纤维化作用机制可能与抑制肝细胞的凋亡有关. 而TFL对人肝星状细胞LX2增殖的影响作用及相关分子机制鲜有报道.
Li等研究报道, p27表达上调, 抑制S-周期蛋白依赖激酶(cyclin dependent kinases, CDKs)(CyclinA-CDK2)复合物活性, 可产生S期阻滞现象, 从而抑制细胞增殖. 本次实验已证实TFL对LX2细胞有增殖抑制及S期阻滞作用, 该作用机制可能与p27表达上调具有密切相关性.
对于TFL对人肝星状细胞LX2增殖的影响作用及相关分子机制鲜有报道. 本实验通过CCK-8法检测TFL对人肝星状细胞LX2增殖的抑制作用, 流式细胞仪分析、RT-PCR和Western blot技术验证TFL对LX2细胞具有S期阻滞作用, 且该机制可能与p27表达上调相关.
本实验旨在探讨TFL的抗肝纤维化作用及可能的作用机制, 结果表明, TFL可通过抑制肝星状细胞增殖从而抑制或延缓肝纤维化的发生发展, 并推测其作用机制可能与p27分子具有密切关系. 为TFL抗肝纤维化提供新的理论依据.
本实验使用不同浓度TFL处理人肝星状细胞LX2, 采用CCK-8法、流式细胞仪分析、RT-PCR和Western blot技术多方面证实了TFL抑制人肝星状细胞增殖并将其阻滞在S期, 且该作用机制可能与p27表达上调相关. 本研究实验设计合理, 资料详细, 结果可信, 有一定的参考价值.
编辑: 韦元涛 电编:闫晋利
国家自然科学基金资助项目, No. 81360530
| 6. | 刘 成海, 刘 平, 胡 义扬, 徐 列明, 刘 成. 中医药抗肝纤维化临床与基础研究进展. 世界科学技术•中医药现代化. 2007;9:112-119. |
| 8. | 成 扬, 汪 美凤, 平 键, 陈 高峰, 胡 义扬. 黄芪总黄酮对二甲基亚硝胺诱导的大鼠肝硬化的干预作用. 中国中西医结合消化杂志. 2013;21:561-564. |
| 16. | Yasutis KM, Kozminski KG. Cell cycle checkpoint regulators reach a zillion. Cell Cycle. 2013;12:1501-1509. [PubMed] [DOI] |
| 17. | Ben-Shlomo R. Chronodisruption, cell cycle checkpoints and DNA repair. Indian J Exp Biol. 2014;52:399-403. [PubMed] |
| 18. | Wang XA, Xiang SS, Li HF, Wu XS, Li ML, Shu YJ, Zhang F, Cao Y, Ye YY, Bao RF. Cordycepin induces S phase arrest and apoptosis in human gallbladder cancer cells. Molecules. 2014;19:11350-11365. [PubMed] [DOI] |
| 19. | Kang K, Nho CW, Kim ND, Song DG, Park YG, Kim M, Pan CH, Shin D, Oh SH, Oh HS. Daurinol, a catalytic inhibitor of topoisomerase IIα, suppresses SNU-840 ovarian cancer cell proliferation through cell cycle arrest in S phase. Int J Oncol. 2014;45:558-566. [PubMed] [DOI] |
| 21. | 仇 玉兰, 夏 昭林. DNA损伤关卡及分子机制研究进展. 国外医学•卫生学分册. 2006;33:198-202. |
| 22. | Canavese M, Santo L, Raje N. Cyclin dependent kinases in cancer: potential for therapeutic intervention. Cancer Biol Ther. 2012;13:451-457. [PubMed] [DOI] |
| 23. | Gallorini M, Cataldi A, di Giacomo V. Cyclin-dependent kinase modulators and cancer therapy. BioDrugs. 2012;26:377-391. [PubMed] [DOI] |
| 24. | Bose P, Simmons GL, Grant S. Cyclin-dependent kinase inhibitor therapy for hematologic malignancies. Expert Opin Investig Drugs. 2013;22:723-738. [PubMed] [DOI] |
| 25. | Harper JW. Cyclin dependent kinase inhibitors. Cancer Surv. 1997;29:91-107. [PubMed] |
| 26. | Bencivenga D, Tramontano A, Borgia A, Negri A, Caldarelli I, Oliva A, Perrotta S, Della Ragione F, Borriello A. p27Kip1 serine 10 phosphorylation determines its metabolism and interaction with cyclin-dependent kinases. Cell Cycle. 2014;13:3768-3782. [PubMed] |
| 27. | Yoon MK, Mitrea DM, Ou L, Kriwacki RW. Cell cycle regulation by the intrinsically disordered proteins p21 and p27. Biochem Soc Trans. 2012;40:981-988. [PubMed] [DOI] |
| 28. | Hung FM, Chen YL, Huang AC, Hsiao YP, Yang JS, Chung MT, Chueh FS, Lu HF, Chung JG. Triptolide induces S phase arrest via the inhibition of cyclin E and CDC25A and triggers apoptosis via caspase- and mitochondrial-dependent signaling pathways in A375.S2 human melanoma cells. Oncol Rep. 2013;29:1053-1060. [PubMed] [DOI] |
| 29. | Zhong S, Ji DF, Li YG, Lin TB, Lv ZQ, Chen HP. Activation of P27kip1-cyclin D1/E-CDK2 pathway by polysaccharide from Phellinus linteus leads to S-phase arrest in HT-29 cells. Chem Biol Interact. 2013;206:222-229. [PubMed] [DOI] |
| 30. | Li YG, Ji DF, Zhong S, Liu PG, Lv ZQ, Zhu JX, Chen JE, Chen HP. Polysaccharide from Phellinus linteus induces S-phase arrest in HepG2 cells by decreasing calreticulin expression and activating the P27kip1-cyclin A/D1/E-CDK2 pathway. J Ethnopharmacol. 2013;150:187-195. [PubMed] [DOI] |