修回日期: 2015-10-31
接受日期: 2015-11-17
在线出版日期: 2015-12-18
目的: 探讨中性粒细胞/淋巴细胞比值(neutrophil-lymphocyte ratio, NLR)是否可以作为胆囊癌患者接受根治术后的预后指标.
方法: 回顾性分析2007-01/2010-06华中科技大学同济医院胆胰外科接受胆囊癌根治术治疗的胆囊癌患者的资料. 根据患者术前外周静脉血NLR值分为低NLR组(NLR<5.0)和高NLR组(NLR≥5.0). 比较两组患者的人口学、临床资料及病理学的差异. 用单因素回归方法分析影响患者长期生存的变量, 并将有统计学意义的变量导入COX多因素回归模型得到影响胆囊癌预后的独立危险因素.
结果: 本研究纳入了90例患者(低NLR组74例, 高NLR组16例). 低NLR组和高NLR组胆囊癌患者5年生存率分别为70.9%和27.6%(P<0.05). 单因素分析显示肿瘤分化程度、淋巴结转移情况、侵犯肝脏、T分期、TNM分期、NRL(P<0.05)为影响胆囊癌预后的因素. COX多因素分析表明NLR是影响胆囊癌预后的独立危险因素(P<0.05).
结论: NLR可以作为胆囊癌根治术后的预后因素, 术前NLR≥5提示胆囊癌患者预后不良.
核心提示: 新近的研究认为炎症反应与肿瘤学的生物学特性相关, 中性粒细胞/淋巴细胞比值(neutrophil-lymphocyte ratio, NLR)是反映炎症反应的指标之一. 一些研究表明, 术前外周血中增高的NLR与恶性肿瘤(如直肠癌, 肝细胞癌等)根治性治疗后的预后负相关. 本研究证实了术前NLR增高的胆囊癌患者在接受根治性治疗后的预后相比正常NLR患者的预后差.
引文著录: 高恒毅, 张航, 徐晓东, 邹文彬, 林凯临, 邓永春, 刘清泉, 江建新, 王敏, 朱峰, 秦仁义. 中性粒细胞/淋巴细胞比值在胆囊癌根治术预后评估中的应用. 世界华人消化杂志 2015; 23(35): 5705-5710
Revised: October 31, 2015
Accepted: November 17, 2015
Published online: December 18, 2015
AIM: To explore whether neutrophil/lymphocyte ratio (NLR) can be used as a prognostic indicator of gallbladder carcinoma (GBC) after radical resection.
METHODS: We retrospectively collected the data of GBC patients who underwent radical resection at Tongji Hospital from January 2007 to June 2010. According to the preoperative NLR value, the patients were divided into a low NLR group (NLR < 5.0) and a high NLR group (NLR ≥ 5.0). We compared the demographic, clinical and pathological variables of the two groups. Univariate analysis was used to identify the factors affecting the prognosis of GBC, and the significant factors entered into a COX regression model to identify independent prognostic factors for GBC after radical surgery.
RESULTS: A total of 90 patients were included in this study. The 5-year survival rates of the low NLR group and high NLR group were 70.9% and 27.6% (P < 0.05), respectively. Univariate analysis showed that tumor differentiation, lymph node metastasis, liver invasion, T stage, TNM stage and NLR were factors affecting prognosis of GBC. COX regression analysis indicated that NLR was an independent predictive factor for prognosis of GBC after operation (P < 0.05).
CONCLUSION: NLR can serve as a prognostic indicator in GBC patients who underwent radical therapy. GBC patients with elevated NLR have a worse prognosis after operation.
- Citation: Gao HY, Zhang H, Xu XD, Zou WB, Lin KL, Deng YC, Liu QQ, Jiang JX, Wang M, Zhu F, Qin RY. Neutrophil-lymphocyte ratio as a prognostic factor for gallbladder carcinoma after radical resection. Shijie Huaren Xiaohua Zazhi 2015; 23(35): 5705-5710
- URL: https://www.wjgnet.com/1009-3079/full/v23/i35/5705.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i35.5705
影响胆囊癌癌预后的因素很多, 包括TNM分期、淋巴结转移、浸润深度、侵犯肝脏、有无转移等. 有研究显示, 多种肿瘤存在淋巴细胞减少的现象[1,2]. 而炎性细胞在防御肿瘤的发展的初始阶段起重要作用, 中性粒细胞/淋巴细胞比值(neutrophil-lymphocyte ratio, NLR)是影响结直肠癌、胃癌、胰腺癌、卵巢癌、食管癌等多种肿瘤的预后因素之一[3-7]. 本研究旨在探讨NLR是否可以作为胆囊癌患者接受根治性切除术后的预后指标.
收集2007-01/2010-06华中科技大学同济医院胆胰外科收治经手术治疗的胆囊癌资料. 病例纳入标准: (1)在华中科技大学同济医院住院, 由胆胰外科专科医生实施手术并经术后病理诊断证实为胆囊癌; (2)术前无感染或其他相关可影响血常规计数结果的异常情况; (3)随访满5年或术后5年内因胆囊癌进展死亡. 其中剔除早期失访、非肿瘤原因死亡的患者. 收集患者术前3 d内的血常规指标.
1.2.1 手术和随访: 所有患者均行肿瘤根治性手术. 肿瘤切除后被立即送往华中科技大学附属同济医院病理科进行病理评估. 病理评估与血常规检测时间间隔<1 wk. 术后病理资料包括肿瘤大小、肿瘤侵犯深度、肿瘤的分化程度、淋巴结转移情况侵犯肝脏及合并结石的情况由华中科技大学同济医院胆胰专科医生联合病理医生及放射科进行评估. 本研究纳入胆囊癌病理评估均采用2010年美国癌症联合会(American Joint Committee on Cancer, AJCC)胆囊癌TNM分期标准(第7版)[8]. 患者术后第1年每3 mo随访1次, 第2年起每半年随访1次. 随访截止日期为2015-06.
1.2.2 研究分组: 纳入本研究的病例外周血白细胞总数均未超过正常值上限, 外周血中性粒细胞百分比与淋巴细胞百分比均在正常范围之内. 根据Walsh等[9]所发表的文章, 我们以NLR为5作为临界点. 所有病例被分为低NLR组(NLR<5)和高NLR组(NLR≥5).
统计学处理 采用SPSS17.0统计软件进行数据分析. χ2检验或Fisher精确概率法检验被用来比较低NLR组与高NLR组患者人口学、临床资料和病理学变量之间是否存在差异. 采用单因素方法分析影响胆囊癌预后的因素. 有统计学差异的变量被选入COX多因素回归分析从而得到影响胆囊癌根治术预后的独立危险因素. 应用Kaplan-meier法计算患者长期生存率, 并绘制了患者的生存曲线. P<0.05为差异具有统计学意义.
本研究共纳入90例具有完整随访资料的胆囊癌接受根治术治疗的患者. 其中男性47例(52.2%), 女性43例(47.8%). 患者的平均年龄为53.6岁(35-87岁). 表1显示高NLR组与低NLR组患者的肿瘤分化程度、浸润深度、淋巴结转移、肝脏侵犯、TNM分期均有统计学差异(P<0.05), 两组患者的年龄、性别、肿瘤大小及合并结石情况均无统计学差异(P>0.05).
| 临床病理因素 | 低中性粒细胞/淋巴细胞比值组(%) | 高中性粒细胞/淋巴细胞比值组(%) | P值 |
| 年龄(岁) | >0.05 | ||
| <60 | 57(77.02) | 11(68.75) | |
| ≥60 | 17(22.98) | 5(31.25) | |
| 性别 | >0.05 | ||
| 男 | 40(54.05) | 7(43.75) | |
| 女 | 34(45.95) | 9(56.25) | |
| 肿瘤大小(cm) | >0.05 | ||
| <2 | 52(70.27) | 5(31.25) | |
| ≥2 | 22(29.73) | 11(68.75) | |
| 合并结石 | >0.05 | ||
| 有 | 23(31.08) | 4(25.00) | |
| 无 | 51(68.92) | 12(75.00) | |
| 侵犯肝脏 | <0.05 | ||
| 有 | 19(25.68) | 13(81.25) | |
| 无 | 55(74.32) | 3(18.75) | |
| 肿瘤分化程度 | <0.05 | ||
| 高分化 | 60(81.08) | 1(6.25) | |
| 中低分化 | 14(18.92) | 15(93.75) | |
| 肿瘤浸润深度 | <0.05 | ||
| T1 | 41(55.41) | 2(12.50) | |
| T2 | 25(33.78) | 3(18.75) | |
| T3 | 8(10.81) | 10(62.50) | |
| T4 | 0 | 1(6.25) | |
| 淋巴结转移 | <0.05 | ||
| 有 | 3(4.05) | 10(62.50) | |
| 无 | 71(95.95) | 6(37.50) | |
| TNM分期 | <0.05 | ||
| ⅠA期 | 32(43.24) | 0 | |
| ⅠB期 | 22(29.73) | 0 | |
| Ⅱ期 | 10(13.51) | 1(6.25) | |
| ⅢA期 | 7(9.47) | 3(18.75) | |
| ⅢB期 | 3(4.05) | 10(62.50) | |
| ⅣA期 | 0 | 1(6.25) | |
| ⅣB期 | 0 | 1(6.25) |
表2为单因素分析结果. 结果显示肿瘤分化程度、淋巴结转移、侵犯肝脏、侵犯深度、肿瘤分期及术前NLR均为影响胆囊癌患者接受根治术后的预后影响因素; 而患者性别、年龄、肿瘤大小不是影响胆囊癌预后的因素. 表3列出了多因素分析的结果, 分析表明术前NLR、淋巴结转移、T分期、TNM分期是影响胆囊癌预后的独立危险因素(均P<0.05).
| 变量 | n | 5年生存(%) | χ2值 | P值 |
| 年龄(岁) | 0.156 | >0.05 | ||
| <60 | 68 | 49.7 | ||
| ≥60 | 22 | 56.8 | ||
| 性别 | 0.035 | >0.05 | ||
| 男 | 47 | 65.4 | ||
| 女 | 43 | 60.3 | ||
| 肿瘤大小(cm) | 0.321 | >0.05 | ||
| <2 | 57 | 77.5 | ||
| ≥2 | 33 | 70.8 | ||
| 肿瘤分化程度 | 5.869 | <0.05 | ||
| 高分化 | 61 | 74..3 | ||
| 中低分化 | 29 | 33.6 | ||
| 肿瘤浸润深度 | 6.316 | <0.05 | ||
| T1 | 56 | 80.0 | ||
| T2 | 22 | 38.3 | ||
| T3 | 11 | 35.4 | ||
| T4 | 1 | 6.2 | ||
| 淋巴结转移 | 4.658 | <0.05 | ||
| 有 | 13 | 31.2 | ||
| 无 | 77 | 76.4 | ||
| 侵犯肝脏 | 6.569 | <0.05 | ||
| 有 | 32 | 30.1 | ||
| 无 | 58 | 73.4 | ||
| TNM分期 | 4.258 | <0.05 | ||
| ⅠA期 | 32 | 86.0 | ||
| ⅠB期 | 22 | 75.4 | ||
| Ⅱ期 | 11 | 50.2 | ||
| ⅢA期 | 10 | 36.3 | ||
| ⅢB期 | 13 | 26.4 | ||
| ⅣA期 | 1 | 12.5 | ||
| ⅣB期 | 1 | 6.2 | ||
| 术前NLR | 5.361 | <0.05 | ||
| NLR<5 | 74 | 70.9 | ||
| NLR≥5 | 16 | 27.6 |
| 变量 | P值 | OR值 | 95%CI |
| 肿瘤分化 | 0.285 | 0.566 | 0.322-1.238 |
| 淋巴结转移 | 0.033 | 0.485 | 0.261-0.869 |
| NLR | 0.027 | 0.412 | 0.237-0.936 |
| 侵犯肝脏 | 0.531 | 0.734 | 0.135-1.366 |
| T分期 | 0.042 | 0.519 | 0.242-0.923 |
| TNM分期 | 0.038 | 0.493 | 0.257-0.839 |
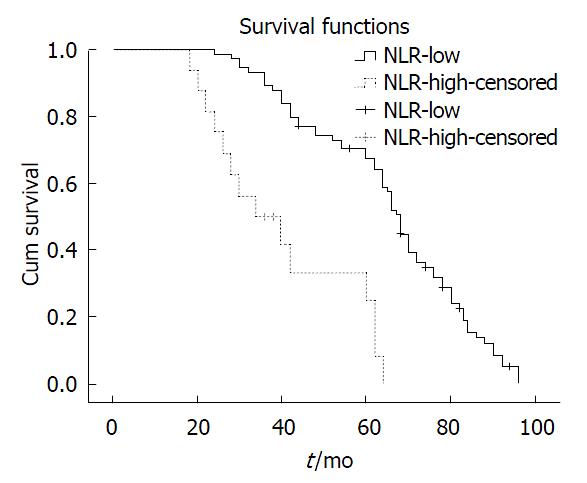
本研究纳入的90例胆囊癌患者的5年生存率为63.2%, 其中低NLR组的5年生存率27.6%, 高NLR组的5年生存率为70.9%. 图1显示两组患者的生存率有显著统计学差异(χ2 = 30.252, P<0.005).
我国胆囊癌位列于消化系肿瘤的第6位, 预后较差[10]. 但目前对于胆囊癌的研究多集中在手术方式及病理资料. 而近年来的研究表明全身炎症性反应与肿瘤的发生、发展存在一定关系. Coussens等[1]报道, 肿瘤侵袭转移能力依赖于肿瘤细胞的特性及肿瘤的微环境. 随着近年的研究发现, 中性粒细胞在肿瘤演变过程中的起着重要的作用[11]. 首先中性粒细胞所生成的多种炎症介质均可促进肿瘤微环境的形成; 而中性粒细胞的增多又将对淋巴细胞因子激活的NK细胞功能下调, 从而有利于肿瘤细胞向远处侵犯及转移. 而在淋巴细胞方面研究发现[12], 由于淋巴细胞是抗肿瘤免疫的主要成分, 淋巴细胞数目的下降提示机体免疫功能异常, 并且由其介导的抗肿瘤免疫反应强度降低, 从而更加形成利于肿瘤细胞克隆增殖及远处转移[13]. 科学研究与临床观察基本达成一致[14]: 全身性的炎症与肿瘤患者本身进行性的器官功能衰竭和全身营养状态相关, 从而导致预后变差. 淋巴细胞计数的减少表明患者抗肿瘤能力降低、机体免疫功能异常. 目前临床常用的检测炎症反应的指标有C反应蛋白、NLR和血小板/淋巴细胞比值等[15]. 其中NLR最能够反应中性粒细胞和淋巴细胞的相对变化, 因为NLR是绝对值计数、具有一定的稳定性, 从而能够在一定程度上显示机体肿瘤炎性反应和肿瘤免疫反应之间的状态[16].
本研究以Walsh等[9]提出的以5作为NLR的临界点. 我们通过回顾分析发现: NLR≥5的胆囊癌患者5年生存率低于NLR<5的胆囊癌患者5年生存率, 提示NLR具有评估胆囊癌预后的临床价值. 研究中对胆囊癌患者进行单因素分析结果显示: 肿瘤分化程度、T分期、淋巴结转移情况、侵犯肝脏情况、TNM分期等均是胆囊癌预后不良的危险因素. 而将危险因素导入COX回归模型分析发现: 术前NLR是影响胆囊癌患者生存的独立危险因素. 由于外周血中的NLR是一个易获得的、低成本的检测指标, 作为胆囊癌患者病情评估的一个有益补充, 是值得推广的. 本研究样本较少, 我们期待多中心大样本临床随机对照研究和基础研究进一步证实我们的研究结果.
有研究证明炎症反应与恶性肿瘤预后相关. 因为由炎症细胞释放的炎性介质能促进肿瘤细胞的转移和血管生成. 中性粒细胞/淋巴细胞比值(neutrophil-lymphocyte ratio, NLR)是反映炎症的指标之一, 并且有研究表明术前增高的NLR与一些恶性肿瘤的恶性程度相关.
张宗明, 教授, 首都医科大学北京电力医院普外科
Halazun等报道了术前增高的NLR结直肠癌肝转移患者在接受肝脏部分切除术后的预后较正常NLR患者预后差. 同时, 一些研究报道在肝细胞癌患者中, 术前增高的NLR与肿瘤的预后呈负相关.
研究表明, 在直肠癌, 肝细胞癌等恶性肿瘤患者中, 术前外周血中增高的中性粒细胞/淋巴细胞预示在患者接受根治性治疗后预后较差. 本研究通过分析接受根治性治疗胆囊癌患者的资料证实了术前NLR增高的胆囊癌患者在接受根治性治疗后的预后相比正常NLR患者的预后差.
术前NLR增高的胆囊癌患者在接受根治性治疗后的预后相比正常NLR患者的预后明显差. 这一无创指标能够帮助作者判断胆囊癌患者根治性治疗的预后.
术前NLR可以更便捷的反应胆囊癌的预后, 其获得途径更便利.
本文的科学性、创新性和可读性能较好地反映我国或国际胃肠病学临床研究的先进水平.
编辑: 郭鹏 电编:都珍珍
| 2. | Motomura T, Shirabe K, Mano Y, Muto J, Toshima T, Umemoto Y, Fukuhara T, Uchiyama H, Ikegami T, Yoshizumi T. Neutrophil-lymphocyte ratio reflects hepatocellular carcinoma recurrence after liver transplantation via inflammatory microenvironment. J Hepatol. 2013;58:58-64. [PubMed] [DOI] |
| 3. | Shimada H, Takiguchi N, Kainuma O, Soda H, Ikeda A, Cho A, Miyazaki A, Gunji H, Yamamoto H, Nagata M. High preoperative neutrophil-lymphocyte ratio predicts poor survival in patients with gastric cancer. Gastric Cancer. 2010;13:170-176. [PubMed] [DOI] |
| 4. | Chua W, Charles KA, Baracos VE, Clarke SJ. Neutrophil/lymphocyte ratio predicts chemotherapy outcomes in patients with advanced colorectal cancer. Br J Cancer. 2011;104:1288-1295. [PubMed] [DOI] |
| 5. | Cho H, Hur HW, Kim SW, Kim SH, Kim JH, Kim YT, Lee K. Pre-treatment neutrophil to lymphocyte ratio is elevated in epithelial ovarian cancer and predicts survival after treatment. Cancer Immunol Immunother. 2009;58:15-23. [PubMed] [DOI] |
| 6. | Bhatti I, Peacock O, Lloyd G, Larvin M, Hall RI. Preoperative hematologic markers as independent predictors of prognosis in resected pancreatic ductal adenocarcinoma: neutrophil-lymphocyte versus platelet-lymphocyte ratio. Am J Surg. 2010;200:197-203. [PubMed] [DOI] |
| 7. | Sharaiha RZ, Halazun KJ, Mirza F, Port JL, Lee PC, Neugut AI, Altorki NK, Abrams JA. Elevated preoperative neutrophil: lymphocyte ratio as a predictor of postoperative disease recurrence in esophageal cancer. Ann Surg Oncol. 2011;18:3362-3369. [PubMed] [DOI] |
| 8. | Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol. 2010;17:1471-1474. [PubMed] [DOI] |
| 9. | Walsh SR, Cook EJ, Goulder F, Justin TA, Keeling NJ. Neutrophil-lymphocyte ratio as a prognostic factor in colorectal cancer. J Surg Oncol. 2005;91:181-184. [PubMed] [DOI] |
| 11. | Yoshizumi T, Ikegami T, Yoshiya S, Motomura T, Mano Y, Muto J, Ikeda T, Soejima Y, Shirabe K, Maehara Y. Impact of tumor size, number of tumors and neutrophil-to-lymphocyte ratio in liver transplantation for recurrent hepatocellular carcinoma. Hepatol Res. 2013;43:709-716. [PubMed] [DOI] |
| 12. | Saharinen P, Eklund L, Pulkki K, Bono P, Alitalo K. VEGF and angiopoietin signaling in tumor angiogenesis and metastasis. Trends Mol Med. 2011;17:347-362. [PubMed] [DOI] |
| 13. | Ohtani H. Focus on TILs: prognostic significance of tumor infiltrating lymphocytes in human colorectal cancer. Cancer Immun. 2007;7:4. [PubMed] |
| 14. | McMillan DC. Systemic inflammation, nutritional status and survival in patients with cancer. Curr Opin Clin Nutr Metab Care. 2009;12:223-226. [PubMed] [DOI] |
| 15. | Kusumanto YH, Dam WA, Hospers GA, Meijer C, Mulder NH. Platelets and granulocytes, in particular the neutrophils, form important compartments for circulating vascular endothelial growth factor. Angiogenesis. 2003;6:283-287. [PubMed] [DOI] |