修回日期: 2015-11-08
接受日期: 2015-11-17
在线出版日期: 2015-12-18
目的: 探讨微小RNA-145(miR-145)在胃癌中的表达及与临床病理特征和预后的关系.
方法: 收集62例胃癌患者肿瘤组织和配对癌旁组织标本, 采用实时荧光定量-聚合酶链反应(qRT-PCR)方法检测miR-145的相对表达量, 并分析其与临床病理资料和预后的关系. 生存分析采用Kaplan-Meier法, 并以Log-rank法比较组间差异, 应用Cox模型进行多因素分析.
结果: miR-145在胃癌组织中的表达水平显著低于配对癌旁组织(P<0.01). miR-145的表达水平与临床分期、浸润深度及淋巴结转移呈明显相关(P<0.05), 与患者的年龄、性别、肿瘤大小、分化程度、民族均无明显相关(P>0.05). miR-145高表达者生存时间明显高于低表达组(P<0.05). 多因素分析未显示单一的因素与患者的生存相关.
结论: miR-145在胃癌组织中呈低表达, 且与预后相关, 可能参与了胃癌的发生、发展过程, 可成为胃癌诊断及预后判断的指标.
核心提示: 本文探讨了miR-145在胃癌及癌旁组织内的表达情况及其与临床病理特征, 并进一步分析了其与预后的关系, 得出miR-145可作为一个新的分子标志物为胃癌的诊治和预后判断提供重要的临床价值.
引文著录: 窦越, 王薇, 唐勇. miR-145在胃癌中的表达及其意义. 世界华人消化杂志 2015; 23(35): 5683-5687
Revised: November 8, 2015
Accepted: November 17, 2015
Published online: December 18, 2015
AIM: To investigate the expression of miR-145 in gastric cancer and its relationship with clinicopathological features and prognosis.
METHODS: The expression levels of miR-145 in 62 gastric cancer tissues and matched normal tissues were detected by real-time PCR. The correlations between the expression of miR-145 and pathological characteristics and prognosis were analyzed. The overall survival data were evaluated using the Kaplan-Meier method, Log-rank test, and Cox hazards regression.
RESULTS: The expression level of miR-145 in gastric cancer tissues was significantly lower than that in paired normal tissues (P < 0.01). The expression of miR-145 was associated with TNM stage, invasion depth, and lymph node metastasis (P < 0.05), but not with age, gender, tumor diameter, tumor differentiation, or ethnicity (P > 0.05). The expression of miR-145 was also correlated with overall survival. No single factor was related to overall survival according to Cox regression.
CONCLUSION: The expression of miR-145 is down-regulated in gastric cancer, which may be correlated with the pathogenesis and development of the disease, and could be a marker for diagnosis and prognosis.
- Citation: Dou Y, Wang W, Tang Y. Clinical significance of expression of miR-145 in gastric cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(35): 5683-5687
- URL: https://www.wjgnet.com/1009-3079/full/v23/i35/5683.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i35.5683
胃癌是全球最常见的恶性肿瘤之一, 自20世纪30年代以后胃癌的患病率开始下降. 目前东亚和东欧地区胃癌的发病率仍较高, 且男性发病率高于女性. 我国属于胃癌高发国家, 每年新发病例约40万, 据2013年统计, 男性和女性胃癌的发病率分别为全部恶性肿瘤的第2、4位, 新发病患者呈年轻化趋势[1]. 胃癌不易早期发现, 诊断时多已是中晚期, 预后不佳, 因此早期诊断及治疗对提高胃癌患者的生存意义重大. miRNA是一类小的非编码RNA, 几乎存在于所有真核生物中, 并在调控基因方面发挥重要作用. 在人类所有蛋白质编码基因中, 约有60%的基因会受到miRNA调控, 机体几乎每一个生理过程都会受到miRNA的影响[2]. 目前研究表明, miRNA的异常表达参与了肿瘤的发生、发展及转移, 并可作为肿瘤治疗的有效靶标, 在临床上有着广阔的应用前景. 本研究通过qRT-PCR方法检测胃癌组织中miR-145的表达情况探讨其与胃癌临床病理特征及预后的相关性, 为进一步研究胃癌发病机制和诊断治疗提供新思路.
选取2010-04/2012-05新疆医科大学附属肿瘤医院手术切除胃癌标本62例, 每例标本均取肿瘤组织和距肿瘤边缘5 cm以上的正常组织. 手术标本离体后经液氮速冻后-80 ℃冰箱保存, 其中男42例, 女20例, 平均年龄56.90岁±10.86岁; 根据2010年国际抗癌联盟(Union for International Cancer Control, UICC)制定的TNM分期标准进行临床分期, Ⅰ期13例、Ⅱ期12例、Ⅲ期35例、IV期2例. 通过复诊和电话方式进行随访, 随访截止时间为2015-08, 中位随访时间37.6 mo±13.7 mo. 所有标本组织性质均经病理专业医师确认, 临床资料完整, 均未接受放化疗. 该实验研究经本院理论委员会批准, 所有患者签署知情同意书. TRIzol试剂, 美国Invitrogen公司; 逆转录试剂盒, 美国Thermo Scientific公司; 荧光定量检测试剂盒(SYRB), 北京TIANGEN公司; miR-145及U6引物, 华大基因科技有限公司合成; qRT-PCR引物序列: 内参U6: (forward) 5'-CTCGCTTCGGCAGCACA-3'; (reverse) 5'-AACGCTTCACGAATTTGCGT-3'; miR-145: (forward) 5'-GGCGGGTCCAGTTTTCCCA-3'. ABI 7500 Fast实时定量PCR检测仪.
1.2.1 RNA提取: 每份样本取10 mg组织加TRIzol试剂1 mL后, 加液氮2 mL, 在陶瓷研钵中研磨粉碎, 按照TRIzol试剂说明书操作提取总RNA. 用紫外分光光度计测定RNA浓度和纯度, 琼脂糖凝胶电泳鉴定RNA完整性.
1.2.2 反转录和荧光定量PCR: 按照RevertAid First Strand cDNA Synthesis kit试剂盒说明书将RNA逆转录成cDNA, 反应条件: 25 ℃ 5 min; 42 ℃ 60 min; 70 ℃ 5 min. 荧光定量PCR采用SYBR Green法, 按照试剂盒说明书配成20 µL反应体系, 模板cDNA(10倍稀释)2 µL+2×miRcute miRNA premix 10 µL+miR-145/U6引物0.4 µL+Reverse primer 0.4 µL+RNase-Free water 7.2 µL(Reverse primer为试剂盒中提供). 反应条件: 94 ℃ 2 min; 94 ℃ 20 s, 60 ℃ 34 s, 进行40个循环. 所有反应均设立3个复孔, 取平均值确定Ct值. miR-145的相对表达量采用2-△△Ct法计算, △△Ct = (CtmiRNA-145-CtU6)胃癌-(CtmiRNA-145-CtU6)正常. 将62标例本按2-△△Ct由低到高排序, 取中位数作为界点, 低于中位值为低表达, 高于中位值为高表达.
统计学处理 采用SPSS17.0软件进行统计学分析, 所获数据以mean±SD表示, 统计数据不符合正态分布, 配对资料采用Wilcoxon符号秩和检验, 非配对资料采用Mann-Whitney U检验, 多组比较采用Kruskal-Wallis H秩和检验, 生存分析采用Kaplan-Meier法分析, 组间比较采用Log-rank法, 应用Cox模型进行多因素分析. P<0.05表示差异有统计学意义.
62例胃癌患者中, 胃癌组织中miR-145的相对表达量为1.053±1.270, 而配对癌旁组织中miR-145表达量为1.780±2.401, 表明miR-145在胃癌组织中的表达水平明显低于配对癌旁组织, 差异有统计学意义(P = 0.009).
miR-145在胃癌组织中表达与患者的年龄、性别、肿瘤大小、分化程度、民族均无明显相关(P>0.05), 而与临床分期、浸润深度、淋巴结转移明显相关(P<0.05)(表1).
| 临床病理特征 | n | miR-145(2-△△Ct) | P值 |
| 性别 | 0.557 | ||
| 男 | 42 | 1.015±1.090 | |
| 女 | 20 | 1.133±1.618 | |
| 年龄(岁) | 0.115 | ||
| <60 | 38 | 0.793±0.865 | |
| ≥60 | 24 | 1.364±1.569 | |
| 肿瘤直径(cm) | 0.104 | ||
| <5 | 27 | 1.543±1.621 | |
| ≥5 | 35 | 0.875±0.939 | |
| 分化程度 | 0.746 | ||
| 高分化 | 5 | 1.940±1.950 | |
| 中分化 | 26 | 1.085±1.153 | |
| 低分化 | 31 | 0.883±1.226 | |
| 民族 | 0.265 | ||
| 汉族 | 42 | 1.282±1.477 | |
| 维吾尔族 | 20 | 0.572±0.334 | |
| 淋巴结转移 | 0.013 | ||
| 阴性(N0) | 40 | 0.822±0.930 | |
| 阳性(N1-3) | 22 | 1.472±1.671 | |
| 临床分期 | 0.005 | ||
| Ⅰ-Ⅱ | 25 | 1.550±1.648 | |
| Ⅲ-Ⅳ | 37 | 0.717±0.797 | |
| 浸润深度(T) | 0.034 | ||
| T1 | 5 | 1.168±1.205 | |
| T2 | 11 | 1.954±1.992 | |
| T3 | 8 | 0.745±0.913 | |
| T4 | 38 | 0.841±0.981 |
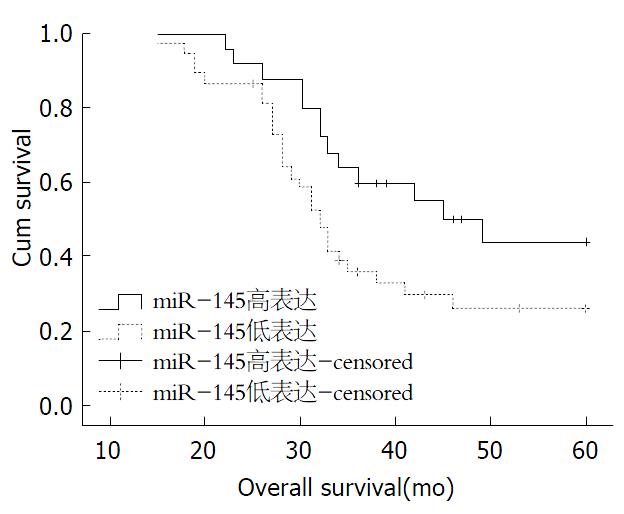
经Kaplan-Meier生存分析显示, miR-145的表达与总生存相关. 62例患者中有10例患者失访, 52例患者中miR-145低表达患者的中位生存时间为32.0 mo, 高表达者的中位生存时间为45.0 mo, miR-145低表达组的生存时间明显低于miR-145高表达组, 差异有显著统计学意义(P = 0.043)(图1). 单因素分析表明, 年龄、性别、肿瘤大小、分化程度、民族、临床分期、浸润深度、淋巴结转移均无预后意义. 多因素分析未显示单一的因素与患者的生存相关(表2).
| 因素 | 回归系数 | 标准误 | 风险率 | 95%置信区间 | P值 |
| 性别 | 7.608 | 17.728 | 0.184 | 0.000-2.479 | 0.668 |
| 年龄 | 0.621 | 1.215 | 1.861 | 0.172-20.151 | 0.609 |
| 民族 | 20.197 | 43.660 | 5.906 | 0.000-8.609 | 0.644 |
| 临床分期 | -6.810 | 16.532 | 0.001 | 0.000-1.810 | 0.960 |
| 分化程度 | -0.668 | 0.766 | 0.513 | 0.114-2.301 | 0.383 |
| 淋巴结转移 | -6.515 | 16.525 | 0.001 | 0.000-2.400 | 0.962 |
| 浸润深度 | 1.133 | 0.984 | 3.105 | 0.451-21.365 | 0.250 |
| miR-145表达 | -7.277 | 17.698 | 0.001 | 0.000-8.027 | 0.681 |
胃癌的发生发展是个多因素、多步骤、多阶段和多基因改变的过程, 目前发现与胃癌相关的癌基因多达400多种[3]. miRNA是一类小分子内源性非编码RNA, 广泛存在于真核细胞中, 他可在转录后水平调控蛋白合成[4], 经近几年研究证实, 约50%的miRNA基因定位于与肿瘤相关的基因组脆性位点[5], 即易发生断裂、移位、缺失或重复的区域, 起着类似癌基因或抑癌基因的作用, 参与肿瘤发生和发展过程.
miR-145是发现与肿瘤关系密切的miRNA之一. Feng等[6]通过在体内外实验转染大肠癌的细胞系发现, 在初级的大肠癌细胞中可检测到表达下调的miR-145, 同时异位表达的miR-145可抑制肿瘤细胞的增殖及体外侵袭, 而稳定表达的miR-145可抑制肿瘤的生长和体内转移, 进一步研究发现, miR-145可直接作用于Fascin-1 mRNA的3'非翻译区, 从而下调其mRNA和蛋白表达水平, 最终抑制肿瘤的生长和转移. 近期Qin等[7]也发现在大肠癌细胞系中miR-145可下调桩蛋白的表达, 能够抑制肿瘤细胞增殖、迁移和侵袭, 影响克隆形成. Han等[8]发现, miR-145在胰腺癌组织和Panc-1细胞系中表达明显下调, 并通过靶定NEDD9来抑制细胞增殖、侵袭和转移. 此外, 在鼻咽癌[9]、非小细胞肺癌[10]、甲状腺癌[11]、乳腺癌[12]中也发现miR-145表达下调, 可以抑制肿瘤细胞的增殖和侵袭, 来发挥抑癌基因作用. 在胃癌中Chang等[13]发现miR-145可通过直接靶定E2F3和CDK6来介导维生素D3抑制细胞集落表达形成, 同时影响其生存力, 从而使细胞停滞于S期, 发挥抗增殖的作用. Chen等[14]的研究中也发现miR-145与FSCN1之间负向调节, 以影响胃癌的侵袭和转移. 此外, 邢晓芳等[15]通过研究胃癌组织及配对肝转移灶, 发现miR-145在胃癌组织中的表达明显低于癌旁组织, 在转移灶中的表达明显低于原发灶, 进一步在细胞系中转染miR-145进行Transwell检测后, 显示miR-145能显著抑制细胞侵袭和转移.
本研究中采用qRT-PCR检测miR-145在胃癌组织中的表达情况, 结果显示, miR-145在胃癌组织中的表达水平显著低于配对癌旁组织(P<0.01), 这与多项研究结果相吻合, 提示miR-145在胃癌中可能作为一种抑癌基因参与胃癌的发生、发展. 通过进一步分析miR-145与胃癌的临床病理因素及生存期之间的关系可见, miR-145表达水平与肿瘤分期、淋巴结转移、浸润深度明显相关, 同时, 在单因素分析中可见miR-145低表达组的中位生存时间低于miR-145高表达组, 这可提示高表达的miR-145可能抑制胃癌转移, 从而改善胃癌患者的预后, 但miR-145的表达并不是影响预后的独立因素. 而在褚以忞等[16]的研究中发现miR-145与患者的临床病理因素均无显著性相关, 这可能与胃癌患者的选择有关, 也可能存在qRT-PCR引物的设计、内参的选择、扩增条件等因素的影响. 由于本实验样本数量偏少, 实验结果仍有待扩大样本进一步研究加以验证. 但本实验结果提示miR-145可作为一个新的分子标志物为胃癌的诊治和预后判断提供重要的临床价值. 虽然miR-145在体内外实验中证实有抑癌作用, 但对于miR-145调控胃癌的分子机制及生物学功能仍尚不明确, 还需进一步研究. 因此, 研究miR-145在胃癌中调控的相关靶基因及其信号通路将是我们下一步的研究重点, 了解其在胃癌中的功能作用, 为胃癌的早期诊断、治疗及预后评估提供理论依据.
胃癌是全球最常见的恶性肿瘤之一, 我国属于胃癌高发国家, 而其发病机制仍尚未明确, miRNA是一类小的非编码RNA, miRNA的异常表达参与了肿瘤的发生、发展及转移, 并可作为肿瘤治疗的有效靶标, 在临床上有着广阔的应用前景.
李徐奇, 副教授, 副研究员, 西安交通大学第一附属医院普通外科
miRNA广泛存在于真核细胞中, 并在调控基因方面发挥重要作用. 目前关于miRNA在肿瘤中的作用为较多研究者关注.
Chang等发现miR-145可通过直接靶定E2F3和CDK6来介导维生素D3抑制细胞集落表达形成, 同时影响其生存力, 从而使细胞停滞于S期, 来发挥抑癌基因作用.
本文通过采用实时定量PCR方法检测胃癌组织及癌旁组织中miR-145的表达, 并分析miR-145的表达与胃癌术后患者预后的关系.
本文研究胃癌与miR-145的关系, 并探讨其与临床病理特征及预后的关系, 为胃癌的诊治和预后判断提供一定依据.
本研究探讨miR-145表达与胃癌患者预后的关系, 具有一定的临床价值.
编辑: 郭鹏 电编:都珍珍
| 1. | Gao M, Yin H, Fei ZW. Clinical application of microRNA in gastric cancer in Eastern Asian area. World J Gastroenterol. 2013;19:2019-2027. [PubMed] [DOI] |
| 2. | Halimi M, Asghari SM, Sariri R, Moslemi D, Parsian H. Cellular Response to Ionizing Radiation: A MicroRNA Story. Int J Mol Cell Med. 2012;1:178-184. [PubMed] |
| 3. | 郭 波, 王 文静, 赵 凌宇, 常 素娥, 童 东东, 杨 阳, 宋 土生, 黄 辰. Hsa-miR-106a在胃癌组织中的表达及其临床意义. 山西医科大学学报. 2014;45:12-15. |
| 4. | Farazi TA, Hoell JI, Morozov P, Tuschl T. MicroRNAs in human cancer. Adv Exp Med Biol. 2013;774:1-20. [PubMed] [DOI] |
| 5. | Berindan-Neagoe I, Monroig Pdel C, Pasculli B, Calin GA. MicroRNAome genome: a treasure for cancer diagnosis and therapy. CA Cancer J Clin. 2014;64:311-336. [PubMed] [DOI] |
| 6. | Feng Y, Zhu J, Ou C, Deng Z, Chen M, Huang W, Li L. MicroRNA-145 inhibits tumour growth and metastasis in colorectal cancer by targeting fascin-1. Br J Cancer. 2014;110:2300-2309. [PubMed] [DOI] |
| 7. | Qin J, Wang F, Jiang H, Xu J, Jiang Y, Wang Z. MicroRNA-145 suppresses cell migration and invasion by targeting paxillin in human colorectal cancer cells. Int J Clin Exp Pathol. 2015;8:1328-1340. [PubMed] |
| 8. | Han T, Yi XP, Liu B, Ke MJ, Li YX. MicroRNA-145 suppresses cell proliferation, invasion and migration in pancreatic cancer cells by targeting NEDD9. Mol Med Rep. 2015;11:4115-4120. [PubMed] [DOI] |
| 9. | Li YQ, He QM, Ren XY, Tang XR, Xu YF, Wen X, Yang XJ, Ma J, Liu N. MiR-145 inhibits metastasis by targeting fascin actin-bundling protein 1 in nasopharyngeal carcinoma. PLoS One. 2015;10:e0122228. [PubMed] [DOI] |
| 11. | Gu Y, Li D, Luo Q, Wei C, Song H, Hua K, Song J, Luo Y, Li X, Fang L. MicroRNA-145 inhibits human papillary cancer TPC1 cell proliferation by targeting DUSP6. Int J Clin Exp Med. 2015;8:8590-8598. [PubMed] |
| 12. | Hu J, Guo H, Li H, Liu Y, Liu J, Chen L, Zhang J, Zhang N. MiR-145 regulates epithelial to mesenchymal transition of breast cancer cells by targeting Oct4. PLoS One. 2012;7:e45965. [PubMed] [DOI] |
| 13. | Chang S, Gao L, Yang Y, Tong D, Guo B, Liu L, Li Z, Song T, Huang C. miR-145 mediates the antiproliferative and gene regulatory effects of vitamin D3 by directly targeting E2F3 in gastric cancer cells. Oncotarget. 2015;6:7675-7685. [PubMed] |