修回日期: 2015-11-11
接受日期: 2015-11-17
在线出版日期: 2015-12-18
目的: 观察水肿型急性胰腺炎(acute pancreatitis, AP)向坏死型AP转变过程中Toll样受体(Toll-like receptor, TLR)9 mRNA和蛋白质动态表达变化.
方法: 以3 mL/h的速度在胆胰管注射5%牛黄胆酸钠(0.1 mL/100 g)的方法制备AP SD大鼠模型(0、3、6和12 h), HE染色观察不同时间点胰腺的病理变化, Q-PCR和ELISA分别检测TLR9 mRNA和蛋白质动态表达变化情况.
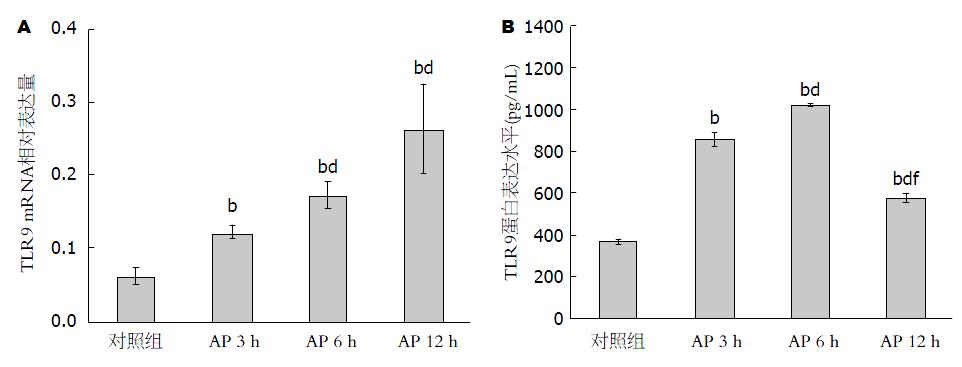
结果: AP后3 h胰腺组织出现轻微水肿, 出现少量红细胞, 6 h后水肿进一步增加, 部分胰腺细胞出现出血坏死, 12 h胰腺细胞变性明显, 出血坏死进一步加重. AP后TLR9 mRNA和蛋白的表达水平明显高于对照组(P<0.01), 且AP 6 h和12 h均高于3 h(P<0.01), 但6 h和12 h比较没有显著性差异(P>0.05). AP 6 h, TLR9的蛋白表达水平达到高峰明显高于3 h和12 h(P<0.01).
结论: TLR9蛋白表达迟于中TLR9 mRNA表达. 与此同时, TLR9蛋白在胰腺水肿高峰达到峰值, 并伴随着胰腺组织的坏死表达有所下降. TLR9在AP由水肿型到坏死型转变过程中发挥了重要作用.
核心提示: 本文对水肿型急性胰腺炎(acute pancreatitis, AP)向坏死型AP转变过程中Toll样受体(Toll-like receptor, TLR)9 mRNA和蛋白质动态表达进行研究, 显示TLR9 mRNA在AP后显著升高, 且AP 6 h达到平台期. 此外, AP 6 h, 即胰腺细胞水肿最为严重时TLR9蛋白表达最高; 当AP 12 h, 即大量胰腺组织坏死时, TLR9蛋白表达有所下降, 但仍高于对照组. 提示TLR9与水肿型AP向坏死型AP进展关系密切.
引文著录: 孙亮, 曾玉剑, 罗华友, 王昆华, 李立. 大鼠急性胰腺炎水肿型向坏死型转变过程中Toll样受体9 mRNA及蛋白的表达特征. 世界华人消化杂志 2015; 23(35): 5677-5682
Revised: November 11, 2015
Accepted: November 17, 2015
Published online: December 18, 2015
AIM: To observe the changes in mRNA and protein expression of Toll-like receptor (TLR) 9 in the conversion of acute edematous to necrotizing pancreatitis in rats.
METHODS: A SD rat model of acute pancreatitis was established by injecting 5% sodium taurocholate (0.1 mL/100 g, 3 mL/h) into the pancreaticobiliary duct (0 h, 3 h, 6 h and 12 h). The pathological changes in the pancreas were observed by HE staining, and TLR9 mRNA and protein expression was detected by Q-PCR and ELISA, respectively.
RESULTS: Mild pancreatic edema was noted at 3 h, and there was a small number of red blood cells. Edema further aggravated at 6 h and some pancreatic cells showed hemorrhage and necrosis. Pancreatic cell degeneration, edema and necrosis continued to aggrvate at 12 h. TLR9 mRNA and protein expression was significantly increased in acute pancreatitis rats compared with control rats (P < 0.01), and the mRNA levels at 6 h and 12 h were up-regulated compared with that at 3 h (P < 0.01). However, there was no significant difference between 6 h and 12 h in TLR9 mRNA expression (P > 0.05). TLR9 protein reached a peak at 6 h, which was significantly higher than those at 3 h (P < 0.01) and 12 h (P < 0.01).
CONCLUSION: Expression of TLR9 protein is later than the mRNA expression. Pancreatic edema along with TLR9 protein increases to the peak at 6 h, followed by pancreatic tissue necrosis and decreased expression of TLR9 protein. TLR9 may play an important role in the conversion of acute edematous to necrotizing acute pancreatitis .
- Citation: Sun L, Zeng YJ, Luo HY, Wang KH, Li L. Expression characteristic of Toll-like receptor 9 mRNA and protein in conversion of acute edematous to necrotizing pancreatitis in rats. Shijie Huaren Xiaohua Zazhi 2015; 23(35): 5677-5682
- URL: https://www.wjgnet.com/1009-3079/full/v23/i35/5677.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i35.5677
急性胰腺炎(acute pancreatitis, AP)是一种由于胰管阻塞、胰管内压突然增高以及胰腺血液供应不足等原因引起的胰腺急性炎症[1], 是临床最常见的急腹症之一, 发病率位居急腹症第3-5位, 且有逐年上升趋势[2]. 按病因主要可以分为胆源性AP和酒精性AP. 胆源性AP占我国胰腺炎年发病人数半数以上, 其发病机制一般认为系由于胆总管内结石、蛔虫、肿瘤及憩室等造成十二指肠壶腹部Oddi括约肌炎症、水肿、梗阻及狭窄等, 使胆汁反流入胰腺, 或由于胆道感染、炎性渗出液经胆胰间淋巴管交通入胰腺[3]. 酒精性AP的发病率已明显增加, 其以男性为主, 病死率高, 重症存活者生活质量低下, 研究显示酒精及其代谢产物、细菌内毒素、病毒感染、饮酒方式、吸烟、肥胖及宿主的基因突变及基因多态性在酒精性AP发生中具有重要作用[4]. 按组织病理可将AP分为水肿型及(出血)坏死型, 前者为轻型, 很常见, 预后良好, 后者为重型, 较少见, 病死率高[5]. 尽管目前对AP的病理生理变化及发病机制有了更深的认知[6-8], 但其并发症的发生率仍很高, 其发病机制尚未完全清楚, 需要进一步研究.
Toll样受体(Toll-like receptor, TLR)家族是天然免疫的门户, 在炎症、自身免疫、肿瘤发生发展等方面发挥重要作用[9,10]. Hemmi等[11]2000年首次在小鼠中发现TLR9并发现他可识别自身DNA. 他与TLR2、TLR4一样, 是与AP发病机制有密切关系的TLR家族成员之一[12], 但其具体的作用机制尚未清楚. 本研究制备不同时间点AP SD大鼠模型(0、3、6和12 h), HE染色观察时间与坏死的关系, Q-PCR和ELISA分别检测TLR9 mRNA和蛋白质表达变化情况. 一方面, 观察AP由水肿向坏死型转化过程中TLR9的表达特征; 另一方面, 结合AP病理变化, 观察AP病理与TLR9表达变化的关系. 希望能为进一步的找到AP由水肿型向坏死型转化过程中TLR9发挥的作用.
成年SD健康♂大鼠32只(体质量: 200 g±20 g)由昆明医科大学动物中心提供. 实验过程中对动物的处置符合中华人民共和国科学技术部2006年颁布的《关于善待实验动物的指导性意见》标准[13]. 随机分为对照组、AP 3 h组、AP 6 h组和AP 12 h组, 每组8只. 牛黄胆酸钠: Sigma, 美国; 苏木精、伊红: 江苏宝莱生物科技有限公司; TRIzol试剂盒: Invitrogen; MMLV逆转录酶: Promega, Madison, WI; 引物: Western Biotechnology DEPC: Sigma; TLR9 ELISA试剂盒: 武汉上海双赢生物科技有限公司. 恒温烤箱: 上海跃进医疗器械厂; 高速台式离心机(BACKMAN CS-15R): 美国Beckman公司; 移液器: 德国Eppendorf; 荧光定量PCR仪FTC2000: Canada; 酶联免疫检测仪: 美国宝特Bio-Tek.
1.2.1 AP模型制备: 大鼠腹腔注射7%水合氯醛(0.5 mL/100 g)将动物麻醉, 用注射器从腹部一侧进针, 穿过腹中线后在腹部的另一侧进入腹腔, 药物注射完毕后, 缓缓拔出针头, 并轻微旋转针头, 防止漏液, 待动物麻醉成功后仰卧位固定于操作台, 腹部酒精棉球消毒, 根据Yu等[14]的方法制备AP模型: 腹壁正中切口入腹, 寻找胰胆管, 动脉夹夹闭肝门部胆管, 在胆胰管十二指肠开口处对侧肠壁以4号儿科头皮针穿刺进入胆胰管, 以3 mL/h的速度注射5%牛黄胆酸钠(0.1 mL/100 g), 注射完成过后, 用PBS溶液润湿胰腺并放回, 逐层缝合伤口, 酒精棉球消毒, 放回笼子.
1.2.2 组织的准备: 各组动物于实验开始后, 分别于AP后0(对照组, n = 8) 、3(n = 8)、6(n = 7)和12 h(n = 6) 进行以下操作: 腹腔注射7%水合氯醛(0.5 mL/100 g)麻醉所有大鼠, 以0.1 mol/L的PBS灌注后, 用生理盐水冲洗血液, 用于HE染色的置于4%的多聚甲醛中固定30 min, 用于Q-PCR和ELISA的组织冻入-80 ℃冰箱备用.
1.2.3 HE染色: 将以备标本进行梯度乙醇脱水后透明15 min, 60 ℃浸蜡, 并制备成5 μm的石蜡切片, 接着放入二甲苯中脱蜡, 梯度酒精复水, 蒸馏水洗涤后移入Harris苏木精液中10 min, 使细胞核着色, 自来水洗去残余染液, 1%的盐酸乙醇分色, 镜检控制时间. 自来水浸洗约2 h, 显微镜下观察, 直到胞核蓝化为止, 伊红溶液中染色2 min, 使细胞质着色. 蒸馏水略洗, 盐酸乙醇分色, 镜检控制时间. 酒精脱水, 二甲苯透明后中性树胶封片.
1.2.4 Q-PCR检测: 总RNA用TRIzol试剂盒进行提取, cDNA用Oligo(dT)18和MMLV逆转录酶进行合成. β-actin用作内对照. 取2 μL总RNA样品在ND-1000分光光度计中测其浓度. PCR反应条件设置如下: 94 ℃ 4 min; 94 ℃ 20 s, 60 ℃ 30 s, 72 ℃ 30 s循环35次. 引物序列如表1.
| 引物名称 | 引物序列(5'-3') | 大小(bp) |
| rat TLR9 | F: GCACCCTCAGACTTTCCGTC | 158 |
| R: TGGTTTTGTTGATGCTCTCGTAG | ||
| rat actin | F: CCCATCTATGAGGGTTACGC | 150 |
| R: TTTAATGTCACGCACGATTTC |
1.2.5 ELISA检测: 所有步骤按照TLR9 ELISA试剂盒说明书进行. 收集各组胰腺提取上清液, 加入预先包被有TLR9多克隆抗体的8孔板内, 4 ℃孵育24 h, 洗去多余抗体, 加入生物素标记的IgG二抗室温孵育2 h, 用终止液终止反应后37 ℃孵育25 min, 在酶联免疫检测仪(Bio-Rad)450 nm处测量各孔的吸光度值. 每组样品重复实验3次.
统计学处理 实验所得数据用One way分析, SPSS17.0统计分析软件处理数据, 所得实验数据均用mean±SD表示, P<0.05为差异有统计学意义.
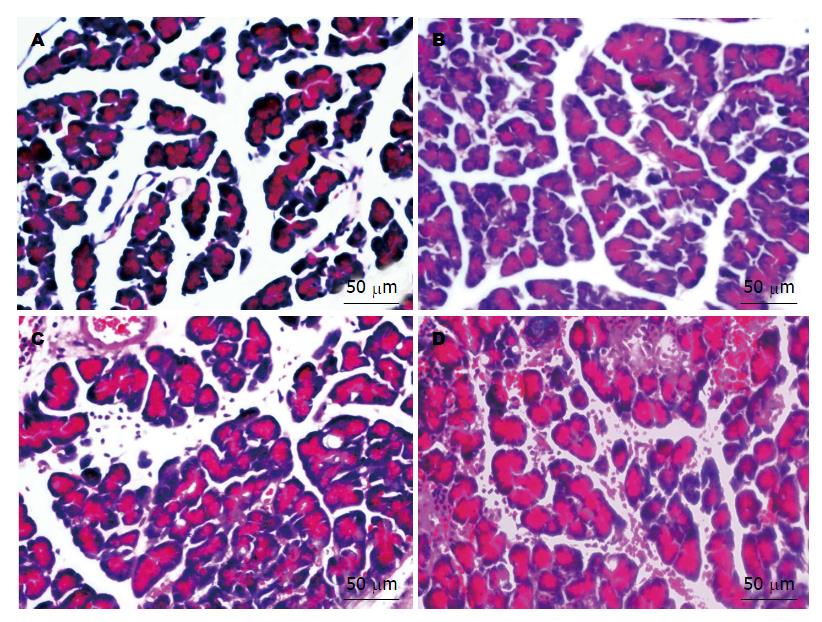
染色后, 光镜下观察发现: 对照组胰腺组织结构正常无水肿和腺泡空泡形成, 无出血坏死现象(图1A); AP 3 h后胰腺间质有略微水肿, 细胞肿胀, 血管内出现少量红细胞(图1B); AP 6 h后组织进一步水肿, 部分胰腺细胞出现坏死, 血管内出现大量红细胞, 腺泡空泡形成(图1C); AP 12 h后出血加重, 细胞空泡化, 出现大量的坏死(图1D).
结果发现: AP 3、6、12 h TLR9的mRNA表达水平与对照组相比都升高, 有显著差异(P<0.01). AP 6、12 h较AP 3 h明显升高(P<0.01), 但AP 6 h与AP 12 h相比较, TLR9的mRNA表达水平无明显变化(P = 0.063>0.05)(图2A).
结果发现: AP 3、6、12 h TLR9的蛋白表达水平与对照组相比都升高, 有明显差异(P<0.01). AP 6 h较AP 3 h明显升高(P<0.01), 但AP 12h与AP 3 h、AP 6 h比较, 蛋白表达水平有所下降(P<0.01)(图2B).
AP时, 炎性细胞释放大量炎性细胞因子, 他们通过凋亡调控途径促进或抑制细胞凋亡, 使胰腺炎表现为水肿型或出血坏死型[15]. 炎性反应的程度也被认为是决定AP严重程度及患者病死率的重要因素[16,17]. TLR9是TLRs家族成员中的重要一员, 通过识别外源性的非甲基化CpG基序从而启动机体炎反应链. 本研究发现AP后TLR9 mRNA及蛋白表达均显著升高. Hoque等[18]报道重度AP患者血清中的TLR9明显升高, 结果与研究报道一致. 有研究[19,20]报道TLR9的上调和一些炎性细胞因子的表达增加有关, 激活TLR9可促使炎性细胞因子上调, 如白介素(interleukin, IL)-1、IL-6、IL-10、IL-12和肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)等的大量释放产生炎症效应进而机体表现为水肿.
此外, 我们还发现AP 6 h TLR9上调最明显, 而AP 12 h表达有所下降, 但仍高于对照组, 即胰腺水肿最明显时TLR9蛋白表达最高. 结果提示AP 6h也许是AP由水肿型转化为坏死型的临界时间点, TLR9可能是AP有水肿型转化为出血坏死型的一个关键分子. Xiang等[21]发现TLR9蛋白的高表达可以进一步的促进细胞凋亡, 从而促使水肿型AP向坏死型AP转变, 当胰管和胰腺微循环的上皮细胞等TLR9蛋白主要表达的细胞[22]坏死时, TLR9蛋白转变为下降. Hoque等[23]证实TLR9在AP炎症反应过程中发挥了重要作用. 基因敲除DNA特异性受体的基因TLR9及加入TLR9拮抗剂都可以明显减轻AP的胰腺水肿、炎症及坏死程度. 虽然此过程中TLR9 mRNA和蛋白存在一定的表达时间差, 但毫无疑问, TLR9与水肿型AP向坏死型AP进展关系密切.
急性胰腺炎(acute pancreatitis, AP)是比较常见的一种急腹症, 其发病率占急腹症的第3-5位. 其中80%以上的患者病情较轻, 即急性水肿性胰腺炎, 可经非手术治愈, 基本上是一种内科病. 10%左右的患者属于重症胰腺炎, 即急性出血性坏死性胰腺炎(acute hemorrhagic necrotic pancreatitis, AHNP), 胰腺的炎症已非可逆性或自限性, 常需手术治疗, 应视为外科病. 因此如何延缓水肿型AP向出血坏死型AP发展至关重要.
王长淼, 教授, 大连医科大学附属第一医院普外科
研究发现AP主要机制是由于提前激活的胰酶进入并损伤胰腺和胰周组织, 激活促炎细胞因子和血小板活化因子等炎症介质, 进而介导局部和全身的细胞因子瀑式反应. Toll样受体(Toll-like receptor, TLR)家族是天然免疫的门户, 在炎症、自身免疫、肿瘤发生发展等方面发挥重要作用. TLR9与TLR2、TLR4一样, 是与AP发病机制有密切关系的TLR家族成员之一, 但其具体的作用机制尚不清楚.
Hoque等报道重度AP患者血清中的TLR9明显升高, 结果与研究报道一致. 此外还有学者发现 TLR9蛋白的高表达可以进一步的促进细胞凋亡.
本文一方面观察AP由水肿向坏死型转化过程中TLR9的表达特征; 另一方面, 结合AP病理变化, 观察AP病理与TLR9表达变化的关系. 研究结果为进一步的找到AP由水肿型向坏死型转化过程中TLR9发挥的作用奠定基础.
本文探讨了TLR9在AP由水肿向坏死型转化过程的动态表达特征及病理变化的关系, 立题较新颖.
编辑: 郭鹏 电编:都珍珍
| 5. | 戴 璟瑜, 郑 通标, 许 燕平, 闫 玉矿, 彭 海峰. 水肿型胰腺炎向坏死型胰腺炎进展中VEGF的表达及意义. 中国现代普通外科进展. 2013;16:11-14. |
| 6. | 陈 杏苑, 杨 元生, 陈 垦, 陈 丽舒, 谢 文瑞, 王 晖. JAK-STAT细胞信号转导通路与急性胰腺炎关系的研究进展. 世界华人消化杂志. 2015;23:932-937. [DOI] |
| 9. | Richez C, Blanco P, Rifkin I, Moreau JF, Schaeverbeke T. Role for toll-like receptors in autoimmune disease: the example of systemic lupus erythematosus. Joint Bone Spine. 2011;78:124-130. [PubMed] [DOI] |
| 10. | Kawai T, Akira S. The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors. Nat Immunol. 2010;11:373-384. [PubMed] [DOI] |
| 11. | Hemmi H, Takeuchi O, Kawai T, Kaisho T, Sato S, Sanjo H, Matsumoto M, Hoshino K, Wagner H, Takeda K. A Toll-like receptor recognizes bacterial DNA. Nature. 2000;408:740-745. [PubMed] |
| 12. | Vaz J, Akbarshahi H, Andersson R. Controversial role of toll-like receptors in acute pancreatitis. World J Gastroenterol. 2013;19:616-630. [PubMed] [DOI] |
| 14. | Yu C, Huang L, Li X, Zhu H, Li Z, Yu X. Spatial and temporal differences of HMGB1 expression in the pancreas of rats with acute pancreatitis. Int J Clin Exp Pathol. 2015;8:6928-6935. [PubMed] |
| 16. | Cruz-Santamaría DM, Taxonera C, Giner M. Update on pathogenesis and clinical management of acute pancreatitis. World J Gastrointest Pathophysiol. 2012;3:60-70. [PubMed] |
| 17. | Kahl S, Mayer JM. Update on experimental acute pancreatitis. Minerva Gastroenterol Dietol. 2012;58:355-363. [PubMed] |
| 18. | Hoque R, Malik AF, Gorelick F, Mehal WZ. Sterile inflammatory response in acute pancreatitis. Pancreas. 2012;41:353-357. [PubMed] [DOI] |
| 19. | Krieg AM, Yi AK, Matson S, Waldschmidt TJ, Bishop GA, Teasdale R, Koretzky GA, Klinman DM. CpG motifs in bacterial DNA trigger direct B-cell activation. Nature. 1995;374:546-549. [PubMed] |
| 20. | Takeda K, Akira S. Toll-like receptors in innate immunity. Int Immunol. 2005;17:1-14. [PubMed] |
| 21. | Xiang Y, Yan H, Zhou J, Zhang Q, Hanley G, Caudle Y, LeSage G, Zhang X, Yin D. The role of toll-like receptor 9 in chronic stress-induced apoptosis in macrophage. PLoS One. 2015;10:e0123447. [PubMed] [DOI] |
| 22. | Zeng YJ, Song JM, Li Y, Wang R, Zhou B, Zhou ZG, Liu HY, Xu B. Toll-like receptor 9 is expressed in rat pancreas and is involved in cerulein-induced pancreatitis. Pancreas. 2008;36:212-214. [PubMed] [DOI] |
| 23. | Hoque R, Sohail M, Malik A, Sarwar S, Luo Y, Shah A, Barrat F, Flavell R, Gorelick F, Husain S. TLR9 and the NLRP3 inflammasome link acinar cell death with inflammation in acute pancreatitis. Gastroenterology. 2011;141:358-369. [PubMed] [DOI] |